技术分享:琥珀酸促进巨噬细胞胞外囊泡转移ITGβ1介导了脓毒症相关性肺纤维化
脓毒症是一种由感染引发的高死亡率临床综合征,表现为宿主反应失调导致危及生命的器官功能障碍[1]。肺脏是脓毒症时最易受损的器官。当脓毒症累及肺部时,其结构和功能会遭受不同程度的损害,如脓毒症相关性肺纤维化(SAPF),病理特征包括肺毛细血管通透性增加,肺泡渗出富含蛋白质的液体,形成透明膜和肺水肿。这会触发肺部炎症反应,进而可能导致急性呼吸窘迫综合征(ARDS)[2]。严重情况下,可能进展为肺纤维化并最终导致呼吸衰竭[3, 4]。然而,目前尚无针对SAPF的有效临床治疗方法,亟需研究其潜在机制并开发靶向疗法[5]。
细胞间通讯驱动微环境变化,影响成纤维细胞的增殖和活化,这一过程对肺纤维化的发展至关重要。这种信号传导是通过释放可溶性分子或转移细胞外囊泡(EV)来实现的。整合素是一个跨膜异二聚体受体家族,介导了细胞粘附和信号转导,可位于EV膜的表面,赋予了EV靶向特定细胞或器官的能力。糖代谢重编程发生在各种细胞类型中,包括成纤维细胞、上皮细胞和巨噬细胞,并通过调节自噬、细胞增殖、凋亡、细胞外基质(ECM)合成和其他过程促进肺纤维化。越来越多的研究证实,在肺纤维化过程中,参与糖酵解、三羧酸循环(TCA循环)和脂肪酸代谢的代谢物会发生动态变化[6]。琥珀酸作为TCA循环的关键代谢物,在巨噬细胞的糖代谢重编程进程中起关键作用[7],并能促进转化生长因子诱导的正常人肺成纤维细胞激活[8]。有研究证实整合素β3的激活可调节肺纤维化期间的糖代谢重编程和成纤维细胞活化。以上研究表明,EV、代谢重编程和整合素激活都与纤维化有关,但它们之间的相互作用以及对SAPF的影响仍不清楚。
2025年9月,Advanced Science期刊在线发表了一项研究,揭示了细胞外囊泡(EV)介导的ITGβ1转移在巨噬细胞-成纤维细胞通讯中的关键作用。具体而言,糖代谢重编程产物琥珀酸促进巨噬细胞内吞作用,驱动促纤维化EV释放,这些EV将ITGβ1从巨噬细胞转移至成纤维细胞,从而激活成纤维细胞并加速脓毒症相关性肺纤维化(SAPF)进程。Alix介导了巨噬细胞内吞过程中多囊泡体(MVB)的形成和EV的分泌,敲降Alix可以抑制EV分泌和缓解SAPF。该研究为SAPF的分子机制提供了新见解,也为治疗SAPF提供了新靶点和新策略[9]。
首先,研究者构建小鼠SAPF模型。连续3天小鼠腹腔注射5 mg/kg LPS,一周后收集肺组织和支气管肺泡灌洗液(BALF)进行后续研究(图一a)。结果显示,与对照组相比,LPS组小鼠肺组织中成纤维细胞活化的关键标志物1型胶原α1链(COL1A1)和纤连蛋白(Fibronectin)表达显著升高(图一b和c)。COL1A1主要定位于肺间质,在气管周围区域也有分布(图一d)。通过高效离子色谱-串联质谱(HPLC-MS/MS)分析肺组织匀浆中的琥珀酸水平,发现LPS诱导琥珀酸、L-乳酸和腺苷二磷酸水平显著增加(图一e)。LC-MS进一步证实,LPS不仅在肺组织中促进琥珀酸生成,在BALF中也检测到琥珀酸水平升高(图一f和g)。探究SAPF期间EV的生成,透射电镜确认BALF中脂质双层囊泡结构的存在,而纳米颗粒追踪分析(NTA)显示LPS组EV数量显著增加(图一h和i)。进行体外实验,用5 mmol/L琥珀酸刺激巨噬细胞以增强EV分泌(图一j和k),随后通过超速离心从巨噬细胞纯化EV来处理成纤维细胞,发现成纤维细胞的活化与EV浓度呈剂量依赖性关系(图一l)。当用40 µg纯化的Suc-EVs处理成纤维细胞时,免疫荧光分析显示COL1A1显著活化(图一m)。以上数据表明,LPS通过促进琥珀酸释放,诱导巨噬细胞来源的促纤维化EV分泌,进而驱动SAPF期间的成纤维细胞活化。
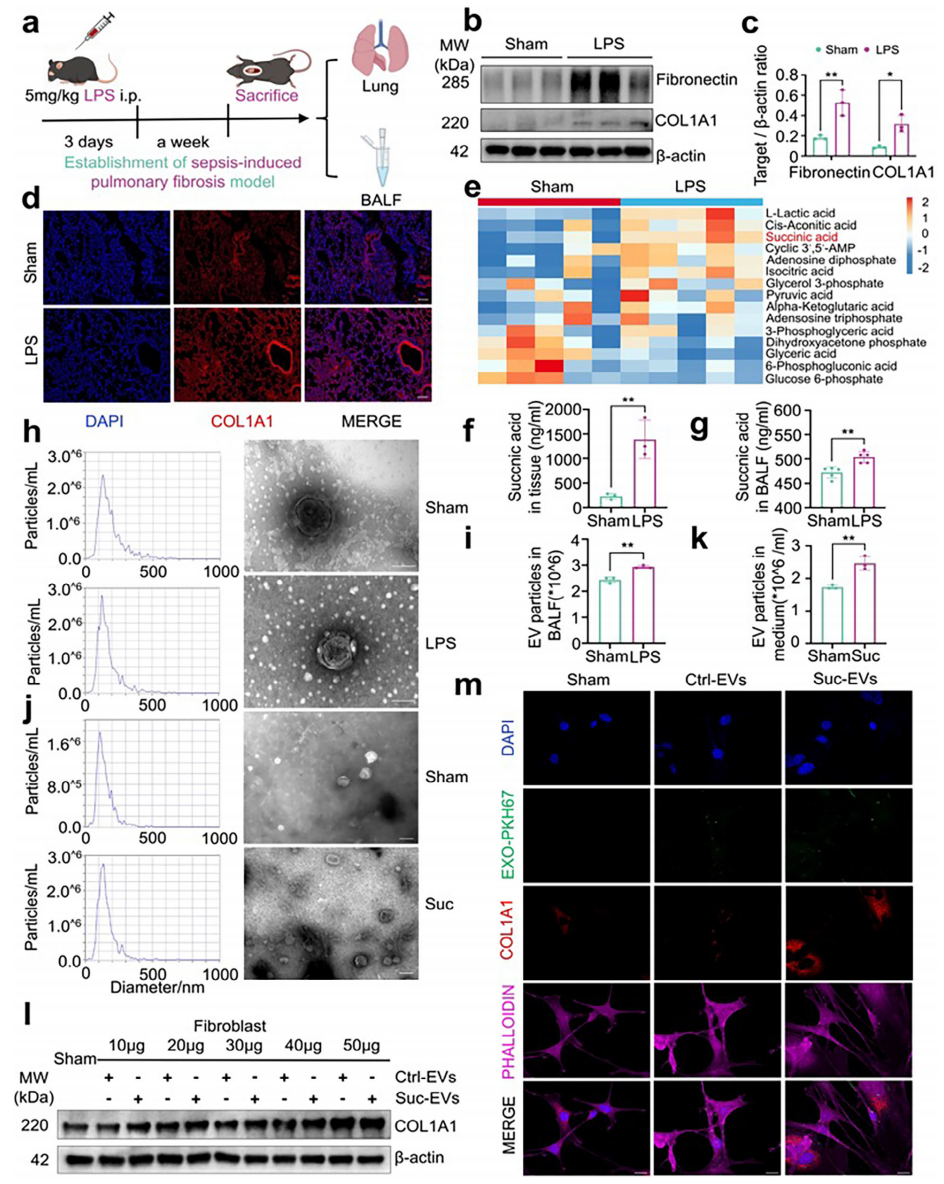
图一 LPS诱导的肺纤维化小鼠中琥珀酸和EV分泌增加[9]
接下来,研究者探究SAPF发病过程中的细胞动态变化。将对照组和LPS组小鼠肺组织进行单细胞RNA测序(scRNA-seq)。使用UMAP降低数据维度,并基于标志基因进行细胞聚类分析(图二a),利用CellChat工具分析巨噬细胞与成纤维细胞间的细胞通讯。结果显示,LPS增强了巨噬细胞与成纤维细胞的相互作用,还增加了巨噬细胞与肌成纤维细胞的交流,后者是一种来源于成纤维细胞到肌成纤维转变(FMT)的细胞群。这些细胞通过释放ECM成分推动肺纤维化进展(图二b)。定量显示M2巨噬细胞与成纤维细胞间存在显著相互作用,其中SPP1作为配体可以与整合素结合,特别是ITGβ1(图二c)。此外,Western blot和免疫荧光证实LPS刺激后肺组织中ITGβ1表达增加(图二d-f)。KEGG通路富集分析显示成纤维细胞通过形成吞噬体和调节肌动蛋白细胞骨架以增强ECM分泌(图二g)。主成分分析(PCA)显示巨噬细胞来源EV在组间呈现明显聚类(图二h),热图显示整合素家族的差异蛋白丰度(图二i)。琥珀酸刺激显著改变了EV组成,与其他整合素家族成员相比,ITGβ1显著富集。火山图显示6种促纤维化基因上调、8种抗纤维化基因下调,Itgb1表达显著升高(图二j)。Western blot显示ITGβ1在EV中水平升高但在巨噬细胞内并未增加(图二k)。用不同剂量Suc-EVs刺激成纤维细胞,ITGβ1表达可呈剂量依赖性上升,其中40 µg剂量效果最显著(图二l)。免疫荧光证实成纤维细胞中ITGβ1上调(图二m)。以上结果表明,成纤维细胞中ITGβ1的上调部分来自巨噬细胞分泌的促纤维化EV,巨噬细胞通过将ITGβ1转移到EV来介导成纤维细胞活化。
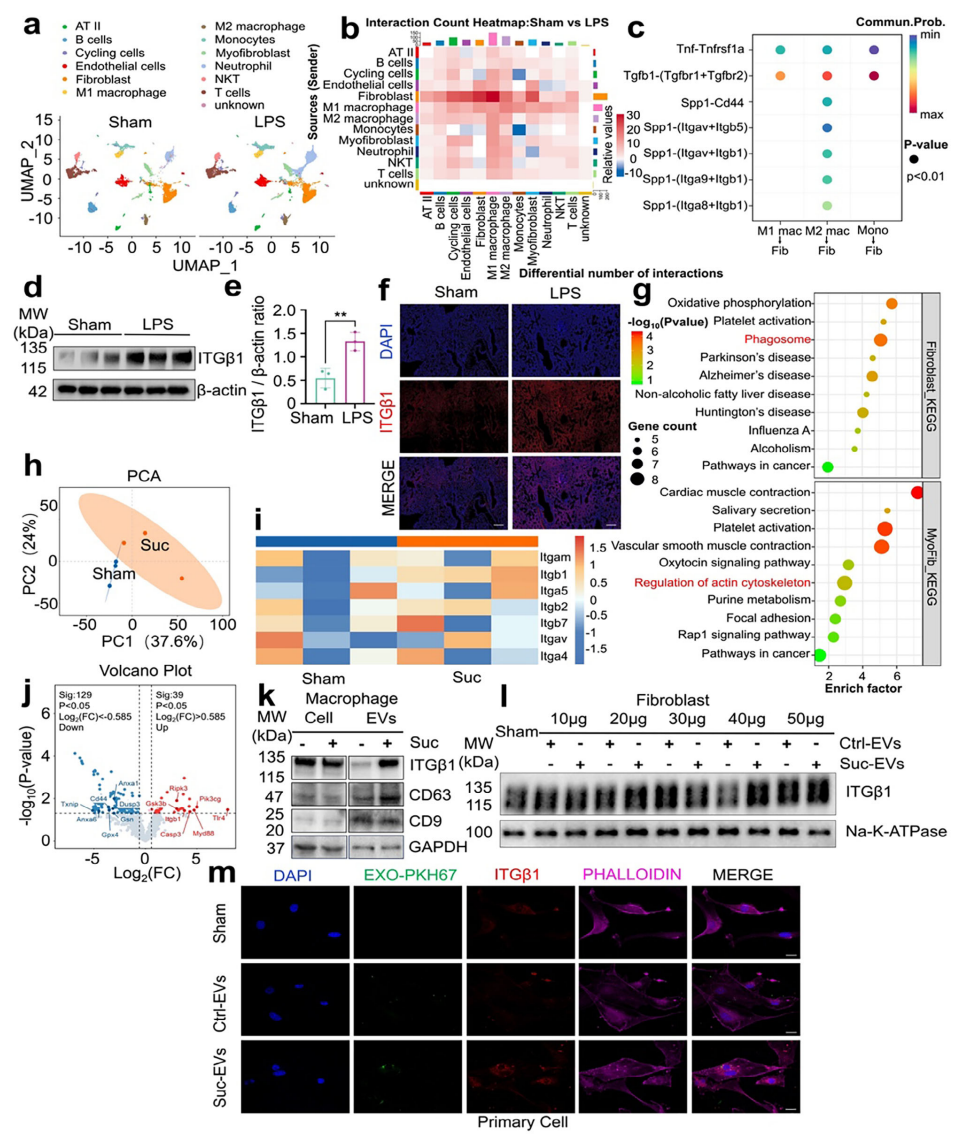
图二 巨噬细胞通过将ITGβ1转移到EV来激活成纤维细胞[9]
研究者深入探究ITGβ1在巨噬细胞释放促纤维化EV过程中的关键作用。特异性敲降巨噬细胞ITGβ1的mRNA表达和蛋白质水平后,琥珀酸刺激的巨噬细胞来源EV的ITGβ1水平显著降低(图三a)。此外,琥珀酸诱导的成纤维细胞活化及ITGβ1表达上调现象也被部分抑制(图三b和c),进一步证实EV的ITGβ1在激活成纤维细胞中的关键作用。敲降成纤维细胞的ITGβ1,随后用40 µg Suc-EVs处理24小时,发现Suc-EVs诱导的COL1A1表达增加被显著抑制(图三d和e)。为了消除琥珀酸本身诱导成纤维细胞ITGβ1表达增加的可能性,研究者对比直接使用琥珀酸刺激成纤维细胞与Suc-EVs处理的效果,发现只有Suc-EVs显著提升ITGβ1表达,且蛋白水平变化比mRNA更明显(图三f-j),表明成纤维细胞中ITGβ1的上调主要源于巨噬细胞来源EV的外源转移。此外,研究者发现抑制成纤维细胞对EV的摄取后,ITGβ1表达呈现不同程度下降(图三k-m)。基于这些发现,研究者假设靶向ITGβ1可能是SAPF的一种潜在治疗策略。使用广谱整合素受体拮抗剂GLPG0187处理SAPF小鼠,发现成纤维细胞活化、炎症细胞浸润及肺组织胶原沉积均被显著抑制(图三n-p)。以上结果表明,琥珀酸通过促进巨噬细胞释放携带ITGβ1的促纤维化EV,激活成纤维细胞并驱动SAPF进展,靶向ITGβ1或阻断EV介导的转移可能成为治疗SAPF的新策略。
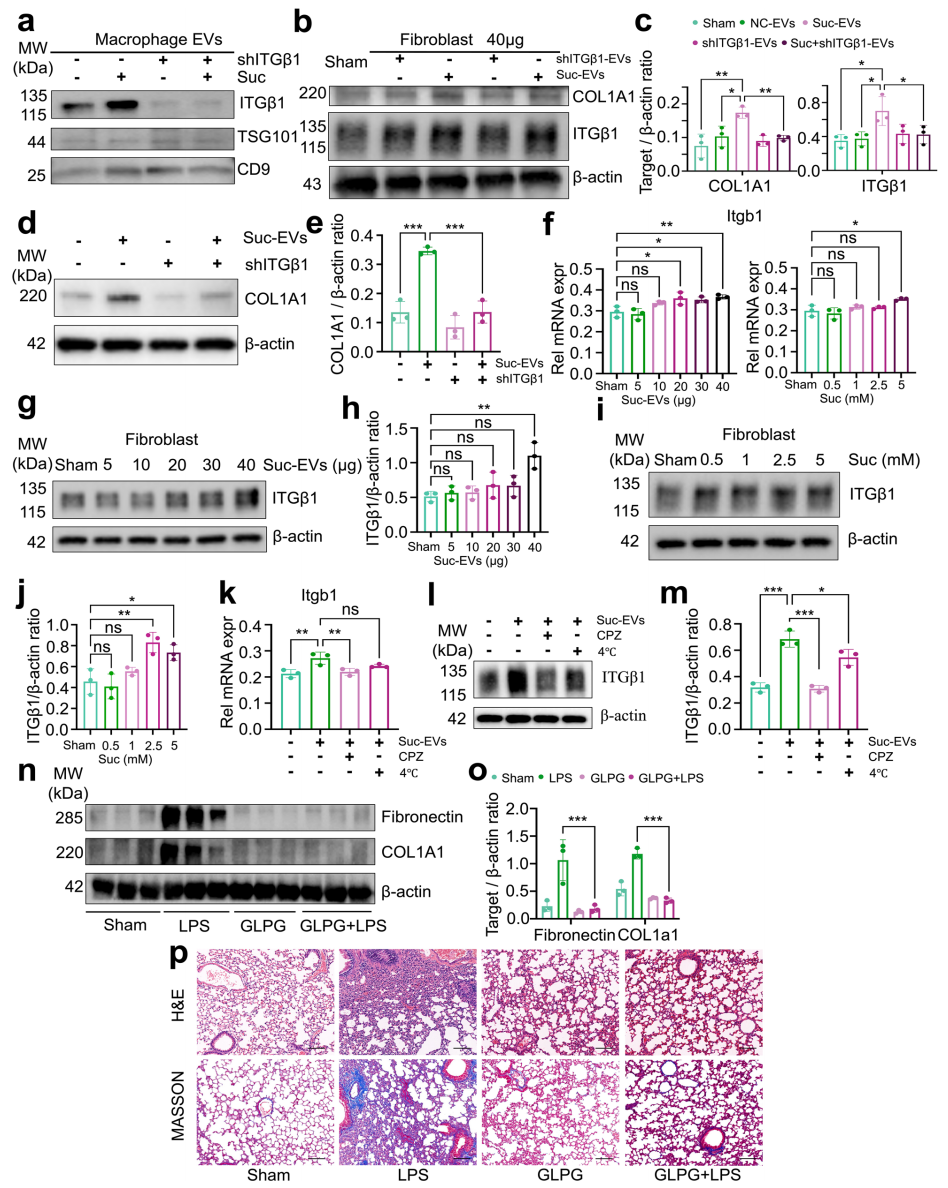
图三 琥珀酸刺激的EV通过转移ITGβ1激活成纤维细胞,促进SAPF进展[9]
随后,研究者阐明琥珀酸刺激增强EV分泌的具体机制。GO分析LPS刺激肺组织中M2巨噬细胞的上调基因,显示网格蛋白包被的内吞囊泡显著富集,提示LPS可能影响内化和迁移过程(图四a)。网格蛋白介导的胞吞作用(CME)是内吞作用的最常见形式,有助于将EV货物蛋白包装到细胞质结构中。小鼠肺组织的免疫荧光分析表明,网格蛋白可能在LPS诱导的过程中发挥作用(图四b)。使用肌动蛋白聚合抑制剂细胞松弛素D(CytoD)预处理巨噬细胞后,琥珀酸诱导的EV分泌显著减少(图四c和d)。多囊泡体(MVB)是一类腔内包含囊泡的晚期内含体,其中包含腔内囊泡(ILV),是EV的前体结构[10]。琥珀酸短期处理上调了早期内体标志物Rab5和EEA1的表达,而CytoD处理减弱了这种影响(图四e),透射电镜也显示CytoD处理减少了MVB和ILV的数量(图四f)。以上结果表明,琥珀酸可以诱导巨噬细胞中MVB的形成,并促进EV分泌,并且内吞抑制剂CytoD可以抑制这些过程。
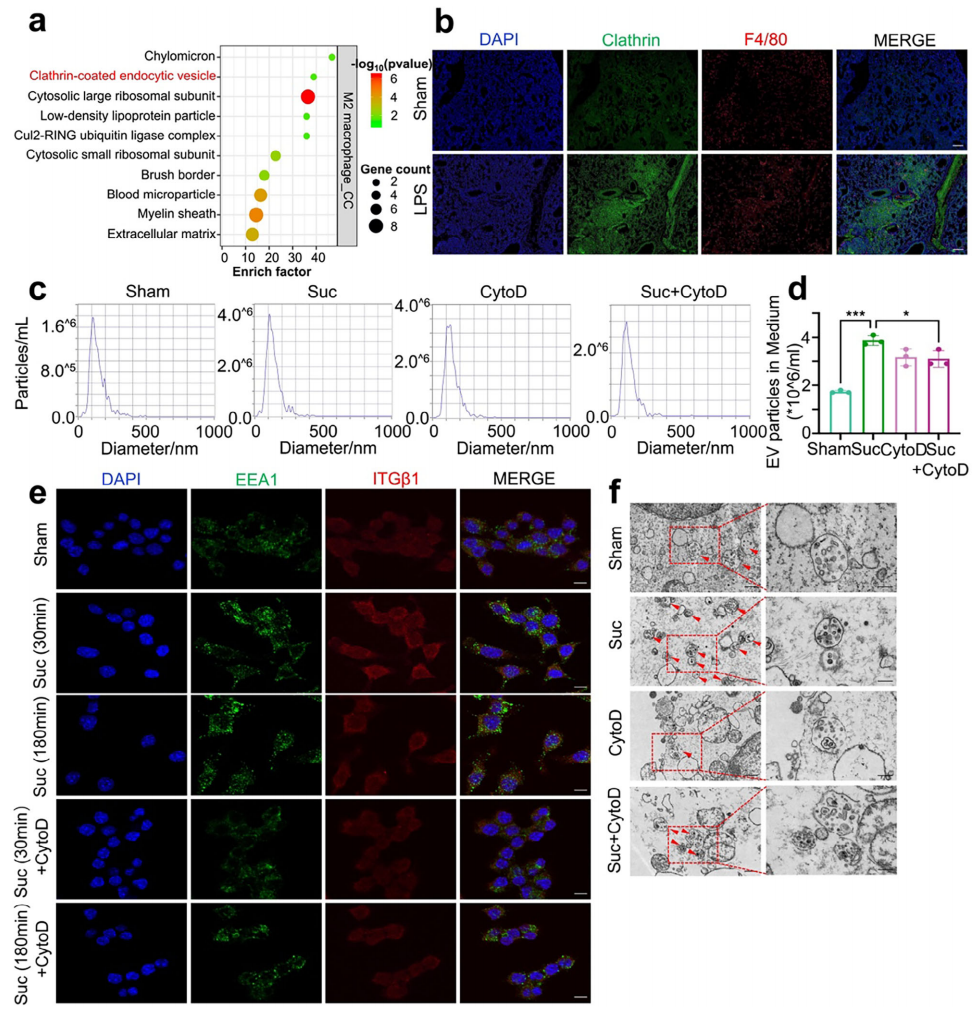
图四 琥珀酸诱导巨噬细胞中MVB的形成和EV分泌[9]
内体分选复合物(ESCRT)在膜出芽和将泛素化膜蛋白分选到内体的特定结构域中起着关键作用,这一过程通过ESCRT-0、-I和-II复合物促进内体内陷[11]。Syntenin-1是一种细胞质适配蛋白,将配体蛋白聚糖与活化的白细胞粘附分子(Alix)连接起来,Alix是ESCRT机制的关键辅助成分,调节内体膜的出芽和脱落,从而驱动EV的合成和释放[12, 13]。为了研究Syntenin-1和Alix在促纤维化EV产生中的作用,研究者分析了它们在对照组和LPS组肺组织中的表达水平。如图五a-c所示,Alix和Syntenin-1在LPS组中的表达和荧光强度都有所增加,并且它们与肺巨噬细胞共定位。敲降巨噬细胞中Alix和Syntenin-1,发现Alix敲降对EV分泌的抑制作用更为显著(图五d和e),透射电镜也显示Alix敲降导致MVB结构更严重的破坏(图五f)。用巨噬细胞来源EV刺激成纤维细胞后,Alix或Syntenin-1敲降组的成纤维细胞活化明显减弱(图五g)。以上结果表明,Syntenin-1和Alix都介导了巨噬细胞中MVB的形成和促纤维化EV的分泌,其中Alix在这一过程中起着更重要的作用。
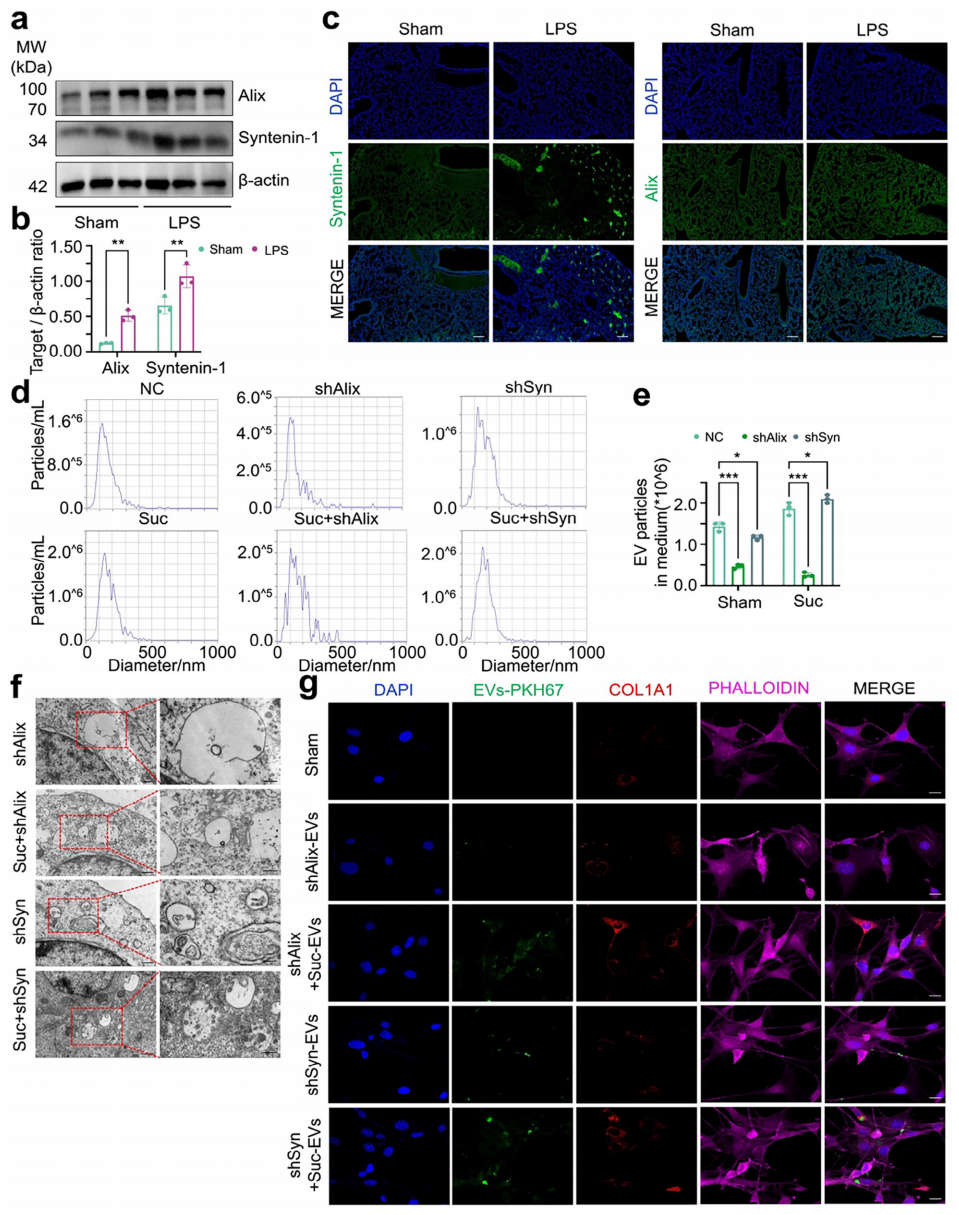
图五 Syntenin-1和Alix调节内吞驱动的MVB形成和EV分泌[9]
最后,研究者探究Alix在SAPF进展中的作用。将shAlix-GFP AAV5病毒通过气管内注射进入小鼠肺部,三周后,连续三天腹腔注射LPS,并在最后一次注射一周后收样(图六a)。结果显示,GFP荧光主要在肺部检测到,表明shAlix-GFP成功靶向肺部(图六b和c)。收集BALF超速离心,NTA显示LPS组EV分泌显著增加,而Alix敲降导致EV数量显著减少(图六d和e),表明Alix是体内EV生物合成的重要驱动因素。评估Alix敲降是否可以减轻肺纤维化并降低LPS相关死亡率。生存分析结果显示,LPS组小鼠在第5天的死亡率达到60%,而Alix敲降后死亡率降低至20%(图六f)。Alix敲降显著减轻了LPS诱导的肺纤维化,表现为胶原蛋白沉积减少和肺泡炎症减少(图六g),伴随着肺成纤维细胞活化的减少,特征是纤连蛋白和COL1A1的表达减少(图六h和i)。以上结果表明,Alix是SAPF中EV分泌的核心调控因子,靶向Alix可有效缓解LPS诱导的EV分泌、纤维化和相关死亡率。
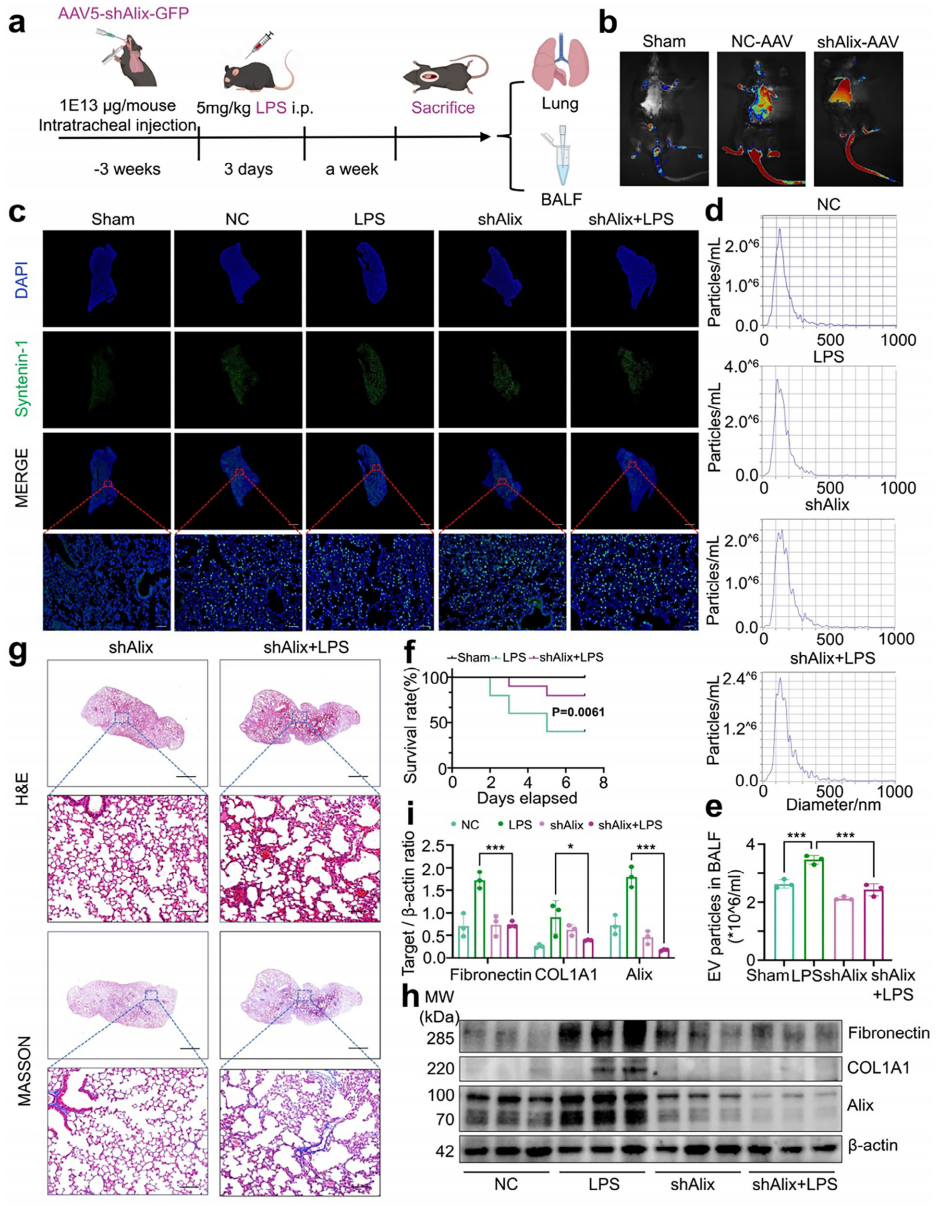
图六 体内抑制Alix可减少EV分泌并缓解SAPF[9]
综上所述,该研究使用多组学分析和体内外多种实验,阐述了琥珀酸和细胞外囊泡(EV)介导的整合素转移在巨噬细胞-成纤维细胞相互作用以及成纤维细胞活化中的作用。发现糖代谢重编程产物琥珀酸,通过诱导巨噬细胞内吞作用,驱动促纤维化EV释放,这些EV介导整合素β1(ITGβ1)从巨噬细胞向成纤维细胞的转移,驱动成纤维细胞活化和脓毒症相关肺纤维化(SAPF)进程。其中,Syntenin-1和Alix介导了巨噬细胞内吞过程中MVB的形成和EV的分泌,且Alix在这一过程中起着更重要的作用,体内敲降Alix可以有效缓解SAPF进展。该研究揭示了EV介导的ITGβ1转移在巨噬细胞-成纤维细胞通讯中的关键作用,为治疗SAPF提供了潜在新靶点和新策略。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hotchkiss RS, Moldawer LL, Opal SM, Reinhart K, Turnbull IR, Vincent JL: Sepsis and septic shock. Nat Rev Dis Primers 2016, 2:16045.
2. Mirzapoiazova T, Kolosova IA, Moreno L, Sammani S, Garcia JG, Verin AD: Suppression of endotoxin-induced inflammation by taxol. Eur Respir J 2007, 30(3):429-435.
3. Xian H, Liu Y, Rundberg Nilsson A, Gatchalian R, Crother TR, Tourtellotte WG, Zhang Y, Aleman-Muench GR, Lewis G, Chen W et al: Metformin inhibition of mitochondrial ATP and DNA synthesis abrogates NLRP3 inflammasome activation and pulmonary inflammation. Immunity 2021, 54(7):1463-1477 e1411.
4. Li B, Xia C, He W, Liu J, Duan R, Ji Z, Pan X, Zhou Y, Yu G, Wang L: The Thyroid Hormone Analog GC-1 Mitigates Acute Lung Injury by Inhibiting M1 Macrophage Polarization. Adv Sci (Weinh) 2024, 11(44):e2401931.
5. Sun ZC, Liao R, Xian C, Lin R, Wang L, Fang Y, Zhang Z, Liu Y, Wu J: Natural pachypodol integrated, lung targeted and inhaled lipid nanomedicine ameliorates acute lung injury via anti-inflammation and repairing lung barrier. J Control Release 2024, 375:300-315.
6. Rajesh R, Atallah R, Barnthaler T: Dysregulation of metabolic pathways in pulmonary fibrosis. Pharmacol Ther 2023, 246:108436.
7. Rosenberg G, Yehezkel D, Hoffman D, Mattioli CC, Fremder M, Ben-Arosh H, Vainman L, Nissani N, Hen-Avivi S, Brenner S et al: Host succinate is an activation signal for Salmonella virulence during intracellular infection. Science 2021, 371(6527):400-405.
8. He Y, Han Y, Zou L, Yao T, Zhang Y, Lv X, Jiang M, Long L, Li M, Cheng X et al: Succinate promotes pulmonary fibrosis through GPR91 and predicts death in idiopathic pulmonary fibrosis. Sci Rep 2024, 14(1):14376.
9. Yang W, Tang R, Zhou Y, Zhang J, Mei S, Peng Y, Huang X, Xing S, Gao Y, Xu Q et al: Succinic Acid-Induced Macrophage Endocytosis Promotes Extracellular Vesicle-Based Integrin Beta1 Transfer Accelerating Fibroblast Activation and Sepsis-Associated Pulmonary Fibrosis. Adv Sci (Weinh) 2025:e07411.
10. Suzuki SW, West M, Zhang Y, Fan JS, Roberts RT, Odorizzi G, Emr SD: A role for Vps13-mediated lipid transfer at the ER-endosome contact site in ESCRT-mediated sorting. J Cell Biol 2024, 223(4):e202307094.
11. Hurley JH, Hanson PI: Membrane budding and scission by the ESCRT machinery: it's all in the neck. Nat Rev Mol Cell Biol 2010, 11(8):556-566.
12. Usmanova N, Tomilin N, Zhivotovsky B, Kropotov A: Transcription factor GABP/NRF-2 controlling biogenesis of mitochondria regulates basal expression of peroxiredoxin V but the mitochondrial function of peroxiredoxin V is dispensable in the dog. Biochimie 2011, 93(2):306-313.
13. Ghossoub R, Lembo F, Rubio A, Gaillard CB, Bouchet J, Vitale N, Slavik J, Machala M, Zimmermann P: Syntenin-ALIX exosome biogenesis and budding into multivesicular bodies are controlled by ARF6 and PLD2. Nat Commun 2014, 5:3477.



