技术分享:PGC-1α介导PV中间神经元成熟的分子开关机制
哺乳动物大脑皮层包含着大量多样的谷氨酸能神经元和GABA能中间神经元[1]。尽管皮质神经元特化发生在胚胎发育时期[2],但它们通常在出生后发育的较晚时期才获得成熟属性,原因是调节其重要功能的基因直至那时才开始表达。这一现象表明,皮质神经元的终末分化与神经元活性、出生后发育过程中接收的环境信号有关。然而,皮质神经元的成熟是不同步的,因而不同的细胞类型必须进化出特定的分子机制,来将环境线索转化为在适当发育阶段的终末分化信号。
表达小清蛋白(PV+)的快速尖峰中间神经元是皮质功能的关键调节器,也是数量最多的GABA能细胞[3]。它们具有与高代谢需求相关的独特电生理特征,包括快速动作电位动力学和离子传导[4]。与其他细胞一样,PV+中间神经元在发育过程中通过逐步选择专用的基因表达程序来获得独特的形态、神经化学和电生理特征。可是,相比其他中间神经元,PV+中间神经元的成熟期特别长。例如,人类PV的表达仅在婴儿期后急剧增加,而包裹这些细胞的神经元周围网络在8岁左右才达到成熟[5]。即使在神经元分化速度比灵长类动物快得多的啮齿动物,PV+中间神经元也只在出生第三周才完全获得高频快速动作电位的特性[6]。然而,这种成熟期较长的发育调控的确切机制尚不清楚。
2025年7月,Cell期刊报道了一项研究,解析了调控小鼠大脑皮层PV+中间神经元终末分化的细胞和分子机制。研究发现PV+中间神经元的成熟由神经元活性触发,并由转录辅因子过氧化物酶体增殖物激活受体γ辅激活因子1-α(PGC-1α)介导。发育缺失PGC-1α阻止了PV+中间神经元获得独特的结构、电生理、突触和代谢特征,并破坏了向不同亚型分化的多样性。PGC-1α作为PV+中间神经元分化的主调节因子,通过包括ERRγ和Mef2c在内的转录复合物直接调控下游基因表达。该研究揭示了一种分子开关,将神经活性转化为特定的转录程序,促进PV+中间神经元在适当的发育阶段成熟, 这为理解哺乳动物大脑神经元成熟和复杂认知能力的发育机制提供了新见解[7]。
首先,研究者探究小清蛋白(PV)表达和神经元周围网络形成是否受到神经元活动的调节。使用基于人工设计药物专用受体(DREADDs)的化学遗传学方法来增加PV+中间神经元的活性。简而言之,向刚出生P0天的Lhx6-Cre幼鼠的初级体感皮层(S1)注射分别表达GFP和诱导神经元激活的hM3Dq-mCherry的Cre依赖性腺相关病毒(AAV),随后在P10-P12天时每天注射两次氯氮平-N-氧化物(CNO,图一A)。选择Lhx6-Cre小鼠是因为皮质中间神经元来源于内侧神经节隆起(MGE),随后发育出的PV+中间神经元和生长抑素(SST+)中间神经元可在有丝分裂后立即表达转录因子Lhx6[8]。结果发现表达hM3Dq第2/3层(L2/3)PV+中间神经元的PV和多花紫藤凝集素(WFA)表达强度高于无hM3Dq表达的相邻中间神经元(GFP+mCherry−)(图一B和C),表明PV+中间神经元的直接激活促进了PV和WFA的表达。WFA是神经元周围网络标志物。锥体细胞是皮质中间神经元兴奋性输入的主要来源,于是研究者研究谷氨酸能突触的形成是否调节发育中PV+中间神经元的PV和WFA表达。谷氨酸能突触的形成需要酪氨酸激酶受体ErbB4。研究者将Erbb4+/+和Erbb4F/F小鼠与RCLtdTomato/+(Ai9)报告小鼠杂交,向P1天子代幼鼠的S1注射AAV-Cre(图一D)。发现Erbb4F/F; Ai9小鼠中的tdTomato+PV+中间神经元的PV强度低于邻近的未转导的PV+细胞(图一E和F),表明谷氨酸能突触介导神经元活性调节了PV表达。研究者进一步敲降编码Vglut1和Vglut2的Slc17a7和Slc17a6来减少皮质谷氨酸能神经传递,将表达shRNA的Cre依赖性AAV注射到P5天NexCre/+幼鼠的S1中(图一G)。与对照组相比,敲降小鼠皮层中表达PV的细胞密度和神经元周围网络密度显著降低(图一H和I)。以上数据表明,皮质兴奋性活动对PV+中间神经元的PV和WFA起始表达至关重要。
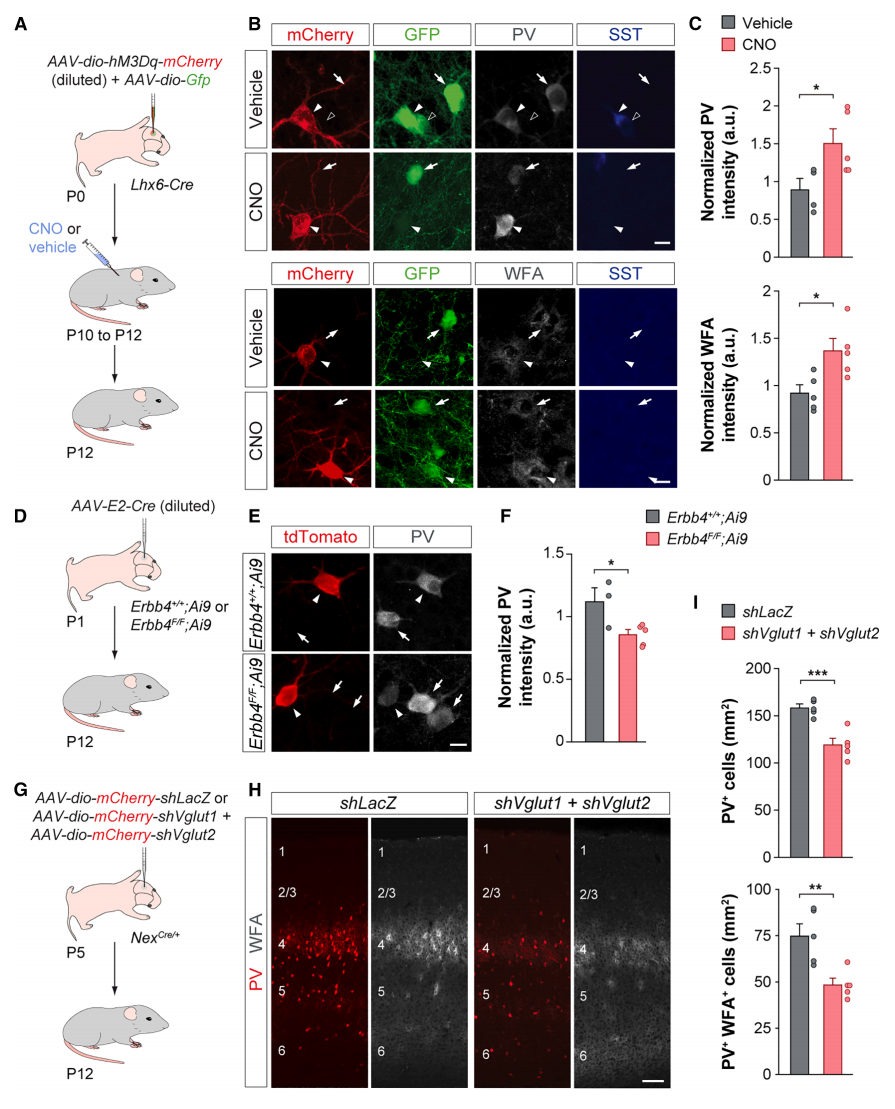
图一 PV+中间神经元的PV和WFA表达取决于出生后早期发育期间的神经元活性[7]
研究者推测转录调节剂可能负责驱动PV+中间神经元的广泛终末分化程序,以响应神经元活性的增加。为了鉴定这些因子,研究者从出生后早期幼鼠皮质中挖掘中间神经元RNA测序(RNA-seq)数据集[9],并筛选富含PV+中间神经元的转录调节剂,确定编码PGC-1α的Ppargc1a是主要候选者(图二A)。Ppargc1a开始在P5天周围的新皮层中表达,从P7天开始(PV表达和神经周围网络形成之前)集中在L2到L6的稀疏胞体中。大多数含有高Ppargc1a mRNA水平的皮质细胞都是MGE衍生的中间神经元,表达Ppargc1a的MGE衍生中间神经元的比例逐渐增加,直到P12天达到平台期(图二B)。将Lhx6-Cre小鼠和RCLGfp/+(RCE)报告小鼠杂交,分析在新皮层PV表达开始期间表达PGC-1α的MGE衍生细胞的比例。发现大多数表达PGC-1α的MGE衍生细胞是PV+中间神经元(GFP+SST-细胞),细胞比例在P10和P12之间增加(图二C和D)。在此期间,PGC-1α集中在PV+中间神经元的细胞核中(图二E和F)。相比之下,表达PGC-1α的SST+细胞的比例仍然相对较低(图二C和D)。为研究PGC-1α是否是PV+中间神经元中表达PV和WFA所必需的,研究者构建了在MGE衍生细胞中特异性敲除Ppargc1a的Lhx6-Cre; Ppargc1aF/F; RCE小鼠。结果显示,敲除Ppargc1a的幼鼠表现出PV表达的剂量依赖性损失(图二G和H)。Ppargc1a敲除小鼠的PV+中间神经元被神经元周围网络包围的数量也少于对照组,特别是在L4,神经元周围网络通常在P12天最为丰富(图二G和H)。为了确定PGC-1α是否足以加速PV+中间神经元的PV起始表达,向P1天Lhx6-Cre幼鼠S1注射了表达Gfp和Ppargc1a的Cre依赖性AAV混合物,分析P12天PV的表达(图二I)。与对照组相比,过表达PGC-1α增加了该阶段PV+中间神经元的密度(图二J和K)。以上实验表明,PGC-1α对于驱动出生后早期皮质中PV和WFA的表达是必要和充分的。
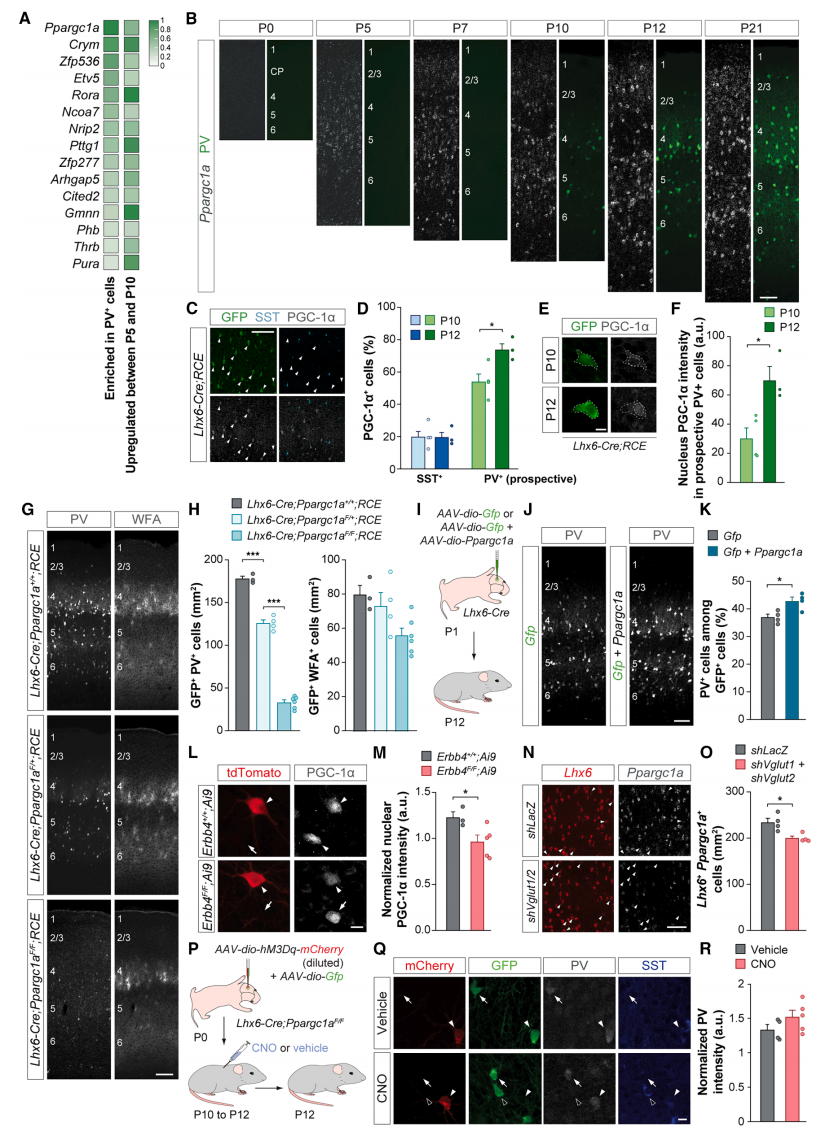
图二 PV+中间神经元中PV和WFA的表达活性剂量依赖于PGC-1α[7]
随后,研究者评估降低兴奋性输入密度(图一D)或降低新皮层中谷氨酸能神经传递(图一G)是否影响PV+细胞的PGC-1α表达。发现这两种操作都降低了PV+细胞中核PGC-1α水平,及其表达Ppargc1a的Lhx6+细胞数量(图二L-O)。使用激活型DREADDs在Lhx6-Cre; Ppargc1aF/F幼鼠P10和P12天之间增加PV+细胞活性(图二P)。与野生型小鼠的结果相比(图一B和C),CNO注射和对照注射的小鼠之间的PV和WFA表达没有显著差异(图二Q和R)。在对照和CNO条件下,Lhx6-Cre幼鼠中过表达Ppargc1a足以缓解这种影响。以上数据表明,PGC-1α在出生后早期发育过程中介导了神经元活性对PV+中间神经元的PV和WFA表达影响。
接下来,研究者探究PGC-1α是否调节皮质PV+中间神经元的终末分化。使用单细胞RNA测序(scRNA-seq)分析来自对照组Lhx6-Cre; Ppargc1a+/+和条件性敲除组Lhx6-Cre; Ppargc1aF/F小鼠的MGE衍生中间神经元基因表达。在神经元特异性人突触蛋白-1基因启动子的驱动下,将表达tdTomato的Cre依赖性AAV注射到P1天幼鼠S1中。然后分离P21天S1的单细胞悬浮液,使用流式分选tdTomato标记细胞,进行scRNA-seq(图三A)。经过质量控制,从每种基因型的三次高度一致的实验重复中分离出5268个对照和3139个Ppargc1a缺失的MGE衍生中间神经元,使用基于Pvalb和Sst基因表达的聚类将细胞分为PV+和SST+身份(图三B)。发现Ppargc1a缺失的PV+和SST+中间神经元与相应的对照细胞聚集在一起(图三B),表明PGC-1α并不调控MGE衍生中间神经元的命运。进行差异基因表达(DGE)分析,发现与对照神经元相比,许多具有PV+中间神经元高度特征的基因在Ppargc1a缺失的PV+中间神经中下调(图三C)。由于PV+和SST+具有共同的发育起源和共享的转录程序,研究者通过比较P21天对照PV+和SST+中间神经元的转录组来鉴定富集于PV+细胞的基因,并分析它们在Ppargc1a缺失的PV+细胞中的表达。发现在缺乏PGC-1α的PV+中间神经元中,许多富集于PV+细胞的基因下调,包括Pvalb、Cplx1、Syt2、Kcnc1、Kcna1和Bcan(图三D-F)。这些基因编码了调控成熟PV+中间神经元中广泛关键特性的蛋白质,包括神经化学、电生理和突触特征。与对照组相比,Ppargc1a缺失的PV+中间神经元中上调的基因相对较少(图三D)。Ppargc1a缺失的PV+中间神经元表现出较慢的快速动作电位动力学,影响了快速动作电位上升时间、衰减时间和半宽度,导致P21天的最大放电频率降低(图三G)。相反,在发育过程中过表达Ppargc1a会驱动PV+中间神经元的成熟特性,包括更快的快速动作电位动力学和P21天最大放电频率的增加(图三H)。以上结果表明,PGC-1α对于PV+中间神经元的功能成熟是必要和充分的。
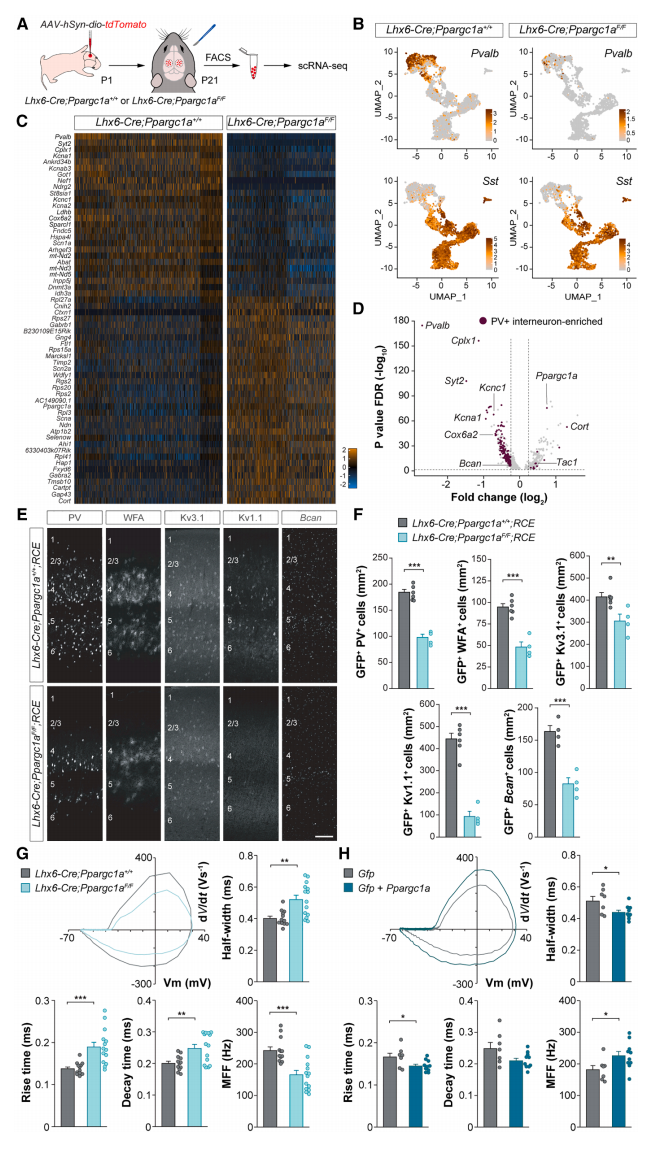
图三 PGC-1α是皮质PV+中间神经元成熟的主调节因子[7]
基于PV+中间神经元具有相当大的代谢需求,比其他中间神经元和锥体细胞含有更多的线粒体[10]。使用AAV-mito-EmGFP标记线粒体(图四A),观察到PV+和SST+中间神经元在P10天具有相似的线粒体含量(图四B和C)。然而,与P21天的SST+细胞相比,PV+中间神经元的线粒体含量不成比例地显著增加(图四B和C),以及大多数线粒体基因在PV+中间神经元中高度上调(图四D),表明PV+中间神经元的线粒体发育与细胞成熟同时发生。由于PGC-1α是细胞线粒体生物合成的主要调节因子,研究者测试缺失Ppargc1a是否破坏PV+中间神经元的代谢。比较PV+和SST+中间神经元DEG分析表明,与代谢途径相关的基因在Ppargc1a缺失PV+中间神经元受到影响,但在SST+细胞中没有(图四E)。许多与线粒体功能相关并富集于PV+中间神经元的基因在Ppargc1a缺失细胞中下调(图三C和D),如编码细胞色素c氧化酶亚基的基因Cox6a2,对PV+细胞具有高度特异性(图四F和G)。为了检查PGC-1α的缺失是否影响MGE衍生中间神经元的线粒体数量, 在P1天向Ppargc1a缺失幼鼠S1注射表达mito-EmGFP的AAV,P21天时分析线粒体含量(图四H)。发现Ppargc1a的缺失影响了PV+中间神经元的线粒体数量,但不显著影响SST+细胞的线粒体(图四I和J)。由于代谢和线粒体是许多组织系统成熟的驱动因素,研究者分析了Cox6a2缺失幼鼠在P12天时的PV和WFA表达。发现与对照组相比,Cox6a2缺失幼鼠的PV密度降低(图四K和L),表明线粒体功能障碍影响了PV+细胞的成熟。以上数据表明,PGC-1α驱动表达了一个分子程序来调控PV+中间神经元的终末分化,并使其具有丰富的线粒体生物合成。
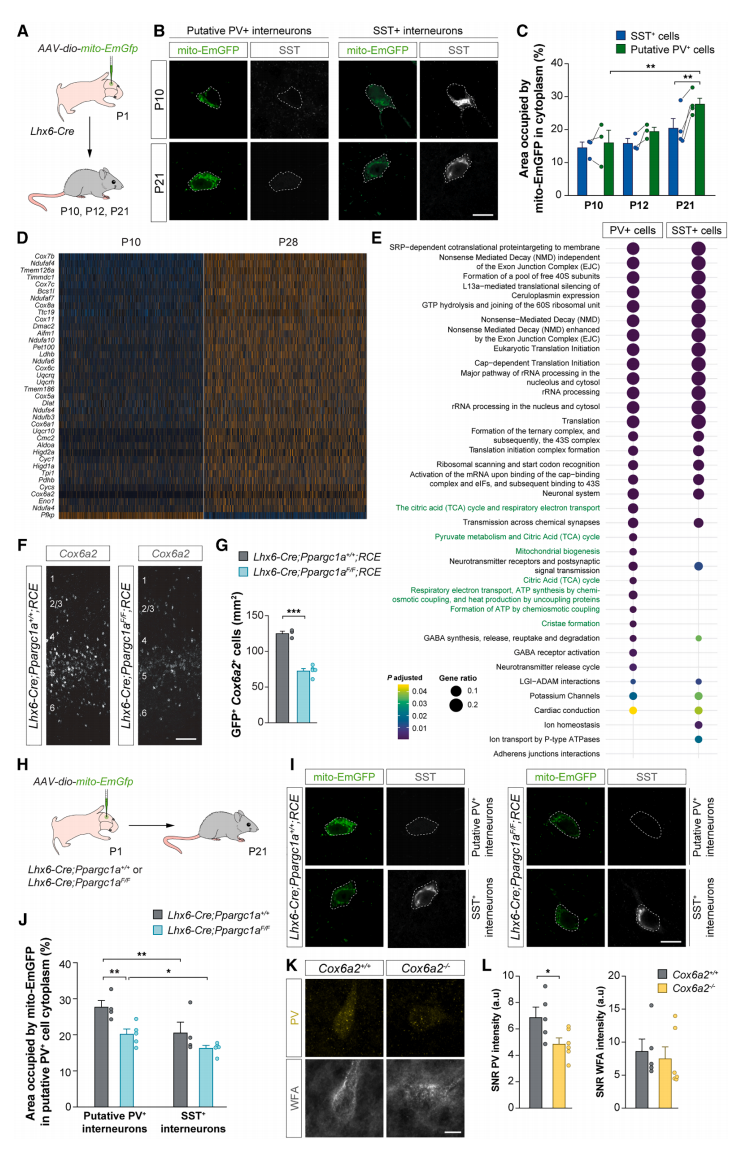
图四 PGC-1⍺调节皮质PV+中间神经元的线粒体功能[7]
有研究表明线粒体代谢决定了神经元成熟的速度[11]。研究者推测在缺乏PGC-1α的PV+中间神经元中,中断线粒体生物合成可能会减缓细胞终末分化。或者,PGC-1α通过直接与启动子和增强子位点相互作用来调控PV+中间神经元下游靶基因的表达。于是,研究者从P12天野生型小鼠中解剖S1,制备核悬浮液,并使用PGC-1α抗体进行核酸酶CUT&RUN测定(图五A)。发现PGC-1α结合在75%的Ppargc1a缺失PV+细胞DEG基因上(图五B)。例如,PGC-1α结合在Bcan、Cplx1和Kcna1的启动子上(图五C),这些基因在PV+中间神经元中高度富集,对其独特特性至关重要。PGC-1α也结合在Kcnc1的增强子位点,可能与Pvalb和Cox6a2有关(图五C)。此外,PGC-1α能够通过结合Ppargc1a脑特异性启动子来调节自身在新皮层中的表达(图五C)。
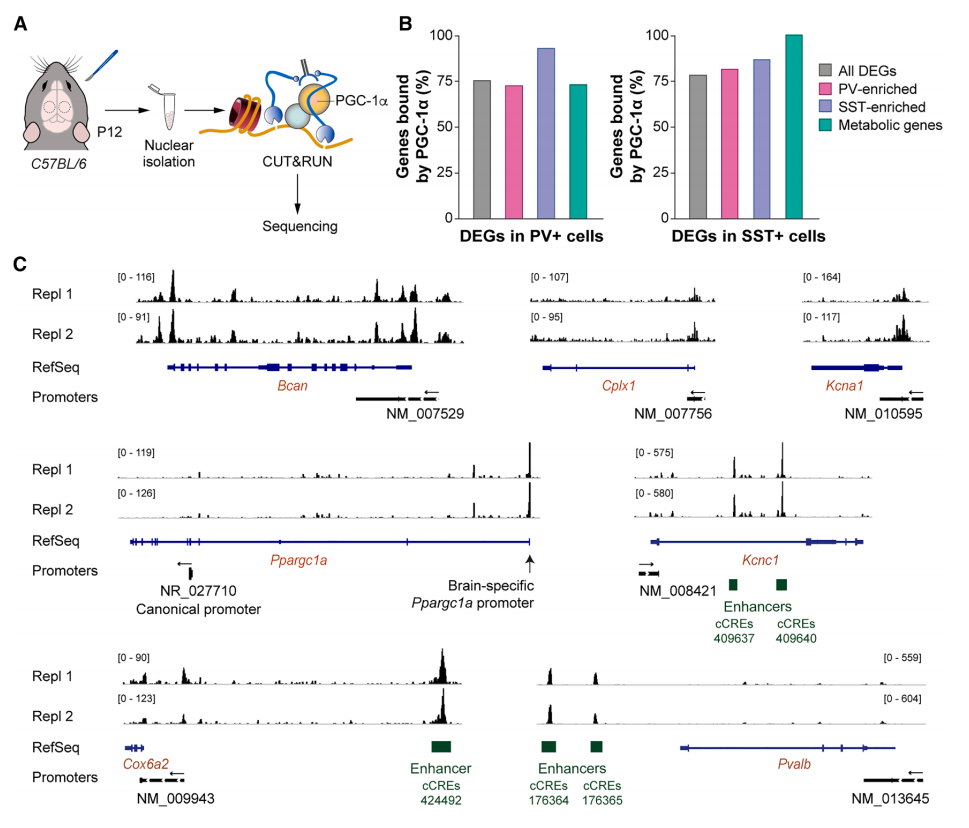
图五 PGC-1α通过直接转录调控调节皮质PV+中间神经元的成熟[7]
PGC-1α不直接结合DNA,而是通过与转录因子和染色质修饰器相互作用来调节基因表达。例如,雌激素相关受体(ERR)家族的成员是PGC-1α的已知共激活因子。其中,Esrrg mRNA在P12和P21天时在PV+中间神经元中的表达比Esrra更加丰富和特异,并且它与Ppargc1a广泛共定位。ERRγ表达特异性直接受PGC-1α控制(图六A),并且在条件性Ppargc1a缺失小鼠中ERRγ水平显著降低(图六B和C)。尽管ERRα被认为与PGC-1α合作调节成年皮层中Pvalb表达[12],但之前的观察表明ERRγ是PGC-1α的相关辅激活因子,调控PV+中间神经元的终末分化。为了验证这一假设,研究者从P12天野生型小鼠中解剖S1,制备核悬浮液,并使用ERRγ抗体进行CUT&RUN(图六D)。皮质神经元中PGC-1α结合靶基因的大约一半位点(52.3%)也与ERRγ相结合。与PGC-1α一样,ERRγ结合在基因启动子或远端基因间和内含子区域。Ppargc1a缺失PV+中间神经元中的75%DEG基因直接与ERRγ相结合,其中大多数基因也与PGC-1α结合(图六E)。例如,ERRγ结合Kcna1、Cplx1的启动子和Ppargc1a的脑特异性启动子(图六F),表明PGC-1α和ERRγ协同调节出生后早期皮层PV+中间神经元的终末分化。对PGC-1α结合位点进行基序富集分析,发现肌细胞增强因子2(Mef2)家族的成员是其潜在结合伴侣。P12天的Co-IP实验证明,Mef2c与PGC-1α的长亚型PGC-1α1直接相互作用(图六G和H)。
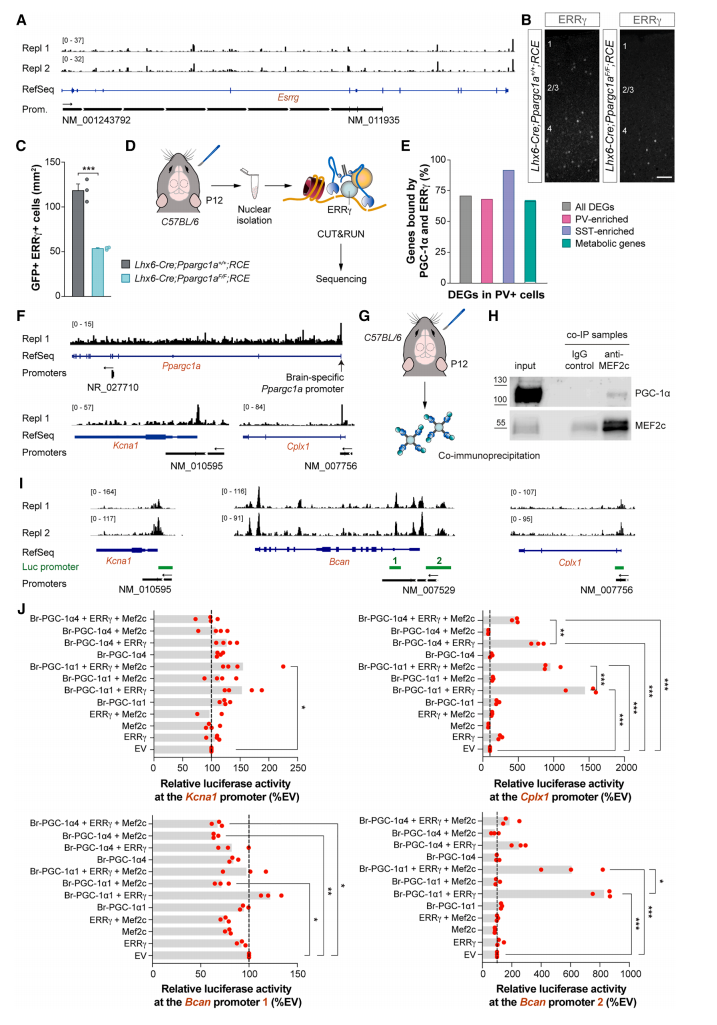
图六 PGC-1α、ERRγ和MEF2C直接调控PV+中间神经元的下游基因表达[7]
为了破译PGC-1α、ERRγ和Mef2c如何调节PV+细胞的下游基因表达,用长亚型PGC-1α1和短亚型PGC-1α4进行体外萤光素酶实验。评估PGC-1α,ERRγ和Mef2c的不同组合能否通过结合启动子特定DNA序列来调节Kcna1、Bcan和Cplx1的表达(图六I)。结果显示,PGC-1α1、ERRγ和Mef2c促进Kcna1的表达。PGC-1α的两个亚型和ERRγ都可以促进Cplx1和Bcan的表达,但仅在与Bcan启动子2结合时(图六J)。这与之前的研究一致,表明ERRγ可以直接与PGC-1α的两种亚型相互作用,而只有PGC-1α长亚型具有Mef2c结合位点[13]。有趣的是,Mef2c与Bcan启动子1结合时可以负调控Bcan表达,表明PGC-1α、ERRγ和Mef2c并不总是协同工作(图六J)。同样,Mef2c降低了ERRγ和PGC-1α1/PGC-1α4对Cplx1表达的强烈激活,但它单独或与PGC-1α一起时并不抑制Cplx1的表达。以上数据表明,PGC-1α通过与ERRγ相互作用,直接调控PV+中间神经元成熟所需的下游基因表达。最后,研究者还证明了PGC-1α不仅是PV+中间神经元终末分化所必需的,而且似乎也有助于在出生后早期皮层的细胞分化亚型的多样化。
综上所述,该研究确定了分子开关调控PV+中间神经元终末分化的细胞和分子机制。PV+中间神经元的成熟受到神经元活性的调节,直接影响了PV蛋白表达和神经元周围网络形成的启动。PGC-1α是这一过程的主调节因子,通过与ERRγ和Mef2c协作直接调控下游基因表达,促进线粒体生物合成和细胞类型特异的转录程序,驱动终末分化。该研究为理解大脑发育中神经元成熟的机制提供了新的视角,也为神经发育障碍相关疾病研究提供了潜在分子靶点。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Jorstad NL, Close J, Johansen N, Yanny AM, Barkan ER, Travaglini KJ, Bertagnolli D, Campos J, Casper T, Crichton K et al: Transcriptomic cytoarchitecture reveals principles of human neocortex organization. Science 2023, 382(6667):eadf6812.
2. Wamsley B, Fishell G: Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature reviews Neuroscience 2017, 18(5):299-309.
3. Kepecs A, Fishell G: Interneuron cell types are fit to function. Nature 2014, 505(7483):318-326.
4. Hu H, Gan J, Jonas P: Interneurons. Fast-spiking, parvalbumin⁺ GABAergic interneurons: from cellular design to microcircuit function. Science 2014, 345(6196):1255263.
5. Rogers SL, Rankin-Gee E, Risbud RM, Porter BE, Marsh ED: Normal Development of the Perineuronal Net in Humans; In Patients with and without Epilepsy. Neuroscience 2018, 384:350-360.
6. Doischer D, Hosp JA, Yanagawa Y, Obata K, Jonas P, Vida I, Bartos M: Postnatal differentiation of basket cells from slow to fast signaling devices. J Neurosci 2008, 28(48):12956-12968.
7. Moissidis M, Abbasova L, Selten M, Alis R, Bernard C, Domínguez-Canterla Y, Oozeer F, Qin S, Kelly A, Mòdol L et al: A postnatal molecular switch drives activity-dependent maturation of parvalbumin interneurons. Cell 2025.
8. Liodis P, Denaxa M, Grigoriou M, Akufo-Addo C, Yanagawa Y, Pachnis V: Lhx6 activity is required for the normal migration and specification of cortical interneuron subtypes. J Neurosci 2007, 27(12):3078-3089.
9. Favuzzi E, Deogracias R, Marques-Smith A, Maeso P, Jezequel J, Exposito-Alonso D, Balia M, Kroon T, Hinojosa AJ, E FM et al: Distinct molecular programs regulate synapse specificity in cortical inhibitory circuits. Science 2019, 363(6425):413-417.
10. Gulyás AI, Buzsáki G, Freund TF, Hirase H: Populations of hippocampal inhibitory neurons express different levels of cytochrome c. The European journal of neuroscience 2006, 23(10):2581-2594.
11. Iwata R, Casimir P, Erkol E, Boubakar L, Planque M, Gallego López IM, Ditkowska M, Gaspariunaite V, Beckers S, Remans D et al: Mitochondria metabolism sets the species-specific tempo of neuronal development. Science 2023, 379(6632):eabn4705.
12. McMeekin LJ, Joyce KL, Jenkins LM, Bohannon BM, Patel KD, Bohannon AS, Patel A, Fox SN, Simmons MS, Day JJ et al: Estrogen-related Receptor Alpha (ERRα) is Required for PGC-1α-dependent Gene Expression in the Mouse Brain. Neuroscience 2021, 479:70-90.
13. Zhang Y, Huypens P, Adamson AW, Chang JS, Henagan TM, Boudreau A, Lenard NR, Burk D, Klein J, Perwitz N et al: Alternative mRNA splicing produces a novel biologically active short isoform of PGC-1alpha. The Journal of biological chemistry 2009, 284(47):32813-32826.



