技术分享:细胞器自噬受体的无序区负责调控细胞器分裂与自噬
在生理和病理条件下,当出现衰老、有毒物质、错误折叠的蛋白质积累、或者病原体攻击时,都可能激活细胞器如内质网(ER)、线粒体和高尔基体进行溶酶体清除[1, 2]。ER自噬、线粒体自噬和高尔基体自噬统称为细胞器自噬,是由细胞器自噬受体激活后所驱动。例如ER自噬受体FAM134B、SEC62、TEX264、CCPG1,线粒体自噬受体FUNDC1、BNIP3、BNIP3L/NIX,以及高尔基体受体YIPF3和YIPF4等。所有这些膜结合细胞器自噬受体都存在一个细胞质内在无序区域(IDR)模块,IDR通过短的共有LC3相互作用区(LIR)基序与脂化LC3/GABARAP蛋白相结合[3, 4](图一a-c)。细胞器自噬受体的激活有两个主要后果:(1)自噬细胞器的分裂,分离出待降解的部分;(2)通过巨自噬、微自噬或LC3依赖的转运途径,向酸性降解细胞器内运输细胞器碎片[5]。细胞器碎片运输到降解室中需要LC3蛋白和LIR参与,但细胞器是如何分配的尚不清楚。
2025年8月,Nature Cell Biology期刊在线报道了一项研究,细胞器自噬受体上的膜锚定模块调控着细胞器的亚细胞分布,而具有负净电荷的细胞质内在无序区域(IDR)模块负责调控细胞器分裂且存在LC3相互作用区域(LIR)。LIR是溶酶体递送所必需的,但对于细胞器分裂是不必要的。IDR以生理pH下的负净电荷为特征,长度大于47个氨基酸,具有细胞器间的功能互换性。内质网(ER)自噬受体的IDR表达在线粒体外膜时,可触发DRP1辅助的线粒体分裂和线粒体自噬。而线粒体自噬受体的IDR表达在ER时,也能触发ER分裂和自噬。该研究颠覆了“膜锚定模块主导细胞器分裂”的传统认知,揭示了IDR作为细胞器自噬调控的核心作用,为理解细胞器稳态调控提供了全新视角,也为治疗细胞器功能异常疾病提供了新思路[6]。
ER、线粒体和高尔基体膜上存在大量的自噬受体(图一a-c)。细胞器自噬受体由一个膜锚定模块和一个胞质内在无序区域(IDR)模块组成,膜锚定模块单次或多次跨膜,IDR包含与LC3/GABARAP蛋白结合的LIR结构域(图一a-c)。哺乳动物FAM134家族成员和RTN3L锚定在ER膜上,网状蛋白同源结构域(RHD)仅部分跨越脂质双层,具有内在的膜重塑活性(图一a)。所有其他细胞自噬受体都通过传统的跨膜结构域锚定在膜上(图一a-c)。哺乳动物和酵母ER自噬受体、线粒体自噬受体和高尔基体自噬受体的IDR长度在47-250个残基之间(图一d),且大多只有一个LIR。尽管细胞器自噬受体的IDR序列各不相同,但都具有生理pH值下负净电荷的特征(图一e)。
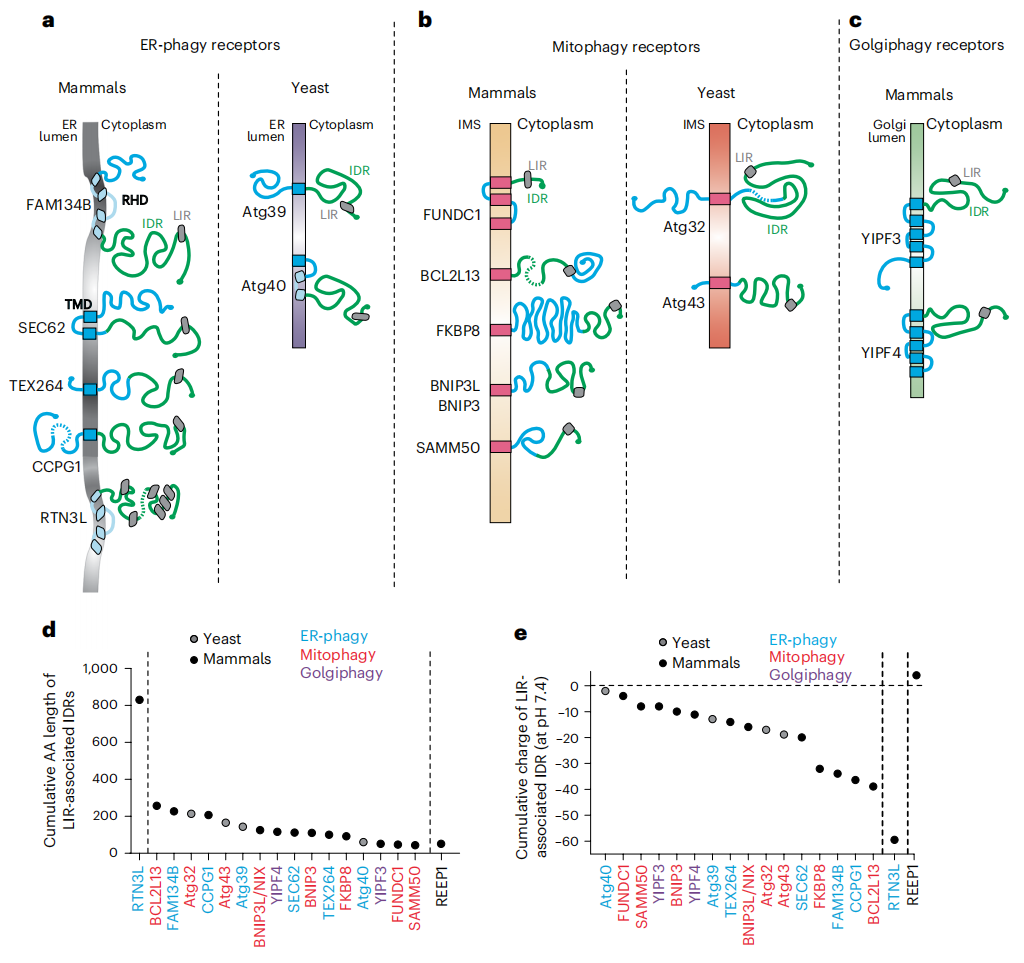
图一 膜结合细胞器自噬受体的特征[6]
异位表达ER自噬受体可用于表征其功能、相互作用及其调控机制。研究者首先表达Halo标签标记的FAM134B、SEC62和TEX264(图二,左),比较它们诱导ER自噬的能力。通过共聚焦激光扫描显微镜(CLSM)监测ER自噬,用巴弗洛霉素A1(BafA1)处理小鼠胚胎成纤维细胞(MEF),以抑制溶酶体水解和保护LAMP1阳性内溶酶体(EL)中的物质。FAM134B、SEC62或TEX264的表达增加了LAMP1阳性EL里的钙联蛋白(CNX)标记ER(图二c,g和k),高于对照组细胞中观察到水平(图二a,e,i和m)。而仅表达ER自噬受体的膜锚定模块FAM134BRHD(图二b和e)、SEC62TMD(图二f和i)或TEX264TMD(图二j和m),不会触发EL内的ER递送。同样地,突变相应LIR的全长蛋白FAM134BLIR(图二d和e),SEC62LIR(图二h和i)和TEX264LIR(图二l和m)也不会触发EL内的ER递送。接着,在没有BafA1处理的情况下,使用HaloTag测定法检测细胞激活的自噬通量。在MEF细胞里表达ER自噬报告基因HT17,它是由HaloTag通过17个残基跨膜结构域连接到ER膜上组成的37 kDa嵌合多肽。当ER片段被递送到溶酶体后,HT17被水解产生约33 kDa的Halo片段,可以在凝胶中直接监测(图二n)。结果证实了图二a-m的成像数据,表达sfGFP标记的FAM134B、SEC62和TEX264(图二n,上图)会触发ER自噬,产生Halo裂解片段荧光;而sfGFP标记的其他模块则没有产生Halo裂解片段(图二n)。以上数据表明,表达ER自噬受体会诱导ER自噬。
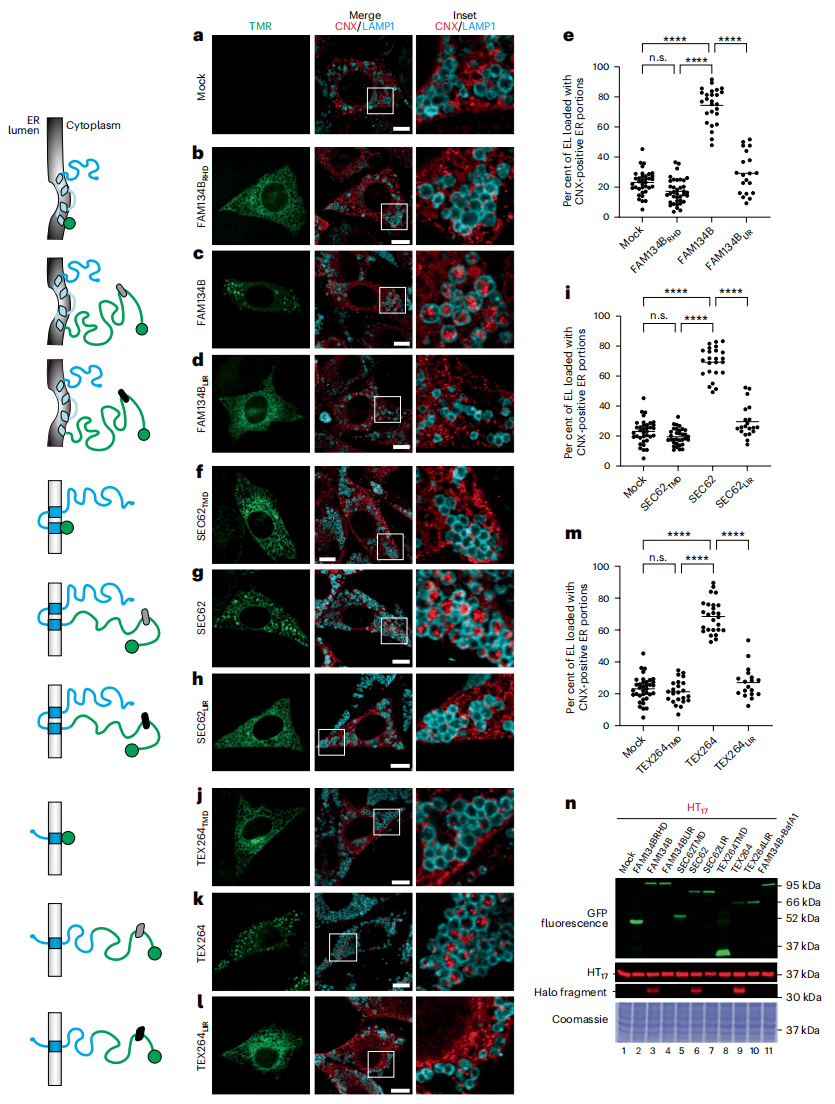
图二 CLSM分析内质网自噬的诱导能力[6]
接下来,研究者测试膜锚定模块和IDR模块诱导ER自噬的能力。在MEF中表达细胞质IDR模块,用17个残基的跨膜结构域将FAM134BIDR、SEC62IDR或TEX264IDR锚定在ER膜上,并用sfGFP标记ER管腔(图三)。CLSM分析(图三a-g)和LysoQuant定量(图三h)显示,与只表达膜锚定模块的细胞(GT17)相比,表达三个IDR模块的ER片段递送到溶酶体内显著增强(图三b、c、d和h)。而突变相应的LIR则消除了这种溶酶体递送的增强(图三e-h)。HaloTag测定显示,在只表达膜锚定GT17的细胞中没有产生Halo裂解片段荧光,而表达sfGFP标记IDR模块的细胞中产生了Halo裂解片段(图三i),表明膜锚定模块在ER自噬诱导中是不必要的,而IDR模块可诱导ER自噬。在用BafA1处理的MEF中,用抗GFP免疫电子显微镜(IEM)监测GFP的定位。结果显示,膜锚定的GT17-SEC62IDR和GT17-SEC62IDRLIR定位在细胞质的内质网管腔中(图三j和k,红色箭头)。但是表达正常IDR模块还能在EL腔内显示GFP阳性(图三j,蓝色箭头),而突变LIR模块不能定位到EL腔内(图三k),证实溶酶体递送需要LC3的参与。
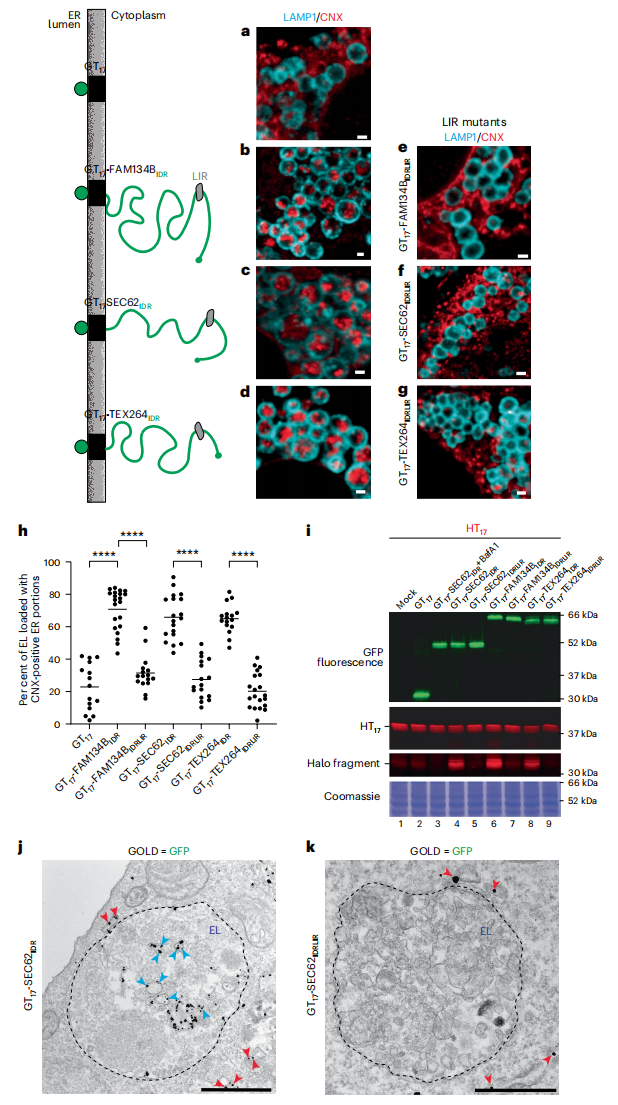
图三 IDR的存在触发ER自噬[6]
随后,研究者直接监测ER自噬受体IDR模块的ER分裂功能。采用ATG7缺失的MEF细胞进行实验(图四a),其LC3脂质化[7]的缺失抑制了LAMP1阳性降解细胞器内ER片段的递送[8],从而将ER片段保存在细胞质中。在ATG7缺失的MEF细胞中重复了图三所示实验。通过RT-TEM分析细胞中ER超微结构,只有表达GT17-SEC62IDR和GT17-SEC62IDRLIR才能驱动细胞质中可见的ER衍生囊泡形成(图四b-e,红色箭头)。用Halo标记ER(HT17、HT17-SEC62IDR和HT17-SEC62IDRLIR)进行的FRAP分析证实,表达IDR模块SEC62IDR和SEC62IDRLIR的细胞荧光恢复受到显著抑制(图四f和g,绿色曲线)。这与RT-TEM图像结果相一致,表明表达IDR模块可导致ER片段与主体ER出现物理分离,并且IDR模块中的LIR对于细胞器分裂是不必要的。
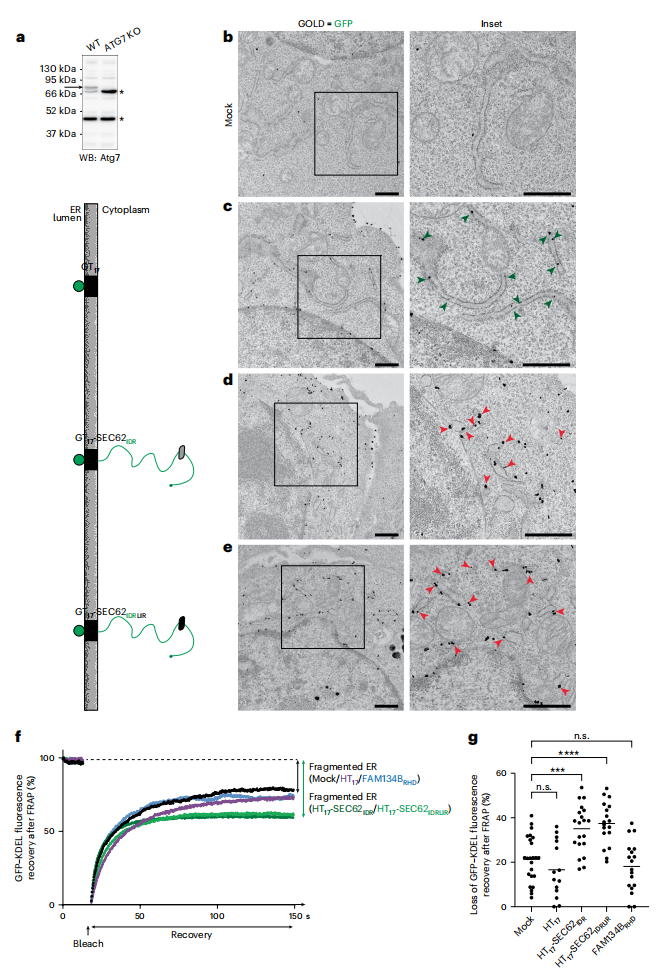
图四 在ATG7-KO MEF中监测IDR模块对ER分裂的影响[6]
其他细胞器的自噬受体也显示具有相似特征IDR模块。于是,研究者探究ER自噬受体的IDR模块能否驱动线粒体的溶酶体递送信号。在MEF细胞表达sfGFP标记的线粒体蛋白TOMM20跨膜结构域以靶向线粒体外膜(Mito-GFP,图五a),或同时融合表达SEC62IDR、FAM134BIDR或TEX264IDR模块(图五c,e和g),或同时融合表达相应LIR突变的IDR模块(图五d,f和h)。用BafA1处理MEF细胞后,仅在融合表达SEC62IDR、FAM134BIDR或TEX264IDR模块的LAMP1阳性EL中检测到显著增强的线粒体片段;而LIR突变后同样阻碍了线粒体片段的溶酶体递送(图五a-h)。在表达线粒体自噬报告基因HMAVSTM的细胞中进行HaloTag检测,证实线粒体自噬需要表达在线粒体膜上的ER自噬受体IDR模块,且需要与LC3结合(图五i)。通过IEM监测到表达SEC62IDR(图五c)产生的线粒体片段递送到EL内(图五k),而突变LIR后SEC62IDRLIR(图五d)不能递送到EL内,而是留在细胞质中(图五l)。以上数据表明,表达在线粒体膜上的来自ER自噬受体的IDR模块可以驱动线粒体自噬。研究者同样在缺乏ATG7的MEF中重复了图五b–h所示的实验,证实了ER自噬受体的IDR模块诱导了线粒体断裂,且IDR模块的LC3结合功能对于线粒体分裂是不必要的。
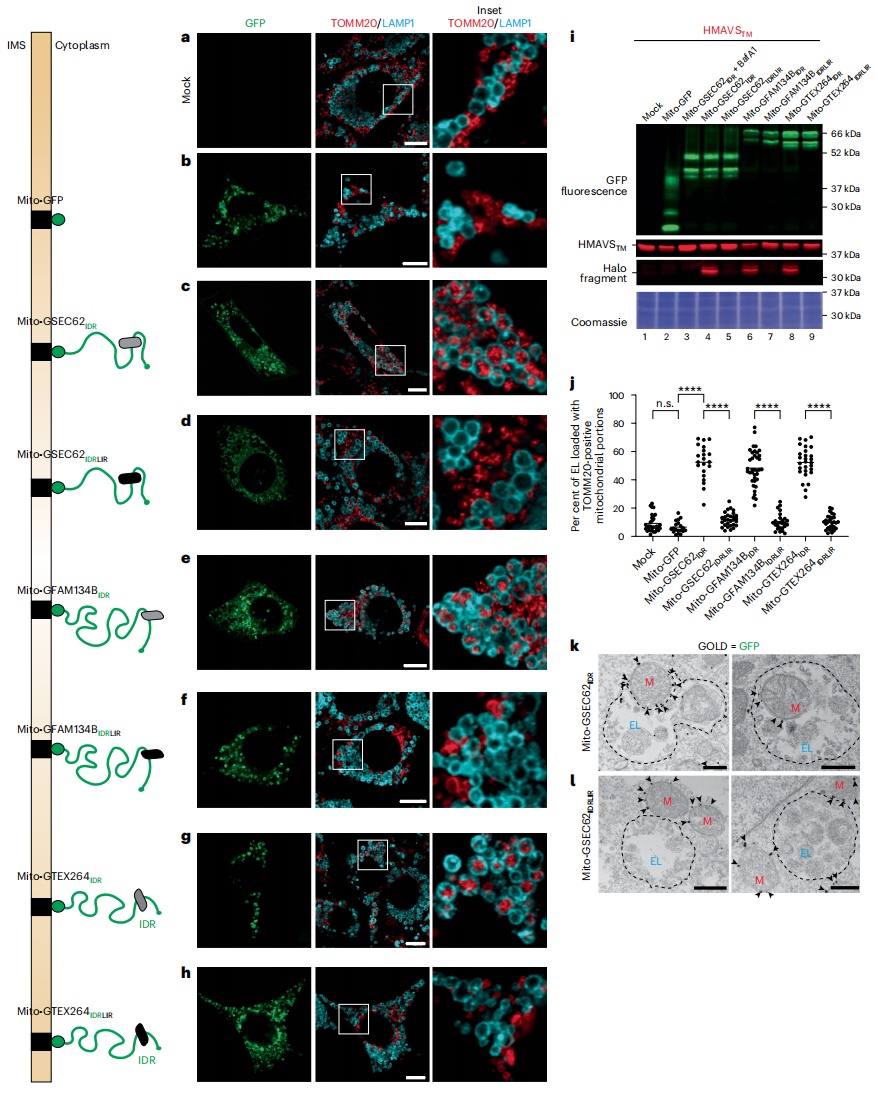
图五 表达在线粒体膜上的ER自噬受体IDR模块可以驱动线粒体自噬[6]
DRP1参与调控线粒体自噬[9]。于是,研究者评估DRP1是否调控IDR模块诱导的线粒体分裂。在野生型MEF和DRP1-KO MEF中表达Mito-GFP,SEC62IDR和SEC62IDRLIR(图六a-g)。DRP1-KO细胞具有增大的线粒体(图六e-g),证实了DRP1的功能性KO导致线粒体分裂功能障碍[10]。SEC62IDR和SEC62IDRLIR的表达可诱导野生型MEF中的线粒体分裂(图六c-d),但在DRP1-KO细胞中没有(图六f和g)。以上数据表明,DRP1对于在线粒体外膜表达ER自噬受体IDR模块诱导的线粒体分裂是必要的。
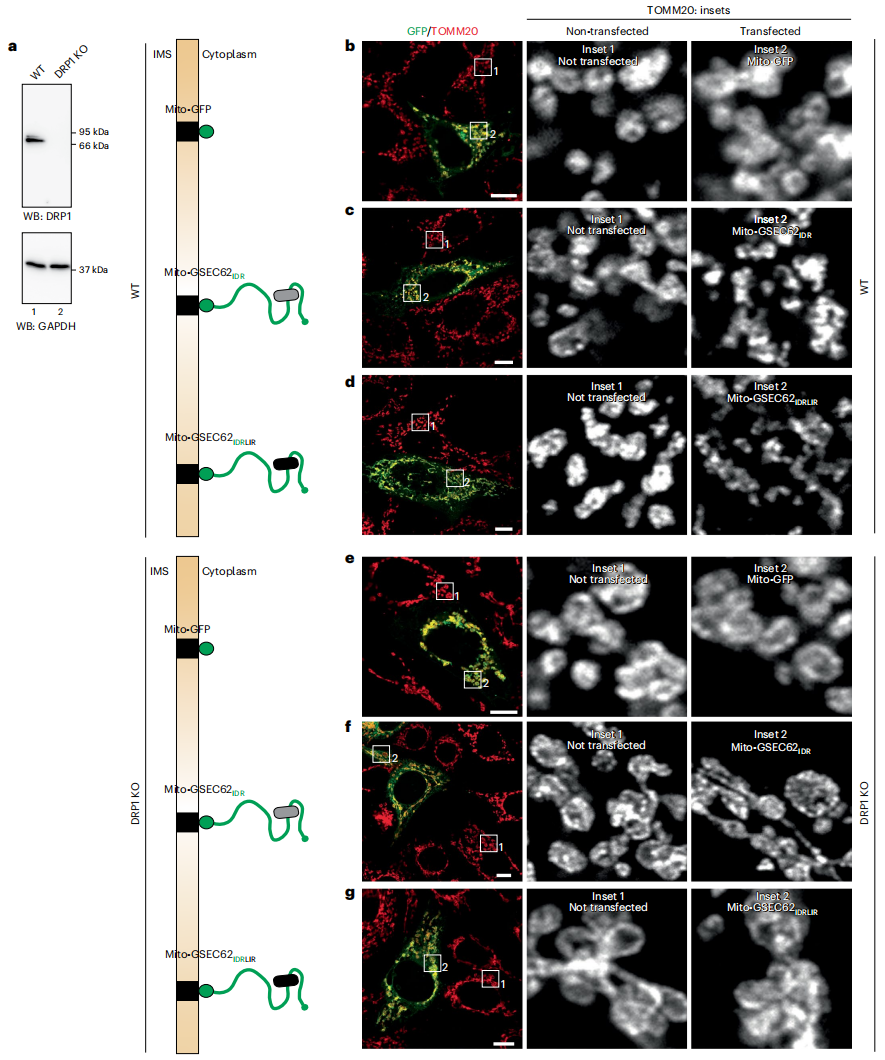
图六 IDR模块未能诱导DRP1-KO细胞的线粒体分裂[6]
最后,研究者探究具有负净电荷的IDR模块在诱导细胞器自噬方面是否具有功能保守性。上述已经证明将ER自噬受体的IDR模块表达在线粒体膜上时会触发线粒体自噬。当线粒体自噬受体如FUNDC1的IDR模块表达到内质网膜上时,是否也能诱导内质网自噬?首先用线粒体蛋白MAVS的跨膜结构域替代FUNDC1的跨膜结构域,证实FUNDC1的三跨膜结构域在促线粒体自噬中的不必要性(图七a-d)。随后用17个残基的膜锚定物将线粒体自噬受体FUNDC1的IDR模块靶向并锚定在ER膜上(图七f)。如共免疫沉淀所示,ER靶向的FUNDC1IDR-GT17与脂质化的LC3B-II结合,当FUNDC1的LIR突变后,LC3的结合被消除(图七i)。与表达GT17相比(图七e和h),表达FUNDC1IDR-GT17显著增强了ER片段在LAMP1阳性EL中的递送(图七f和h)。并且,当FUNDC1IDR模块的LC3结合功能失活,大大抑制了这种递送(图七g和h)。以上数据表明,内质网膜上表达FUNDC1的IDR模块也能够诱导内质网自噬。
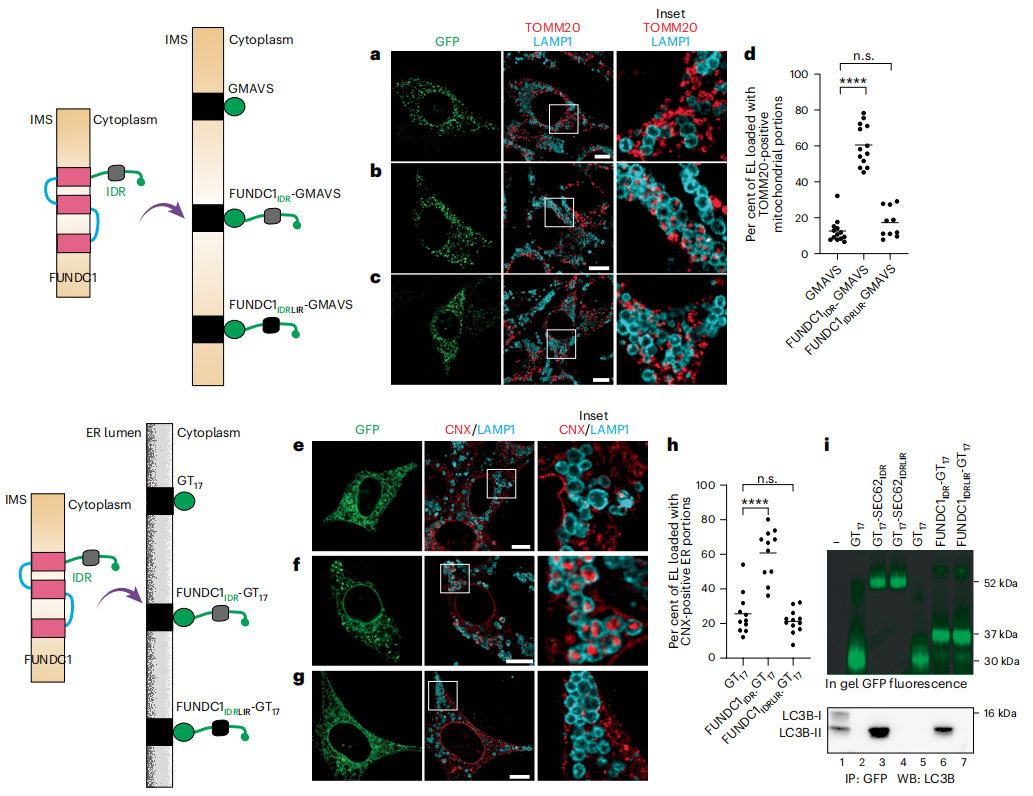
图七 内质网膜上表达FUNDC1的IDR模块能够诱导内质网自噬[6]
综上所述,该研究发现哺乳动物内质网(ER)和线粒体自噬受体在其细胞质表面暴露出一个具有不同蛋白质序列但却功能保守的内在无序区域(IDR)模块,IDR长度在47-250个残基之间,且在生理pH值下具有负净电荷。细胞器自噬受体上的膜锚定模块决定了其在亚细胞器的定位但不参与片段化。而细胞器的片段化和自噬是由IDR模块驱动的,且具有功能保守性,不同IDR替换到不同细胞器膜上都能诱导自噬。其中,IDR模块上的LIR负责与LC3蛋白结合和脂质化,LIR对于细胞器分裂是不必要的,但对于溶酶体递送是必要的。该研究揭示了细胞器自噬受体的IDR具有功能普适性,提供了一种通过IDR设计人工调控细胞器稳态的方法,也为理解细胞器演化和相关疾病治疗提供了新的思路。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Adriaenssens E, Ferrari L, Martens S: Orchestration of selective autophagy by cargo receptors. Current biology : CB 2022, 32(24):R1357-r1371.
2. Chino H, Mizushima N: ER-Phagy: Quality and Quantity Control of the Endoplasmic Reticulum by Autophagy. Cold Spring Harb Perspect Biol 2023, 15(1).
3. Johansen T, Lamark T: Selective Autophagy: ATG8 Family Proteins, LIR Motifs and Cargo Receptors. Journal of molecular biology 2020, 432(1):80-103.
4. Jiang X, Wang X, Ding X, Du M, Li B, Weng X, Zhang J, Li L, Tian R, Zhu Q et al: FAM134B oligomerization drives endoplasmic reticulum membrane scission for ER-phagy. The EMBO journal 2020, 39(5):e102608.
5. Gubas A, Dikic I: A guide to the regulation of selective autophagy receptors. Febs J 2022, 289(1):75-89.
6. Rudinskiy M, Galli C, Raimondi A, Molinari M: The intrinsically disordered regions of organellophagy receptors are interchangeable and control organelle fragmentation, ER-phagy and mitophagy flux. Nat Cell Biol 2025.
7. Komatsu M, Waguri S, Ueno T, Iwata J, Murata S, Tanida I, Ezaki J, Mizushima N, Ohsumi Y, Uchiyama Y et al: Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. The Journal of cell biology 2005, 169(3):425-434.
8. Khaminets A, Heinrich T, Mari M, Grumati P, Huebner AK, Akutsu M, Liebmann L, Stolz A, Nietzsche S, Koch N et al: Regulation of endoplasmic reticulum turnover by selective autophagy. Nature 2015, 522(7556):354-358.
9. Smirnova E, Griparic L, Shurland DL, van der Bliek AM: Dynamin-related protein Drp1 is required for mitochondrial division in mammalian cells. Molecular biology of the cell 2001, 12(8):2245-2256.
10. Osellame LD, Singh AP, Stroud DA, Palmer CS, Stojanovski D, Ramachandran R, Ryan MT: Cooperative and independent roles of the Drp1 adaptors Mff, MiD49 and MiD51 in mitochondrial fission. Journal of cell science 2016, 129(11):2170-2181.



