技术分享:基于玻璃态离子液体的全新组织透明化技术VIVIT
生命机体的各种生物结构通过无缝协作,执行着多样化的生物功能。以高保真度、高分辨率的手段可视化这些生物结构,可为理解复杂的生物系统奠定基础[1]。近年来,得益于组织光学透明化技术的发展,已实现中尺度分辨率的生物组织完整三维结构的可视化。将组织透明化技术与光片显微镜相结合,通过深度光学穿透,可在不进行物理切片的情况下实现整个器官结构的可视化。目前光学透明化方法可分为两大类:基于疏水性有机溶剂或者基于亲水性水溶液[2]。可是,溶剂法和水溶液法在实现高透明化的同时,分别导致严重的组织收缩和肿胀,造成自然组织结构一定程度的扭曲。
在分辨率提升方面,实现高分辨率需要短的工作距离,仅适用于薄的组织切片。目前将组织制备成薄片的方法也存在些问题。经典的石蜡切片过程会导致严重的组织收缩和生物分子变性。而冷冻切片过程的冻融循环不可避免地在切片内形成冰晶,对细胞结构造成损伤。因此,尽管已开发出多种组织学方法来可视化生物组织的复杂结构,但是在保持大体积结构完整性的同时实现高分辨率揭示微观结构,仍然是一个主要挑战。
2025年8月,Cell 期刊在线报道了一项研究,开发了一种基于玻璃态离子液体溶剂的全新组织透明化技术VIVIT,集透明化、高保真度、高分辨率于一体。VIVIT技术可将不透光的生物组织在低温下转变为离子玻璃态,获得高透明度的组织几乎不发生形变,即具有高保真度。此外,VIVIT技术既保护组织免受低温晶体的损伤,还能稳定并放大荧光信号,实现完整三维结构荧光信号的可靠采集与清晰呈现。基于VIVIT技术的优势,创新性将小鼠多模态丘脑神经元的突触输入模式与其全脑输出投射之间进行定量化描绘,并揭示了人类大脑皮层中抑制性神经元的微观连接。VIVIT技术为高分辨、跨尺度的空间数据获取和生物组织建模提供了系统化解决方案,为阐明包括大脑在内的跨尺度生物结构及其多样化组织连接提供了一种全新手段[3]。
组织透明化的基本要素是匹配组织中各种化学成分的折射率(RI)。在现有的透明化方法中,有两种折射率匹配方法:基于有机溶剂或者水溶液。有机溶剂具有高折射率(1.54-1.56),但它们是疏水性质的,在匹配之前需要彻底脱水,如iDISCO、uDISCO、SHANEL和PEGASOS。相反,稳定的水溶液具有有限的折射率(<1.52),为了实现高透明度,组织中高折射率元素必须在匹配之前进行超水合(如Scale、CUBIC和CUBIC-X)或用十二烷基硫酸钠(SDS)等表面活性剂进行稀释(如CLARITY、PACT和SHIELD)。因此,这两种方法处理后,分别导致组织发生收缩和肿胀。为了克服上述方法的局限性,研究者选择N-(3-氨基丙基)-咪唑(NAPI)和邻苯二甲酸(PA)进行中和反应,两者分别是具有高亲水性和高折射率的有机碱和有机酸,最终反应形成氨基烷基咪唑邻苯二甲酸盐离子液体(APIL)(图一A)。为优化APIL的性能,引入几种添加剂来调节pH值、降低粘度,进一步提高折射率和抗氧化性。所得APIL具有高度亲水性,可与水混溶。APIL的折射率与水的比例呈负相关,范围从1.33到1.59(R2=0.997),涵盖了组织折射率匹配的所有可能值(图一B)。惊喜的是,含水量低的APIL不会冻结成结晶固体。差示扫描量热法显示,稀释的APIL(10%、30%和50%w/w)显示出队列式的凝固点(Tf分别为-12°C、-13°C和-24°C),且这些凝固点与含水量呈正相关(R2=0.849;图一C),表明稀释的APIL是可结晶的,并表现出水溶液的依数性。相比之下,浓缩的APIL(70%、83%和96%w/w)没有凝固点,但表现出玻璃化转变温度(Tg分别为-75°C、-55°C和-31°C),且与水的比例呈负相关(R2=0.998;图一C)。当逐渐降低温度时,浓缩的APIL没有表现出水溶液样的结晶行为,而是像大多数高分子材料一样玻璃化成非晶体固体。
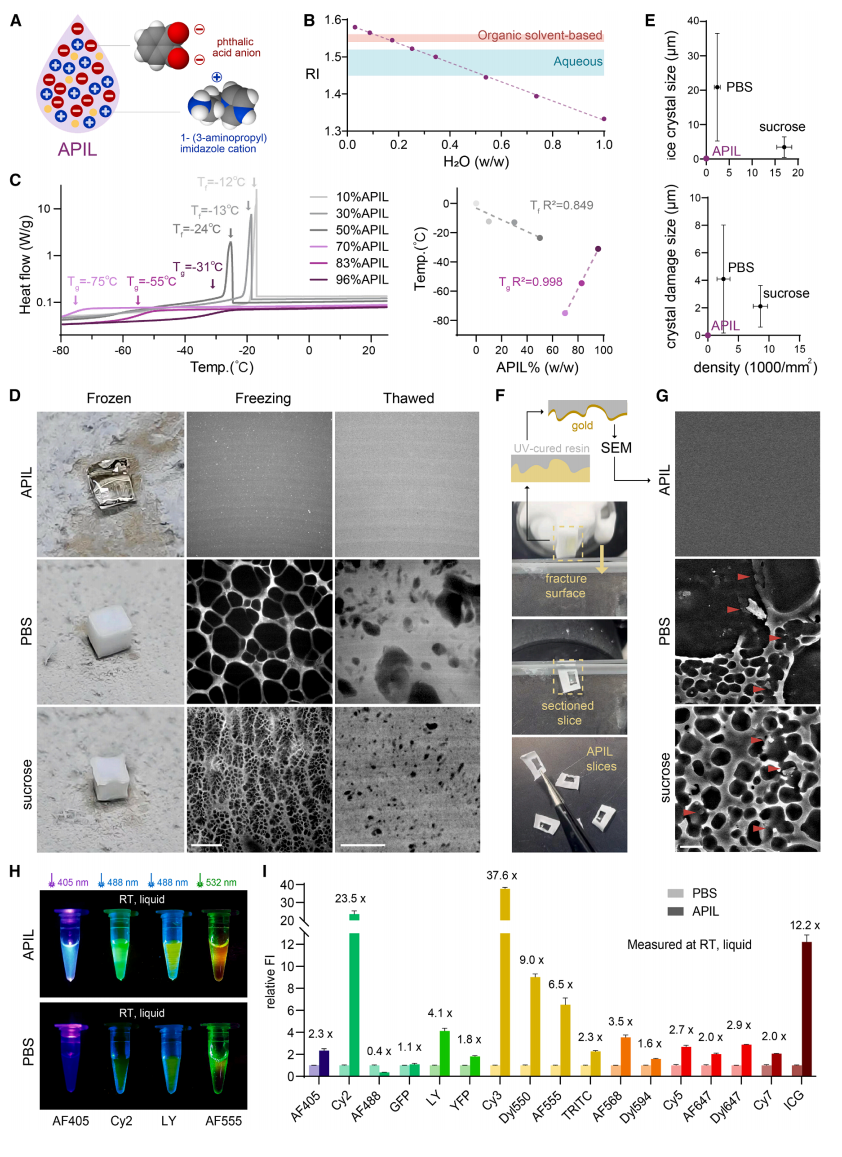
图一 表征一种亲水性高折射率离子液体APIL[3]
接下来,研究者探究生物大分子在浸入APIL后是否表现出非结晶固化方式。使用多聚甲醛(PFA)固定猪明胶(8%)来模拟固定和脱脂的生物组织,将其放置在含干冰的金属平台上冷却。与经PBS浸泡和30%蔗糖浸泡明胶的快速冷冻不同,APIL浸泡明胶保持透明(图一D)。通过荧光显微镜检查干冰冷却后的含EGFP明胶块(图一D)。PBS浸泡明胶内含有大量的大冰晶,30%蔗糖浸泡明胶的冰晶较小,但晶体损伤仍然明显。与之形成鲜明对比的是,APIL浸泡明胶中没有观察到晶体(图一D和E)。进一步对明胶样品进行三次冻融。与PBS浸泡明胶相比,蔗糖浸泡明胶显示出更小但更多的损伤。而APIL浸泡明胶保持与冻融前一致的均质信号(图一D和E)。此外,APIL浸泡明胶可在改良的包埋介质中及特定条件下,冷冻切片成平滑的薄片(图一F)。为评估切片的平滑度,使用紫外线固化树脂对横切面进行反模,随后进行扫描电镜观察(图一F和G)。由于冰晶的存在,PBS和蔗糖浸泡明胶显示出凹凸不平的横切面(图一G),这将阻碍连续切片间的精细生物结构重新连接。而APIL浸泡明胶显示出异常平滑的横切面。为探索对荧光成像的潜在影响,将荧光分子溶解在APIL和PBS中,并使用旋转盘共聚焦显微镜在室温下测量荧光强度。在宽光谱范围内测试了17种小分子荧光染料和荧光蛋白。与PBS相比,APIL显著增强了16种荧光分子(图一H和I)。其中,菁染料所有成员包括Cy2、Cy3、Cy5、AF555、AF647、Cy7和ICG的荧光都显著增强,最高达38倍,表明APIL对菁染料具有特异的溶剂效应。以上结果表明,APIL表现出三个主要特性:高亲水性与高折射率、非晶体凝固行为、以及广泛增强荧光分子的能力。这些特性促使APIL成为组织透明化的理想制剂,相应地能同时实现多种功能,包括(1)组织光学透明化的同时还能保持形状,(2)完美的抗冻保护作用,既能长期储存组织,又能获得无损冷冻切片,以及(3)放大荧光信号。
在表征完APIL的特性后,研究者尝试将APIL用于生物组织。由于离子液体(IL)的高离子强度,需要从组织中去除低极性的脂质,然后进行过度电离以增强大分子电荷,从而改善组织适应APIL(图二A)。为了在保持组织体积的同时有效地去除脂肪,研究者开发了一种水性试剂脱氧胆酸二异丙胺(DIDC),DIDC通过脱氧胆酸和二异丙胺的中和反应获得(图二B)。与现有的水性脱脂试剂相比,DIDC对组织体积的膨胀效应最小(图二D)。此外,DIDC由具有甾醇侧链的表面活性剂组成,形成较小的胶团,产生更高的脱脂率(图二E)。与其他水性脱脂试剂相比,DIDC还为YFP荧光提供了更好的保护。随后测试用于过度电离的辛基硫酸钠(SOS)溶液(图二C)。与SDS-PAGE中使蛋白质带负电荷的SDS类似,SOS也能结合蛋白质,但变性作用较弱,溶解度较高,电荷质量比较大。SOS溶液不仅在浸泡期间和离子液化后保留了脱脂脑的尺寸,而且与SDS溶液相比,更好地保护了YFP荧光。由此,研究者将DIDC脱脂、SOS过度电离、APIL离子液化这些处理步骤称为VIVIT,整个处理过程中组织没有发生任何剧烈的形状变化(图二F)。
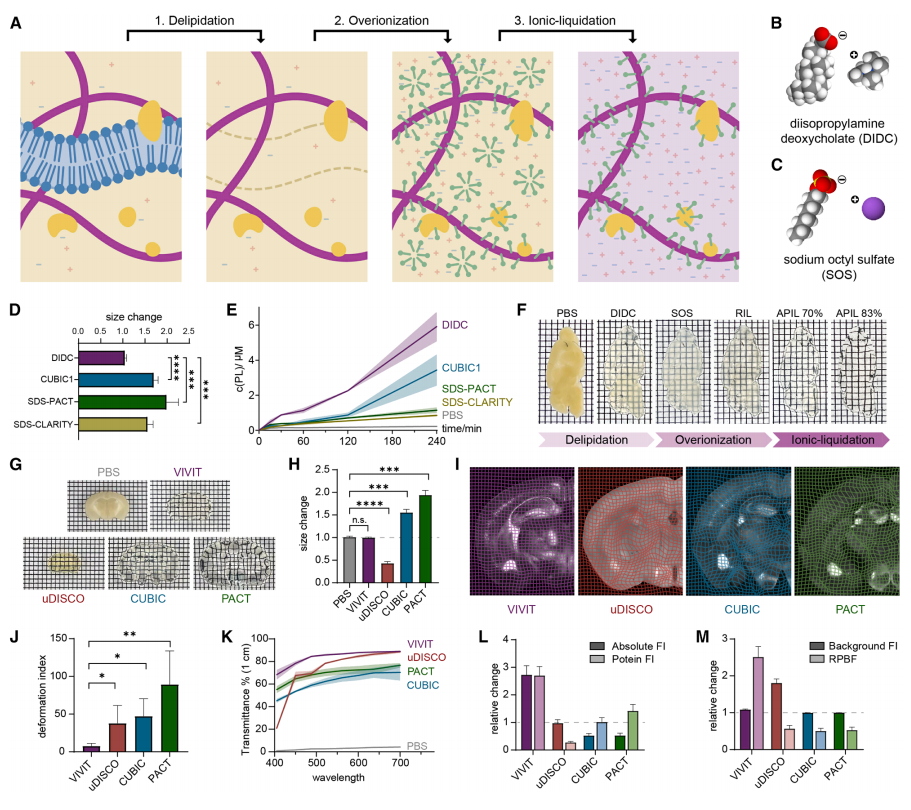
图二 VIVIT透明化技术的开发[3]
于是,将VIVIT透明化技术与之前的透明化方法进行比较,包括基于有机溶剂方法uDISCO、水性方法CUBIC和PACT。在形态保留方面,VIVIT技术是唯一没有显著改变脑体积的方法,而溶剂法和水性法分别导致了相当大的收缩和膨胀(图二G和H)。为了评估内部形态特征,采用非刚性变换来校正Thy1-YFP小鼠在透明化前后的冠状脑切片图像(图二I),并提取变形指数来评估透明化过程中导致的非等向性变形。值得注意的是,VIVIT表现出最低的变形指数(7.68±3.56),其次是uDISCO(37.77±23.70)、CUBIC(47.31±23.13)和PACT(89.50±44.25,图二J),表明VIVIT保持了组织样本的大小和内部形态特征,即高保真地保留了生物结构。在透明度方面,与其他方法相比,VIVIT在各种波长下的透明度最高,特别是在较短波长下(图二K)。在荧光信号保留方面,测量Thy1-YFP小鼠脑切片透明化前后YFP+皮质神经元荧光强度的绝对变化,计算蛋白质荧光强度。与其他方法不同,VIVIT技术将YFP信号增强2-3倍(图二L)。关键的是,VIVIT提高了蛋白质与背景荧光的比率(RPBF),且没有显著提高背景信号(图二M)。以上数据表明,基于APIL开发的VIVIT技术,代表了一种新的组织透明化方法,不仅能够光学透明化组织且只有轻微形态改变,还有效增强标记生物结构的荧光信号。
接下来,研究者验证VIVIT技术对各种类型的组织样本的透明化效果,测试了小鼠的脑、肝、脾、肺、肾、心脏、胰腺、胸腺、小肠、雌性生殖系统、肘部和脊柱及其相关组织,都能保持形态和高透明度(图三A)。对VIVIT技术处理后的Thy1-YFP小鼠大脑和RFP标记血管结构的其他组织样本进行全器官光片成像(图三B)。全器官图像显示出高均质性和强信号质量,图像展示细节丰富,清晰可见神经元的神经突起和各种器官的毛细血管网络。通过优化脱脂和脱钙步骤,VIVIT还能够透明化复杂的组织样本如神经组织(脊髓)、骨组织(椎骨和肋骨)、肌肉组织(背部和肋间肌肉)和脂肪组织(图三B)。
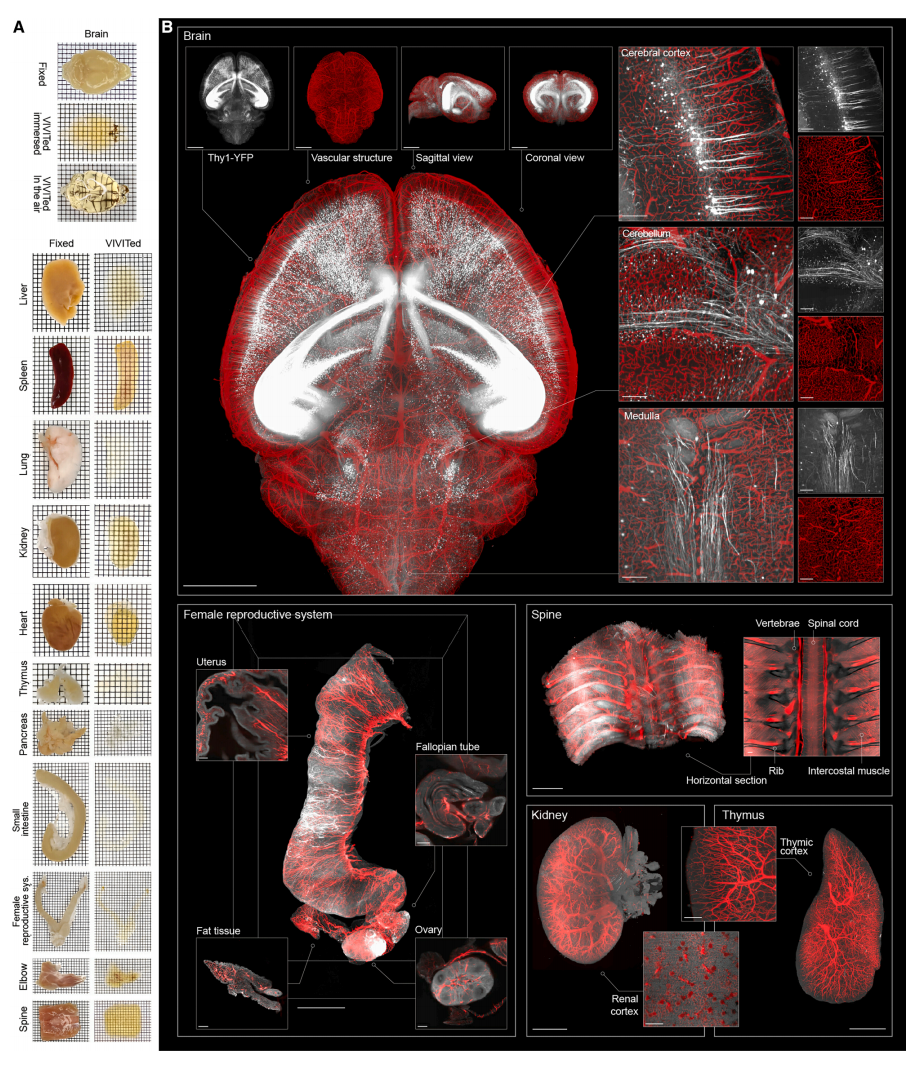
图三 VIVIT技术能够透明化整个器官,并保持高保真度形态[3]
为演示跨尺度成像过程,研究者采用VIVIT技术透明化Thy1-YFP小鼠大脑进行全脑光片成像,其分辨率相对较低(像素尺寸1.6×1.6×3 μm,光片显微镜)。将成像的大脑切成几层厚切片后,以高分辨率(0.22×0.22×0.5 μm,旋转圆盘共聚焦显微镜)对这些切片进行成像,以便精确追踪神经纤维,但不能观察微观亚细胞结构。随后,将厚切片内的感兴趣区域切成薄片,进行更高分辨率(0.11×0.11×0.25 μm;旋转圆盘共聚焦显微镜)和超分辨率(0.06×0.06×0.1 μm,超分辨率共聚焦显微镜)成像,以揭示微观亚细胞结构,如树突棘(图四)。
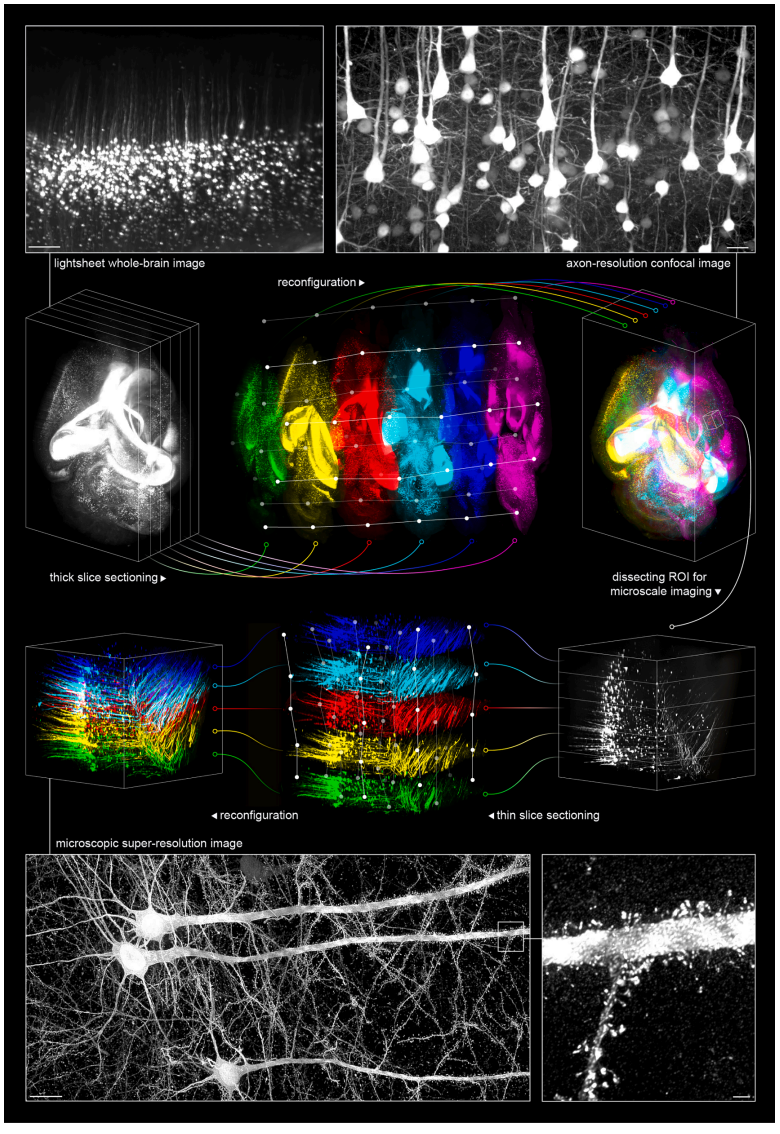
图四 VIVIT技术能够实现从整个大脑到突触的跨尺度结构成像[3]
在哺乳动物的大脑中,听觉和视觉系统协同工作,整合感知并对外部世界快速反应。听觉丘脑是这一过程中的关键枢纽,它们整合了听觉和视觉输入,并向边缘系统进行广泛投射[4]。然而,听觉丘脑中的单个神经元如何介导视听输入对各种脑功能的影响仍然不清楚[5]。为了将单个丘脑神经元的输出结构与其突触输入相耦合,研究者用YFP稀疏标记小鼠选定丘脑神经元,并用mCulean或mCherry分别标记听觉或视觉中脑的下丘(IC)和上丘(SC)神经元(图五A和B)。将大脑切成1.5 mm厚片,成像前用VIVIT技术处理,采集所有包含YFP信号区域的高分辨率中尺度图像(像素尺寸0.22×0.22×0.5 μm)。随后,切割包含YFP+丘脑神经元胞体和树突结构的区域,并将其切成250 μm薄片进行微尺度成像(0.11×0.11×0.25 μm),追踪下丘或上丘到YFP+丘脑神经元的突触输入(图五C、图六A和B)。
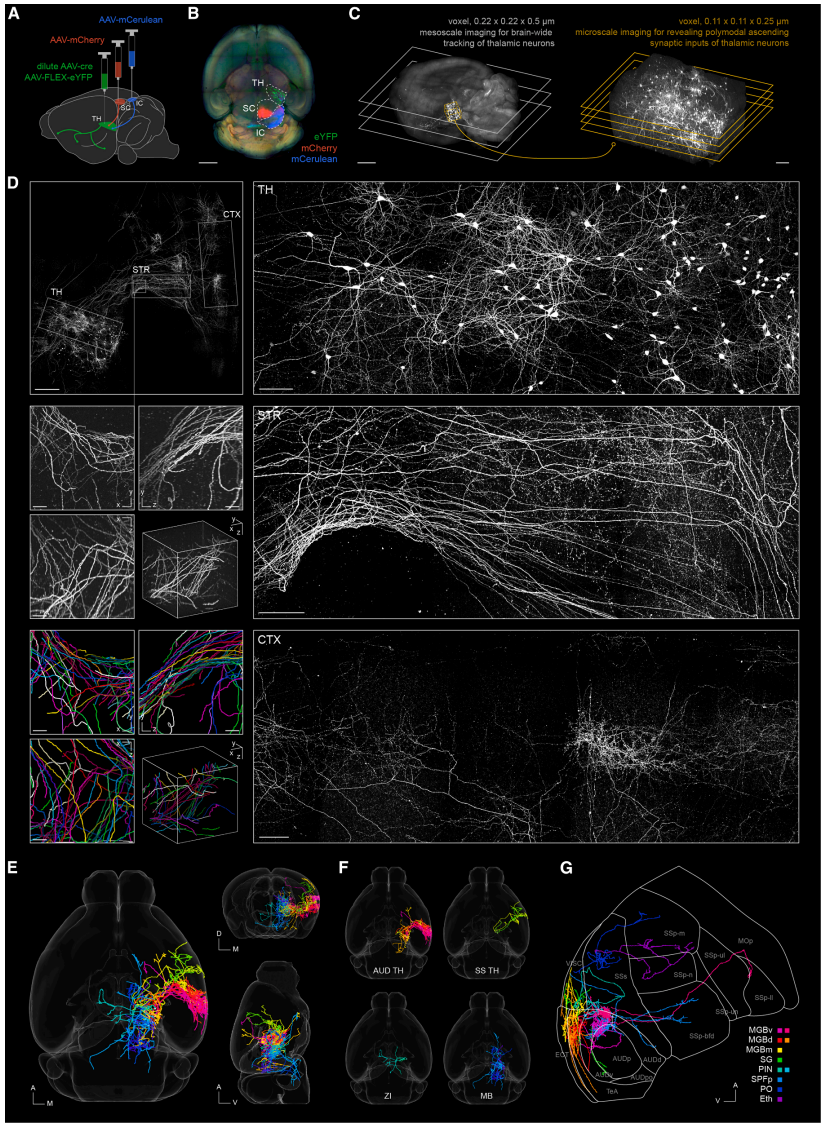
图五 VIVIT技术能够精确追踪单个神经元的全脑输出结构[3]
首先,精确追踪了VIVIT技术处理后的1.5 mm厚切片上的轴突纤维,重建了位于听觉(17)、体感(2)丘脑的19个YFP+神经元,以及位于其他区域的18个YFP+神经元的轴突结构(图五D-G)。其次,使用250 μm薄片收集高分辨率显微镜图像,重建了20个丘脑神经元中14个的树突结构(图六B),进而分析与其表面直接接触的来自下丘或上丘的突触输入。总共确定了1835个突触输入,834个来自下丘,1001个来自上丘,发现所有丘脑神经元都接受了来自下丘和上丘的突触输入,表明视听整合确实发生在丘脑中。然而,源自下丘和上丘的突触输入的不同数量表明,不同丘脑神经元在接收听觉和视觉信息方面具有不同的倾向(图六C和D)。基于微观尺度上的突触输入和中尺度上的全脑投射,研究者将小鼠多模态丘脑神经元在突触输入(微观)方面的视听模态偏好性与在全脑输出(介观和宏观)方面的目标脑区偏好性定量化地联系了起来,发现通过听觉丘脑神经元,下丘信息优先投射到皮质和TRN,而上丘信息主要投射到基底神经节、下丘脑、中脑和后脑(图六D-F)。
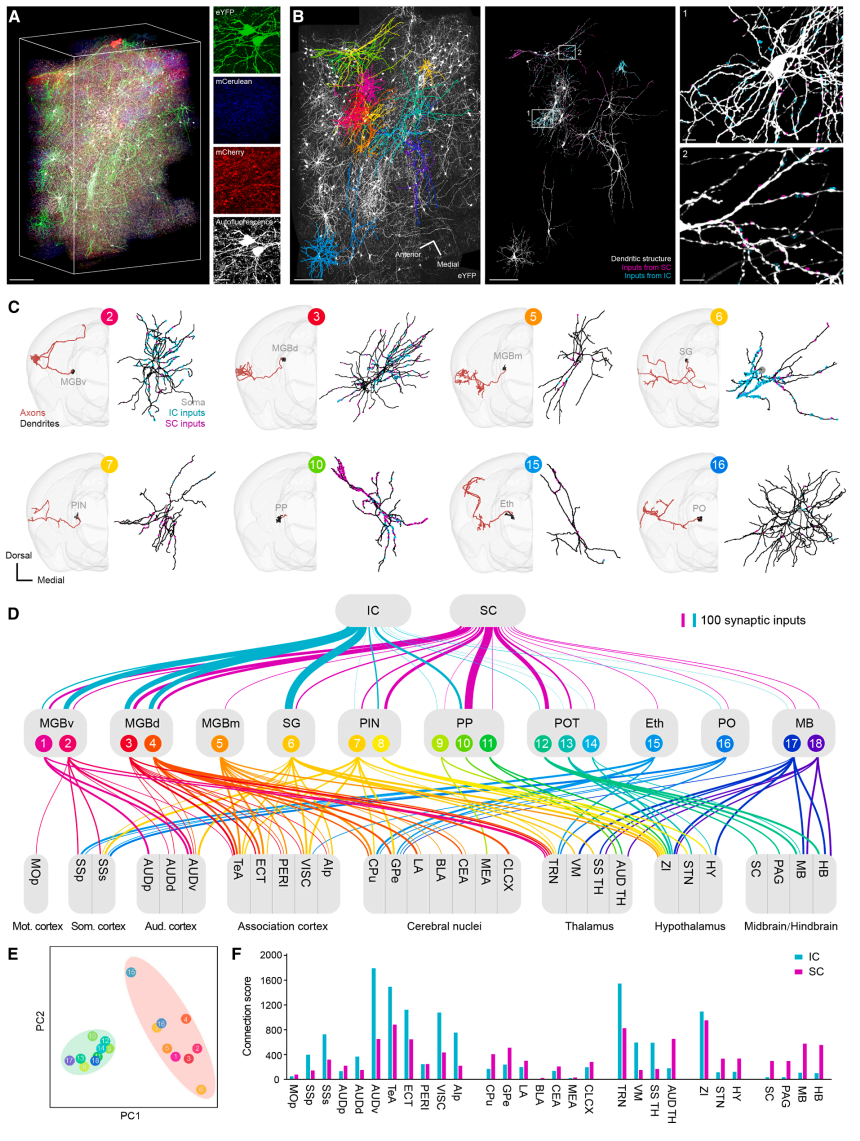
图六 VIVIT技术揭示单个神经元的突触输入及其全脑输出[3]
免疫荧光(IF)对于标记人类和非人灵长类样本中的生物结构必不可少。为评估VIVIT技术与IF的相容性,研究者观察到在脱脂和过度电离处理后的小鼠皮质切片上,免疫染色NeuN、Ctip2和CB的荧光衰减(图七B)。因此增加了一个招募双琥珀酰亚胺戊二酸酯(DSG)的交联步骤(图七A),使组织内铵基和抗体交联,稳定抗体-抗原结合防止信号丢失(图7B)。改良后的VIVIT技术,Alexa555偶联二抗显示出荧光信号增加了3-5倍(图七B和C)。进一步利用改良VIVIT技术处理狨猴皮层,免疫染色NeuN、MAP2、小清蛋白(PV)、Satb2、PSD95和gephyrin等抗原,获得了高分辨率的狨猴皮层免疫染色图像(图七D),显示出改良VIVIT技术用于非人灵长类样本免疫染色的优越性。
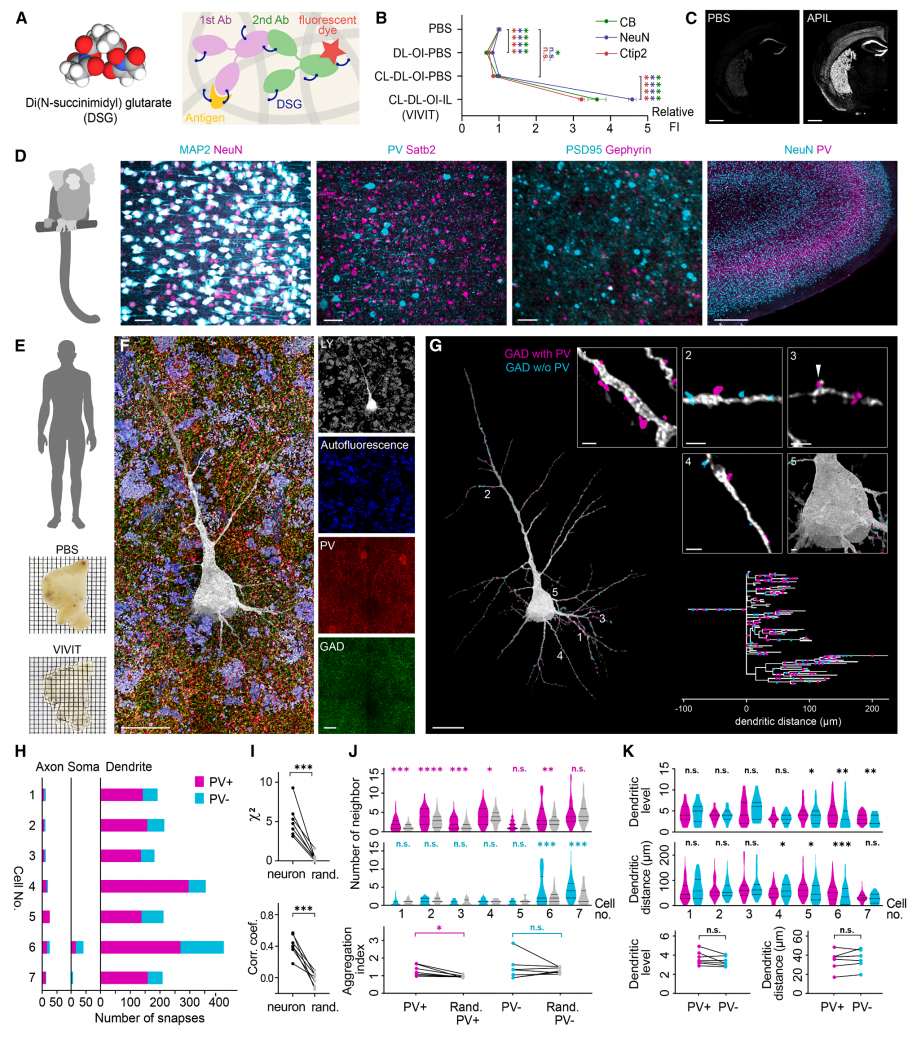
图七 VIVIT技术揭示免疫荧光标记的人类神经元微观连接[3]
最后,利用VIVIT技术处理人类皮质组织。先通过DIC成像引导细胞内注射荧光素黄(LY)标记锥体神经元,并用免疫染色谷氨酸脱羧酶(GAD)和小清蛋白(PV)分别标记常规和PV+的抑制性突触前结构。之后,透明化250 μm厚的人脑切片,采集了超分辨率图像,识别突触并重建精确细胞结构(图七E和F)。分析了7个人类皮质锥体神经元的抑制性突触输入模式,共鉴定出1897个抑制性突触(图七G)。发现了大量的抑制性树突输入,以及人类神经元上非常罕见的胞体输入(图七H),其中大多数神经元(5/7)甚至没有接收到胞体输入。这与啮齿动物等其他物种的观察结果形成鲜明对比[6]。揭示了人类皮层神经元相比与其他物种,具有不同的抑制整合模式(图七H-K)。
综上所述,该研究开发了一种基于玻璃态离子液体溶剂(APIL)的全新组织透明化技术VIVIT。APIL在低温下玻璃化成无定形的玻璃状固体,而不是形成晶体,从而实现无损冷冻和长期储存。利用VIVIT技术制备出高透明化组织,既保持了原始的组织形态,还显著增强了荧光蛋白和抗体偶联荧光染料的信号,为高保真度、高分辨率可视化生物组织结构奠定了基础。基于VIVIT的技术优势,该研究首次实现小鼠单神经元水平输入-输出模式的准确连接,以及揭示人脑神经元微观连接的不同模式,为深入解析脑功能的神经环路机制提供了新的机遇。VIVIT技术为生物组织的跨尺度三维数据获取与空间重建提供了系统性解决方案,为包括脑科学在内的基础研究、病理分析等应用打开了新的空间。

GTP研发中心拥有自主知识产权的类精子干细胞介导的半克隆技术,可在体外实现类精子干细胞的多位点改造并进行功能元件测试,最后将类精子干细胞通过卵母细胞注射可以一步法获得基因改造小鼠。基于类精子干细胞单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株类精子干细胞中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Oh SW, Harris JA, Ng L, Winslow B, Cain N, Mihalas S, Wang Q, Lau C, Kuan L, Henry AM et al: A mesoscale connectome of the mouse brain. Nature 2014, 508(7495):207-214.
2. Yu T, Zhu J, Li D, Zhu D: Physical and chemical mechanisms of tissue optical clearing. Iscience 2021, 24(3):102178.
3. Gao Y, Xin F, Wang T, Shao C, Hu Y, Chen Z, Wang Y, Xie F, Li T, Li S et al: VIVIT: Resolving trans-scale volumetric biological architectures via ionic glassy tissue. Cell 2025.
4. Barsy B, Kocsis K, Magyar A, Babiczky Á, Szabó M, Veres JM, Hillier D, Ulbert I, Yizhar O, Mátyás F: Associative and plastic thalamic signaling to the lateral amygdala controls fear behavior. Nature neuroscience 2020, 23(5):625-637.
5. Liu M, Gao Y, Xin F, Hu Y, Wang T, Xie F, Shao C, Li T, Wang N, Yuan K: Parvalbumin and Somatostatin: Biomarkers for Two Parallel Tectothalamic Pathways in the Auditory Midbrain. J Neurosci 2024, 44(10).
6. Kawaguchi Y, Kubota Y: GABAergic cell subtypes and their synaptic connections in rat frontal cortex. Cerebral cortex (New York, NY : 1991) 1997, 7(6):476-486.



