技术分享:免疫-神经回路介导癌症恶病质的淡漠样行为
恶病质是一种严重的消耗性综合征,常见于许多慢性疾病的晚期如癌症。其特征包括食欲减少导致的体重减轻、肌肉和脂肪耗竭、以及能量消耗增加。除了身体机能的衰退,恶病质患者还常伴有严重的疲劳、淡漠和抑郁等精神症状,这些症状进一步降低了患者的生活质量,导致高达30%的死亡率[1]。临床治疗上侧重于体重和肌肉的维持,而恶病质患者精神层面的动机缺乏综合征和抑郁往往被忽视,没能得到充分解决。炎症是癌症恶病质的关键因素,促炎细胞因子会触发外周的脂解和蛋白水解,并破坏大脑的食欲调节[2]。促炎细胞因子白介素-6(IL-6)在恶病质患者和小鼠癌症模型中都显著上调,通过激活下游分子通路,重编程外周器官的功能[3]。然而,肿瘤诱导的IL-6与恶病质患者的大脑行为改变之间的生物学机制尚不完全清楚。
2025年4月,Science期刊报道了一项研究,揭示了炎症通过一种免疫-神经回路驱动癌症恶病质的淡漠样行为。该研究发现肿瘤产生的促炎细胞因子如白介素-6(IL-6)在血液和大脑中显著升高,这一炎症信号被逐级转化成中脑边缘的多巴胺水平降低。而多巴胺是负责驱动力与奖惩机制的关键物质,降低多巴胺导致削弱动机,回避与行为抑制,表现出淡漠样的精神症状。通过抑制IL-6的表达或定点促进多巴胺的释放,可以缓解动机缺陷,改善恶病质的精神症状,有望改善患者的生活质量[4]。
首先,研究者探究恶病质对动机的影响。皮下注射C26腺癌细胞构建小鼠结肠癌模型[5],该模型小鼠在移植后约20~40天出现恶病质,表现为进食量显著减少和体重显著减轻(图一A和B),与人类癌症恶病质的特征相似。为排除疾病进展的个体差异,将发病数据与实验终点进行校正,发现最明显的体重减轻发生在最后3天(图一B,右)。为评估癌症恶病质小鼠的动机,研究者测试了一组行为学实验。1)使用特殊的笼盒使得小鼠需自主操作才能获取食物,小鼠需用鼻子顶开笼盒里的一个舱门,才能摄取到食物(图一C)。小鼠在接种肿瘤前完成这一训练,并在肿瘤接种后每日固定时间测试摄食动机的变化。将小鼠放弃摄食之前连续戳击舱门的次数称为断点。结果发现,恶病质小鼠的食物摄入量和摄食行为(最大断点)显著减少(图一D和E)。最大断点的减少,表明其为食物奖励付出努力的意愿降低(图一E,左),这种下降在恶病质终点前3天最为明显,并遵循昼夜节律(图一E,右)。2)通过减少奖励测试小鼠“留下或离开”的觅食决策变化。可变高度的桥梁连接着两个出水口,当小鼠停留在一个出水口时,水奖励逐渐减少,促使小鼠越过桥梁移动到另一个出水口(图一F)。结果发现,随着恶病质的发展,小鼠饮水量显著减少,饮水动机降低,完成试验的数量下降(图一G和H),在无水出水口的停留时间延长,离开的意愿降低(图一I)。3)测试小鼠的蔗糖选择偏好性,发现恶病质小鼠的蔗糖选择偏好性与无肿瘤小鼠相比没有显著差异(图一J),4)尾巴悬吊测试和5)强迫游泳测试也没有显著的差异(图一K和L)。以上数据表明,恶病质小鼠表现出与淡漠特征一致的特定行为,如动机降低和努力敏感性增加,而不是快感缺失或绝望等其他情感状态。
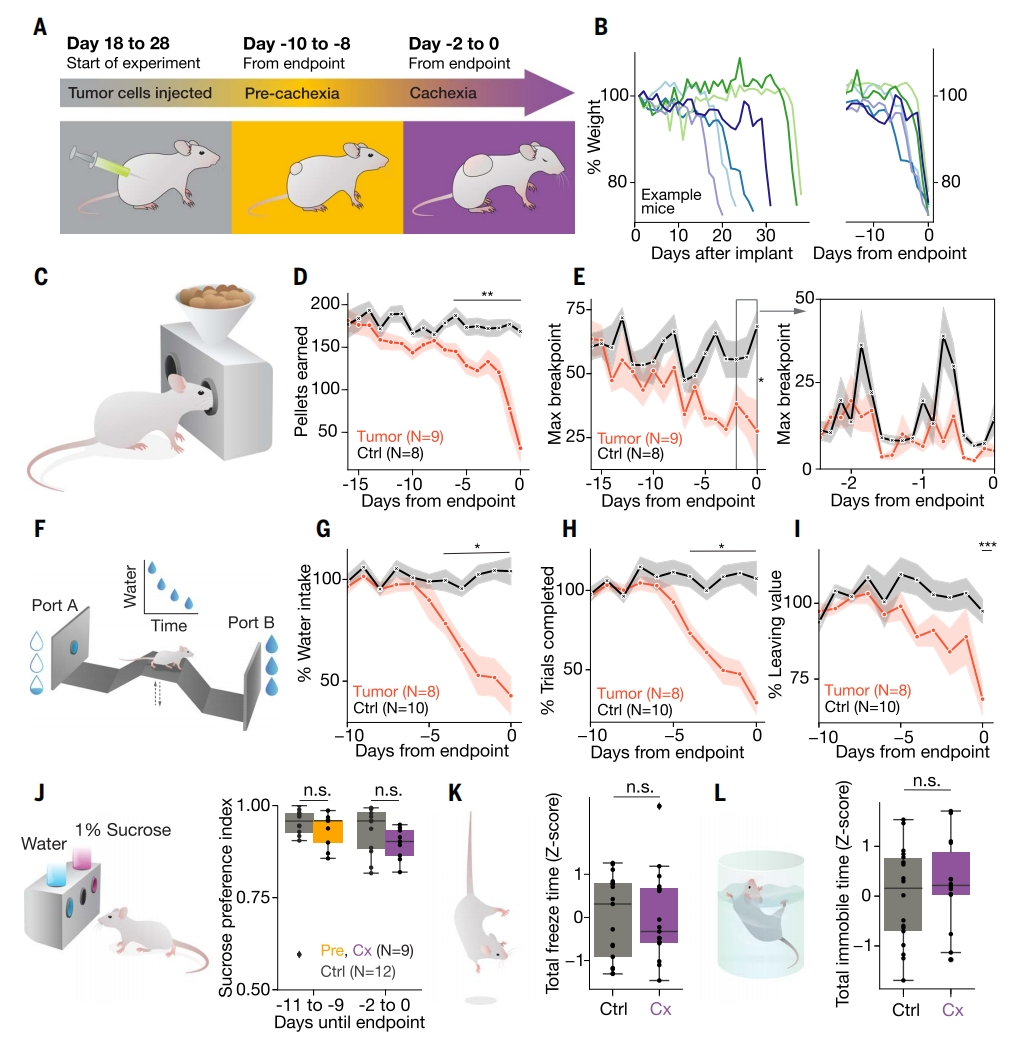
图一 癌症恶病质小鼠表现出淡漠样表型[4]
炎症是癌症恶病质和肿瘤防御机制的关键因素[2]。为了确定癌症恶病质小鼠出现动机缺陷的关键细胞因子,研究者对血浆和脑样本的44种细胞因子进行全面筛查。使用主成分分析(PCA)可区分开恶病质、恶病质前小鼠和对照小鼠的脑部细胞因子变化模式,而血样品无法区分恶病质和恶病质前小鼠(图二A和C)。在分析的细胞因子中,IL-6是恶病质小鼠血浆和脑样本中细胞因子谱式变化的主要因素之一(图二B和D)。结合先前IL-6对大脑和抑郁症的影响研究[6, 7],研究者重点分析IL-6在恶病质中的潜在作用,发现恶病质小鼠血浆和大脑中IL-6的表达显著升高(图二E),与恶病质的发作相吻合。多种细胞类型均可表达产生IL-6,包括血管上皮细胞和小胶质细胞等[8]。为了评估IL-6是否可以穿过血脑屏障,研究者在外周注射His标记的IL-6,观察到恶病质小鼠大脑中His-IL6的增加(图二F)。伊文思蓝渗透实验结果显示恶病质小鼠血脑屏障遭到破坏(图二G),使得IL-6和其他因子能够渗透到大脑中。在恶病质小鼠的几个大脑区域,包括伏隔核(NAc)、杏仁核(Amy)和整个皮层(Ctx),小胶质细胞数量显著增加(图二I和J),表明出现慢性神经炎症[9]。进一步测试IL-6在恶病质进程中的作用,研究者在肿瘤细胞移植后的第十天,使用单克隆抗体降低血浆IL-6水平,发现延缓了恶病质的发作,延长了小鼠的生存期(图二H)。
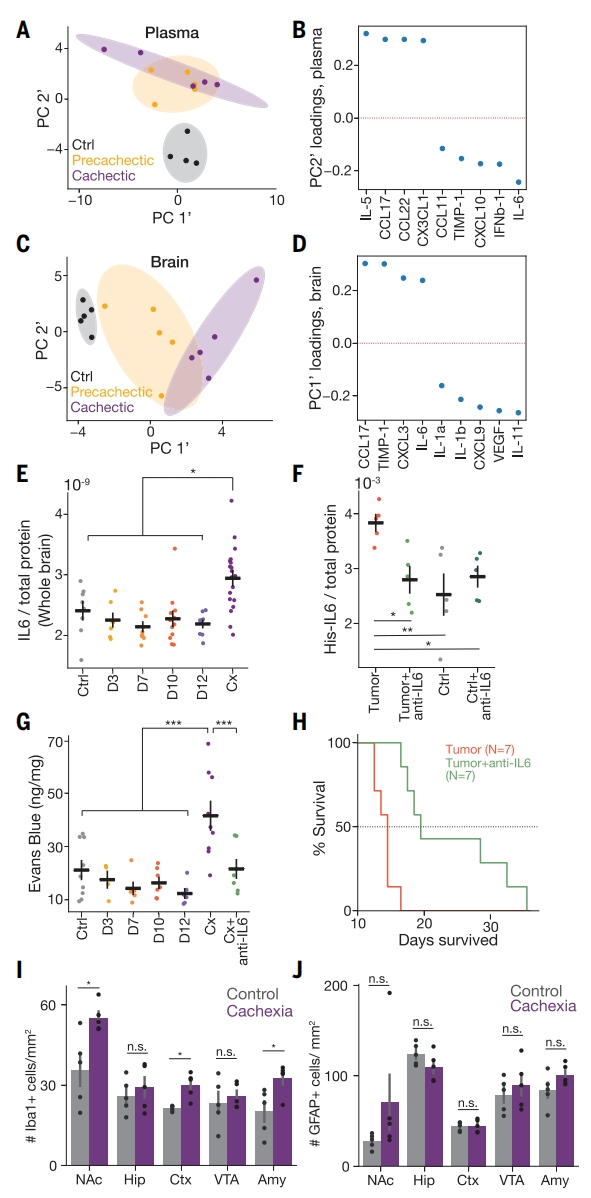
图二 癌症恶病质在小鼠外周和大脑中诱导炎症反应[4]
随后,研究者使用即刻早期基因c-Fos绘制神经元活动图谱(图三A),比较大脑不同区域的激活状态,脑片染色显示有17个区域被显著激活(图三C)。在这些激活区域中,臂旁核的外侧分支(PBle)显示出强烈的c-Fos表达(图三B和D)。臂旁核(PBN)是整合内感受性和伤害性信号的关键中枢[10, 11],其激活与食欲调节和癌症厌食症相关[12, 13]。极后区(ArP)是一种感知体液信号的室周器官[14, 15],孤束核(NTS)传递来自迷走神经的内感受器信号[16]。ArP和NTS也表现出较高的c-Fos表达(图三B和D),并且两者主要投射到PBN。此外,还观察到NAc内侧有一个激活点,以下称为“mNAc-sh热点”(图三B-D),同时抑制了多巴胺能输入的中脑腹侧被盖区(VTA)。基于c-Fos+的所有807个脑区的PCA分析,可以完全区分恶病质与恶病质前小鼠的全脑激活模式(图三E),表现出明显的表达网络变化。值得注意的是,单独的PBle激活可有效地对各组进行分类,额外叠加一个区域如mNAc-sh热点后,分类准确率达到100%,突显了PBle的核心作用(图三F)。区域间的相关性分析表明恶病质会引发不同功能网络的出现,并且ArP和PBle之间的相关性增加(图三G)。mNAc-sh热点激活发生在PBle激活水平的阈值之上,表明PBle协调了恶病质的下游效应。以上数据表明,恶病质诱导了大脑神经活动的个别网络变化。
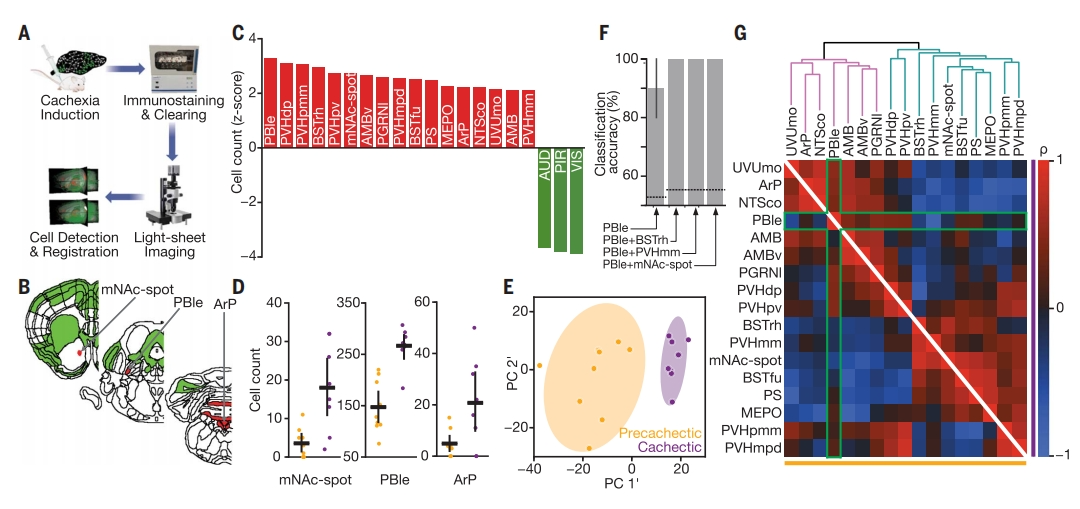
图三 癌症恶病质诱导的全脑神经活动谱式[4]
以上全脑成像呈现出中脑边缘区域的变化,mNAc的活动增加,VTA的活动减少,表明多巴胺能系统的参与。多巴胺能系统通常与抑郁症和情绪障碍有关[17, 18]。为了实时测量多巴胺活性,研究者注射基因编码的AAV-GRAB-DA到NAc,通过GRAB-DA多巴胺生物传感器[19]对多巴胺活性进行毫秒分辨率的荧光示踪,并使用光纤记录技术监测多巴胺波动在小鼠“留下或离开”的觅食决策中的变化(图四A、B和E)。已知奖励会促使中脑边缘多巴胺的释放,可以在试验中监测到奖励诱发的多巴胺瞬变,并且多巴胺瞬变与水奖励的大小成正比(图四C和D)。在小鼠恶病质的造模过程中,监测到奖励诱发的多巴胺释放的明显减少,特别是恶病质实验终点前3天(图四F-H)。接着测试IL-6的作用,在恶病质发作后开始抗IL-6处理(图四I)。尽管对整体恶病质的表型改善很小,仅延长了一天生存期且没有改善体重,但是可以完全挽救多巴胺释放的减少(图四J和K),改善觅食测试的动机缺陷(图四L)。随后,研究者通过光遗传学刺激或药理学增加多巴胺水平。使用逆行病毒在投射到NAc的VTA神经元中表达光敏感通道ChR2,光激活增加VTA-NAc神经元的多巴胺释放(图四M),挽救了恶病质诱导的动机缺陷(图四N),但没有挽救体重减轻也没有延长生存时间。将多巴胺激动剂直接注入NAc(图四O),这种定点给药也恢复了恶病质引起的动机缺陷(图四P)。以上数据表明,中脑边缘的多巴胺减少导致了癌症恶病质小鼠的淡漠样表型。
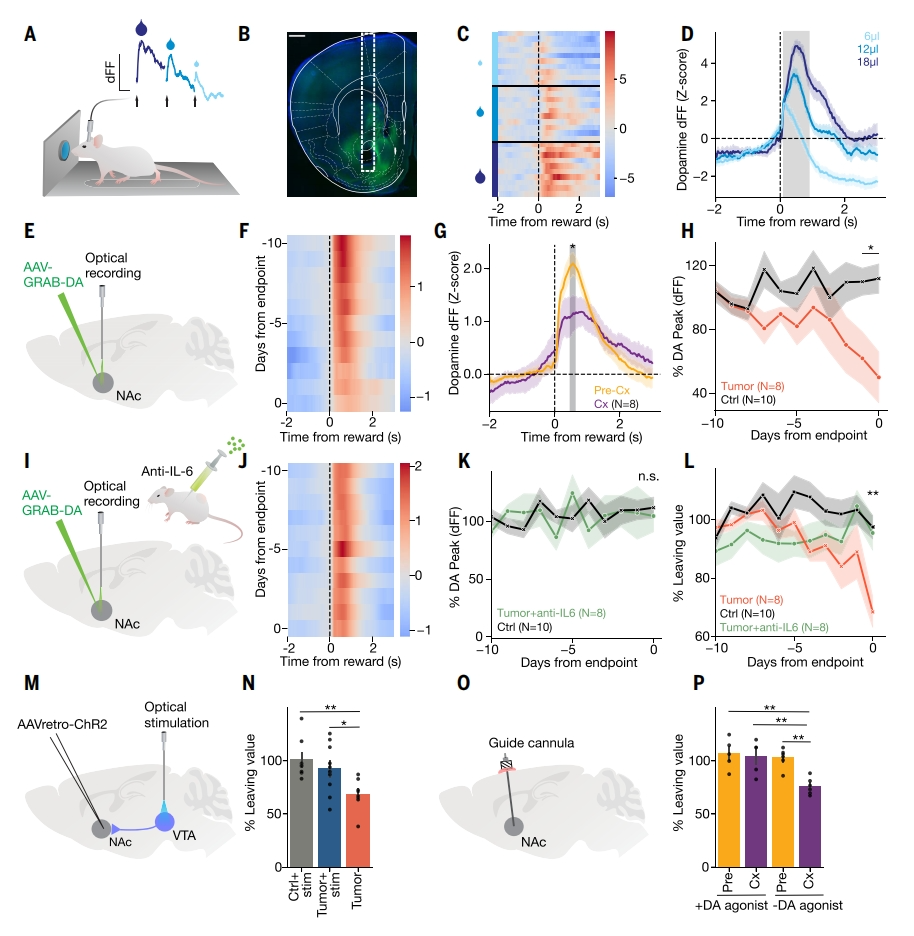
图四 中脑边缘多巴胺减少导致了癌症恶病质小鼠的淡漠样改变[4]
研究者使用体外方法研究VTA激活减少和多巴胺活性降低的突触和回路机制,发现恶病质通过抑制PBN进而减少了VTA多巴胺神经元的激活。鉴于ArP神经元投射到PBN,且ArP作为一种血脑屏障通透性较强的室周器官,易于感受血中循环细胞因子的变化。最后,研究者探究ArP是否具有响应IL-6升高的关键节点作用。为确定IL-6受体IL6R的作用,构建了IL6R-flox+/-小鼠,通过ArP注射AAV-Cre进行条件性敲降IL6R(IL6R-KD小鼠,图五A)。与对照恶病质小鼠相比,IL6R-KD小鼠ArP中IL6R的表达被显著降低,并降低了Fos+的激活(图五A)。尽管生存期和体重没有变化,但IL6R-KD恶病质小鼠的动机被显著改善,相较健康小鼠仅略微下降(图五B和C)。使用RNAscope分析表征ArP中表达IL6R的神经元,发现高表达IL6R、Fos和各种ArP神经元标志物(图五D)。为评估ArP投射到PBN的神经元在恶病质中的作用,研究者在PBN中注射逆行CAV2-Cre,在ArP中注射AAV-DIO-hCAR-DTR诱导性表达白喉毒素受体DTR,随后白喉毒素给药触发细胞死亡(图五E和F),这一靶向消除ArP投射到PBN的神经元部分挽救了恶病质的动机缺陷表型(图五G)。进一步研究ArP投射到PBN的神经元对中脑边缘多巴胺水平的调节作用(图五H)。短暂光刺激ArP投射到PBN的神经元,产生了短暂的多巴胺瞬变。然而,长期光刺激降低了NAc的整体多巴胺水平(图五H)。以上数据表明,激活ArP投射到PBN的神经元可以复制恶病质的多巴胺减少表型,反之消除ArP投射到PBN的神经元减轻了恶病质诱导的动机缺陷表型。
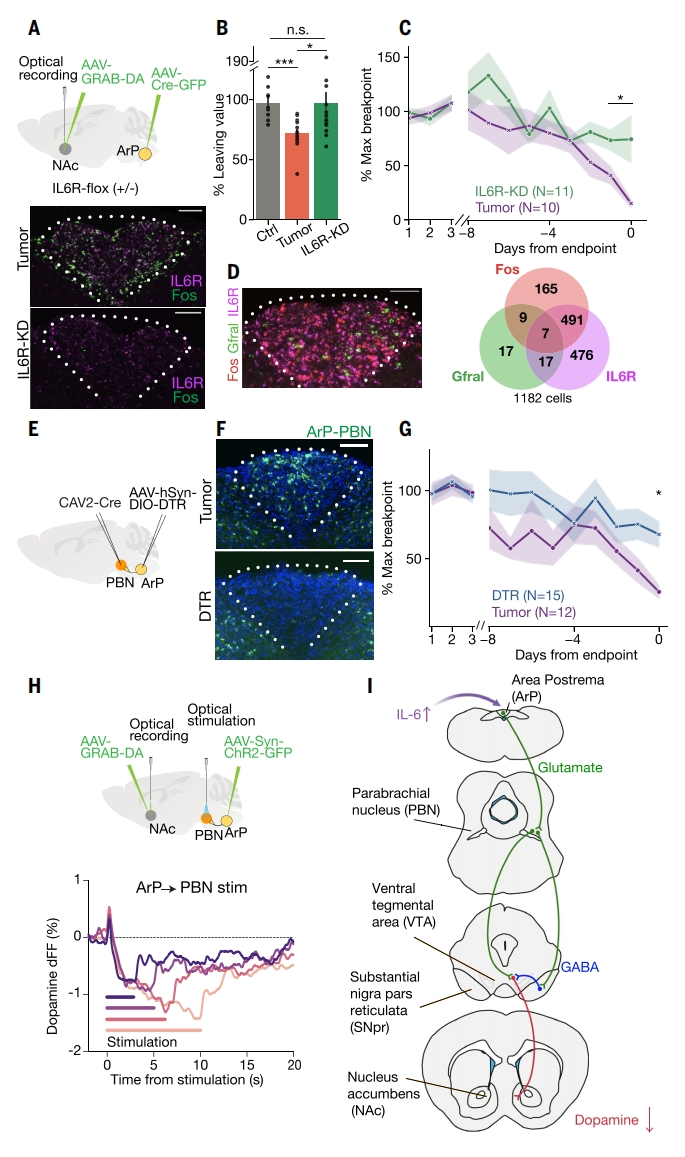
图五 免疫-神经回路介导癌症恶病质的淡漠样行为[4]
综上所述,该研究利用小鼠结肠癌恶病质模型,结合行为学分析、全脑神经活动图谱分析、病毒逆行示踪和药理干预等多种手段,确定了由炎症驱动大脑表现出癌症恶病质的淡漠样行为的一种免疫-神经回路。极后区(ArP)神经元检测到血循环中IL-6信号的剧增,将该信号传递到臂旁核(PBN),PBN驱动黑质网状部(SNpr)的抑制性神经元,随后抑制中脑腹侧被盖区(VTA)中的多巴胺神经元。这一逐级传递降低了伏隔核(NAc)中的多巴胺水平,表现为恶病质引起的淡漠样行为(图五I)。通过全身性抑制IL-6的表达或者定点促进多巴胺的释放,可以缓解恶病质引起的动机缺陷。该研究揭示了癌症恶病质进程中长期炎症导致神经症状的潜在生物学机制,为缓解这些症状开发有效治疗手段提供了理论基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Argilés JM, Busquets S, Stemmler B, López-Soriano FJ: Cancer cachexia: understanding the molecular basis. Nat Rev Cancer 2014, 14(11):754-762.
2. Fearon KC, Glass DJ, Guttridge DC: Cancer cachexia: mediators, signaling, and metabolic pathways. Cell metabolism 2012, 16(2):153-166.
3. Kir S, White JP, Kleiner S, Kazak L, Cohen P, Baracos VE, Spiegelman BM: Tumour-derived PTH-related protein triggers adipose tissue browning and cancer cachexia. Nature 2014, 513(7516):100-104.
4. Zhu XA, Starosta S, Ferrer M, Hou J, Chevy Q, Lucantonio F, Munoz-Castaneda R, Zhang F, Zang K, Zhao X et al: A neuroimmune circuit mediates cancer cachexia-associated apathy. Science 2025, 388(6743):eadm8857.
5. Tanaka Y, Eda H, Tanaka T, Udagawa T, Ishikawa T, Horii I, Ishitsuka H, Kataoka T, Taguchi T: Experimental cancer cachexia induced by transplantable colon 26 adenocarcinoma in mice. Cancer Res 1990, 50(8):2290-2295.
6. Musselman DL, Miller AH, Porter MR, Manatunga A, Gao F, Penna S, Pearce BD, Landry J, Glover S, McDaniel JS et al: Higher than normal plasma interleukin-6 concentrations in cancer patients with depression: preliminary findings. Am J Psychiatry 2001, 158(8):1252-1257.
7. Yohn SE, Arif Y, Haley A, Tripodi G, Baqi Y, Muller CE, Miguel NS, Correa M, Salamone JD: Effort-related motivational effects of the pro-inflammatory cytokine interleukin-6: pharmacological and neurochemical characterization. Psychopharmacology (Berl) 2016, 233(19-20):3575-3586.
8. Erta M, Quintana A, Hidalgo J: Interleukin-6, a major cytokine in the central nervous system. Int J Biol Sci 2012, 8(9):1254-1266.
9. Vainchtein ID, Molofsky AV: Astrocytes and Microglia: In Sickness and in Health. Trends Neurosci 2020, 43(3):144-154.
10. Chiang MC, Bowen A, Schier LA, Tupone D, Uddin O, Heinricher MM: Parabrachial Complex: A Hub for Pain and Aversion. J Neurosci 2019, 39(42):8225-8230.
11. Yang H, de Jong JW, Cerniauskas I, Peck JR, Lim BK, Gong H, Fields HL, Lammel S: Pain modulates dopamine neurons via a spinal-parabrachial-mesencephalic circuit. Nat Neurosci 2021, 24(10):1402-1413.
12. Carter ME, Soden ME, Zweifel LS, Palmiter RD: Genetic identification of a neural circuit that suppresses appetite. Nature 2013, 503(7474):111-114.
13. Campos CA, Bowen AJ, Han S, Wisse BE, Palmiter RD, Schwartz MW: Cancer-induced anorexia and malaise are mediated by CGRP neurons in the parabrachial nucleus. Nat Neurosci 2017, 20(7):934-942.
14. Price CJ, Hoyda TD, Ferguson AV: The area postrema: a brain monitor and integrator of systemic autonomic state. Neuroscientist 2008, 14(2):182-194.
15. Borison HL: Area postrema: chemoreceptor circumventricular organ of the medulla oblongata. Prog Neurobiol 1989, 32(5):351-390.
16. Browning KN, Verheijden S, Boeckxstaens GE: The Vagus Nerve in Appetite Regulation, Mood, and Intestinal Inflammation. Gastroenterology 2017, 152(4):730-744.
17. Treadway MT, Cooper JA, Miller AH: Can't or Won't? Immunometabolic Constraints on Dopaminergic Drive. Trends Cogn Sci 2019, 23(5):435-448.
18. Stuber GD: Neurocircuits for motivation. Science 2023, 382(6669):394-398.
19. Lerner TN, Shilyansky C, Davidson TJ, Evans KE, Beier KT, Zalocusky KA, Crow AK, Malenka RC, Luo L, Tomer R et al: Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell 2015, 162(3):635-647.



