技术分享:表征胰腺癌重编程浸润神经元,以及去神经支配的抗肿瘤疗效
外周神经系统(PNS)不论在生理或病理条件下,时刻支配协调着机体的器官功能。大多数癌症如胰腺导管腺癌(PDAC)可被PNS神经元浸润,形成复杂的肿瘤微环境(TME)[1]。然而,这些神经元的胞体存在于各种PNS神经节中,远离肿瘤,使得目前所有RNA-seq数据集都缺少了它们的分子信息[2]。多项研究表明,PDAC中的神经元亚型与癌症进展具有功能相关性,背根神经节(DRG)感觉神经元和腹腔神经节(CG)来源的交感神经元可促进PDAC生长[3, 4],而胆碱能迷走神经活动减慢其生长。促结缔组织增生基质生态系统是PDAC的显著特征之一,该系统由各种细胞类型所组成,表现出神经肥大和神经周围浸润[5]。尽管已知神经元肥大与肿瘤进展、转移和疼痛相关,但其潜在机制尚不清楚。
2025年4月,Nature期刊报道了一项研究,利用开发的Trace-n-Seq技术,对支配胰腺和胰腺导管腺癌(PDAC)的神经元进行了单细胞水平的分子表征。该技术使用荧光逆行示踪剂从组织轴突逆行追踪到各自神经节,随后单细胞分离标记神经元进行转录组分析。通过表征5000多个交感神经元和感觉神经元,其中约4000个神经元支配了PDAC或健康胰腺,揭示了支配胰腺、胰腺炎、PDAC或黑色素瘤转移的特异性神经元细胞类型和分子网络。之后,整合了神经元和微环境(TME)的单细胞数据集,建立了神经元-癌症-微环境的相互作用组,描绘了癌症驱动的神经元重编程以及胰腺癌-神经特征。临床应用上,通过药理学去神经支配,可诱导促炎性微环境,提高了免疫检查点抑制剂的抗肿瘤效果。并且,白蛋白结合型紫杉醇与去交感神经支配的6-OHDA联合使用,可以协同提高抗肿瘤效果。该研究揭示了PDAC的支配神经元网络和功能,提出了去神经支配这一概念可纳入未来的癌症治疗方案中[6]。
首先,为探究小鼠胰腺中神经元的三维定位、范围和类型,研究者通过光片荧光显微镜(LSFM)对iDISCO透明化样本进行成像。使用不同标志物来标记不同类型的神经元,例如外周蛋白(PRPH)标记泛神经元、酪氨酸羟化酶(TH)标记交感神经元、降钙素基因相关肽(CGRP)标记感觉神经元,并使用像素分类预测(PCP)进行定量(图一a和b)。发现胰腺的DRG感觉神经元的分布比CG交感神经元更均匀,DRG和CG切片中可见多种神经元亚型。由于神经元胞体位于靶器官之外,目前靶器官的分子数据里缺乏其支配神经元的信息。由此,研究者开发了一种名为Trace-n-Seq的方法,将荧光逆行示踪剂Fast Blue(FB)注射到靶器官[7],FB可被位于靶器官的支配神经元轴突末端吸收,进而逆行转运回PNS神经节的胞体中(图一c)。经过5-14天的追踪,分离神经节,消化和染色,通过荧光细胞分选(FACS)分离出单个FB+ 神经元,并进行scRNA-seq(图一c)。研究者通过流式细胞术和免疫荧光比较了DRG和CG中的FB标记效率,两种方法都显示,来自胸神经节Th6-Th10的75-90%的CG神经元和4-15%的DRG神经元投射到胰腺中(图一d);对于含有内脏感觉迷走神经纤维的颈静脉结节神经节(JNG),约12%被FB标记。在不同靶器官注射FB如脾脏、结肠和腹膜,显示出靶器官特异性神经元FB标记的比例不同,证实了FB标记方法的可行性以及Trace-n-Seq数据的特异性。

图一 Trace-n-Seq方法表征支配胰腺神经元[6]
在建立Trace-n-Seq后,研究者系统性分析免疫缺陷NSG小鼠和C57/BL6小鼠的健康胰腺支配神经元,总共分离了1384个高质量的单个神经元进行下游分析,其中589个DRG、689个CG和106个JNG神经元。所有细胞都是表达Prph的真正神经元,神经元亚型采用小鼠神经系统scRNA-seq图谱[8]进行注释(图一e)。该分析表明,胰腺由两种主要的交感神经支配:去甲肾上腺素能(NAergic)神经元亚型CG1和CG2,以及三种先前描述的JNG或DRG来源谷氨酸能神经元亚型支配:神经丝神经元(NEFM),肽能神经元(PEP)和非肽能神经元(NPEP)(图一f和g)。在单基因水平上,DRG神经元表达Piezo2,DRG亚型表达特征是Slit2(NEFM)、Calca和Bmpr1b(PEP)、Socs2(NPEP)。通过免疫荧光验证了胰腺FB追踪的DRG神经元中选择性表达SLIT2和CGRP(Calca)(图一g)。为了研究器官特异性,研究者将Trace-n-Seq应用于腹膜(181个DRG神经元)、横结肠(128个CG神经元)和脾脏(76个CG神经元),显示更多的CGRPα+、CGRPβ+ 和CGRPε+ PEP伤害感受器支配腹膜,而更多的NEFM神经元支配胰腺(图一h-j),表明了器官特异性的神经支配模式。
接下来,研究者探究四种不同胰腺导管腺癌(PDAC)模型的浸润神经元:两种人PDAC异种移植物(PDX)模型、KRAS-G12V和Tp53缺失的EPO原发模型、以及KPC小鼠细胞系的同种异体移植物模型。研究者通过3D LSFM评估PDAC的神经支配,发现伤害性(CGRP)、交感神经(TH)和副交感神经(vACHT)神经元表现出无序的神经发芽,轴突末端密集地分布在整个肿瘤中(图二a)。在PDAC中,神经元覆盖的面积大于健康胰腺(图二b)。整合PDAC和胰腺的神经元Trace-n-Seq数据,在所有PDAC模型中发现了与健康胰腺相似的集群(图二c和d)。通过比较354个健康和960个PDAC的CG神经元,确定了431个差异表达基因(DEG,图二e)。PDAC CG神经元下调基因包括神经肽编码基因Gal,受体Erbb2、Erbb3和Ntrk3、细胞外基质蛋白Matn2、Postn和Sparc、免疫调节因子Mif;而上调基因包括轴突引导受体Robo1、非编码RNA Mir6236、Neat1和Lars2、转录因子Hoxc5、信号分子Fgf14和Edn3(图二e)。GSEA显示,PDAC CG神经元主要富集在钙信号传导、突触形成和微管组装等过程,这与轴突发芽增加相一致。PDAC DRG神经元上调了神经元引导因子Ntn1和Epha、谷氨酸受体信号传导。转录因子分析表明,PDAC神经元中代谢调节因子Ppargc1a下调,而神经元发育因子Hox和Meis1上调。确定了对DRG亚型有影响的DEG 94个,NEFM中155个DEG,但PEP仅6个、NPEP仅5个DEG(图二f)。与胰腺支配神经元相比,PDAC表达最低的DEG与代谢、神经肽、受体和免疫调节因子有关,表达较高的基因包括转录因子Atf3和Dclk2、分泌因子Angptl2、受体Ptgfr、以及非编码RNA Lars2和Mir6236(图二e)。以上数据表明,PDAC诱导了浸润神经元的重编程。
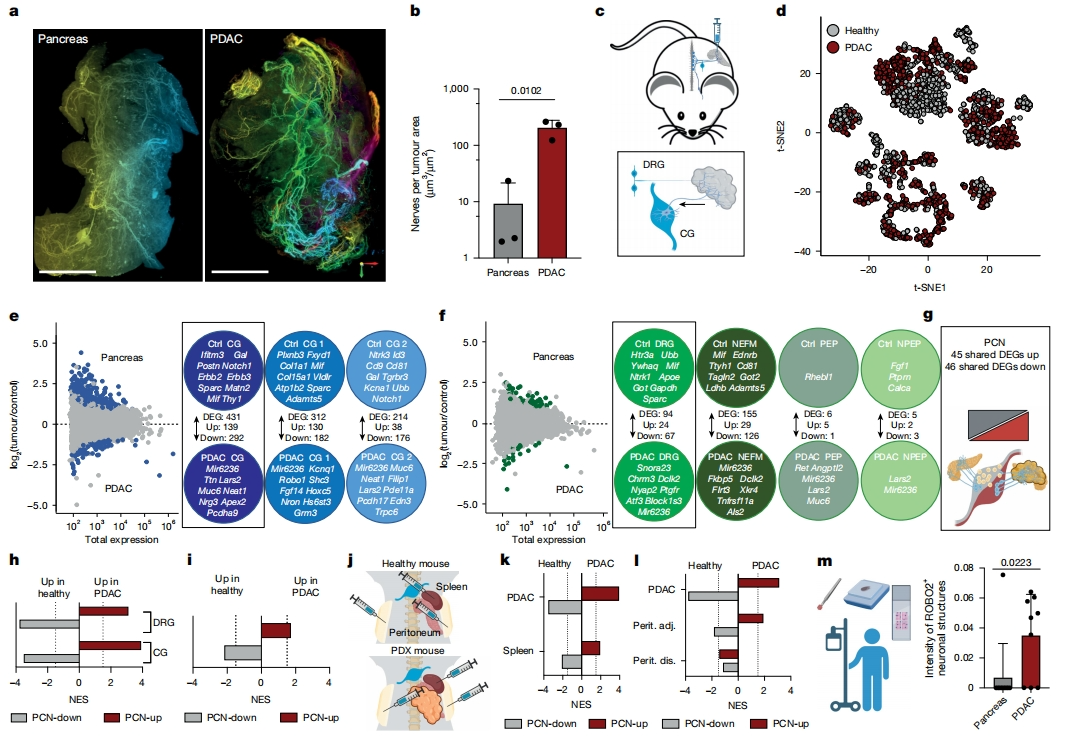
图二 PDAC诱导肿瘤特异性神经元表达谱式[6]
为了识别支配PDAC神经元的亚型非依赖性变化,研究者整合了来自所有五个主要CG和DRG亚簇的稳定表达差异基因,创建两个胰腺癌-神经(PCN)数据集:包含45个基因的PCN-up和46个基因PCN-down(图二g)。PCN-up在PDAC神经元中富集,而PCN-down在健康胰腺中富集(图二h和i)。为了评估PDAC是否系统性诱导这一PCN特征,分别将FB注射到原位移植的PDAC-PDX或健康小鼠的脾脏和腹膜(图二j)。发现PCN-down基因在同样在健康脾支配神经元中富集,PCN-up基因在PDX脾支配神经元中富集(图二k)。脾脏和胰腺在解剖学上相邻,一些神经元同时支配两者,这表明肿瘤可能通过重编程神经元影响脾脏造血和免疫细胞。同样,在靠近原发性肿瘤PDX小鼠的腹膜支配DRG神经元中,PCN-up显著富集,但在远离肿瘤的盆腔DRG神经元则无富集(图二j-l)。值得注意的是,肿瘤驱动的神经元重编程是区域性的,因为没有检测到肿瘤远端DRG神经元的全局失调(图二l)。此外,研究ROBO2作为PCN-up成员在人胰腺和PDAC中的表达,验证了ROBO2在人PDAC支配神经元中上调(图二m)。以上数据表明,研究者将PDAC重编程神经元的分子特征定义为一种“癌症-神经”特征,其表现取决于肿瘤的接近程度。
随后,研究其他癌症模型中的神经元变化,将黑色素瘤细胞注射到胰腺中(图三a)。尽管胰腺和PDAC-PDX模型的神经元示踪频率相似,但黑色素瘤显示CG(25% FB+)、DRG(1.7%)和JNG(1.3%)神经元的神经支配都显著降低(图三b)。从黑色素瘤、KPC和胰腺支配神经元中获得Trace-n-Seq数据(图三c)。在黑色素瘤神经元中,PCN-up富集,而PCN-down则倾向于调控DRG神经元,这可能是由于交感神经元快速生长而没有富集(图三d)。在健康和所有癌症浸润DRG神经元之间发现了相似数量的DEG,但在胰腺炎中发现的DEG较少(图三e)。在癌症神经支配中,KPC和黑色素瘤的Nefm特异性上调,PEP和NPEP标志物Calca和Socs2下调,而胰腺炎DRG神经元的变化不明显(图三f)。PDAC DRG神经元过表达NEFM标志基因Slit2,而Calca减少(图三g)。与健康胰腺相比,在PDAC的3D图像中检测到更少的CGRP+ 神经元,表明CGRPneg神经元可能更具吸引力,或者PDAC神经元的CGRP水平较低(图三h-i)。量化六种模型和相应对照中癌症支配神经的DRG亚型比率,一致发现NEFM增加,而NPEP和PEP神经元减少,且这种亚型转换是肿瘤特异性的,在胰腺炎中不存在(图三j)。以上数据表明,胰腺癌症的各种模型,但不包括胰腺炎,优先受NEFM型神经元支配。
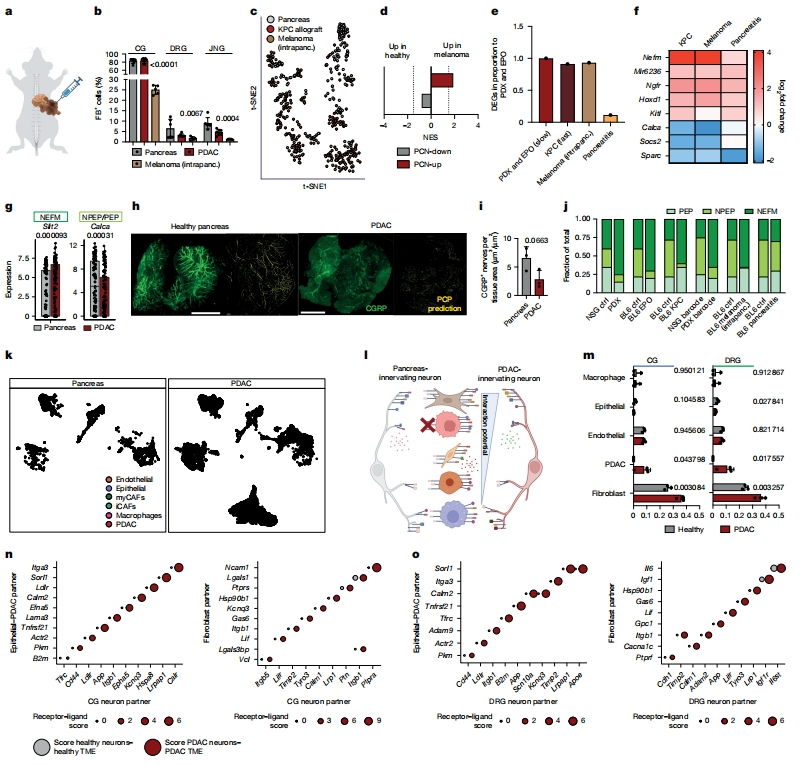
图三 TME中PDAC改变神经元相互作用,并吸引特定亚型[6]
PDAC的特征是广泛的纤维性结缔组织增生。为了识别PDAC或胰腺基质中的神经元相互作用伙伴,研究者将神经元转录组与来自PDX模型和健康胰腺的scRNA-seq数据进行生物信息学整合,确定了以下细胞类型:PDAC、健康上皮细胞、内皮细胞、免疫细胞和两种成纤维细胞群(图三k)。为了绘制神经元相互作用,对PDAC神经元和所有其他PDAC细胞类型之间的共表达配体-受体对进行评分(图三l和m)。在胰腺和PDAC中,成纤维细胞是最强的神经元相互作用伙伴,但癌症相关成纤维细胞(CAF)的得分高于健康成纤维细胞。其他TME细胞类型的相互作用评分保持相似,但PDAC细胞的评分高于同时具有CG和DRG神经元的健康上皮细胞(图三m)。对共表达和改变最显著的受体-配体对进行了排名,由此产生了PDAC-神经元和胰腺-神经元相互作用,揭示了PDAC中许多剧烈增强的受体-配体相互作用,包括Efna5(PDAC)-Epha5(CG),Gas6(CAF或内皮细胞)-Tyro3(DRG)或Il6(CAV或PDAC)-Il6st(DRG)。此外,在PDAC中,内皮-神经元相互作用增加,强调了这些生长因子的关键作用(图三n和o)。以上数据表明,PDAC及其TME中神经元相互作用显著增强,CAF是其主要相互作用伙伴。
下一步,研究者探究神经元在体内PDAC生长中的作用,通过手术腹腔神经节细胞切除术或在PDX和KPC模型中使用抗儿茶酚胺能神经毒素(6-OHDA)来耗竭交感神经元。即使在肿瘤形成后3-4周切除神经元,这两种方法也能将肿瘤重量减轻三倍(图四a-c)。肿瘤PRPH染色后的3D成像证实了神经元的失活,6-OHDA处理后胰腺CG FB+ 示踪效率降低了八倍(图四e)。在神经支配不良的皮下PDAC异种移植物中进行的相同实验,既没有减少肿瘤大小,也没有减少神经元浸润,排除了6-OHDA的神经非依赖性抗癌作用(图四d)。在6-OHDA失活神经元后PDAC的scRNA-seq数据中,PDAC细胞和CAF中与增殖和氧化磷酸化相关的基因被耗尽,而与对照肿瘤相比,炎症和柠檬酸循环特征被富集(图四f-h)。与此一致,检测到6-OHDA处理后CAF减少,肉毒杆菌处理后CAF减少程度较低(图四h和i)。此外,去神经支配后,CAF与CG和DRG神经元的相互作用评分回落到健康成纤维细胞的水平。这些去神经CAF上调了干扰素-α反应和同种异体排斥反应、以及Tnf或Il1b等基因,表明存在促炎状态(图四j和k)。为了支持促炎性PDAC TME,KPC肿瘤在6-OHDA处理后含有更多的CD45+ 细胞(图四l)。研究PDAC神经元是否通过CAF抑制抗肿瘤免疫,将6-OHDA与免疫检查点抑制剂(ICI)纳武单抗联合使用。单独使用ICI不会影响KPC肿瘤大小,但与6-OHDA联合使用时,肿瘤大小减小了5.7倍,表明去神经支配可以提高ICI的效率(图四m和n)。以上数据表明,去神经元支配使PDAC对免疫治疗敏感。
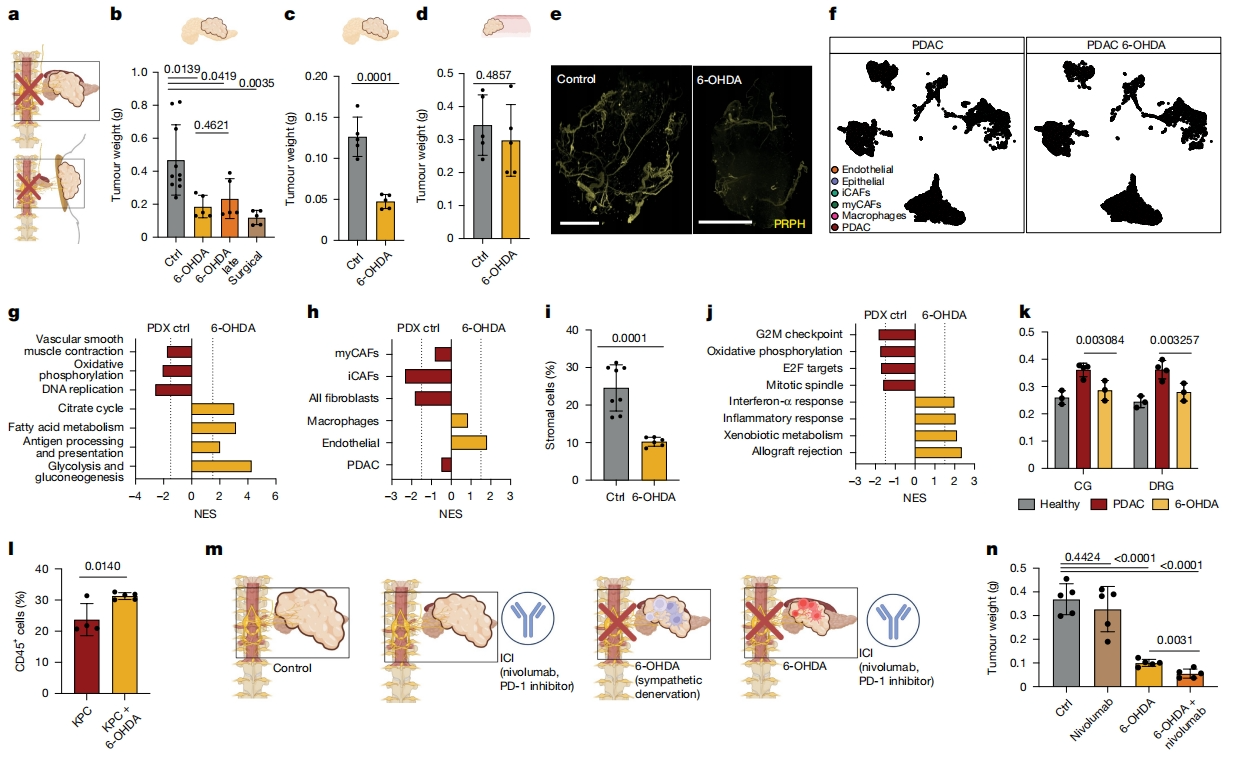
图四 去神经支配可减缓PDAC生长,诱导促炎变化,使PDAC对ICI敏感[6]
原位复发是PDAC切除术后的主要问题。研究者评估神经元与原位复发的关系。小鼠注射PDX细胞系10周后接受肿瘤切除术(PDX)、或者接受PBS/基质胶胰内注射10周后接受部分胰腺切除术。随后,将PDAC细胞注射到剩余胰腺中,每组分别接受6-OHDA或对照NaCl注射(图五a)。结果显示,先前携带肿瘤的小鼠继发性PDAC肿瘤增大了2.5倍,6-OHDA处理可减少原发性和继发性肿瘤的生长,6-OHDA介导的去神经支配可以防止继发性肿瘤的生长增加(图五b),表明神经元是重塑TME的关键驱动因素,导致继发性肿瘤生长加速。为了发现肿瘤切除后的神经元分子变化,将FB注射到肿瘤或胰腺中,7天后切除肿瘤或进行部分胰腺切除术(对照组),并在28天后分离神经节进行Trace-n-Seq(图五c)。与胰腺切除的对照小鼠神经元相比,即使在肿瘤切除后4周,PDX-CG神经元仍保持Mir6236等基因的过表达。此外,在CG神经元中仍富集了PCN-up和PCN-down信号,表明交感神经元持续维持“癌症-神经”特征(图五c和d)。以上数据表明,肿瘤重编程交感神经在肿瘤切除后仍能保持肿瘤促进特征,推动PDAC的原位复发。
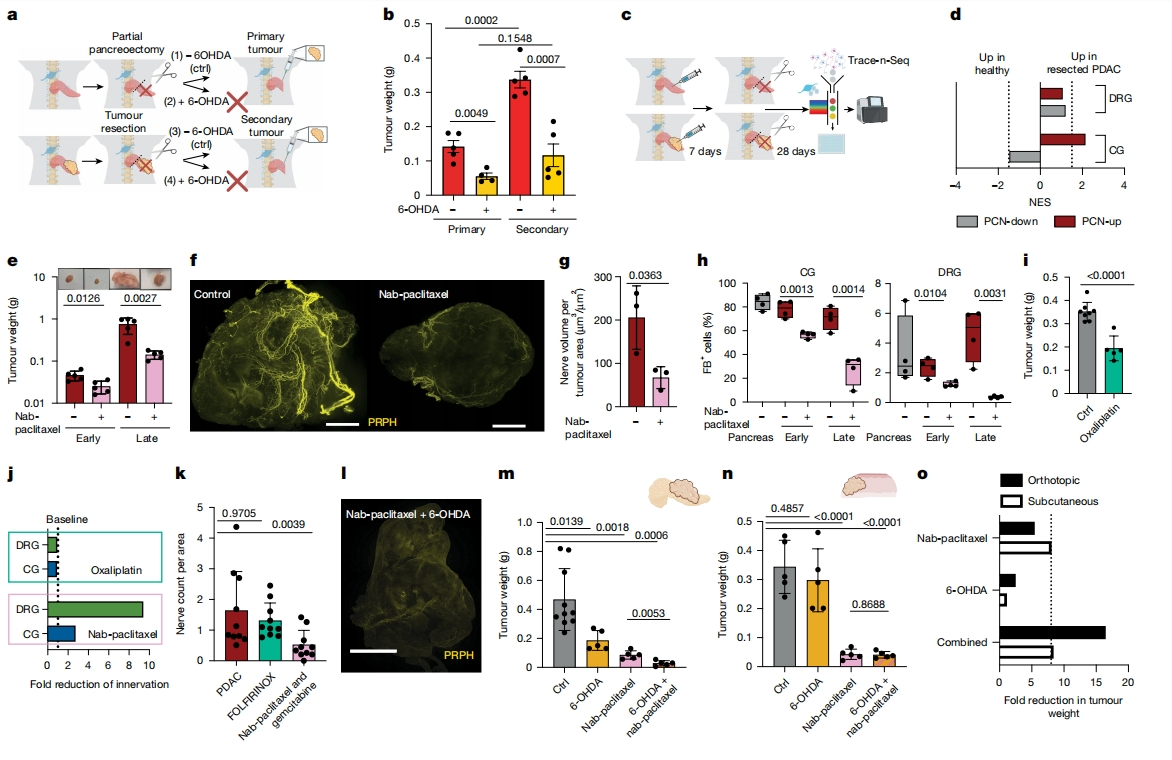
图五 白蛋白结合型紫杉醇通过减少浸润神经元抑制肿瘤生长[6]
白蛋白结合型紫杉醇联合吉西他滨是PDAC的标准治疗方案。通过阻断微管,白蛋白结合型紫杉醇抑制有丝分裂纺锤体,诱导细胞周期停滞,并影响依赖微管的轴突运输,尤其是感觉神经元。由此产生的周围神经病变是紫杉烷类药物的常见不良反应,导致感觉迟钝和治疗中断。因此,研究者用Trace-n-Seq研究白蛋白结合型紫杉醇对PDAC神经元的影响。正如预期的那样,白蛋白结合型紫杉醇不仅减少了肿瘤大小,还减少了肿瘤内轴突发芽。治疗后,每个CG的神经元保持稳定,而肿瘤内的神经元纤维减少了62%(图五e-g)。此外,FB+ CG PDAC神经元在四个治疗周期内从84%持续下降到27%。两个周期后,FB+ DRG神经元减少了两倍,四个周期后减少了9.8倍(图五h)。因此,白蛋白结合型紫杉醇可破坏肿瘤内的神经元发芽,以至于几乎没有感觉神经元投射到肿瘤中。另一种标准的PDAC治疗方案FOLFIRINOX,通过钙耗竭和钠通道去极化诱导神经病变。然而,在奥沙利铂治疗的PDX小鼠中,肿瘤体积有所减小,但FB+ PDAC神经元的数量没有减少(图五i和j)。在患者样本切片中,用吉西他滨和白蛋白结合型紫杉醇治疗的患者神经/肿瘤比率和神经元结构降低,但用FOLFIRINOX治疗的患者没有,验证了紫杉烷类特异性减少PDAC中的神经元浸润(图五k)。以上数据表明,白蛋白结合型紫杉醇,而非奥沙利铂,可靶向抑制肿瘤内神经元发芽,主要抑制感觉神经元,发挥抗肿瘤作用。
最后,研究者将6-OHDA耗竭交感神经元与白蛋白结合型紫杉醇抑制感觉神经元相结合。作为单一药物,它们分别减少了PDAC生长2.5倍或5.5倍,但联合使用后,肿瘤体积减少了16.5倍(图五m和o)。这种协同效应导致神经元浸润减少(图五l)。在原位肿瘤可观察到6-OHDA作为单一或联合治疗的效果,但在神经支配较差的皮下PDX肿瘤中没有观察到效果,表明了去神经支配的特异性作用(图五n)。 以上数据表明,联合去交感神经支配与白蛋白结合型紫杉醇,可显著增强抗PDAC作用。
综上所述,该研究开发了Trace-n-Seq技术,在单细胞分辨率下对胰腺导管腺癌(PDAC)癌组织的支配神经元进行鉴定和分子表征。在PDAC中,浸润神经元被癌细胞重编程,导致广泛的神经元出芽和向NEFM亚型感觉神经元的转变。该研究发现了一种独特的“癌症-神经”(PCN)特征,该特征在肿瘤切除后仍持续存在,可能会促进肿瘤增殖和原位复发。去神经支配可增加PDAC对免疫检查点阻断的敏感性。白蛋白结合型紫杉醇不仅靶向肿瘤细胞,还能破坏神经元浸润来减少肿瘤生长,联合去交感神经支配疗法时,可协同抑制PDAC生长,强调了癌症-神经轴的重要性。该研究揭示了PDAC与外周神经系统之间的复杂相互作用,提示了靶向胰腺癌与神经元的相互作用可能成为一种有效的治疗策略,有望为胰腺癌治疗开辟新的方向,改善胰腺癌患者的预后。此外,Trace-n-Seq技术还可以扩展到其他器官的健康组织和肿瘤中,在不同的生理和病理条件下,提供相应器官的神经支配分子特征,有望开辟通用型的肿瘤治疗新方向。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Demir IE, Mota Reyes C, Alrawashdeh W, Ceyhan GO, Deborde S, Friess H, Görgülü K, Istvanffy R, Jungwirth D, Kuner R et al: Future directions in preclinical and translational cancer neuroscience research. Nature cancer 2021, 1:1027-1031.
2. Zahalka AH, Frenette PS: Nerves in cancer. Nat Rev Cancer 2020, 20(3):143-157.
3. Hruban RH, Goggins M, Parsons J, Kern SE: Progression model for pancreatic cancer. Clinical cancer research : an official journal of the American Association for Cancer Research 2000, 6(8):2969-2972.
4. Saloman JL, Albers KM, Li D, Hartman DJ, Crawford HC, Muha EA, Rhim AD, Davis BM: Ablation of sensory neurons in a genetic model of pancreatic ductal adenocarcinoma slows initiation and progression of cancer. Proceedings of the National Academy of Sciences of the United States of America 2016, 113(11):3078-3083.
5. Demir IE, Reyes CM, Alrawashdeh W, Ceyhan GO, Deborde S, Friess H, Görgülü K, Istvanffy R, Jungwirth D, Kuner R et al: Clinically Actionable Strategies for Studying Neural Influences in Cancer. Cancer Cell 2020, 38(1):11-14.
6. Thiel V, Renders S, Panten J, Dross N, Bauer K, Azorin D, Henriques V, Vogel V, Klein C, Leppä AM et al: Characterization of single neurons reprogrammed by pancreatic cancer. Nature 2025.
7. Renier N, Wu Z, Simon DJ, Yang J, Ariel P, Tessier-Lavigne M: iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell 2014, 159(4):896-910.
8. Zeisel A, Hochgerner H, Lönnerberg P, Johnsson A, Memic F, van der Zwan J, Häring M, Braun E, Borm LE, La Manno G et al: Molecular Architecture of the Mouse Nervous System. Cell 2018, 174(4):999-1014.e1022.



