技术分享:InflaMix模型精准预测CAR-T治疗效果
CD19嵌合抗原受体T细胞(CAR-T)疗法在治疗复发或难治性大B细胞淋巴瘤(LBCL)方面具有显著疗效[1-4]。与传统的标准二线疗法相比,CD19 CAR-T疗法提高了总生存期(OS),显著延长了无事件生存期(EFS)和无进展生存期(PFS)[5]。CAR-T疗法也被批准用于治疗非霍奇金淋巴瘤(NHL)、套细胞淋巴瘤(MCL)和滤泡性淋巴瘤(FL)等[6, 7]。然而,并非所有患者都能受益,超过50%的LBCL患者在接受CAR-T治疗后6个月内出现肿瘤复发,这些患者的OS中位数仅为6个月[4, 8-10]。此外,CAR-T治疗的疗效受益还需要平衡一些毒性风险,包括细胞因子释放综合征(CRS)、神经毒性、感染并发症、长期血细胞减少症等[11-13]。因此,亟需开发一种能预测CAR-T疗效的模型,通过对患者CAR-T治疗后的复发或疾病进展进行准确预测,以便在治疗前预判CAR-T疗效,进而帮助患者选择最合适的治疗方案,避免不必要的痛苦和经济负担。
2025年4月,Nature Medicine 期刊发表了一项名为“InflaMix”的预测模型,用于预测非霍奇金淋巴瘤(NHL)患者对嵌合抗原受体T细胞(CAR-T)治疗的响应程度。这是一种无监督的定量模型,具有很强的稳健性,通过整合患者在CAR-T治疗前的14项血液标志物的检测数据,来评估其炎症状态以及功能器官状况,从而敏锐预测和识别出在CAR-T治疗后发生疾病复发和死亡可能性较高的患者。此外,InflaMix在指标数据缺失的情况下,只有6项血液标志物数据仍可进行准确的评估。未来,InflaMix模型作为一种临床决策支持工具,可以为NHL患者是否进行CAR-T治疗提供有价值的评估[14]。
先前研究表明,患者血液血细胞计数和炎症标志物可以指示CAR-T细胞治疗的效果[15-18]。由此,研究者验证149名接受CD19 CAR-T治疗的LBCL患者的输注前实验室测量指标之间的相关性,包括器官功能指标ALP、AST、白蛋白、总胆红素(Tbili)、白细胞(WBC)计数、血红蛋白、血小板(Plt),肿瘤负荷(LDH)和炎症标志物C-反应蛋白(CRP)、铁蛋白、D-二聚体、IL-6、IL-10和肿瘤坏死因子α(TNFα)等(图一a)。结果显示,CRP、铁蛋白、IL-6等炎症指标与LDH呈正相关,与白蛋白和血红蛋白呈负相关(图一a),这一发现与表征急性期反应物如铁蛋白、阴性反应物白蛋白的临床数据相一致。相比之下,IL-6、LDH与IL-10无相关性,IL-10是一种多效性细胞因子,通过负反馈调节促炎细胞因子[19]。Tbili、ALP、TNFα与IL-10呈正相关,与白蛋白和血红蛋白呈负相关。已知IL-10、TNF与肝损伤有关,其中IL-10具有肝保护作用[20]。以上结果表明,这些LBCL患者的血相检测炎症和器官功能指标提供了一些相互联系的正交信息。
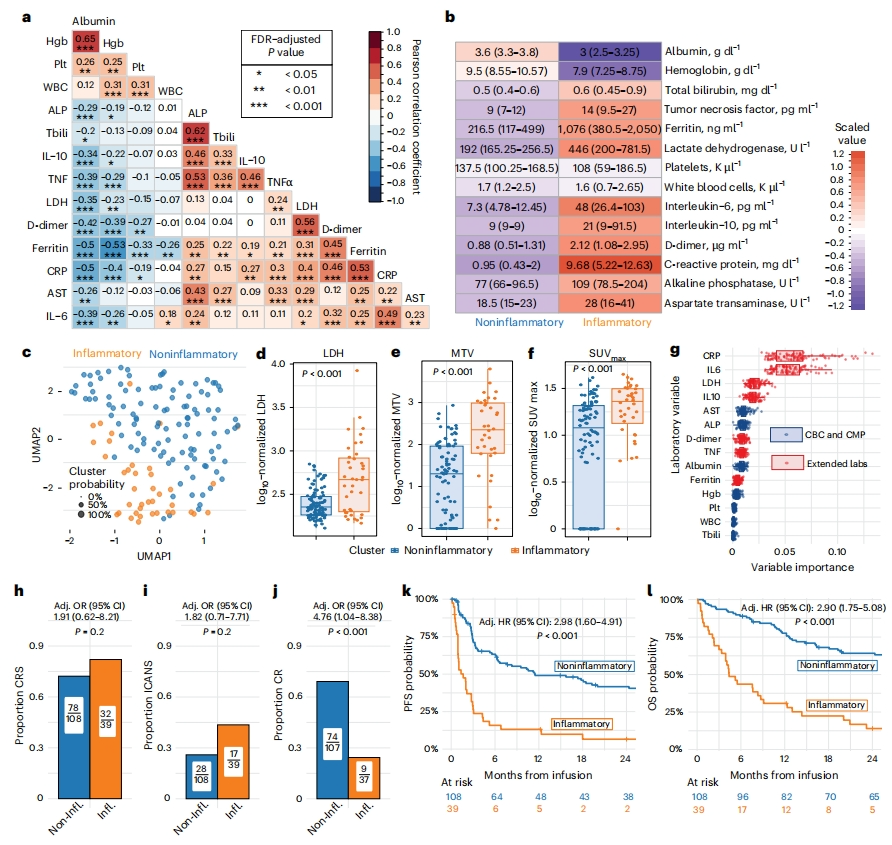
图一 利用CAR-T输注前14项血液标志物开发的InflaMix模型[14]
于是,研究者基于患者接受CAR-T输注前的以上14项血液标志物数据,建立了一个高斯混合模型“InflaMix”,旨在使用无监督学习对患者进行分组。InflaMix模型将患者划分为炎症组和非炎症组两个群体(图一b和c)。在CAR-T治疗前的最近一次PET-CT评估中,炎症组的疾病负荷基线指标LDH、以及淋巴瘤的放射学特征代谢肿瘤体积(MTV)和最大标准化摄取值(SUVmax)都显著高于非炎症组(图一d-f)。为了解哪些特征对InflaMix聚类分配最为重要,开发了100次迭代的交叉验证随机森林模型来分析各项实验室指标在预测聚类分配中的重要性,结果显示,IL-6、CRP、LDH等指标对于区分炎症组和非炎症组最为重要(图一g)。为了确定InflaMix的准确性,研究者在多变量回归模型中评估其预测能力,并根据患者特征和疾病特征进行调整。结果发现,分组与CRS和免疫效应细胞相关神经毒性综合征(ICANS)的发生率无关(图一h和i)。但是,炎症组与治疗100天未达到完全缓解(CR)的概率增加有关(图一j),与PFS降低(图一k)和OS降低有关(图一l)。以上数据表明,利用InflaMix可对患者进行有效分组,对LBCL患者接受CAR-T治疗的疾病反应和生存风险进行有价值的评估。
然后,研究者使用两个独立的LBCL队列和一个其他类型NHL(MCL和FL)队列,来验证InflaMix的分组预测能力。结果显示,InflaMix模型均能可靠地将患者分为炎症组和非炎症组,炎症组患者的PFS、OS和CR率都显著低于非炎症组患者(图二),表明InflaMix模型在不同患者类型中表现稳定,具有很强的普遍适用性;提示在治疗前表现出高炎症特征的患者,其CAR-T治疗失败的风险将显著增加。
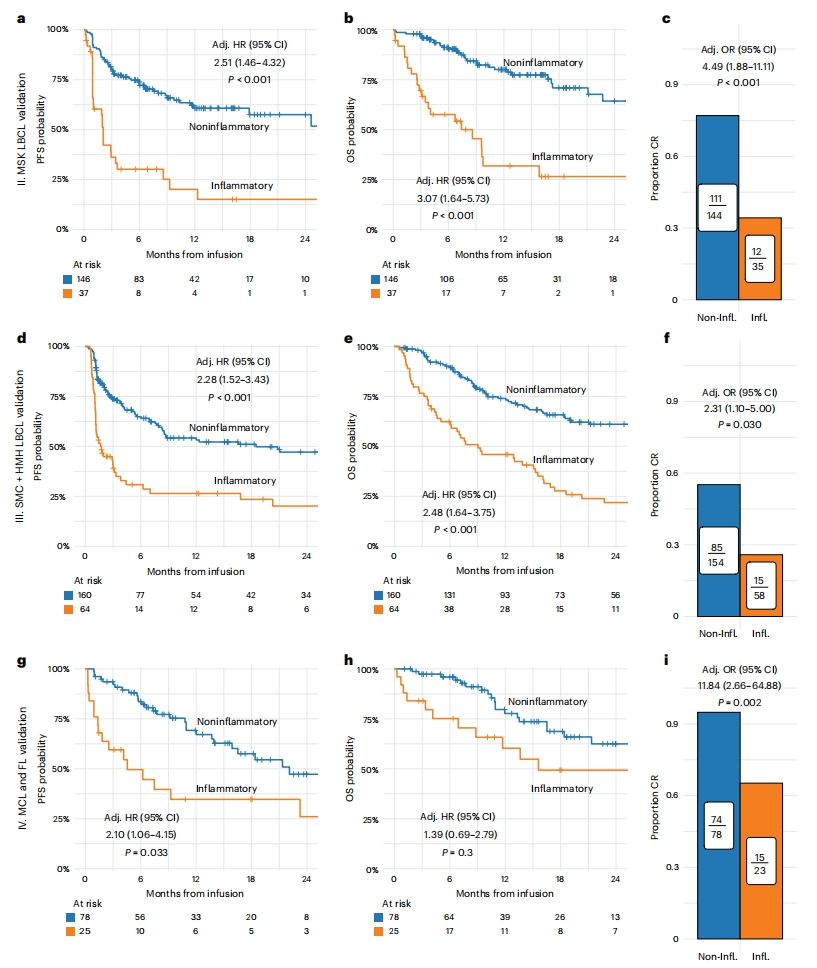
图二 InflaMix模型可对不同患者群体进行有效分组[14]
因临床实验和检测时效性上难免会遇到患者采集指标数据不足的情况,研究者进一步简化指标,使用6项指标白蛋白、Hgb、AST、ALP、CRP、LDH进行聚类分析,并以14项指标的聚类作为对照,验证简化后的InflaMix聚类分析的可靠性。结果发现,使用简化6项指标预测的CAR-T治疗患者的临床结果包括PFS、OS和CR(图三)与使用完整14项指标的聚类结果(图二)高度一致,表明简化InflaMix模型在聚类分析中仍具有可靠性。研究者为InflaMix的临床应用开发了一个在线软件https://github.com/vdblab/InflaMix。为了获得最佳结果,用户尽量输入14项血相指标,至少保证输入简化的6项指标。
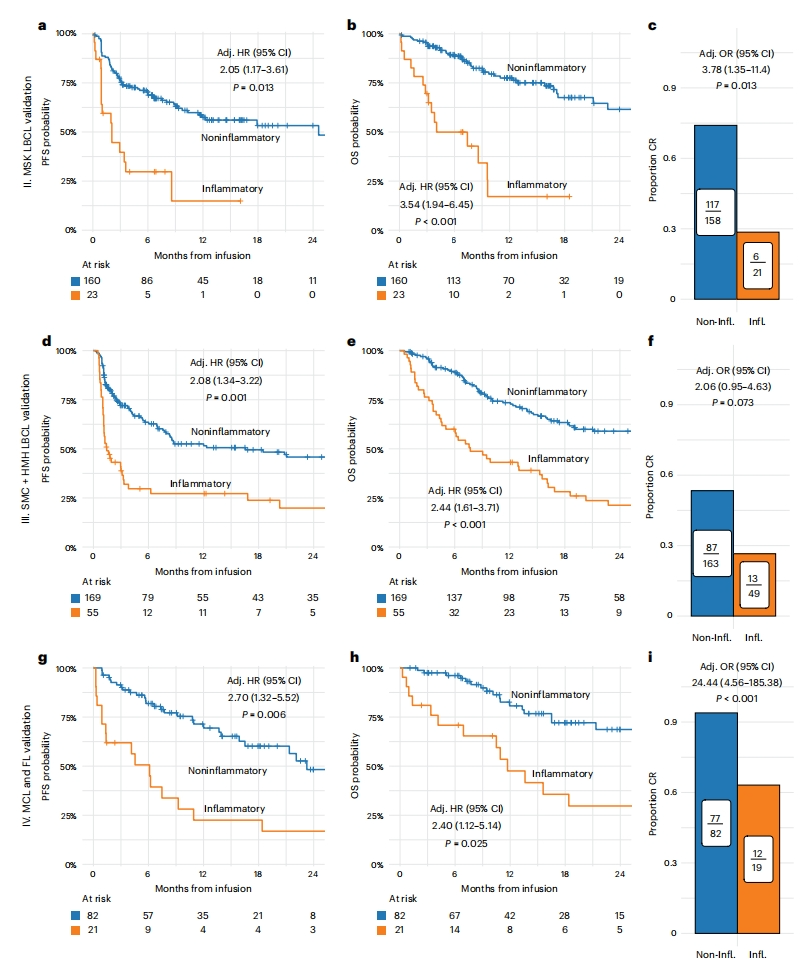
图三 仅6项指标的简化InflaMix模型可对不同患者群体进行有效分组[14]
全身性炎症是一种可改变的特性。最后,研究者探究在CAR-T治疗的关键时间点,包括分离T细胞前、淋巴清除术前和CAR-T细胞输注前的血相指标进行InflaMix分类,分析是否与临床结果的变化相关。发现各阶段之间均可能发生聚类状态的转变,如从炎症组(I)转变到非炎症组(NI),或者从非炎症组转变到炎症组(图四a),热图的颜色深浅反映了14项检测指标的高低和转变(图四b)。在治疗效果的预测方面,患者如果在分离T细胞前到CAR-T细胞输注前的这段时间内,从炎症组转变到非炎症组,就能在CAR-T细胞治疗后显示出更好的生存率和疾病反应率(图四c和e);同样地,患者如果在淋巴清除术前到CAR-T细胞输注前的这段时间内发生这种转变,也能观察到类似的临床疗效改善(图四d和f)。以上数据表明,在CAR-T治疗前采取积极的干预措施降低患者的炎症水平,可大大提高CAR-T治疗的疗效,而InflaMix分组的转变可为预测这一临床结果提供重要信息。
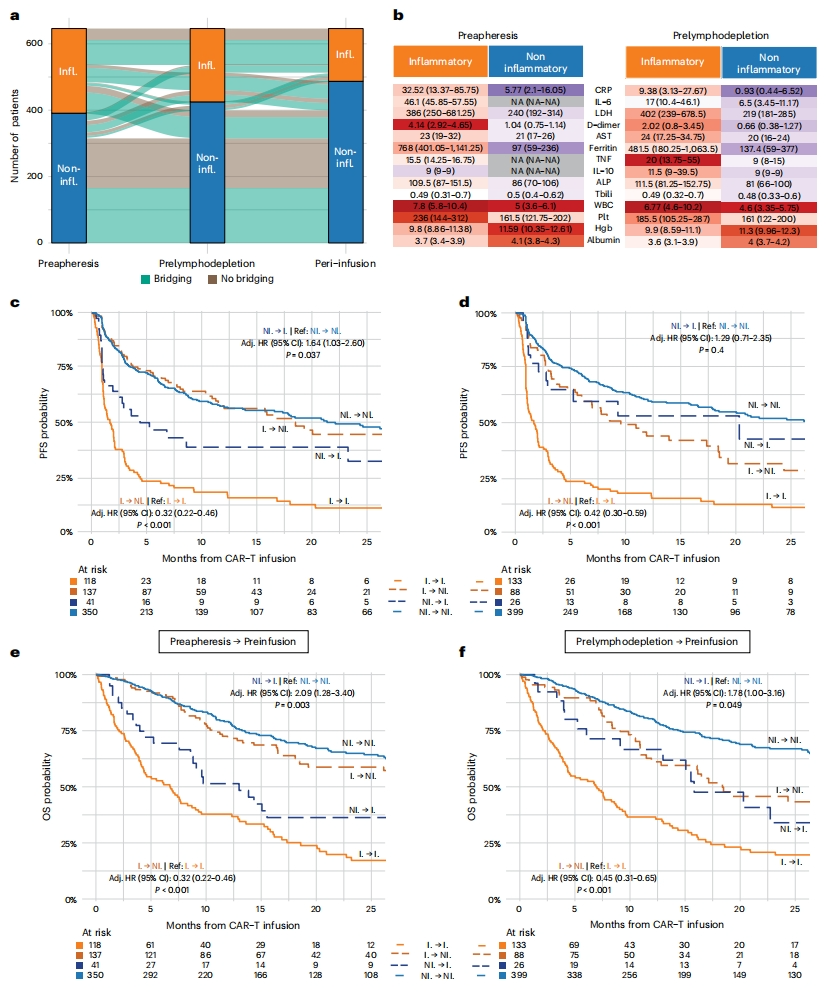
图四 CAR-T治疗前有效降低患者炎症水平可显著增加疗效[14]
综上所述,研究者基于患者的炎症标志物和器官功能指标数据,建立了一个InflaMix预测模型,旨在利用治疗前的14项血液检测标志物来全面、深入地评估患者CAR-T治疗的临床受益。InflaMix模型能够可靠地将患者分为炎症组和非炎症组两个聚类,炎症组患者具有更高的炎症标志物水平和肿瘤负荷,其CAR-T治疗失败的风险显著增加,而非炎症组患者CAR-T治疗的成功概率增加。基于InflaMix模型,医生可以通过患者CAR-T治疗前的血液检测,预判患者的疗效,从而制定更合理的治疗策略和风险管理计划。InflaMix模型的预测性能优于传统生物标志物和替代建模方法,为临床决策提供了额外的预测价值,且在数据缺失情况下仍能保持较高的准确性,仅使用6项常用血相检测指标也能有效区分患者的风险。InflaMix模型可为NHL患者是否接受CAR-T治疗提供了一个有价值的临床决策支持工具,有助于实现CAR-T疗法的个性化治疗。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, Braunschweig I, Oluwole OO, Siddiqi T, Lin Y et al: Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med 2017, 377(26):2531-2544.
2. Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, Jager U, Jaglowski S, Andreadis C, Westin JR et al: Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med 2019, 380(1):45-56.
3. Abramson JS, Palomba ML, Gordon LI, Lunning MA, Wang M, Arnason J, Mehta A, Purev E, Maloney DG, Andreadis C et al: Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet 2020, 396(10254):839-852.
4. Locke FL, Ghobadi A, Jacobson CA, Miklos DB, Lekakis LJ, Oluwole OO, Lin Y, Braunschweig I, Hill BT, Timmerman JM et al: Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol 2019, 20(1):31-42.
5. Westin JR, Oluwole OO, Kersten MJ, Miklos DB, Perales MA, Ghobadi A, Rapoport AP, Sureda A, Jacobson CA, Farooq U et al: Survival with Axicabtagene Ciloleucel in Large B-Cell Lymphoma. N Engl J Med 2023, 389(2):148-157.
6. Jacobson CA, Chavez JC, Sehgal AR, William BM, Munoz J, Salles G, Munshi PN, Casulo C, Maloney DG, de Vos S et al: Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol 2022, 23(1):91-103.
7. Wang M, Munoz J, Goy A, Locke FL, Jacobson CA, Hill BT, Timmerman JM, Holmes H, Jaglowski S, Flinn IW et al: KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. N Engl J Med 2020, 382(14):1331-1342.
8. Nastoupil LJ, Jain MD, Feng L, Spiegel JY, Ghobadi A, Lin Y, Dahiya S, Lunning M, Lekakis L, Reagan P et al: Standard-of-Care Axicabtagene Ciloleucel for Relapsed or Refractory Large B-Cell Lymphoma: Results From the US Lymphoma CAR T Consortium. J Clin Oncol 2020, 38(27):3119-3128.
9. Alarcon Tomas A, Fein JA, Fried S, Flynn JR, Devlin SM, Fingrut WB, Anagnostou T, Alperovich A, Shah N, Fraint E et al: Outcomes of first therapy after CD19-CAR-T treatment failure in large B-cell lymphoma. Leukemia 2023, 37(1):154-163.
10. Spiegel JY, Dahiya S, Jain MD, Tamaresis J, Nastoupil LJ, Jacobs MT, Ghobadi A, Lin Y, Lunning M, Lekakis L et al: Outcomes of patients with large B-cell lymphoma progressing after axicabtagene ciloleucel therapy. Blood 2021, 137(13):1832-1835.
11. Pennisi M, Jain T, Santomasso BD, Mead E, Wudhikarn K, Silverberg ML, Batlevi Y, Shouval R, Devlin SM, Batlevi C et al: Comparing CAR T-cell toxicity grading systems: application of the ASTCT grading system and implications for management. Blood Adv 2020, 4(4):676-686.
12. Wudhikarn K, Pennisi M, Garcia-Recio M, Flynn JR, Afuye A, Silverberg ML, Maloy MA, Devlin SM, Batlevi CL, Shah GL et al: DLBCL patients treated with CD19 CAR T cells experience a high burden of organ toxicities but low nonrelapse mortality. Blood Adv 2020, 4(13):3024-3033.
13. Jain T, Knezevic A, Pennisi M, Chen Y, Ruiz JD, Purdon TJ, Devlin SM, Smith M, Shah GL, Halton E et al: Hematopoietic recovery in patients receiving chimeric antigen receptor T-cell therapy for hematologic malignancies. Blood Adv 2020, 4(15):3776-3787.
14. Raj SS, Fei T, Fried S, Ip A, Fein JA, Leslie LA, Alarcon Tomas A, Leithner D, Peled JU, Corona M et al: An inflammatory biomarker signature of response to CAR-T cell therapy in non-Hodgkin lymphoma. Nat Med 2025, 31(4):1183-1194.
15. Locke FL, Rossi JM, Neelapu SS, Jacobson CA, Miklos DB, Ghobadi A, Oluwole OO, Reagan PM, Lekakis LJ, Lin Y et al: Tumor burden, inflammation, and product attributes determine outcomes of axicabtagene ciloleucel in large B-cell lymphoma. Blood Adv 2020, 4(19):4898-4911.
16. Vercellino L, Di Blasi R, Kanoun S, Tessoulin B, Rossi C, D'Aveni-Piney M, Oberic L, Bodet-Milin C, Bories P, Olivier P et al: Predictive factors of early progression after CAR T-cell therapy in relapsed/refractory diffuse large B-cell lymphoma. Blood Adv 2020, 4(22):5607-5615.
17. Pennisi M, Sanchez-Escamilla M, Flynn JR, Shouval R, Alarcon Tomas A, Silverberg ML, Batlevi C, Brentjens RJ, Dahi PB, Devlin SM et al: Modified EASIX predicts severe cytokine release syndrome and neurotoxicity after chimeric antigen receptor T cells. Blood Adv 2021, 5(17):3397-3406.
18. Rejeski K, Perez A, Sesques P, Hoster E, Berger C, Jentzsch L, Mougiakakos D, Frolich L, Ackermann J, Bucklein V et al: CAR-HEMATOTOX: a model for CAR T-cell-related hematologic toxicity in relapsed/refractory large B-cell lymphoma. Blood 2021, 138(24):2499-2513.
19. Saraiva M, O'Garra A: The regulation of IL-10 production by immune cells. Nat Rev Immunol 2010, 10(3):170-181.
20. Nagaki M, Iwai H, Naiki T, Ohnishi H, Muto Y, Moriwaki H: High levels of serum interleukin-10 and tumor necrosis factor-alpha are associated with fatality in fulminant hepatitis. J Infect Dis 2000, 182(4):1103-1108.



