技术分享:RUNX2促进肺泡成纤维细胞转变为病理成纤维细胞
肺纤维化是一种由多病因引起的肺组织损伤,其特征是存在大量异常活化的成纤维细胞以及细胞外基质(ECM)蛋白的过度沉积,进而导致肺功能逐渐失调[1, 2]。多种来源的成纤维细胞与肺纤维化有关,包括GLI1+ 基质细胞、TBX4+ 驻留成纤维细胞、AXIN2+ 肌成纤维祖细胞和PDGFRA+ ADRP+ 脂肪成纤维细胞[3, 4]。最近,小鼠模型和人类特发性肺纤维化(IPF)的单细胞RNA测序(scRNA-seq)分析表明,纤维化变化与CTHRC1+ 病理成纤维细胞的存在有关[5]。这些CTHRC1+ 细胞来源于肺泡成纤维细胞,后者对维持正常的肺泡结构至关重要[6]。研究病理成纤维细胞的细胞起源对于揭示其潜在的分子机制和开发有效的治疗方法非常重要。尽管已知包括TGFβ和PDGF在内的多种信号通路与肺纤维化有关,但这些病理成纤维细胞的来源及其关键的下游调节因子还有待确定。
2025年2月,Nature期刊发表了一项研究,发现病理成纤维细胞主要来源于LEPR+ SCUBE2+ 肺泡成纤维细胞,且RUNX2是关键调节因子。具体而言,研究者使用小鼠肺纤维化模型,证明在肺泡形成过程中出现的LEPR+ 成纤维细胞主要为SCUBE2+ 肺泡成纤维细胞。LEPR+ SCUBE2+ 肺泡成纤维细胞是CTHRC1+POSTN+ 病理成纤维细胞的主要贡献者。而转录因子RUNX2是促进病理成纤维细胞生成的关键调节因子,其敲除减少了病理成纤维细胞的生成、细胞外基质沉积和肺纤维化。该研究印证了肺泡成纤维细胞作为病理成纤维细胞的主要来源,揭示了促进病理成纤维细胞生成的关键调节因子RUNX2,为治疗肺纤维化提供了新的靶点[7]。
瘦素受体Lepr已被证明可以标记骨髓的基质细胞亚群[8]。通过异位表达糖蛋白激素血小板生成素来诱导骨髓纤维化,发现Leprcre标记的基质细胞是肌成纤维细胞的主要来源[9]。于是,研究者重新分析小鼠肺部发育的scRNA-seq数据[10],发现Lepr转录本存在于多种间充质细胞中,包括肺泡成纤维细胞、次级嵴肌成纤维细胞、外膜成纤维细胞、周细胞和内皮细胞(图一a和b)。Lepr水平在出生后肺泡形成过程中逐渐升高,在胚胎第18.5天(E18.5)表达较少,在出生后第14天(P14)表达丰富(图一c)。与此发现一致,在Leprcre;Rosa26tdtomato(R26tdT)小鼠的肺中,在P0观察到的tdTomato阳性(tdT+)细胞很少,相比之下,在P10肺实质中tdT+ 细胞增加,到P30和P60时整个肺泡中都观察到tdT+ 间充质细胞,证实了Lepr的表达。于是研究者探究LEPR+ 细胞是否贡献到肺纤维化的病理成纤维细胞。使用博来霉素诱导的肺纤维化小鼠模型,用博来霉素处理成年Leprcre;R26tdT小鼠,并在损伤后14天检查肺组织 (图一d),tdT+ 细胞在严重损伤的区域显著增多(图一d-g)。tdT+ 细胞与肌成纤维细胞标志物αSMA和病理成纤维细胞标志物CTHRC1共定位(图一d和f)。LeprcreERT2;R26tdT小鼠在喂食他莫昔芬饲料后,也用博来霉素处理,同样在纤维化灶中检测到大量表达αSMA和CTHRC1的tdT+ 细胞(图一h-k)。以上数据表明,在肺泡形成过程中出现的LEPR+ 间充质细胞是导致肺纤维化的病理成纤维细胞的主要来源。
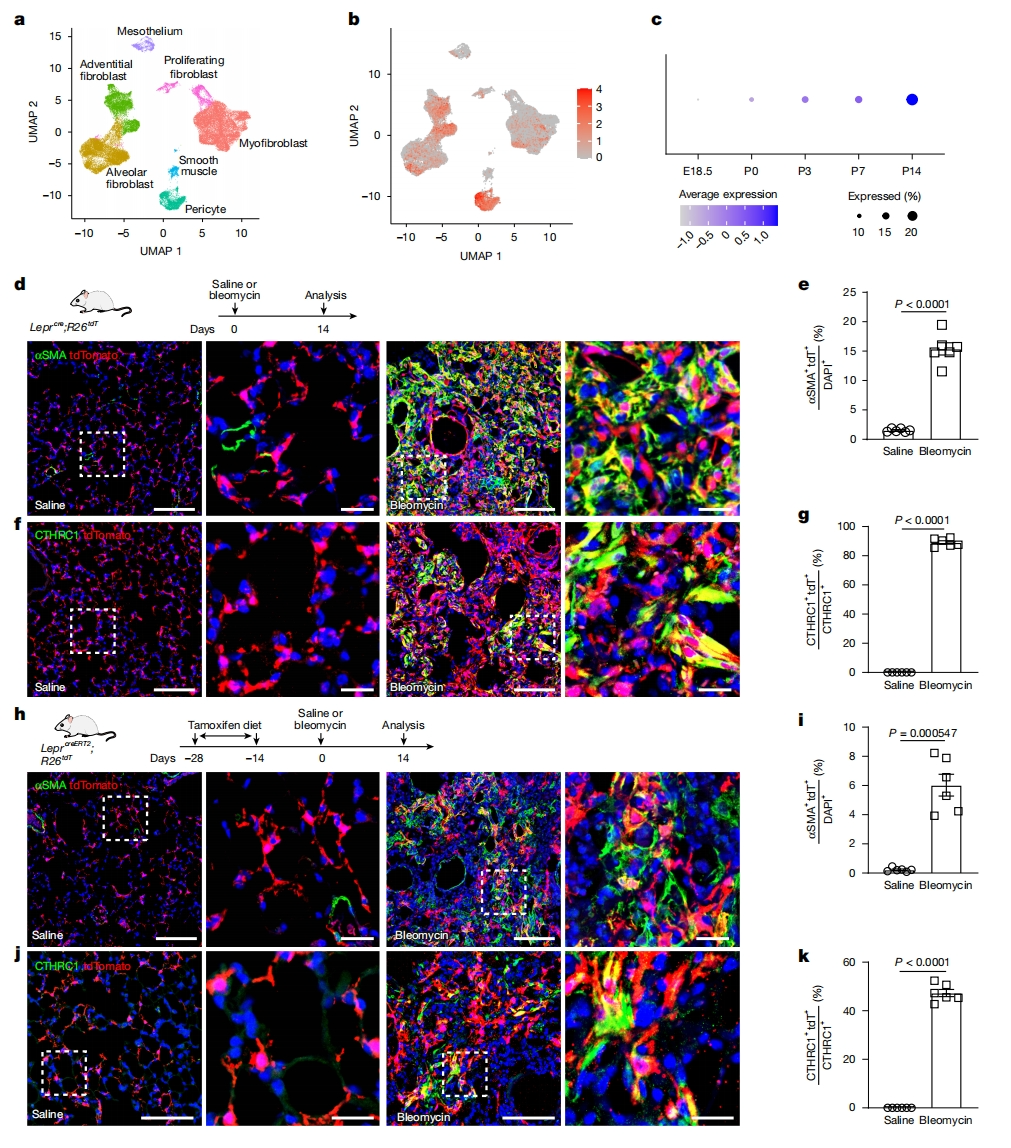
图一 在肺纤维化过程中,表达Lepr的肺间质细胞会产生病理成纤维细胞[7]
接下来,研究者试图定义源自LEPR+ 细胞的成纤维细胞亚群。首先,用博来霉素或生理盐水处理Leprcre;R26tdT小鼠,从肺中分选tdT+ 细胞,进行单细胞RNA测序,可在所有细胞中检测到tdTomato转录本。尽管大多数Leprcre标记的细胞是间质细胞,但也识别出少量上皮细胞、内皮细胞和免疫细胞。为了更好地表征成年肺中的LEPR+ 肺间质细胞及其衍生物,使用他莫昔芬饲料喂养LeprcreERT2;R26tdT小鼠,然后用博来霉素处理(图二a)。如预期,博来霉素处理导致肺部发生纤维化,表现为纤维化基因Acta2、Col1a1、Col3a1、Tnc和Fn1的转录水平显著增加。重新聚类Leprcre和LeprcreERT2标记的成纤维细胞群体,揭示了四个亚群:肺泡成纤维细胞、外膜成纤维细胞、病理成纤维细胞和增殖成纤维细胞(图二b-e)。肺泡成纤维细胞通过Scube2、Npnt和Inmt的表达进行鉴定(图二c,f和g)。在稳态下,Leprcre和LeprcreERT2标记的成纤维细胞主要为肺泡成纤维细胞和外膜成纤维细胞,但二者在博来霉素处理后数量均减少,伴随着病理成纤维细胞和增殖成纤维细胞的显著增加(图二e)。这些变化与细胞周期调节因子表达增加相关(图二c和e)。最近,病理成纤维细胞被定义为表达纤维化特征基因,包括Cthrc1和Postn[11]。值得注意的是,由博来霉素诱导的Leprcre标记和LeprcreERT2标记的成纤维细胞群体也具有这些基因特征(图二c和h)。免疫染色证实纤维化病灶中的Leprcre和LeprcreERT2标记细胞表达了CTHRC1(图一f和j)。轨迹分析结果表明,Leprcre和LeprcreERT2标记的肺泡成纤维细胞转变为病理成纤维细胞(图二i和j)。差异基因表达分析证实Scube2、Inmt和Npnt在LeprcreERT2标记的肺泡成纤维细胞中富集,相比之下,包括Col1a1和Tnc以及Cthrc1和Postn在内的纤维化相关基因在病理成纤维细胞中高度表达(图二k)。通路分析结果表明,细胞外基质(ECM)与受体相互作用、ECM组织和胶原生物合成等ECM相关通路在病理成纤维细胞中被激活(图二l)。与此一致,Tgfb1转录本和TGFβ信号通路特征在LeprcreERT2标记的病理成纤维细胞中富集(图二m)。以上数据表明,在博来霉素处理后纤维化程序被激活,LEPR+ 成纤维细胞是病理成纤维细胞的关键贡献者。
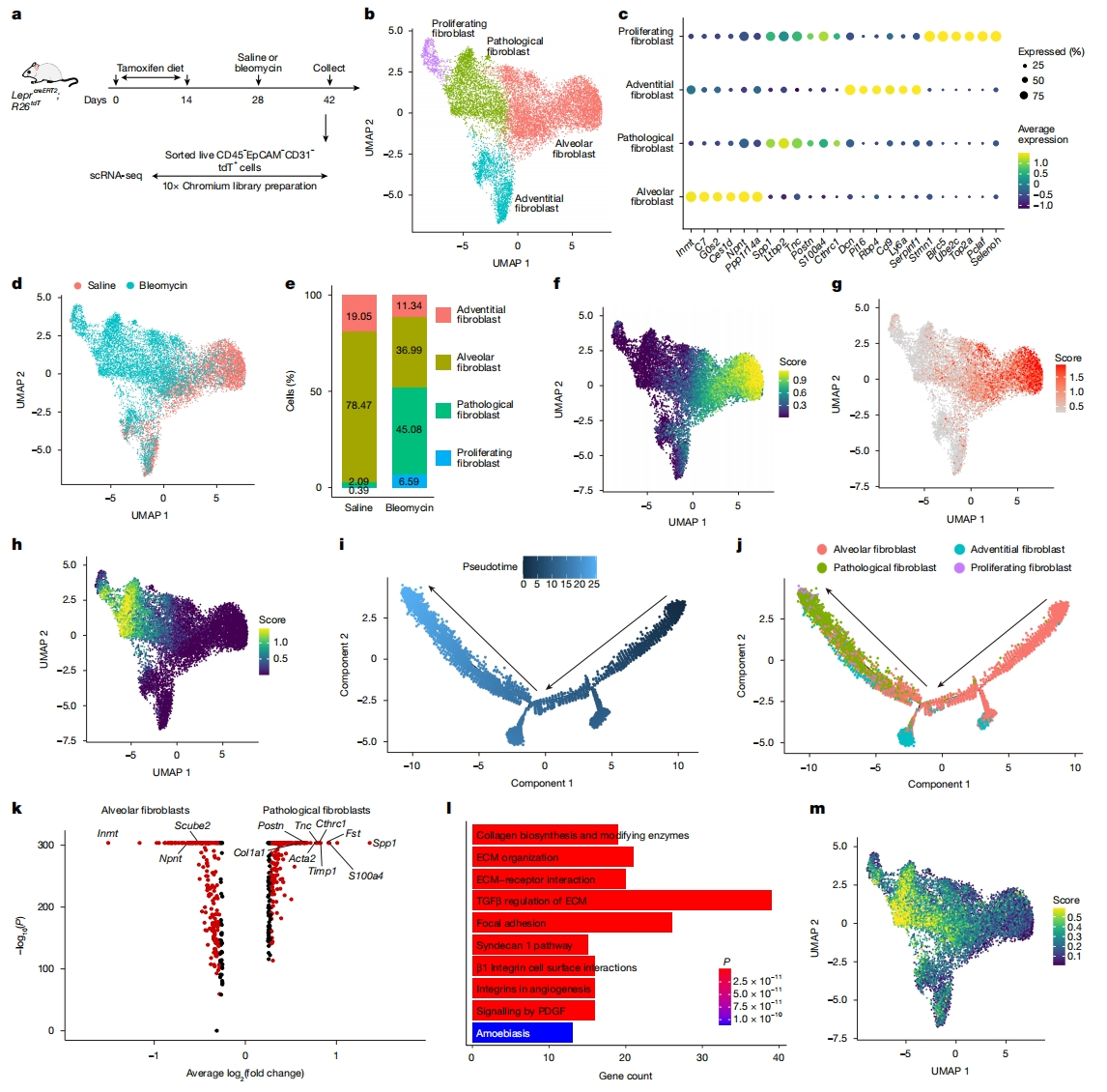
图二 单细胞RNA测序揭示LeprcreERT2可标记博来霉素诱导的病理成纤维细胞[7]
scRNA-seq分析结果表明,病理成纤维细胞以表达Postn和Cthrc1为特征,而这些基因在正常肺成纤维细胞中很少表达(图三a-c)。使用敲入Postn-MerCreMer(PostncreER)小鼠品系[12]进行细胞命运图谱分析,在用生理盐水处理的成年小鼠肺中,tdT+标记的间质细胞很少(图三d)。相比之下,在博来霉素处理后的纤维化区域,表达成纤维细胞标志物αSMA、病理成纤维细胞标志物CTHRC1和细胞外基质成分胶原I的tdT+细胞数量众多(图三d-g)。鉴于在纤维化过程中存在大量POSTN+ 病理成纤维细胞,研究者推测消除这些细胞将减轻纤维化。使用博来霉素处理PostncreER;R26DTA小鼠后,注射他莫昔芬消除POSTN+细胞(图三h),量化纤维化区域和羟脯氨酸含量,结果显示肺纤维化的显著减轻(图三h-k),且对肺血管没有明显影响。以上数据表明,在LEPR+ 肺泡成纤维细胞转变为病理成纤维细胞的过程中,Postn被激活,并且消除POSTN+ 细胞可以减轻肺纤维化。
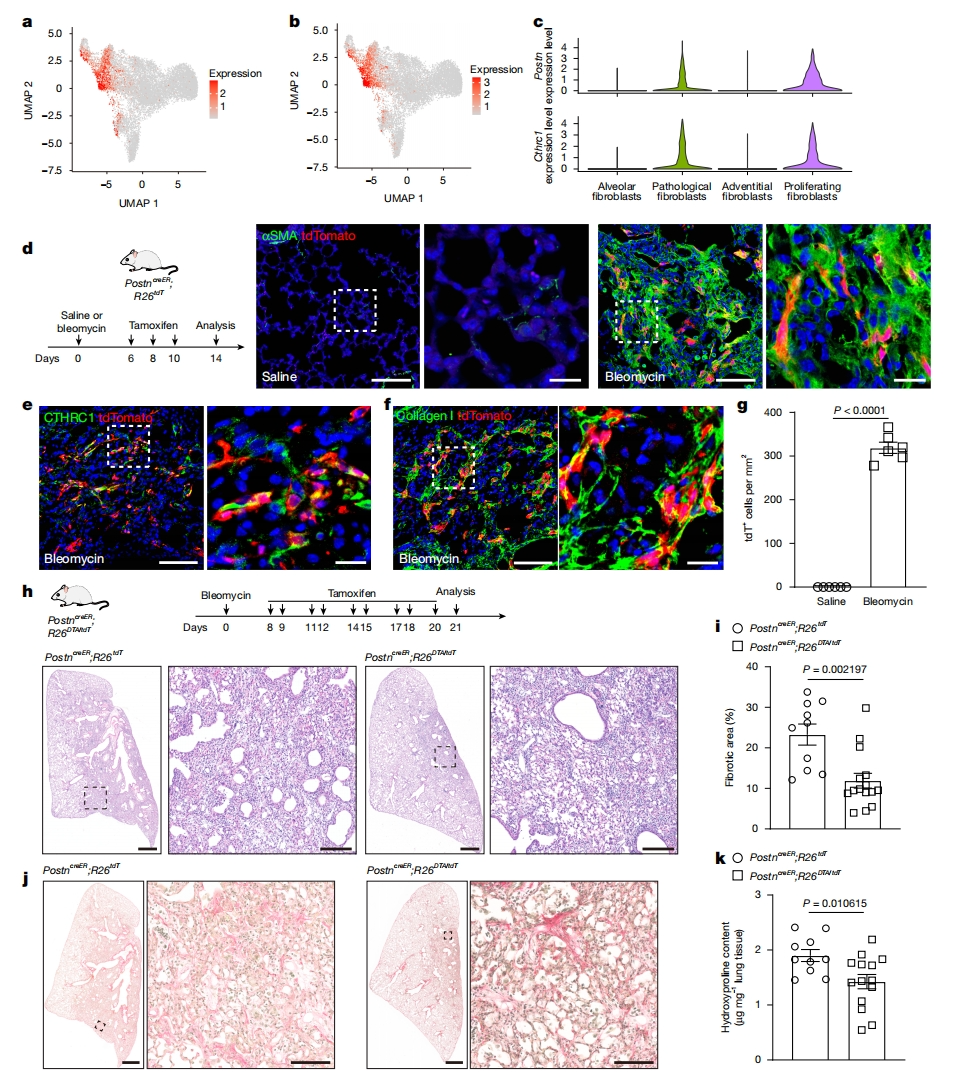
图三 消除POSTN+ 病理成纤维细胞可减轻肺纤维化[7]
Enrichr程序在富集分析和识别对组织再生及疾病起关键作用的转录因子方面发挥了重要作用,研究者使用该程序预测调控肺泡成纤维细胞向病理成纤维细胞转变的转录因子。在多个被识别的转录因子中,RUNX2被预测为最有可能参与调控纤维化相关基因的因子(图四a)。值得注意的是,scRNA-seq分析显示在Leprcre和LeprcreERT2标记细胞中,Runx2转录本显著增加,并在病理成纤维细胞群体中高度富集(图四b)。ChromVAR分析显示,RUNX2结合基序优先富集在病理成纤维细胞中(图四c)。一致地,Runx2位点的染色质可及性在病理成纤维细胞中高度富集(图四d)。这些结果通过Leprcre;R26tdT小鼠在博来霉素处理后肺部RUNX2+tdT+ 细胞的广泛存在进一步得到证实(图四e和f)。接下来,研究者测试RUNX2是否在肺纤维化过程中促进病理成纤维细胞的生成。用博来霉素处理LeprcreERT2;Runx2f/f小鼠,在小鼠肺部敲除Runx2后,同样减少了纤维化区域和羟脯氨酸含量(图四g-j),肺组织中αSMA+ 肌成纤维细胞和CTHRC1+ 病理成纤维细胞也都减少了(图四k和l)。鉴于SCUBE2+ 肺泡成纤维细胞是LEPR+细胞衍生物的主要组成部分,进一步探究通过Scube2creERT2敲除Runx2能否减轻博来霉素诱导的纤维化(图四m)。一致地,Scube2creERT2敲除Runx2后,纤维化区域和羟脯氨酸含量均显著减少(图四m-p),αSMA+ 肌成纤维细胞和CTHRC1+ 病理成纤维细胞也显著减少(图四q和r)。以上数据表明,在肺纤维化过程中,RUNX2在肺泡成纤维细胞转变为病理成纤维细胞过程中起重要作用。
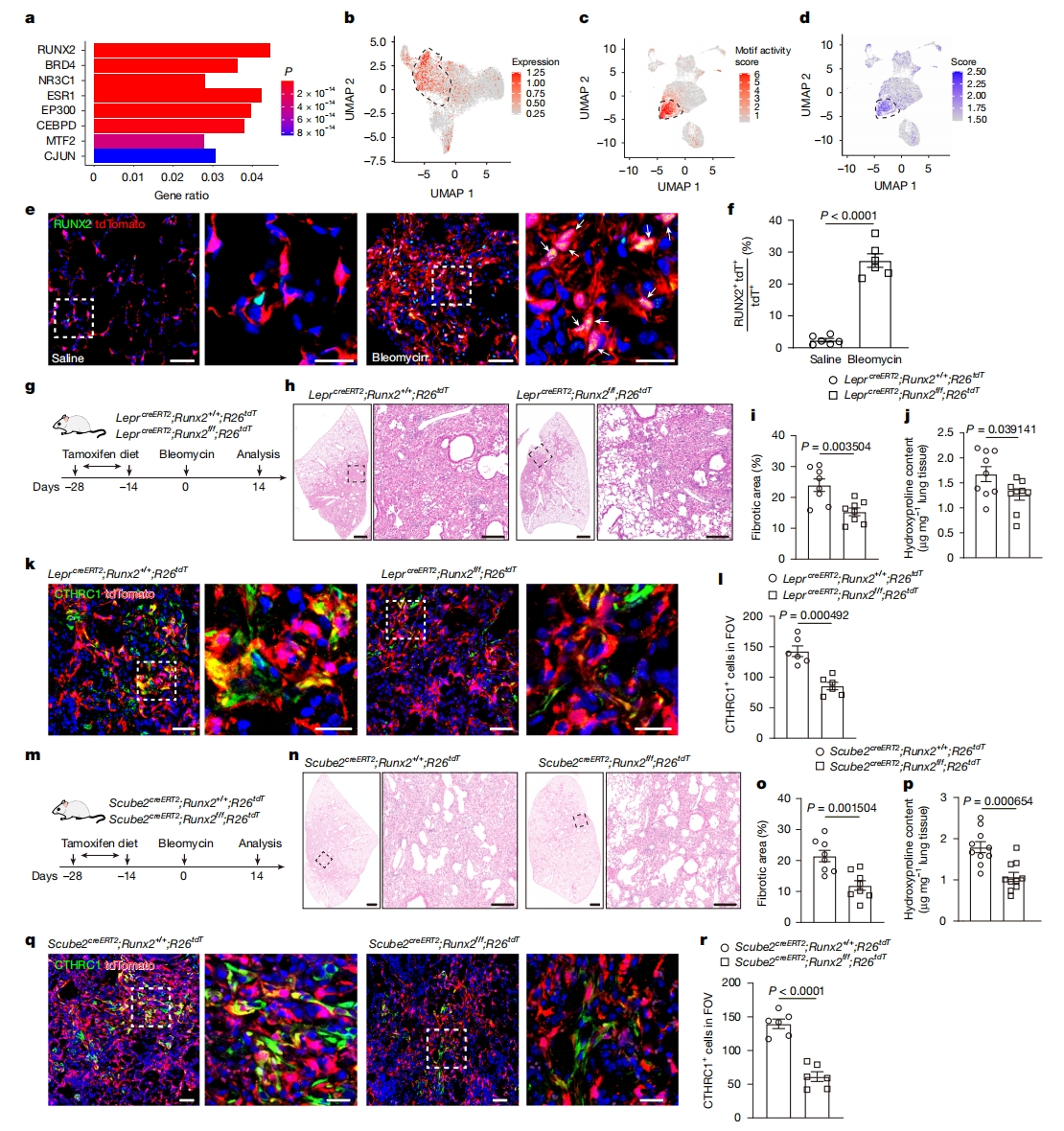
图四 敲除Runx2可阻碍病理成纤维细胞生成,减轻肺纤维化[7]
最后,研究者探究RUNX2是否也在IPF患者的肺中表达增加。重新分析已发表得IPF患者scRNA-seq数据,识别出了四种成纤维细胞群体:肺泡成纤维细胞、外膜成纤维细胞、病理成纤维细胞和增殖成纤维细胞(图五a)。RUNX2主要在POSTN+CTHRC1+ 病理成纤维细胞表达,这些成纤维细胞也高表达ACTA2和COL1A1以及其他ECM蛋白(图五b-d)。对scRNA-seq数据的进一步分析证实IPF病理成纤维细胞中RUNX2转录本的表达增加(图五e和f),这与两个不同研究组发表的RNA-seq数据一致(图五g)。在IPF肺组织中观察到大量RUNX2+αSMA+ 成纤维细胞,而正常肺组织中此类细胞极少(图五h)。一致地,在TGFβ1处理后,原代人类正常肺成纤维细胞中的RUNX2表达水平显著增加(图五i),并且敲降RUNX2可抑制TGFβ1诱导的病理成纤维细胞转变和ECM生成(图五j)。从IPF肺样本中分离出成纤维细胞,敲降RUNX2后,显示纤维化基因ACTA2、FN1和COL1A1的转录水平显著降低(图五k),表明RUNX2在人类肺纤维化中也具有重要功能。
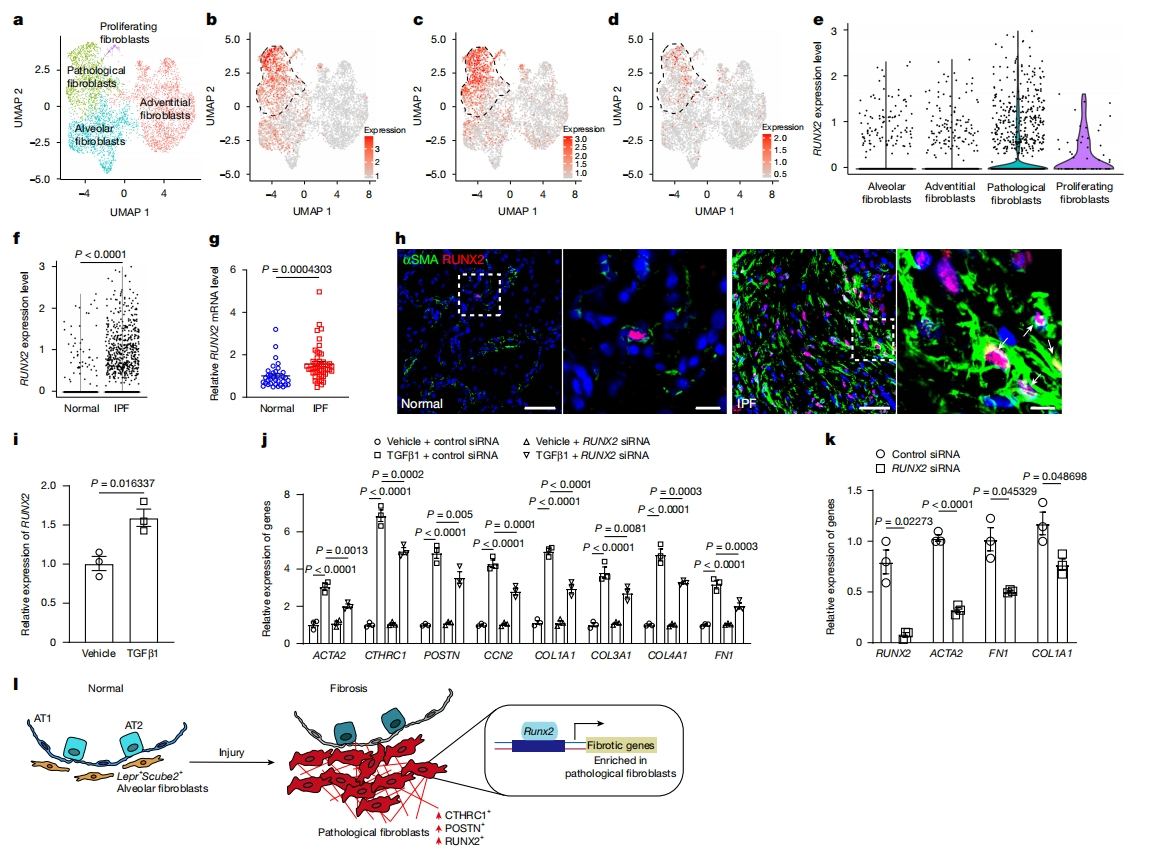
图五 RUNX2在人类IPF成纤维细胞中调节ECM的产生[7]
综上所述,该研究发现Lepr是一个标志基因,可标记成年肺中持续存在的大多数SCUBE2+ 肺泡成纤维细胞。细胞命运图谱证实LEPR+ SCUBE2+ 肺泡成纤维细胞是纤维化过程中转变成病理成纤维细胞的主要贡献者。进一步分析表明,RUNX2是肺纤维化的关键驱动因子,而缺失Runx2阻止了肺泡成纤维细胞向病理成纤维细胞的转变(图五l)。该研究为治疗肺纤维化提供了一个潜在的治疗靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Noble PW, Barkauskas CE, Jiang D: Pulmonary fibrosis: patterns and perpetrators. The Journal of clinical investigation 2012, 122(8):2756-2762.
2. Mayr CH, Simon LM, Leuschner G, Ansari M, Schniering J, Geyer PE, Angelidis I, Strunz M, Singh P, Kneidinger N et al: Integrative analysis of cell state changes in lung fibrosis with peripheral protein biomarkers. EMBO molecular medicine 2021, 13(4):e12871.
3. Kramann R, Schneider RK, DiRocco DP, Machado F, Fleig S, Bondzie PA, Henderson JM, Ebert BL, Humphreys BD: Perivascular Gli1+ progenitors are key contributors to injury-induced organ fibrosis. Cell stem cell 2015, 16(1):51-66.
4. Zepp JA, Zacharias WJ, Frank DB, Cavanaugh CA, Zhou S, Morley MP, Morrisey EE: Distinct Mesenchymal Lineages and Niches Promote Epithelial Self-Renewal and Myofibrogenesis in the Lung. Cell 2017, 170(6):1134-1148.e1110.
5. Tsukui T, Sun KH, Wetter JB, Wilson-Kanamori JR, Hazelwood LA, Henderson NC, Adams TS, Schupp JC, Poli SD, Rosas IO et al: Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nature communications 2020, 11(1):1920.
6. Lee JH, Tammela T, Hofree M, Choi J, Marjanovic ND, Han S, Canner D, Wu K, Paschini M, Bhang DH et al: Anatomically and Functionally Distinct Lung Mesenchymal Populations Marked by Lgr5 and Lgr6. Cell 2017, 170(6):1149-1163.e1112.
7. Fang Y, Chung SSW, Xu L, Xue C, Liu X, Jiang D, Li R, Korogi Y, Yuan K, Saqi A et al: RUNX2 promotes fibrosis via an alveolar-to-pathological fibroblast transition. Nature 2025, 640(8057):221-230.
8. Zhou BO, Yue R, Murphy MM, Peyer JG, Morrison SJ: Leptin-receptor-expressing mesenchymal stromal cells represent the main source of bone formed by adult bone marrow. Cell stem cell 2014, 15(2):154-168.
9. Decker M, Martinez-Morentin L, Wang G, Lee Y, Liu Q, Leslie J, Ding L: Leptin-receptor-expressing bone marrow stromal cells are myofibroblasts in primary myelofibrosis. Nature cell biology 2017, 19(6):677-688.
10. Negretti NM, Plosa EJ, Benjamin JT, Schuler BA, Habermann AC, Jetter CS, Gulleman P, Bunn C, Hackett AN, Ransom M et al: A single-cell atlas of mouse lung development. Development 2021, 148(24).
11. Melms JC, Biermann J, Huang H, Wang Y, Nair A, Tagore S, Katsyv I, Rendeiro AF, Amin AD, Schapiro D et al: A molecular single-cell lung atlas of lethal COVID-19. Nature 2021, 595(7865):114-119.
12. Kanisicak O, Khalil H, Ivey MJ, Karch J, Maliken BD, Correll RN, Brody MJ, SC JL, Aronow BJ, Tallquist MD et al: Genetic lineage tracing defines myofibroblast origin and function in the injured heart. Nature communications 2016, 7:12260.



