技术分享:Parkin-PINK1和OMA1双重调控线粒体融合
细胞可对多种致病性和外源性应激做出反应来保护线粒体。线粒体应激反应受损与神经退行性疾病、心力衰竭和代谢综合征有关。然而,这些应激反应途径在生理条件下的作用仍然难以捉摸。当线粒体功能障碍时,可诱导两种应激感应系统Parkin-PINK1和OMA1。受损线粒体去极化,膜电位降低,使得PINK1聚集在线粒体膜表面,进而磷酸化激活Parkin,后者是一种泛素E3连接酶[1, 2]。Parkin泛素化的线粒体蛋白质涉及线粒体融合、降解、线粒体囊泡和生物发生[3]。Parkin和PINK1缺陷会导致散发性和家族性的帕金森病[4]。OMA1是线粒体内膜中的一种金属蛋白酶,与Parkin-PINK1类似同样在线粒体膜电位降低后被激活[5]。活化的OMA1切割线粒体融合GTP酶视神经萎缩蛋白1(OPA1),从而抑制线粒体融合。活化的OMA1还切割线粒体蛋白DAP3结合细胞死亡增强子1(DELE1),将其释放到细胞质中,进而激活综合应激反应(ISR)[6, 7]。然而,在正常生理条件下,Parkin、PINK1或OMA完全敲除(KO)小鼠的线粒体功能和动物生理学都没有明显缺陷[8]。提示Parkin-PINK1和OMA1可能主要在响应外源性应激时发挥作用,而在无应激条件下不是必需的。或者在正常的生理条件下,这两种应激感应系统仍具有关键功能,只是单一防御系统的缺失可被另一个补偿。
2024年2月,Nature期刊报道了一项研究,发现两种线粒体应激反应系统——泛素E3连接酶Parkin和金属蛋白酶OMA1协同发挥作用,通过抑制外膜GTP酶MFN1和内膜GTP酶OPA1介导的线粒体融合来保护线粒体结构和基因组。尽管Parkin或OMA1的单一缺失不会影响线粒体的完整性,但它们的共同缺失会导致小鼠体型变小、运动活动减弱、过早死亡、线粒体异常和先天免疫反应。揭示Parkin和OMA1维持着一种双重调节机制,即使在没有外源性应激的情况下,也协同调控着两层膜上的线粒体融合[9]。
鉴于Parkin、PINK1或OMA1完全敲除(KO)小鼠的线粒体功能和动物生理学没有明显的缺陷(图一a-d,e(i,ii)),研究者构建Parkin和OMA1双敲除小鼠(Parkin-/-Oma1-/-)。发现小鼠体型非常小,出现过早死亡,平均存活期约为70天(图一a-c,e(iii)),在开放场测试中表现出显著降低的运动活动(图一d)。Parkin-/-Oma1-/-小鼠还出现了癫痫发作,而在野生型(WT)和单KO小鼠中没有。为了确定PINK1的缺失是否与Parkin相似,研究者构建了Pink1-/-Oma1-/-小鼠,其表型复制了Parkin-/-Oma1-/-小鼠(图一a-d,e(iii)),表明Parkin-PINK1和OMA1协同保护小鼠的发育、生理和存活。
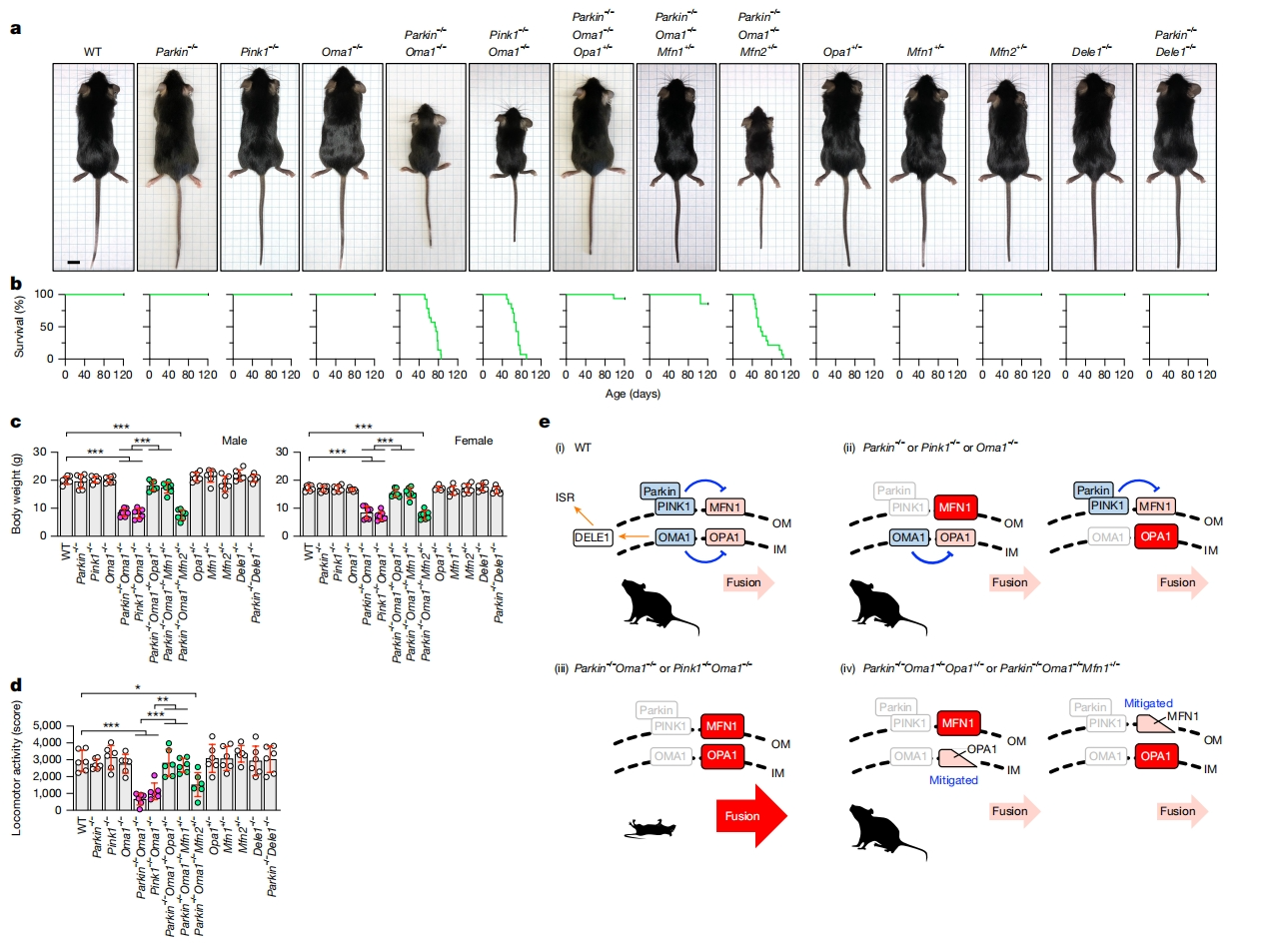
图一 Parkin-PINK1和OMA1通过抑制线粒体融合来确保小鼠健康[9]
金属蛋白酶OMA1切割灭活线粒体融合中的OPA1 [10]。为了确定OPA1的重要性,在Parkin-/-Oma1-/-小鼠中引入OPA1杂合KO(Parkin-/-Oma1-/-Opa1+/-),OPA1纯合KO导致胚胎致死。杂合OPA1的缺失在体型、存活率和运动活动方面显著挽救了Parkin-/-Oma1-/-小鼠表型(图一a-d,e(iv))。OPA1介导了线粒体融合和内膜嵴形成。为了区分OPA1的这两种功能,研究者在Parkin-/-Oma1-/-小鼠中引入了MFN1杂合KO,MFN1能调控线粒体融合,但不调控嵴结构形成。发现Parkin-/-Oma1-/-Mfn1+/-小鼠表型与Parkin-/-Oma1-/-Opa1+/-小鼠相似(图一a-d,e(iv)),表明在没有外部线粒体应激的情况下,Parkin和OMA1调节OPA1-MFN1融合机制。与MFN1相反,MFN2的杂合缺失没能挽救Parkin-/-Oma1-/-小鼠表型(图一a-d)。MFN2与MFN1同源,在内质网-线粒体接触位点形成和线粒体自噬中发挥作用[11]。这些数据与之前的研究一致,表明OPA1-MFN1比OPA1-MFN2更有效地介导线粒体融合[12]。测试另一种OMA1底物DELE1在综合应激反应(ISR)中的作用,使用CRISPR构建系统性Dele1-/-小鼠,并将其与Parkin-/-小鼠杂交。如果Parkin-/-Oma1-/-小鼠的表型是由Parkin和OMA1介导的ISR联合缺失引起的,那么Parkin−/−Dele1-/-小鼠将复制Parkin-/-Oma1-/-表型。然而,Dele1-/-和Parkin-/-Dele1-/-小鼠的体型、存活率和运动活动都正常(图一a-d)。以上数据表明,Parkin-/-Oma1-/-小鼠的缺陷与线粒体融合的增强有关,而不是与ISR的抑制有关。
为确定Parkin和OMA1的缺失是否影响线粒体形态,研究者使用激光共聚焦免疫荧光显微镜,结合线粒体蛋白丙酮酸脱氢酶(PDH)抗体染色,系统性定量评估了十个脑亚区和八个主要器官(心脏、肾脏、棕色脂肪组织、骨骼肌、肺、肝脏、肠道和脾脏)的线粒体形态(图二a-c)。线粒体形态分析表明,Parkin或OMA1的单一KO不会影响线粒体形态(图二a-c)。相比之下,Parkin-/-Oma1-/-小鼠在多个器官中表现出线粒体增大(巨型线粒体),在大脑和心脏中尤为显著(图二a-c)。在大脑中,脑桥/延髓显示出最高的巨型线粒体形成频率(图二b、c)。透射电子显微镜显示,在脑桥/延髓和心脏中,增大的线粒体含有较少的内膜嵴(图二d)。而Parkin-/-Oma1-/-Opa1+/-或Parkin-/-Oma1-/-Mfn1+/-小鼠强有力地挽救了Parkin-/-Oma1-/-小鼠的线粒体形态增大和嵴结构紊乱表型(图二a-d)。因此,Parkin-/-Oma1-/-小鼠的线粒体动力学平衡倾向于发生融合而非分裂。以上数据表明,Parkin和OMA1在生理条件下可以防止线粒体的过度融合。

图二 Parkin和OMA1可防止线粒体过度融合[9]
接下来,研究者探究Parkin和OMA1缺失的额外影响。对WT、Parkin-/-Oma1-/-、Parkin-/-Oma1-/-Opa1+/-和Parkin-/-Oma1-/-Mfn1+/-小鼠的脑桥/延髓进行RNA测序(RNA-seq)。基因集富集分析(GSEA)显示,与WT相比,Parkin-/-Oma1-/-脑桥/延髓中参与免疫反应的基因上调(图三a和b)。在Parkin-/-Oma1-/-Opa1+/-和Parkin-/-Oma1-/-Mfn1+/-小鼠脑桥/延髓中,这些免疫反应基因的表达模式恢复到接近WT水平(图三b),表明Parkin-/-Oma1-/-脑桥/延髓中发现的基因表达升高是由于过度融合,而不是Parkin缺失引起的自噬缺陷。
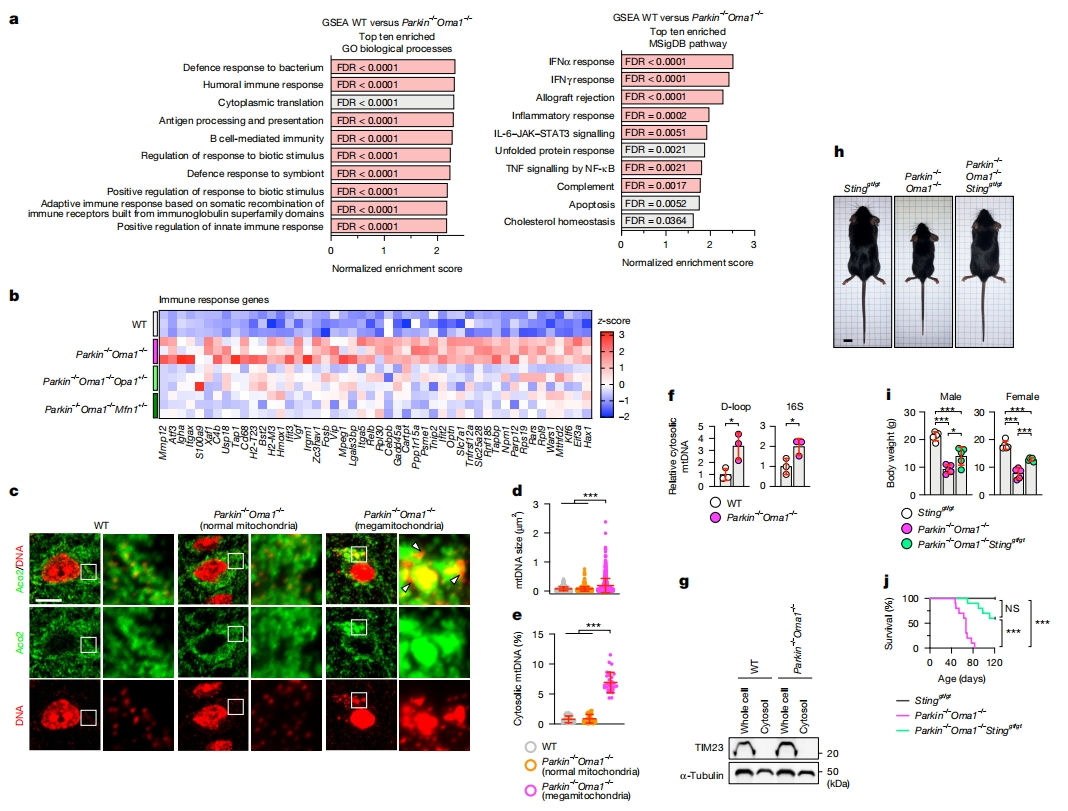
图三 Parkin和OMA1保护线粒体基因组[9]
线粒体DNA释放到细胞质中,可通过STING诱导先天免疫反应[13]。使用激光共聚焦免疫荧光显微镜和图像定量技术检测WT和Parkin-/-Oma1-/-小鼠脑桥/延髓的线粒体DNA(mtDNA),发现在WT线粒体外的区域观察到DNA信号低于1%(图三c和e)。同样地,Parkin-/-Oma1-/-脑桥/延髓中线粒体形态正常的细胞,也显示出正常的mtDNA大小和线粒体外DNA水平(图三c-e;正常线粒体)。相比之下,Parkin-/-Oma1-/-脑桥/延髓中线粒体增大的细胞,表现出mtDNA大小和线粒体外DNA水平显著增加,上升到6-7%(图三c-e;巨型线粒体),表明Parkin-/-Oma1-/-脑桥/延髓的mtDNA是从增大线粒体中释放的,而不是从正常线粒体释放的。核质分离结合qPCR证实mtDNA释放到Parkin-/-Oma1-/-脑桥/延髓的细胞质中(图三f),免疫印迹证实细胞质部分的均一性(图三g)。为了解STING在Parkin-/-Oma1-/-小鼠表型中的作用,使用STING缺陷的Stinggt/gt小鼠[14]构建三重纯合突变小鼠,发现STING缺陷显著改善了Parkin-/-Oma1-/-小鼠的体型和死亡率(图三h-j),强调了STING在这些表型中的关键作用。
线粒体分裂GTP酶DRP1缺失引起的线粒体增大,导致MFN1减少和OPA1切割增加,从而抑制肝细胞和其他细胞中的过度线粒体融合。由于在Parkin-/-Oma1-/-小鼠的肝脏中没有形成巨型线粒体(图二),研究者测试Parkin和OMA1是否在线粒体分裂应激下保护肝脏,构建DRP1(Alb-Cre::Drp1flox/flox),Parkin;OMA1(Alb-Cre::Parkinflox/floxOma1flox/flox),以及DRP1;Parkin;OMA1(Alb-Cre::Drp1flox/floxParkinflok/floxOma1flox/flox)的肝细胞特异性敲除小鼠。所有这些肝脏特异性KO小鼠的体重都正常(图四a)。与其他三种小鼠相比,三重KO小鼠表现出轻微的肝脏增重(图四b)。如激光共聚焦免疫荧光显微镜(图四c-e)和透射电子显微镜(图四f-k)所示,Parkin;OMA1肝脏特异性KO对肝脏线粒体形态没有严重影响,与Parkin;OMA1的全身性双KO一致(图二)。正如预期,DRP1肝脏特异性KO增加了巨型线粒体频率(图四d)、线粒体大小(图四e和g)、周长(图四h)和嵴紊乱(图四i),线粒体失去了管状形态,纵横比降低(图四j),圆形度增加(图四k)。值得注意的是,三重KO小鼠肝脏进一步增强了DRP1表型。免疫印迹显示,DRP1的肝脏缺失增加了OMA1介导的OPA1切割产物(S3和S5),减少了OPA1的OMA1底物形式(L2),降低了MFN1和MFN2水平(图四l和m);Parkin和OMA1的额外缺失部分逆转了这些变化(图四l和m)。以上数据表明,当线粒体分裂减少时,Parkin和OMA1可以防止线粒体进一步增大。
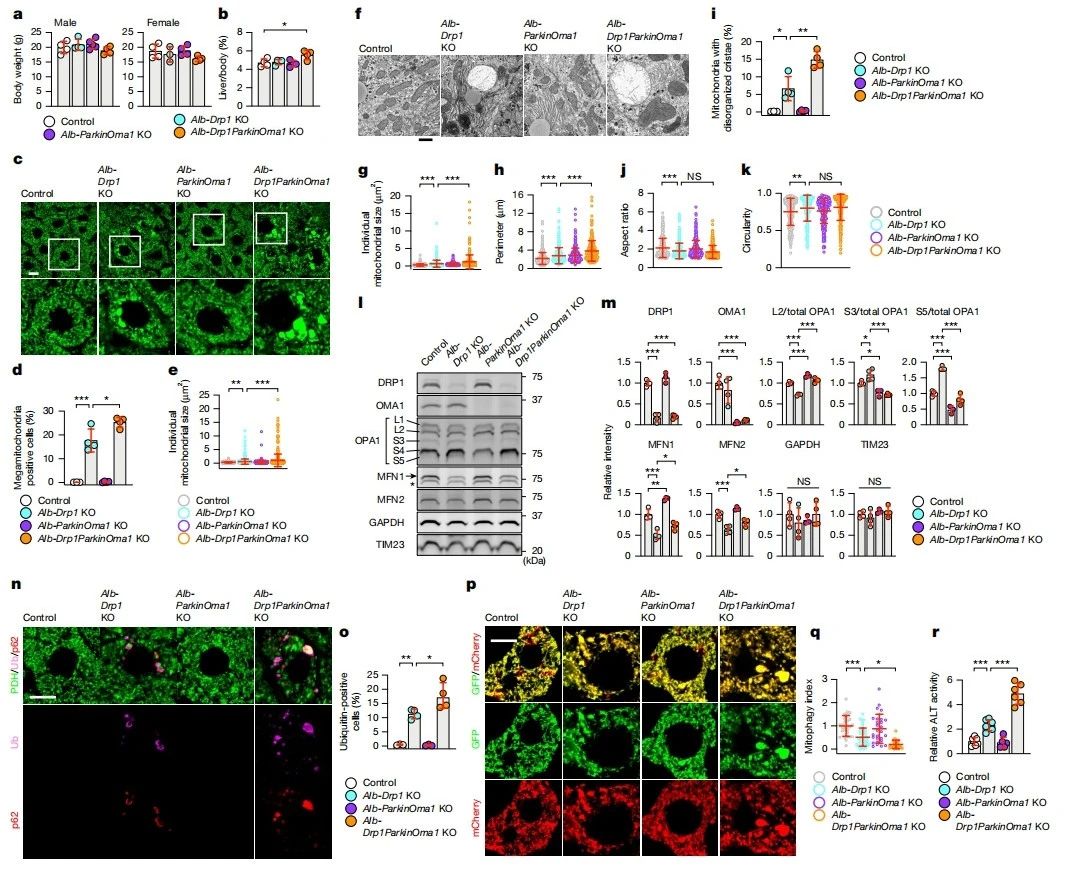
图四 Parkin和OMA1抑制应激诱导的肝脏线粒体增大[9]
DRP1 KO肝脏中的线粒体增大会降低线粒体自噬作用,导致泛素和p62在线粒体上积累,而p62是泛素连接酶复合物的接头蛋白和亚基。这些泛素化、增大的线粒体是停滞的线粒体自噬中间体,它们的泛素化需要p62,且不需要Parkin或PINK1。与这些研究相一致,研究者发现DRP1 KO肝脏中线粒体增大,泛素和p62积累(图四n和o)。Parkin和OMA1的额外损失进一步增加了三重KO肝脏中这种停滞的自噬中间体,而Parkin和OMA1双KO肝脏没有显示出这种中间体(图四n和o)。为了直接检测线粒体自噬,将表达线粒体自噬生物传感器的质粒,基质靶向的Su9-mCherry-GFP,尾静脉注射递送到四组小鼠的肝脏中(图四p和q)。正常情况下,可在线粒体内观察到mCherry和GFP双信号;发生线粒体自噬后被转运到溶酶体,因溶酶体的酸性pH值,只有mCherry信号可被检测到。尾静脉注射后四天,量化肝切片中mCherry和GFP信号之间的比率,记录线粒体自噬通量(线粒体自噬指数)。DRP1 KO肝脏的线粒体自噬指数显著降低,三重KO肝脏的这一缺陷显著加剧(图四p和q)。而Parkin和OMA1双KO肝脏的线粒体自噬没有减少,与WT组接近(图四p和q),表明尽管Parkin和OMA1不参与肝脏线粒体的泛素化,但它们在调节线粒体大小方面起着重要作用,进而影响线粒体自噬。DRP1 KO肝脏导致血清丙氨酸氨基转移酶(ALT)增加,Parkin和OMA1的额外缺失进一步提高了三重KO小鼠的血清ALT水平(图四r)。以上数据表明,在线粒体分裂缺陷的压力下,Parkin和OMA1共同确保线粒体完整性和肝脏健康。
综上所述,该研究通过构建18种KO/突变小鼠模型,发现Parkin-PINK1和OMA1介导了一种线粒体的双重调控机制,分别在外膜和内膜融合阶段调节线粒体融合。Parkin-PINK1或OMA1的存在可以维持线粒体形态,防止其过度融合。Parkin和OMA1的双重敲除消除了这两种抑制机制,导致小鼠出现体型小、运动活性低、过早死亡、线粒体异常和先天免疫反应。该研究还揭示了这种双重调节机制的组织特异性影响,其中对脑的影响最大,可为人类健康和帕金森等疾病提供重要见解。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Koyano F, Okatsu K, Kosako H, Tamura Y, Go E, Kimura M, Kimura Y, Tsuchiya H, Yoshihara H, Hirokawa T et al: Ubiquitin is phosphorylated by PINK1 to activate parkin. Nature 2014, 510(7503):162-166.
2. Sarraf SA, Raman M, Guarani-Pereira V, Sowa ME, Huttlin EL, Gygi SP, Harper JW: Landscape of the PARKIN-dependent ubiquitylome in response to mitochondrial depolarization. Nature 2013, 496(7445):372-376.
3. Giacomello M, Pyakurel A, Glytsou C, Scorrano L: The cell biology of mitochondrial membrane dynamics. Nature reviews Molecular cell biology 2020, 21(4):204-224.
4. Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG et al: Hereditary early-onset Parkinson's disease caused by mutations in PINK1. Science 2004, 304(5674):1158-1160.
5. Acin-Perez R, Lechuga-Vieco AV, Del Mar Muñoz M, Nieto-Arellano R, Torroja C, Sánchez-Cabo F, Jiménez C, González-Guerra A, Carrascoso I, Benincá C et al: Ablation of the stress protease OMA1 protects against heart failure in mice. Sci Transl Med 2018, 10(434):eaan4935.
6. Guo X, Aviles G, Liu Y, Tian R, Unger BA, Lin YT, Wiita AP, Xu K, Correia MA, Kampmann M: Mitochondrial stress is relayed to the cytosol by an OMA1-DELE1-HRI pathway. Nature 2020, 579(7799):427-432.
7. Ahola S, Rivera Mejías P, Hermans S, Chandragiri S, Giavalisco P, Nolte H, Langer T: OMA1-mediated integrated stress response protects against ferroptosis in mitochondrial cardiomyopathy. Cell metabolism 2022, 34(11):1875-1891.e1877.
8. Quirós PM, Ramsay AJ, Sala D, Fernández-Vizarra E, Rodríguez F, Peinado JR, Fernández-García MS, Vega JA, Enríquez JA, Zorzano A et al: Loss of mitochondrial protease OMA1 alters processing of the GTPase OPA1 and causes obesity and defective thermogenesis in mice. The EMBO journal 2012, 31(9):2117-2133.
9. Yamada T, Ikeda A, Murata D, Wang H, Zhang C, Khare P, Adachi Y, Ito F, Quirós PM, Blackshaw S et al: Dual regulation of mitochondrial fusion by Parkin-PINK1 and OMA1. Nature 2025, 639(8055):776-783.
10. Murata D, Roy S, Lutsenko S, Iijima M, Sesaki H: Slc25a3-dependent copper transport controls flickering-induced Opa1 processing for mitochondrial safeguard. Developmental cell 2024, 59(19):2578-2592.e2577.
11. Schrepfer E, Scorrano L: Mitofusins, from Mitochondria to Metabolism. Molecular cell 2016, 61(5):683-694.
12. Cipolat S, Martins de Brito O, Dal Zilio B, Scorrano L: OPA1 requires mitofusin 1 to promote mitochondrial fusion. Proceedings of the National Academy of Sciences of the United States of America 2004, 101(45):15927-15932.
13. West AP, Khoury-Hanold W, Staron M, Tal MC, Pineda CM, Lang SM, Bestwick M, Duguay BA, Raimundo N, MacDuff DA et al: Mitochondrial DNA stress primes the antiviral innate immune response. Nature 2015, 520(7548):553-557.
14. Sauer JD, Sotelo-Troha K, von Moltke J, Monroe KM, Rae CS, Brubaker SW, Hyodo M, Hayakawa Y, Woodward JJ, Portnoy DA et al: The N-ethyl-N-nitrosourea-induced Goldenticket mouse mutant reveals an essential function of Sting in the in vivo interferon response to Listeria monocytogenes and cyclic dinucleotides. Infection and immunity 2011, 79(2):688-694.



