技术分享:癌症相关血栓形成起源于肺间质巨噬细胞分泌的细胞外囊泡
癌症是一种全身性疾病,其并发症不仅限于原发肿瘤的部位。其中,血栓形成是某些癌症和晚期患者的第二大死因。癌症相关血栓的形成,部分是通过肿瘤细胞与血小板之间的协同作用实现的。血小板在响应肿瘤信号后聚集,进而支持肿瘤的转移扩散和生长[1]。这种肿瘤-血小板的协同作用创造了一个自我延续的环境,加速了疾病进展和死亡。由此产生的血栓并发症,尤其是弥散性血管内凝血(DIC)和血栓栓塞(TE),是癌症相关死亡的主要原因[2]。DIC是一种系统性综合征,与多组织微血栓沉积相关,导致灌注不良、器官衰竭和由凝血因子和血小板耗竭所引起的出血,患者生存率较差。癌症相关血栓栓塞的临床表征明显,胰腺导管腺癌(PDAC,12-36%患者)、肺和脑恶性肿瘤(>10%)具有血栓栓塞的最高风险,乳腺癌和黑色素瘤的风险较低(3-5%)。但不论癌症类型,所有的晚期患者都有更高的血栓形成风险,这突出了癌症转移与血栓形成之间的联系。发生血栓事件表现为较短生存期和较高致死率。此外,50%的血栓栓塞幸存者会罹患血栓形成后综合征。尽管预防血栓能使有症状的血栓患者受益[3],但由于缺乏风险预测的生物标志物以及手术患者常出现抗凝剂使用相关的出血并发症,临床上仍然难以诊断亚临床DIC、预防血栓形成和癌症转移。
已知多种机制与血栓形成风险的增加有关,如止血因子组织因子(TF)和平足蛋白的基因突变[4]。虽然肿瘤细胞上这些因子的高表达水平可能导致肿瘤内血栓形成,但它们出现在循环细胞外囊泡(EV)上可能解释了系统性血栓形成模式。核外颗粒体和小细胞外囊泡(sEV)介导着细胞-细胞通讯,在系统性疾病中具有治疗和预测价值[5]。有研究表明TF可存在于癌症患者血液外泌体中,EV-TF与癌症血栓风险在一部分研究中具有相关性,说明还存在尚未被识别的、不依赖TF途径驱动的EV诱导血栓形成[6]。因此,解析肿瘤微环境中非癌细胞来源EV的促凝血特性,仍然是一个未被充分研究但临床重要的研究领域。
2025年2月,Cell期刊在线发表了一项研究,发现在荷瘤小鼠和癌症患者的非转移性和转移性肺组织中,肿瘤释放的趋化因子CXCL13能够激活肺间质巨噬细胞(IM),促使它们分泌含有整合素β2的小细胞外囊泡(sEV),这种sEV是血栓形成风险升高的关键因素,表明肺是癌症相关血栓形成的主要起始部位,进而将这种肺组织微环境定义为促血栓形成生态位(PTN)。具体而言,这种sEV表面激活并聚集的整合素β2是血管内血栓形成的起始因子,sEV-β2与整合素αX二聚化,并与血小板表面糖蛋白GPIb相互作用,启动血小板聚集形成血栓。选择性阻断β2不仅能预防血栓形成,还能减少肺转移。在胰腺导管腺癌(PDAC)患者中,血浆sEV中β2水平的升高与后续血栓栓塞的发生具有相关性。该研究表明肺PTN的建立是肿瘤进展的系统性结果,而血浆sEV-β2可作为一种新的潜在生物标志物,用于预测癌症患者的血栓形成风险,也是预防血栓形成和转移的潜在靶点[7]。
首先,研究者探索癌症小鼠不同器官来源的小细胞外囊泡(sEV)对凝血的影响。通过超速离心从胰腺导管腺癌(PDAC)KPC小鼠(KrasHet)或同窝对照小鼠(KrasWT)的不同组织培养物中分离sEV,将sEV通过眼眶后注射到未处理的小鼠体内(图一A)。发现只有来自PDAC小鼠肺(无论是否有肺转移)的sEV在5分钟内诱导了小鼠呼吸窘迫和死亡,以及血小板计数减少(图一B)。测试其他癌症模型包括黑色素瘤、乳腺癌和实验性PDAC模型,来自转移性肺的sEV同样诱导了系统性血栓形成,表现为血小板减少症、D-二聚体水平升高和小鼠死亡(图一C);相应地,肺组织的免疫组化显示动脉和静脉血管内均存在含有sEV的大块纤维蛋白血栓(图一D和E)。为了解sEV注射后的血栓形成动力学过程,进行肺血管的活体显微镜观察。通过眼眶后注射标记的右旋糖酐以可视化血液,并注射血小板标记抗体,随后注射来自黑色素瘤B16F10转移性肺的sEV。在注射后的20秒内,肺血管中形成了大块血小板血栓,并在10分钟内阻断了血流(图一F和G),而注射正常肺sEV的小鼠肺血管中未形成血栓。在体外,将血小板与来自PDAC小鼠(非)转移性肺的sEV共同孵育,诱导了血小板CD62P暴露和血小板聚集(图一H-J)。在体内,注射亚致死剂量的B16F10转移性肺sEV后,10分钟内诱导了持续的血小板活化,并伴随sEV-血小板相互作用(图一K-N),在sEV注射前去除血小板可防止致命性血栓形成并延长小鼠存活时间(图一O和P),表明血小板在sEV诱导的凝血中起关键作用。以上数据表明,在多种小鼠癌症模型的非转移性和转移性肺中均形成了促血栓形成生态位(PTN),并产生了支持弥散性血管内凝血(DIC)的sEV。

图一(非)转移性肺组织的sEV可诱导小鼠血栓形成[7]
接着,研究者鉴定促血栓sEV上的成分。对来自图一B和C中描述的癌症模型小鼠原发肿瘤、肝脏和肺的sEV进行无偏倚的定量液相色谱-质谱(LC-MS)分析。与正常肺sEV相比,(非)转移性肺sEV具有独特的蛋白质组学特征,富含与免疫细胞反应相关的蛋白质。其中,整合素β2是促血栓sEV中最显著富集的蛋白质(图二A和B)。Western blot和超分辨率直接随机光学重建显微镜(dSTORM)成像证实,(非)转移性肺sEV上的β2显著富集(图二C-E)。有趣的是,整合素β2在正常肺sEV表面呈分散分布,但在荷瘤小鼠的(非)转移性肺来源的促血栓sEV上则集中在离散的簇中(图二D),类似于整合素以配体结合构象存在的黏着斑[8]。研究者从不同癌症患者尸检中分离转移性结节与未受累的邻近肺组织,并从组织培养基中分离出sEV进行dSTORM成像。结果发现,邻近肺组织而非转移性结节,产生了具有高度聚集β2的sEV(图二D-F),表明PTN起源于转移灶周围的肺组织。对PDAC小鼠肺部sEV进行整合素β2的功能阻断,可防止体外血小板聚集(图二G和H)。在注射前阻断(非)转移性肺来源sEV上的β2,或在sEV注射前对小鼠进行系统性β2阻断,可减少肺纤维蛋白血栓和血小板减少症,从而防止肺栓塞和受体小鼠死亡(图二I-N)。在Itgb2基因敲除(KO)小鼠(Itgb2−/−)中进行类似实验。将同源乳腺癌4T1细胞植入野生型(Itgb2+/+)、Itgb2+/−或Itgb2−/−小鼠的乳腺脂肪垫中,这些癌细胞自发转移至肺部。与具有相似转移负荷的Itgb2+/+或Itgb2+/−小鼠相比,来自4T1荷瘤Itgb2−/−小鼠肺部的sEV不含有整合素β2,并且在注射到未处理小鼠体内时缺乏促凝血作用(图二O-Q)。肺部活体成像显示,在注射来自B16F10转移性肺的sEV前,用β2阻断抗体预处理小鼠可限制血栓大小,维持血流,防止死亡(图二R和S)。此外,在接受抗β2治疗的小鼠中,较小的血栓在sEV注射后20分钟内溶解(图二R和S)。以上数据表明,PTN来源sEV上的整合素β2是急性血栓形成所必需的。

图二(非)转移性肺sEV上的整合素β2起始小鼠血栓形成[7]
随后,研究者测试长期抗β2处理是否能降低癌症相关血栓形成风险。给早期皮下B16F10荷瘤小鼠每周两次注射同型对照或抗β2抗体,持续最多3周(图三A)。结果显示,虽然对照组和实验组的原发肿瘤生长情况相似(图三B),但与对照组小鼠相比,接受抗β2抗体处理的小鼠肺部血栓减少了50%(图三C和D)。抗β2处理使肺部MelanA+微转移结节的数量和大小减少了4倍以上(图三E-G)。进一步测试阻断整合素β2是否能预防晚期癌症中的血栓形成,将B16F10细胞静脉注射到C57BL/6J小鼠体内,并在转移形成后,每周两次给小鼠注射同型对照或抗β2抗体,持续4周(图三H)。抗β2处理减少了血小板减少症和DIC的发生(图三I-K),显著减少了50%的肺转移,表现为肺结节的数量和大小显著减少(图三L和M),显著延长小鼠的存活时间(图三N)。评估接受溶剂、肝素、同型对照或抗β2抗体的黑色素瘤小鼠的尾部出血情况(图三O)。与溶剂相比,肝素增加了出血时间和溶血血液样本中的血红蛋白浓度,而抗β2抗体并未改变这些参数(图三P和Q)。以上数据表明,阻断整合素β2可预防癌症的肺转移和血栓形成。
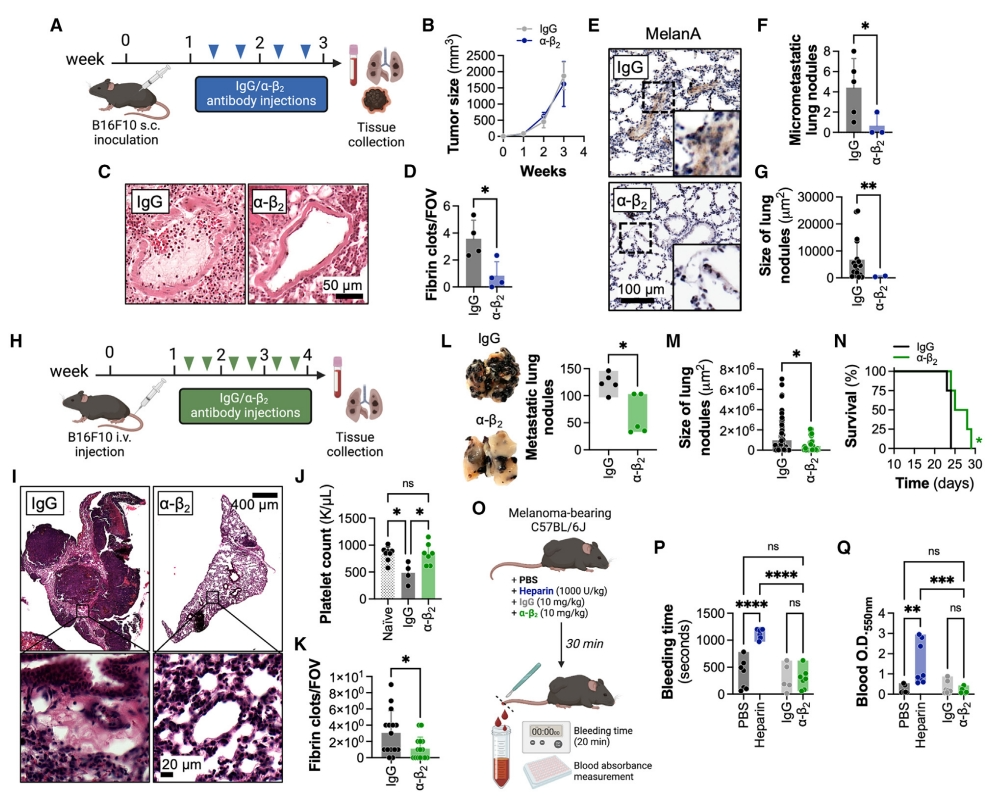
图三 阻断整合素β2可预防癌症肺转移和血栓形成[7]
下一步,研究者试图确定PTN中β2+ sEV的来源。使用流式细胞术分析主要肺细胞亚群中整合素β2的表达情况,包括CD31+内皮细胞、CD45+免疫细胞、EpCam+上皮细胞和CD140+成纤维细胞。结果发现,PDAC或黑色素瘤转移性小鼠肺中β2+细胞增加了2倍以上,其中96%为免疫细胞(图四A和B)。接着对18周龄PDAC荷瘤小鼠(KrasHet)无转移性肺组织中的CD45+细胞进行RNA测序和CITE-seq分析(图四C),观察到免疫群体频率的显著变化,包括中性粒细胞、嗜碱性粒细胞、单核细胞的显著减少,而效应T细胞、B细胞、自然杀伤(NK)细胞和巨噬细胞在PDAC荷瘤小鼠肺中显著富集(图四D)。由于巨噬细胞中的整合素信号通路和β2表达高于其他免疫细胞,将巨噬细胞和树突状细胞(DC)分为三个亚群:DC(簇0)、间质巨噬细胞(IM,簇1)和浆细胞样DC(pDC,簇2)(图四E)。观察到β2+CD11c+CD11b+ Ly6C−SiglecF−F4/80+ IM的数量增加了5倍(图四F),这一结果通过流式细胞术和免疫荧光(IF)在PDAC荷瘤小鼠的肺中得到验证(图四G-I)。转录组和CITE-seq分析显示,PTN中IM极化为M2样表型,表现为CD206、Cx3CR1、Mrc1和其他先前鉴定标志物的表达(图四J-M)。评估IM是否产生促血栓sEV,在B16F10或KPC4662肺转移小鼠中耗竭肺IM。发现虽然IM的耗竭并未影响转移性生长,但短期耗竭IM后产生的肺sEV未能引起未处理小鼠的血栓形成(图四N-Q)。以上数据表明,PTN中促血栓性β2+ sEV的主要来源于肺间质巨噬细胞。
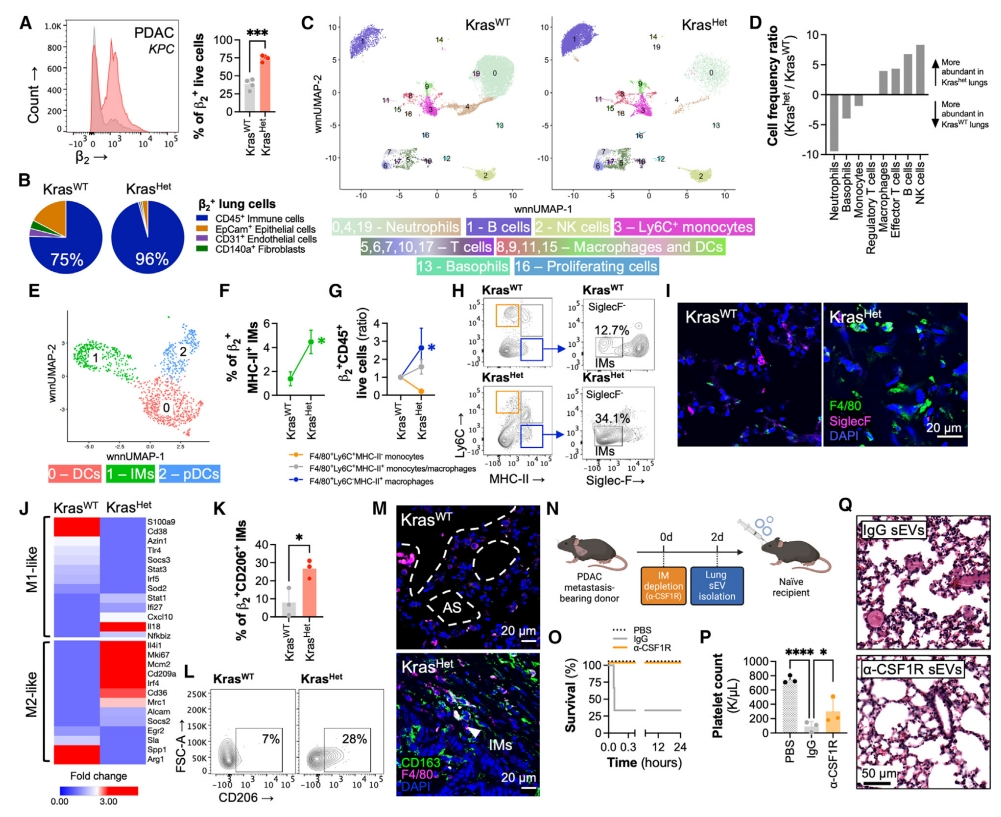
图四 活化的IM是肺PTN中β2+ sEV的主要来源[7]
接着,研究者探究肿瘤促进CD206+ IM增殖并产生促血栓sEV的机制。测量了对照组和PDAC荷瘤KPC小鼠的胰腺条件培养基(CM)和血浆中的趋化因子和细胞因子水平。与对照相比,C-X-C基序趋化因子13(CXCL13)在KrasHet小鼠血浆中上调了50倍,在胰腺条件培养基中上调了200倍以上(图五A-C)。与无肿瘤小鼠相比,转移性乳腺癌(PyMT)和黑色素瘤肺转移(B16F10细胞)的小鼠血浆中循环CXCL13水平显著升高(图五C),表明CXCL13来源于原发性和转移性肿瘤。随后,用来自三名不同PDAC患者的肿瘤组织条件培养基(CMTT),在存在同种型对照或抗CXCL13抗体的情况下,处理健康供体外周血来源的人单核细胞衍生巨噬细胞,评估M1/M2极化标志物的表达(图五D)。阻断CXCL13消除了CMTT介导的CD206+ M2样巨噬细胞的增加,而不影响CD80的表达(图五E和F)。此外,用CMTT和CXCL13抗体处理巨噬细胞的sEV在与血小板一起孵育时缺乏促血栓形成作用(图五G)。在体内,接受了PDAC肿瘤CMTT +对照抗体、重组小鼠CXCL13(rmCXCL13)肺sEV可诱导小鼠肺血栓和血小板减少症,而接受了CMTT + CXCL13抗体处理的小鼠未出现此现象(图五H-K)。rmCXCL13和CMTT处理足以诱导PTN形成和肺中β2+ IM的扩增,而这些效应可被CXCL13抗体处理所消除(图五L和M)。以上数据表明,循环肿瘤来源的CXCL13诱导了肺IM的重编程和促血栓sEV的产生。

图五 肿瘤来源CXCL13促进IM重编程和释放促血栓形成sEV [7]
整合素是由α和β亚基组成的异二聚体,其中整合素αD、αL、αM和αX是整合素β2的潜在伴侣。研究者实验证明,sEV-β2优先与αX结合,来自肺转移周围或非转移区域的IM促血栓sEV携带了激活的αXβ2二聚体,与血小板表面GPIb直接相互作用,启动了血小板激活级联反应,涉及血小板表面的磷脂酰丝氨酸(PS)暴露,从而促进组织因子介导的FVIIa、FXa和凝血酶的生成,最终导致纤维蛋白沉积和血栓增加。
最后,研究者评估整合素β2作为癌症患者血栓风险生物标志物的潜力。测量健康对照或有/无血栓栓塞(TE)病史的I–IV期PDAC患者血浆中sEV的浓度及其β2水平,TE事件前血浆sEV的浓度和β2水平高于TE事件后或与无TE事件患者(图六A-C)。在TE事件发生前的30天内,EV相关的β2水平达到峰值,增加了4倍(图六D),在IV期患者中尤为显著(图六E)。同样,与健康对照组相比,β2在肺腺癌(LUAD)患者的血浆sEV中富集,而肺腺癌在血栓栓塞风险方面仅次于PDAC(图六F)。在儿童癌症中,霍奇金淋巴瘤患者的循环sEV中β2水平显著高于神经母细胞瘤和骨肉瘤患者(图六G)。评估sEV-β2血浆水平所提示的肿瘤邻近或非转移组织中PTN的形成情况,对LUAD和PDAC患者的肺活检样本进行免疫染色。在LUAD中,观察到在未受累的肺组织中αX actβ2+和CSF1R+ F4/80+ IM的数量增加,而在原发肿瘤中则未观察到这一现象(图六H和I)。同样,在PDAC中,actβ2+和CSF1R+ IM在肿瘤周围或非转移肺组织中的比例显著高于转移结节(图六J-L)。还评估了PDAC中去除sEV血浆中的循环CXCL13水平。与sEV-β2类似,经历TE患者血浆中CXCL13水平高于无TE的患者(图六M),循环CXCL13水平与癌症分期相关(图六N)。以上数据表明,sEV相关的整合素β2与癌症患者的血栓风险相关。
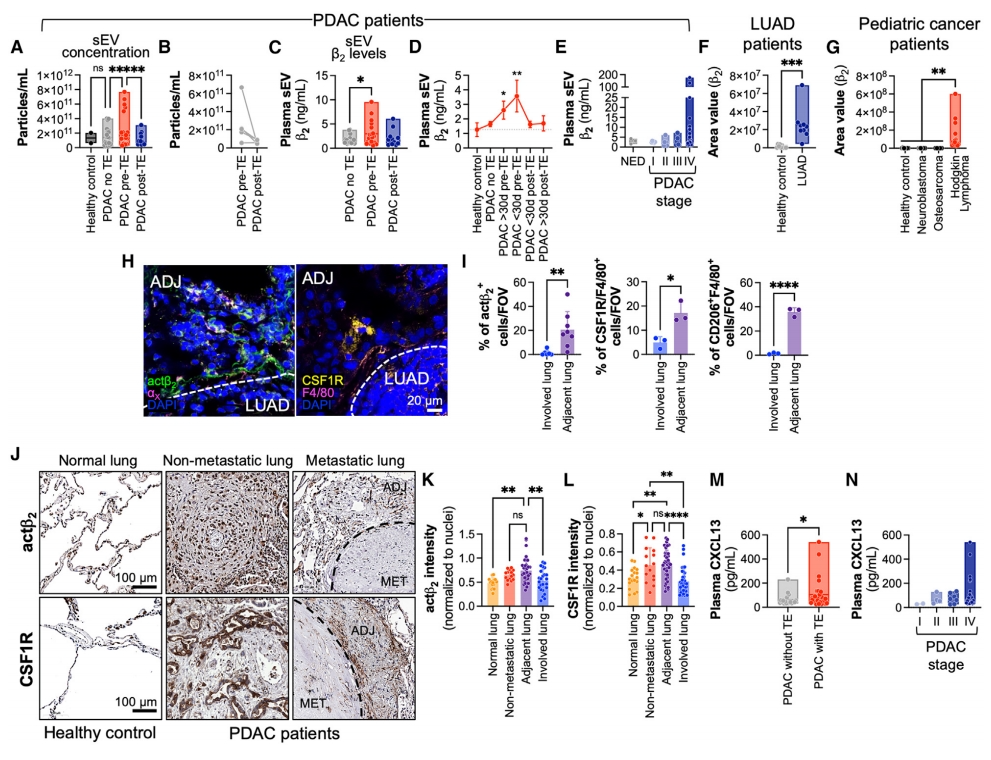
图六 EV-β2与癌症患者TE风险和预后相关[7]
综上所述,该研究发现肿瘤来源的CXCL13能够重编程多种癌症的非转移性或转移灶周围的肺间质巨噬细胞,使其分泌活化的整合素αXβ2的小细胞外囊泡(sEV),这一微环境称为促血栓形成生态位(PTN)。这些sEV直接与血小板GPIb结合,诱导系统性血小板活化和聚集。阻断sEV上的整合素β2或系统性阻断整合素β2能够预防致命性血栓形成并减少肺转移,小鼠也没有过度出血的情况。此外,在胰腺导管腺癌(PDAC)患者中,血浆sEV中β2水平的升高与后续血栓栓塞的发生相关。该研究创新性地发现癌症相关血栓起源于肺部,重新定义了血栓形成。sEV-β2可以作为一种新型的血液生物标志物,用于评估癌症患者的血栓形成风险,并作为预防癌症患者血栓形成和肺转移的潜在治疗靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Lucotti S, Muschel RJ: Platelets and Metastasis: New Implications of an Old Interplay. Frontiers in oncology 2020, 10:1350.
2. Tuzovic M, Herrmann J, Iliescu C, Marmagkiolis K, Ziaeian B, Yang EH: Arterial Thrombosis in Patients with Cancer. Current treatment options in cardiovascular medicine 2018, 20(5):40.
3. Rothwell PM, Wilson M, Price JF, Belch JF, Meade TW, Mehta Z: Effect of daily aspirin on risk of cancer metastasis: a study of incident cancers during randomised controlled trials. Lancet (London, England) 2012, 379(9826):1591-1601.
4. Wang JG, Geddings JE, Aleman MM, Cardenas JC, Chantrathammachart P, Williams JC, Kirchhofer D, Bogdanov VY, Bach RR, Rak J et al: Tumor-derived tissue factor activates coagulation and enhances thrombosis in a mouse xenograft model of human pancreatic cancer. Blood 2012, 119(23):5543-5552.
5. Hoshino A, Kim HS, Bojmar L, Gyan KE, Cioffi M, Hernandez J, Zambirinis CP, Rodrigues G, Molina H, Heissel S et al: Extracellular Vesicle and Particle Biomarkers Define Multiple Human Cancers. Cell 2020, 182(4):1044-1061.e1018.
6. Zwicker JI, Liebman HA, Neuberg D, Lacroix R, Bauer KA, Furie BC, Furie B: Tumor-derived tissue factor-bearing microparticles are associated with venous thromboembolic events in malignancy. Clinical cancer research : an official journal of the American Association for Cancer Research 2009, 15(22):6830-6840.
7. Lucotti S, Ogitani Y, Kenific CM, Geri J, Kim YH, Gu J, Balaji U, Bojmar L, Shaashua L, Song Y et al: Extracellular vesicles from the lung pro-thrombotic niche drive cancer-associated thrombosis and metastasis via integrin beta 2. Cell2025.
8. Ivaska J: Unanchoring integrins in focal adhesions. Nat Cell Biol 2012, 14(10):981-983.



