技术分享:基于自噬的细胞膜蛋白靶向降解技术AUTAB
细胞表面信号受体是治疗多种人类疾病包括癌症和自身免疫性疾病的重要靶点[1],针对这类蛋白质开发有效策略来选择性抑制其功能将有助于改善人类健康[2]。与传统的抑制剂相比,靶向蛋白降解技术提供了一种更强大的方法来消除目标靶标[3]。经典的靶向蛋白降解物如蛋白水解靶向嵌合体(PROTAC)已具有显著的疗效,但其靶向降解机制只存在于细胞质中,因此仅适用于降解胞质蛋白[4]。为了扩大降解蛋白的范围,最近开发了一些新技术,包括溶酶体靶向嵌合体、通过脱唾液酸糖蛋白受体降解细胞外蛋白质、基于抗体的PROTAC、蛋白水解靶向抗体和细胞因子受体靶向嵌合物[5]。尽管这些技术的设计策略存在差异,但作用机制都是将目标膜蛋白与膜结合的E3泛素连接酶[6]或膜结合的溶酶体穿梭受体[5]结合,造成靶蛋白泛素化或内化,最终进行溶酶体降解。为此,需要合成复杂的双功能降解分子,能够同时以高亲和力和正确构象结合到两个靶标上。此外,涉及到的E3泛素连接酶和膜受体的表达在不同的细胞类型和组织中差异很大,从而限制了这些技术的应用。因此,亟需开发设计一种更精简的方法来降解细胞膜受体。
泛素-蛋白酶体系统(UPS)和自噬是细胞内的两种主要降解机制[7]。最近,受PROTAC技术的启发,开发基于自噬降解的技术引起了人们的关注,如自噬靶向嵌合体(AUTAC/AUTOTAC)和自噬小体绑定化合物(ATTEC)[8]。相比UPS,自噬靶向降解可能更具优势,特别是破坏蛋白质聚集物和细胞内细胞器等大的组分。例如,AUTAC已成功用于降解受损的线粒体[8],而ATTEC和AUTOTAC也已用于消除神经元的病理蛋白聚集物[9]。然而,这些自噬靶向降解分子都仅限于细胞质蛋白或细胞器。鉴于细胞表面受体通常表现出相当大的分子量,形成同源或异源复合物,因此利用自噬来降解这些膜受体大分子是一条有前景的研究途径。
2025年1月,Nature Chemical Biology期刊在线发表了一篇文章,开发了一种基于自噬的细胞膜蛋白靶向降解技术AUTAB,将靶蛋白抗体与可诱导自噬的聚乙烯亚胺(PEI)共价偶联,使其获得了降解靶蛋白的能力。AUTAB与细胞膜靶蛋白结合,可以激活内在的自噬机制,最终通过自噬-溶酶体途径降解靶蛋白。利用AUTAB,研究者成功靶向降解PDL1、EGFR 和CD73。此外,将PEI偶联的纳米二抗作为一种通用型AUTAB分子,与靶蛋白一抗联合使用,也能有效降解多种细胞膜蛋白。该研究开发了一种引导细胞膜蛋白通过自噬降解的新策略,具有广谱适用性和简单便捷性[10]。
聚乙烯亚胺(PEI)因其优良的跨膜传递能力而被广泛用于基因递送,也能高效诱导自噬[11]。于是,研究者选择PEI作为AUTAB分子的自噬诱导剂,首先研究PEI对自噬诱导的影响。使用25 kDa线性PEI(L25K PEI)处理Hela细胞,发现LC3B-II蛋白呈现剂量依赖性和时间依赖性显著增加,表明自噬被激活(图一a和b)。此外,异硫氰酸荧光素(FITC)标记的PEI与mCherry标记的LC3B信号重叠不多,但与另一个ATG8家族蛋白LC3C的重叠更多(图一c和d)。PEI处理诱导LC3C斑点在1小时内积累,而LC3B斑点仅在6小时后才出现,表明PEI更倾向于触发LC3C介导的自噬,这是一种非经典途径,对消除内吞的质膜物质至关重要[12]。一致的是,PEI诱导的LC3C阳性自噬体与早期(Rab5)和晚期(Rab7)内体标志物共定位(图一e和f)。此外,这些自噬体遵循典型的自噬途径,最终在红色荧光蛋白(RFP)-Lamp1标记的溶酶体中降解(图一g)。先前的研究表明,细胞膜损伤与LC3C介导的自噬之间存在很强的联系[13]。使用半乳糖凝集素3,一种膜损伤传感器,在PEI-FITC处理的细胞中观察到明显的内体膜损伤(图一h),表明PEI可能通过引入内体膜损伤来诱导自噬。进一步研究不同的PEI类型是否都能诱导自噬,发现线性和分支的PEI,从800到25000 Da,都诱导了类似水平的LC3C介导的自噬(图一i和j),表明无论分子大小和结构如何,PEI都能触发自噬。以上数据揭示了PEI诱导自噬的机制:通过内吞作用进行细胞内化后,PEI诱导内体膜损伤,从而激活LC3C介导的自噬途径,随后内体转向溶酶体降解(图一k)。
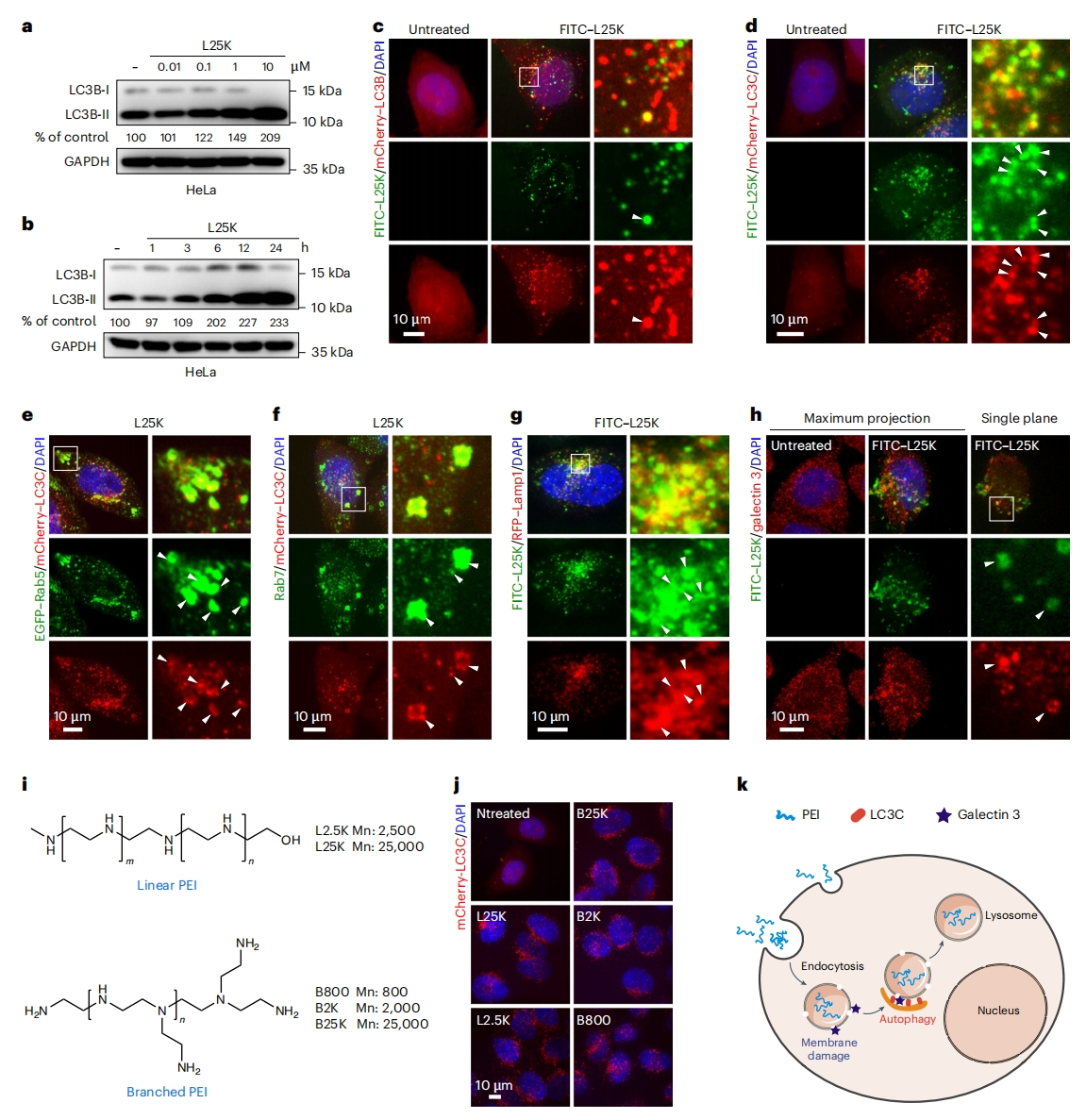
图一 PEI诱导LC3C依赖的自噬[10]
基于上述结果,研究者设想PEI与抗体结合将促进内吞作用,并通过触发自噬机制进一步引导其靶向受体进行溶酶体降解(图二a)。首先验证免疫治疗靶点程序性细胞死亡配体1(PDL1),将PEI与阿替利珠单抗(Atz)共价偶联合成了一种Atz-AUTAB分子(图二b),Atz是FDA批准用于癌症治疗的PDL1阻断抗体。变性凝胶电泳证实了Atz-AUTAB比未经修饰的Atz抗体表现出较慢的迁移(图二c)。在稳定表达HA-PDL1的HeLa细胞中,Atz-AUTAB诱导了显著的PDL1内吞和内体膜损伤,表现为半乳糖凝集素3在囊泡上的积聚(图二d)。此后,Atz-AUTAB通过在受损的内体上招募LC3C蛋白进一步激活自噬(图二e)。相一致地,在Atz-AUTAB处理细胞中,观察到内化的PDL1进入溶酶体(图二f)。相比之下,在Atz处理细胞中,大多数含有PDL1的内体分散在细胞质中,只有一小部分到达溶酶体(图二f)。免疫荧光染色显示,Atz-AUTAB处理显著降低了细胞表面的HA-PDL1(图二g);流式细胞术证实Atz-AUTAB处理使细胞表面HA-PDL1降低了约10倍(图二h)。在MAD-MB-231细胞的内源性PDL1上也观察到了这种作用。Atz-AUTAB处理可逐渐降低细胞表面PDL1水平:30分钟时降低约25%,2小时时降低约40%,24小时后降低约80%(图二i)。值得注意的是,PEI的跨膜传递能力使Atz-AUTAB的内吞作用速度比Atz快2-3倍。与此同时,Atz-AUTAB极大地促进了PDL1的内化,表明AUTAB在诱导自噬之前使用了一种额外的内吞机制,从而帮助细胞膜蛋白的自噬降解。以上数据表明,开发靶向PDL1的Atz-AUTAB可通过触发自噬进行降解。
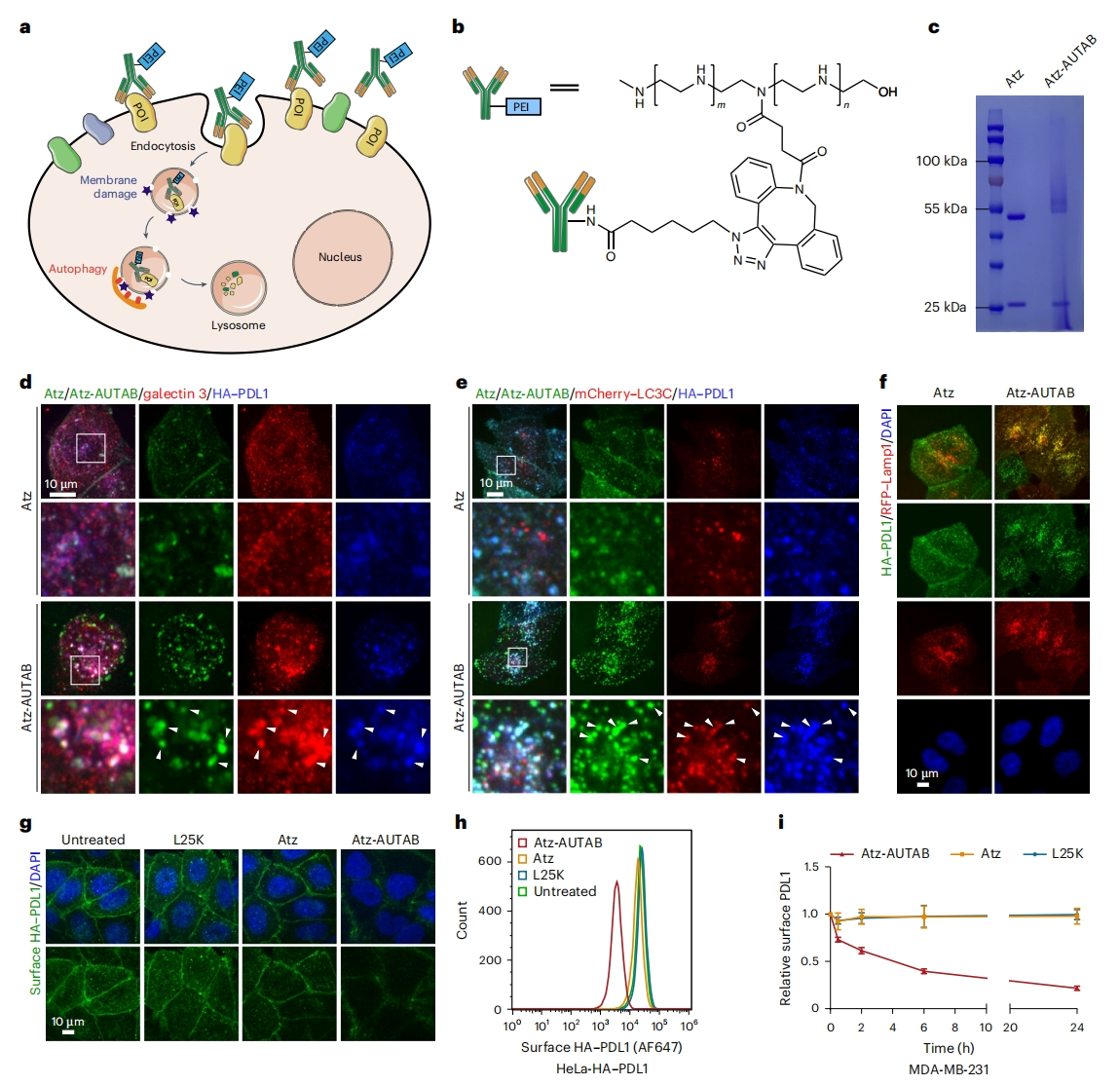
图二 开发靶向PDL1的Atz-AUTAB[10]
接下来,研究者评估Atz-AUTAB降解PDL1的情况。使用Atz-AUTAB处理MDA-MB-231细胞24小时,显著降低了PDL1总蛋白水平;而Atz单独或联合两倍浓度的PEI处理均不影响PDL1总蛋白水平(图三a)。Atz-AUTAB的降解是剂量依赖性的,从0.09 nM开始,到6.25 nM达到峰值(图三b)。时间曲线上,Atz-AUTAB在处理后12小时开始降解PDL1,24小时后几乎消除了PDL1信号(图三c)。Atz-AUTAB的降解作用在各种癌症细胞系中得到证实,表明其具有广泛的应用性(图三d)。用溶酶体抑制剂巴佛洛霉素A1和氯喹处理MDA-MB-231细胞,都能阻断Atz-AUTAB对PDL1的降解(图三e)。此外,敲降LC3C显著抑制了Atz-AUTAB诱导的PDL1降解,尽管不是完全抑制(图三f)。而敲除LC3C的同时敲降ATG8蛋白的不同亚家族蛋白GABARAP、GABARAPL1和GABARAPL2,几乎完全挽救了Atz-AUTAB诱导的PDL1降解(图三g),而沉默任何单个蛋白质都没有影响。敲除ATG8的两个上游基因ATG4B和ATG5也在很大程度上挽救了AUTAB引起的PDL1降解(图三h),表明Atz-AUTAB是通过自噬-溶酶体途径降解PDL1。定量蛋白分析显示PDL1是Atz-AUTAB处理细胞中下调最显著的蛋白,没有其他蛋白显示出类似的降低水平(图三i),表明AUTAB的降解特异性。随后,给携带MDA-MB-231肿瘤的小鼠每天5 mg/kg Atz-AUTAB静脉注射3天,发现Atz-AUTAB给药组的肿瘤里PDL1表达显著降低(图三j),表明AUTAB具有体内靶向降解能力。以上数据表明,Atz-AUTAB可通过自噬-溶酶体途径降解PDL1。
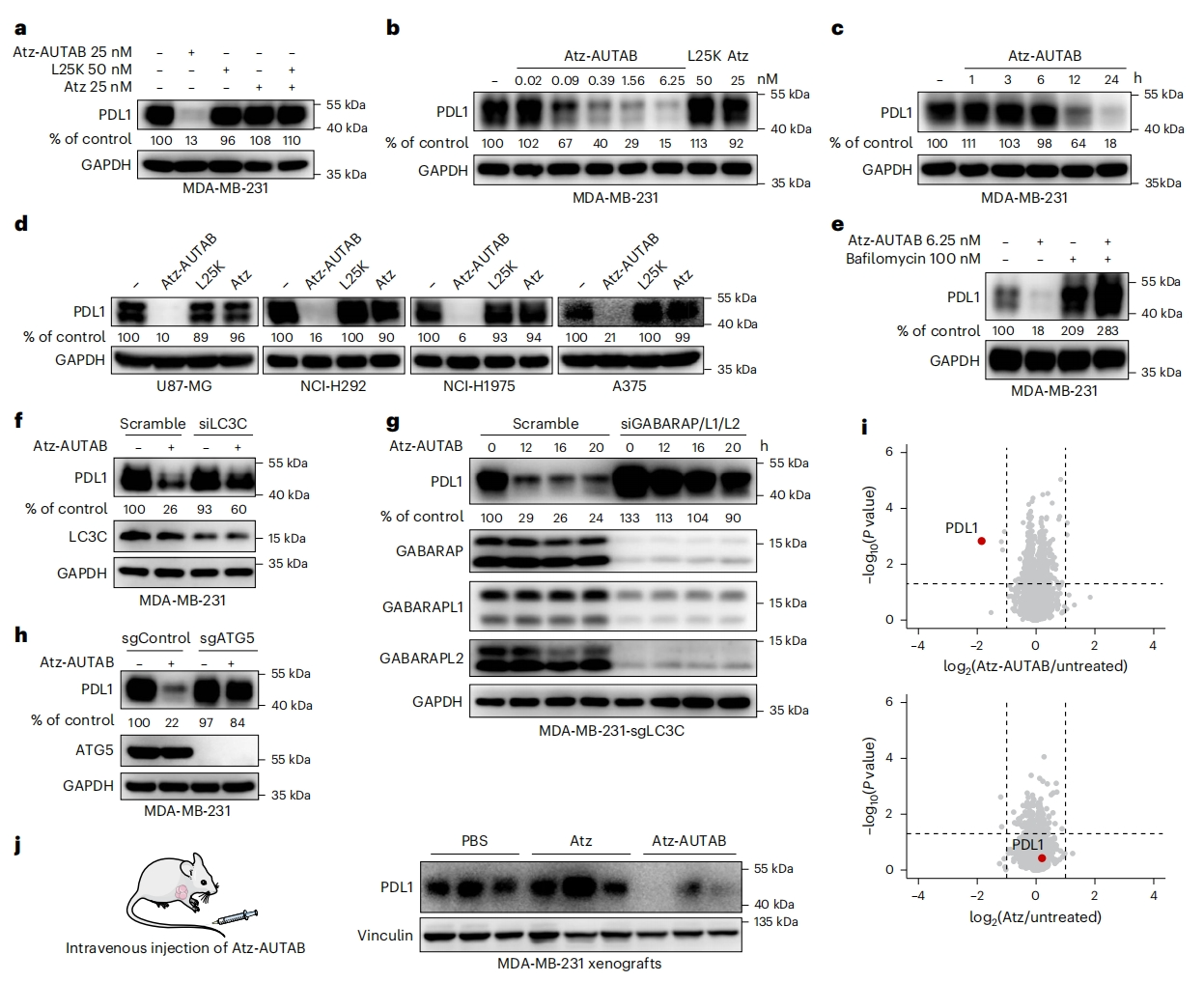
图三 Atz-AUTAB通过自噬-溶酶体途径驱动靶向降解PDL1 [10]
随后,研究者探究AUTAB模式的普遍性,将其应用于多种癌症治疗靶点表皮生长因子受体(EGFR)的降解[14]。将FDA批准的EGFR阻断抗体西妥昔单抗(Ctx)与L25K PEI相偶联开发了Ctx-AUTAB。与Atz-AUTAB类似,Ctx-AUTAB也诱导了LC3C介导的自噬,并伴有EGFR内吞作用(图四a)。免疫印迹进一步证实了Ctx-AUTAB在四种癌症细胞系中降解EGFR的功效(图四b),并且抑制溶酶体活性可以抑制Ctx-AUTAB诱导的EGFR降解(图四c)。继续研究Ctx-AUTAB降解EGFR后的生物活性。与Ctx类似,Ctx-AUTAB抑制了EGF诱导的蛋白激酶B(AKT)和细胞外信号调节激酶1(ERK1)的磷酸化(图四d)。伤口愈合试验显示Ctx-AUTAB显著阻碍了肿瘤细胞的迁移(图四e和f)。在展示了AUTAB对跨膜蛋白PDL1和EGFR的降解能力后,研究者测试AUTAB对膜锚定蛋白的可行性,设计了靶向CD73的AUTAB降解剂(图四g)。CD73是新出现的免疫治疗癌症靶点,通过糖基磷脂酰肌醇锚定在细胞膜上,临床试验中使用奥来鲁单抗(Ole)阻断CD73[15]。与Atz-AUTAB和Ctx-AUTAB类似,Ole-AUTAB显著促进了CD73通过溶酶体途径的降解(图四h),在各种类型癌症细胞中进一步证实其降解能力(图四i)。以上数据表明,AUTAB分子在靶向不同类型细胞膜蛋白方面具有广泛适用性。
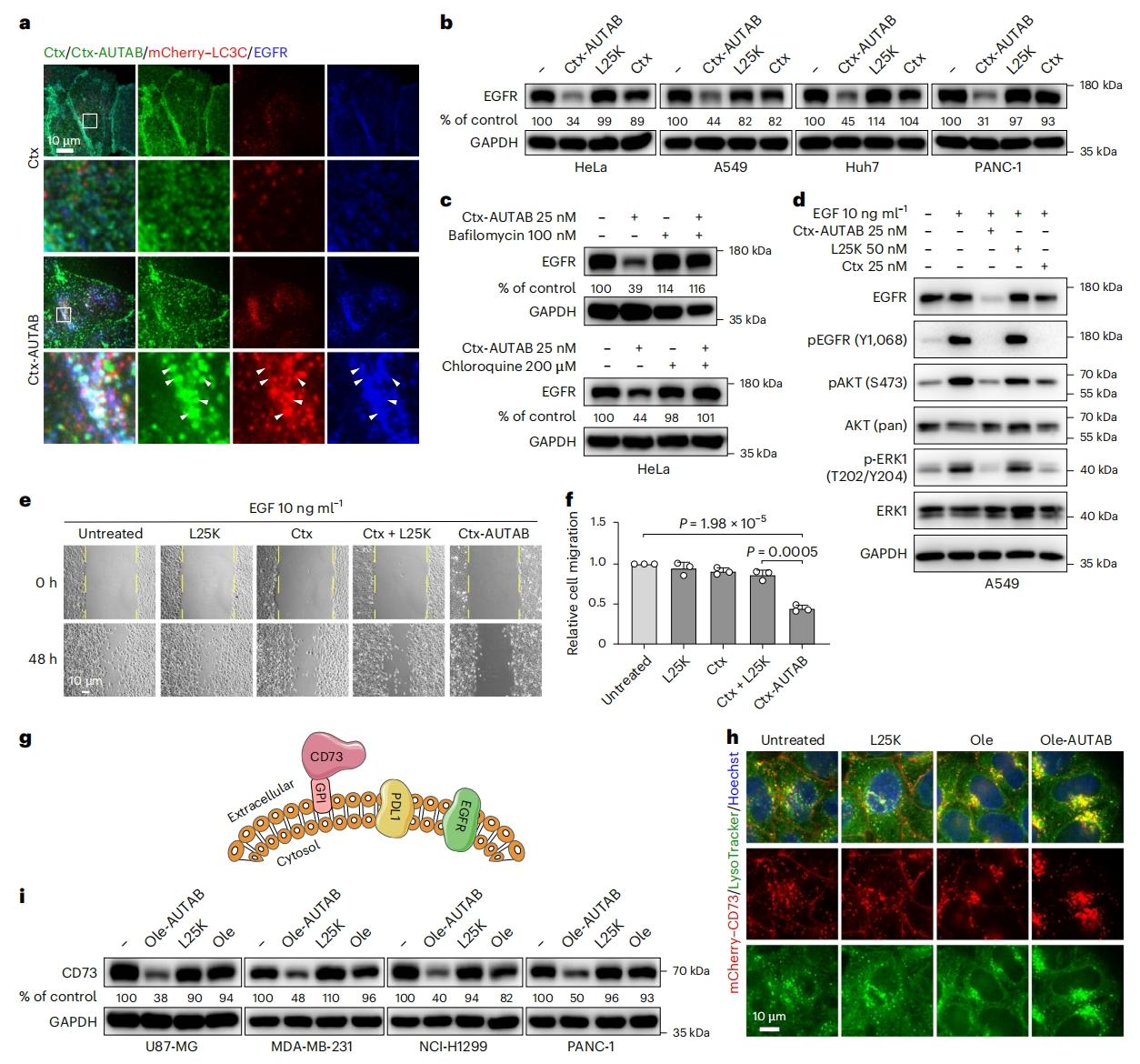
图四 AUTAB可应用于降解EGFR和CD73[10]
接着,研究者探索不同类型PEI开发AUTAB的潜力,使用不同结构和尺寸的PEI分子合成各种Atz-AUTAB。免疫印迹分析显示,无论其结构和大小如何,这些Atz-AUTAB对PDL1均表现出相当的降解效果(图五a和b),表明PEI分子在AUTAB构建中具有普遍性。将Atz与部分乙酰化(约65%)的L2.5K PEI结合,创建一个低电荷的AUTAB(图五c)。与常规Atz-AUTAB相比,这种低电荷Atz-AUTAB会破坏PDL1内吞、自噬启动和PDL1蛋白降解能力(图五d-g)。聚赖氨酸(polyLys)是生物医学研究中常用的材料,具有丰富的正电荷,将其与Atz偶联发现polyLys-Atz-AUTAB与Atz-AUTAB类似,也能诱导强烈的自噬(图五h)。此外,两种不同大小的polyLys变体都能有效降解PDL1(图五i),表明AUTAB具有正电荷依赖性。
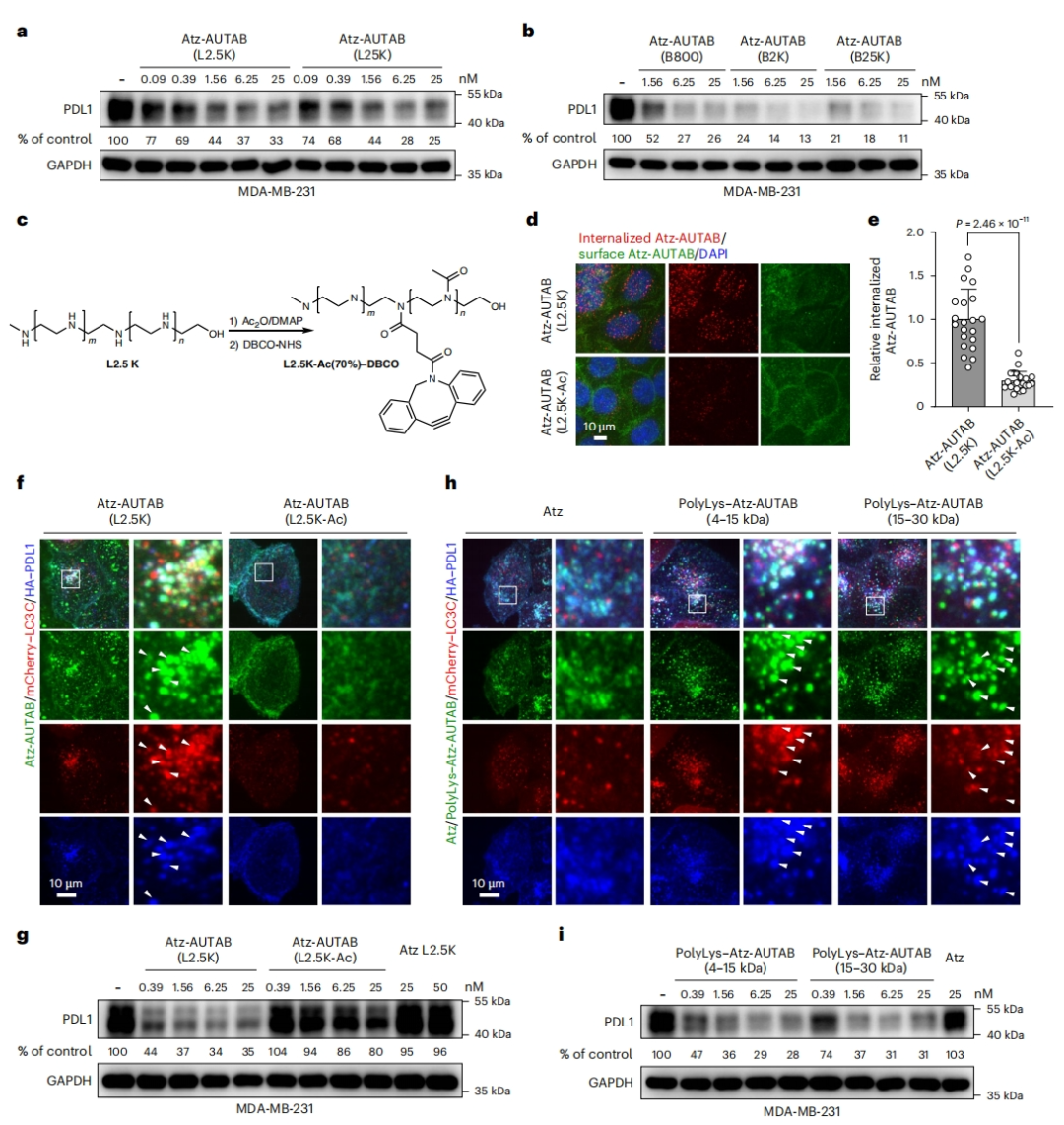
图五 AUTAB的功能依赖于PEI的阳离子性质[10]
最后,研究者探究通用型AUTAB分子的可行性,这将大大简化AUTAB技术,测试利用Nano二抗作为中间媒介将PEI与靶点抗体偶联的可行性。为缩短PEI与靶点抗体的距离,研究者选择较小的马来酰亚胺修饰L2.5K PEI(L2.5K-MA),将其偶联到市售的识别人和兔IgG的纳米二抗胱氨酸残基上,称为nano-AUTAB。原则上,当与特异性一抗联合使用时,nano-AUTAB可以选择性降解不同的细胞膜蛋白(图六a)。变性凝胶电泳确认PEI和纳米二抗的成功偶联后(图六b),测试其能否降解PDL1。结果显示,Atz联合nano-AUTAB处理可有效清除细胞表面的PDL1,而没有偶联PEI的纳米二抗则无效果(图六c)。此外,nano-AUTAB可与不同的PDL1一抗联合使用,包括研究级PDL1抗体,都能有效降解PDL1(图六d-f)。联合特异性一抗,nano-AUTAB能降解其他细胞膜蛋白,包括CD73和整合素α5(图六g和h)。值得注意的是,nano-AUTAB还能同时降解多个靶点,如在MDA-MB-231细胞中同时降解PDL1和EGFR(图六i)。
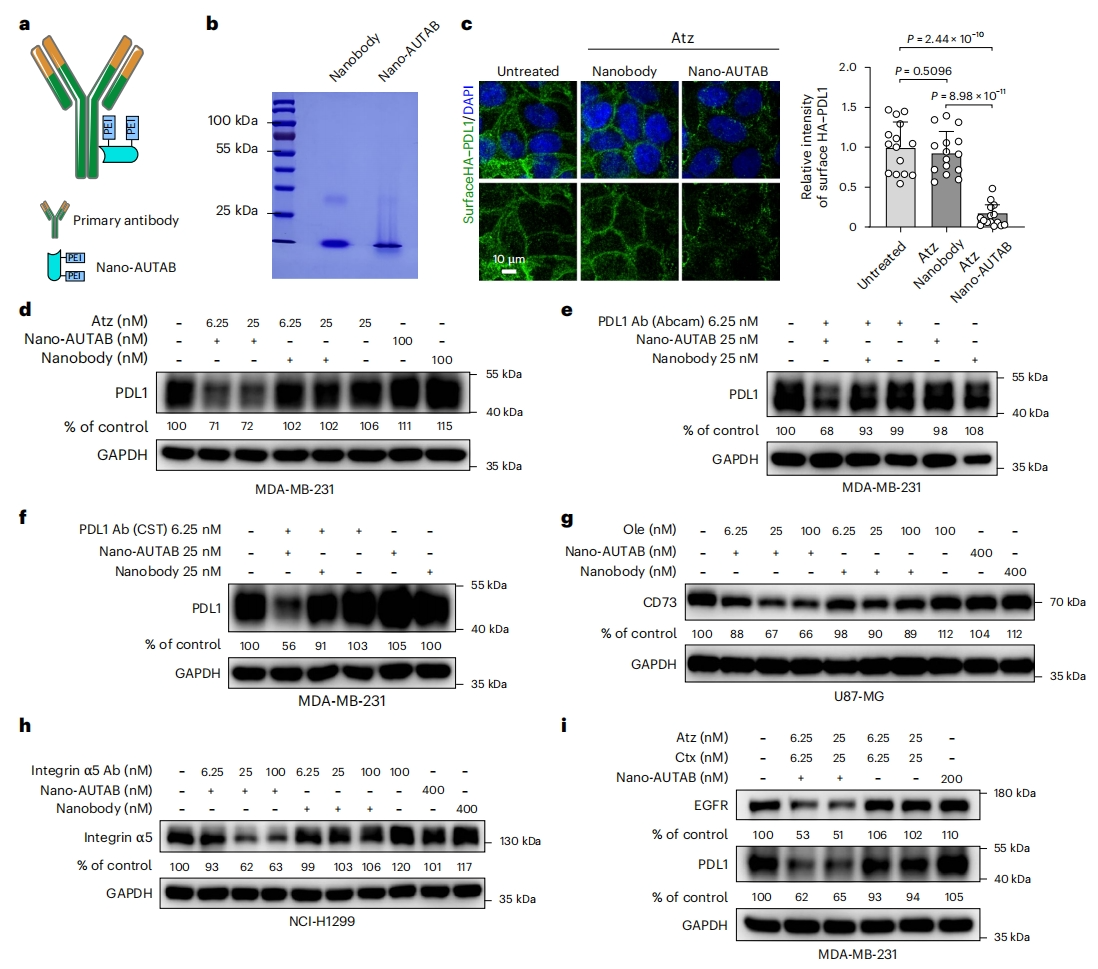
图六 通用型nano-AUTAB的开发[10]
综上所述,研究者利用自噬诱导化学剂PEI与靶蛋白一抗共价偶联,促使靶蛋白通过自噬-溶酶体途径降解,成功建立了基于自噬的细胞膜蛋白靶向降解技术AUTAB。与现有的大多数蛋白质降解技术不同,AUTAB不需要与细胞内自噬诱导剂的物理相互作用,而是通过产生细胞内自噬信号来驱动蛋白质降解。此外,基于纳米二抗的通用型nano-AUTAB,在与靶点特异性一抗联合使用时,也能发挥AUTAB分子的降解作用,为靶向蛋白降解提供了一种更普遍适用的方法。可是,AUTAB分子在体内会被快速代谢,导致在动物模型体内降解蛋白质的能力有限,以及肿瘤靶向性较差。即便如此,AUTAB的独特优势使其成为一个强大且多功能的细胞膜蛋白降解平台,在生物学研究和治疗性抗体药物发现等方面具有广谱适用性和简单便捷性。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hu Z, Yuan J, Long M, Jiang J, Zhang Y, Zhang T, Xu M, Fan Y: The Cancer Surfaceome Atlas integrates genomic, functional and drug response data to identify actionable targets. 2021, 2(12):1406-1422.
2. Santos R, Ursu O, Gaulton A, Bento AP, Donadi RS, Bologa CG, Karlsson A, Al-Lazikani B, Hersey A, Oprea TI et al: A comprehensive map of molecular drug targets. Nature reviews Drug discovery 2017, 16(1):19-34.
3. Ahn G, Banik SM, Bertozzi CR:Degradation from the outside in: Targeting extracellular and membrane proteins for degradation through the endolysosomal pathway. Cell chemical biology 2021, 28(7):1072-1080.
4. Alabi SB, Crews CM: Major advances in targeted protein degradation: PROTACs, LYTACs, and MADTACs. The Journal of biological chemistry 2021, 296:100647.
5. Banik SM, Pedram K:Lysosome-targeting chimaeras for degradation of extracellular proteins. 2020, 584(7820):291-297.
6. Marei H, Tsai WK: Antibody targeting of E3 ubiquitin ligases for receptor degradation. 2022, 610(7930):182-189.
7. Mizushima N, Komatsu M: Autophagy: renovation of cells and tissues. Cell 2011, 147(4):728-741.
8. Takahashi D, Moriyama J, Nakamura T, Miki E, Takahashi E, Sato A, Akaike T, Itto-Nakama K, Arimoto H: AUTACs: Cargo-Specific Degraders Using Selective Autophagy. Molecular cell 2019, 76(5):797-810.e710.
9. Ji CH, Kim HY:The AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system. 2022, 13(1):904.
10. Cheng B, Li M, Zheng J, Liang J, Li Y, Liang R, Tian H, Zhou Z, Ding L, Ren J et al: Chemically engineered antibodies for autophagy-based receptor degradation. 2025.
11. Gao X, Yao L, Song Q, Zhu L, Xia Z, Xia H, Jiang X, Chen J, Chen H:The association of autophagy with polyethylenimine-induced cytotoxicity in nephritic and hepatic cell lines. Biomaterials 2011,32(33):8613-8625.
12. Coelho PP, Hesketh GG, Pedersen A, Kuzmin E, Fortier AN, Bell ES, Ratcliffe CDH, Gingras AC, Park M: Endosomal LC3C-pathway selectively targets plasma membrane cargo for autophagic degradation. Nature communications 2022, 13(1):3812.
13. Pied N, Daussy CF, Denis Z, Ragues J, Faure M, Iggo R, Tschan MP, Roger B, Rayne F, Wodrich H: TBK1 is part of a galectin 8 dependent membrane damage recognition complex and drives autophagy upon Adenovirus endosomal escape. 2022, 18(7):e1010736.
14. Guardiola S, Varese M, Sánchez-Navarro M, Giralt E:A Third Shot at EGFR: New Opportunities in Cancer Therapy. Trends in pharmacological sciences 2019, 40(12):941-955.
15. Bendell J, LoRusso P, Overman M:First-in-human study of oleclumab, a potent, selective anti-CD73 monoclonal antibody, alone or in combination with durvalumab in patients with advanced solid tumors. 2023, 72(7):2443-2458.



