技术分享: LXRα突变揭示胆固醇感应在代谢功能障碍相关脂肪性肝炎(MASH)中的作用
代谢功能障碍相关脂肪性肝病(MASLD)估计影响全球35%的人群[1]。MASLD本身可能是相对良性的,但约25%的患者会发展为代谢功能障碍相关脂肪性肝炎(MASH),而MASH会增加肝硬化、肝细胞癌和肝功能衰竭的风险[2]。MASLD的特征是肝脏脂肪的过度积累,并且经常观察到脂肪酸从头合成的速率升高[3]。大多数MASLD患者并不发展成MASH,目前尚不清楚是肝脏脂肪增加单独导致转变成MASH,还是需要额外的触发因素。
人类肝脏里的胆固醇水平与MASH的严重程度相关,临床研究表明MASH患者可从抑制胆固醇合成的他汀类药物中获益[4, 5]。然而,胆固醇直接影响疾病的机制尚不清楚。核受体LXRα是肝脏主要表达的肝X受体亚型,在脂质代谢的转录调控中发挥着关键作用。LXRα是一种细胞内胆固醇水平传感器,可直接结合胆固醇衍生物,进而转录调控靶基因的表达来维持脂质稳态。LXRα基因缺失会损害胆固醇的分解代谢和排泄,也会减少脂肪酸从头合成[6, 7]。由于脂肪酸合成的增加被认为是主要驱动MASLD脂肪变性因素,因此已提出通过抑制LXR活性来治疗脂肪变性肝病的潜在治疗方法[8]。人类全基因组关联研究也发现与脂质水平和胰岛素敏感性相关的LXRα基因(NR1H3)突变[9, 10]。然而,尚不清楚LXRα是否在脂肪变性转变为MASH的炎症和纤维化过程中发挥作用。2025年1月,Nature Communications期刊发表了一项研究,利用核受体LXRα W441F突变小鼠证明肝脏胆固醇升高在MASH的发展中起着关键作用。LXRα W441F发挥显性负调控功能,使其关闭胆固醇感应,损害了LXRα对内源性胆固醇衍生配体的转录反应。突变小鼠在高脂肪、高胆固醇饮食喂养后,迅速发展出MASH表型,包括气球样变肝细胞、免疫浸润和纤维化,并且降低了肝脏甘油三酯,却增加了肝脏胆固醇。通过合成强效LXR激动剂处理突变小鼠重新激活LXR信号传导,可以逆转其MASH表型,表明LXRα的正常功能可阻碍MASH的发展。该研究构建了一种MASH遗传小鼠,为研究MASH相关机制和鉴定LXR信号下游的潜在治疗靶点提供了一种新的快速造模小鼠模型[11]。
基于结构研究和报告基因分析表明,LXR配体结合域羧基末端螺旋12的保守色氨酸(对应小鼠LXRα氨基酸441)突变为苯丙氨酸(W441F),削弱了LXR对胆固醇衍生配体的转录反应所需的螺旋10组氨酸(小鼠氨基酸419)与π阳离子的相互作用。然而,与组氨酸419直接氢结合的强效合成配体如T0901317,可逆转W441F的转录抑制[12]。于是,研究者探索小鼠LXRα W441F突变的影响。在LXRα和LXRβ双敲除小鼠的永生化骨髓来源巨噬细胞中,感染表达小鼠LXRα或LXRα W441F的腺病毒,mRNA定量分析LXR下游靶基因Srebp1c和Scd1。正如预期,表达野生型LXRα的细胞可响应24,25-环氧胆固醇以及合成激动剂T0901317的诱导,增加靶基因的表达;而W441F细胞选择性丧失对24,25-环氧胆固醇的反应。进一步构建Lxrα(Nr1h3)W441F突变小鼠,杂合突变小鼠(W/F)的交配繁殖可按孟德尔比率获得野生型(W/W)和纯合突变型(F/F)后代。在10-12周龄时,W/W、W/F和F/F雌性或雄性小鼠的体重没有显著差异。然而,与W/W对照组相比,W441F小鼠肝脏和肠道中参与胆固醇代谢(图一a-c)和脂肪酸合成(图一d-f)的LXR调节基因显著减少,纯合突变型F/F的减少相对最多。血浆甘油三酯和胆固醇相应降低(图一g和h),这反映了LXR在促进极低密度脂蛋白(VLDL)分泌和高密度脂蛋白颗粒产生方面的作用。突变小鼠的血浆葡萄糖水平略低(图一i),可能发生了肝脏损伤。
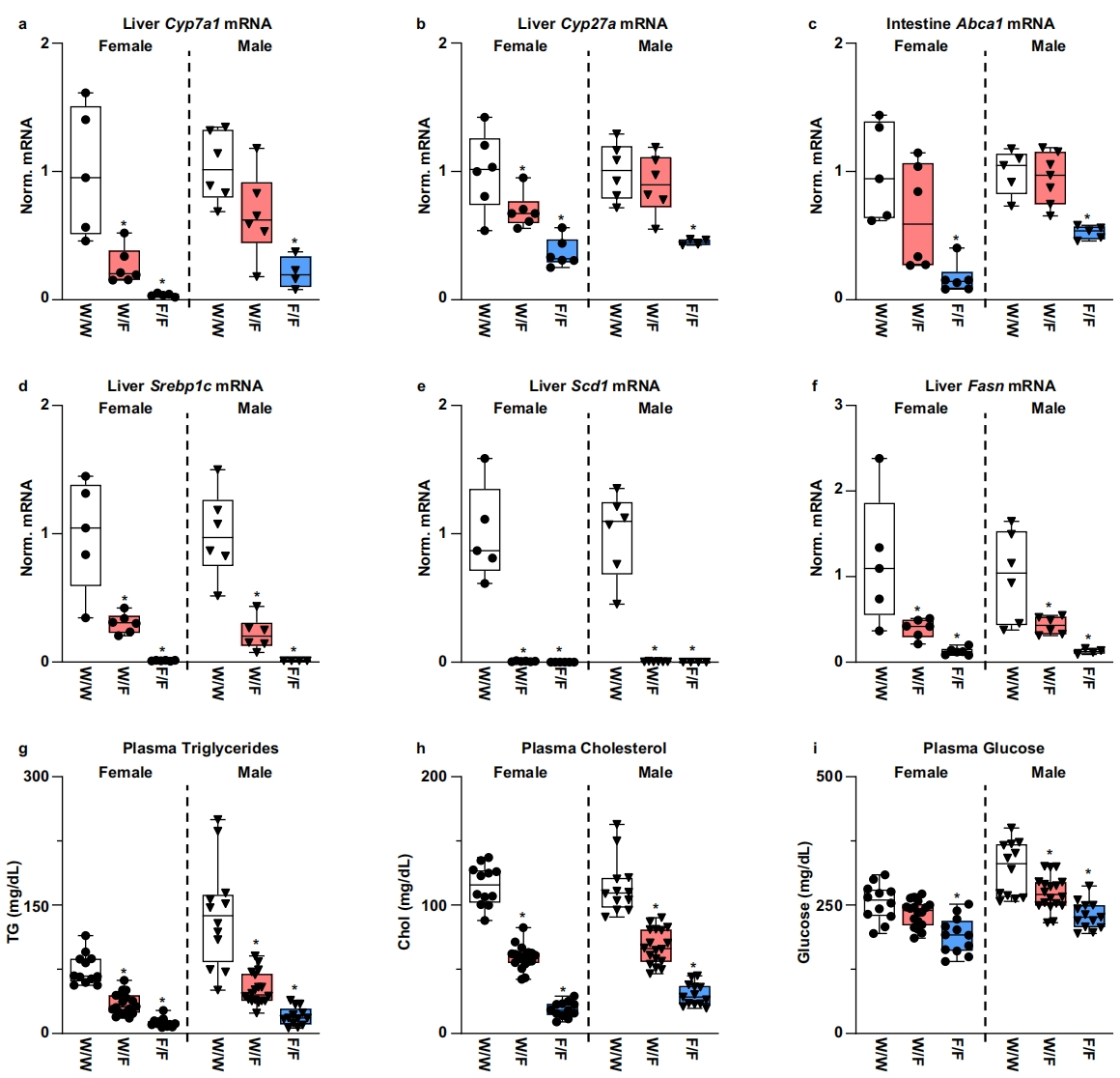
图一 LXRα W441F突变小鼠的肝脏靶基因和血浆脂质表征[11]
肝脏切片的组织学H&E染色显示F/F纯合突变小鼠免疫浸润(图二a),油红O染色显示出现大量中性脂质(图二b)。杂合W/F和纯合F/F突变小鼠的肝脏甘油三酯都降低(图二c)。而肝脏胆固醇仅在F/F纯合突变小鼠中增加(图二d和e),表明油红O染色最有可能鉴定出胆固醇负荷细胞。与参与脂肪酸合成的基因相比,杂合突变小鼠中参与胆固醇分解代谢的LXR靶基因受影响较小(图一a-f)。F/F纯合突变小鼠也观察到肝脏肿大,表现为肝脏与体重比更大。此外,F/F纯合突变小鼠肝细胞核中检测到增殖标志物Ki67的染色增加(图二f),表明细胞正在分裂。
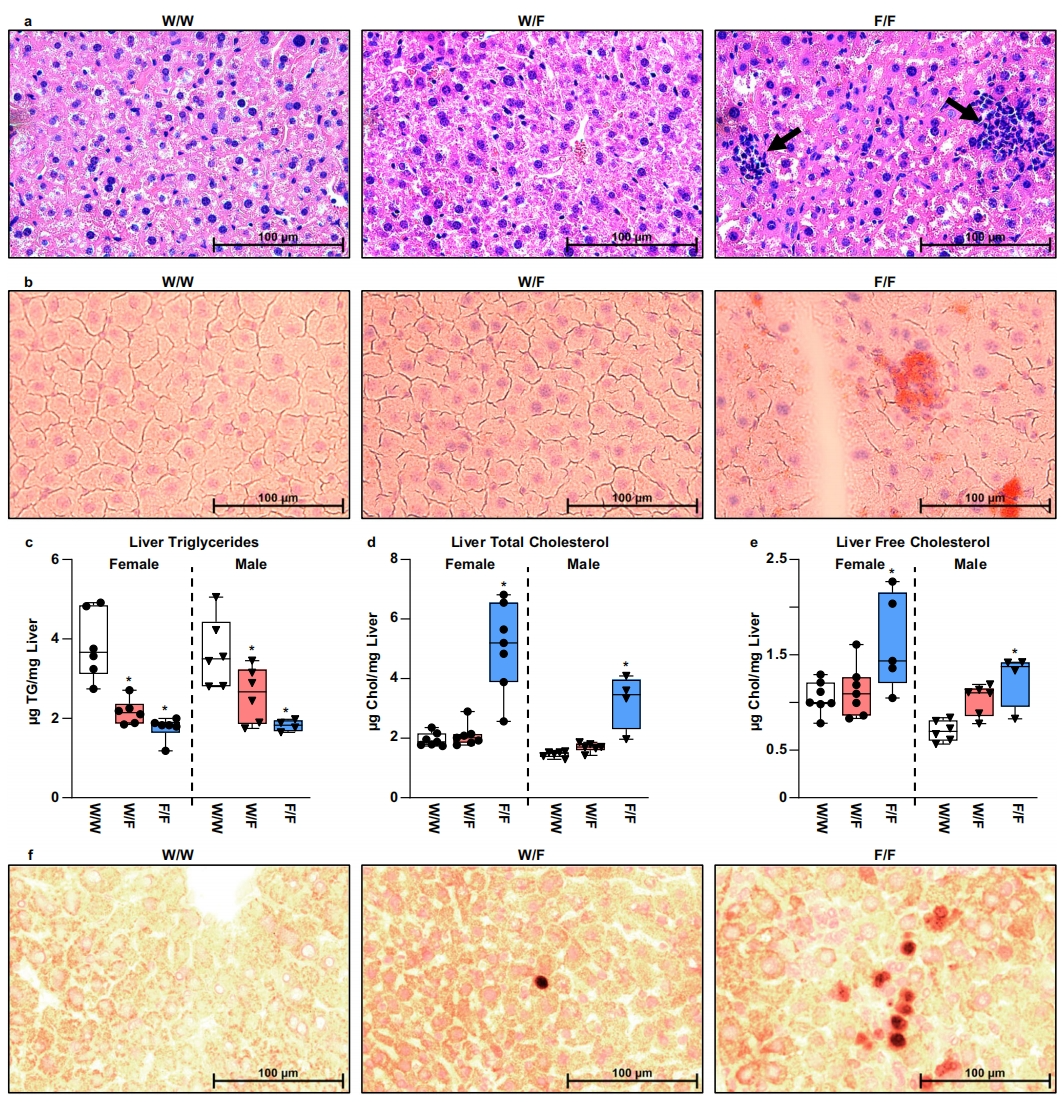
图二 LXRα W441F突变小鼠的肝脏胆固醇累积和细胞分裂增加[11]
进一步探索3种基因型小鼠的肝脏基因表达差异。肝脏RNA测序(RNA-Seq)的基因表达主成分分析(PCA)显示,W/F杂合突变比F/F纯合突变更接近W/W对照(图三a)。与W/W对照组相比,W/F杂合突变肝脏有59个差异基因,其中39个基因下调,20个基因上调。GO分析表明,大多数下调基因与脂肪酸代谢有关(图三b),18个基因要么是LXR靶基因,要么是LXR染色质结合位点的临近基因[13]。W/F杂合突变肝脏唯一显著上调的途径与甾醇代谢相关,4个基因被诱导2-2.3倍。与W/W对照组相比,F/F纯合突变肝脏有2000多个差异基因,其中488个基因下调,1688个基因上调。F/F纯合突变肝脏下调基因很大程度上也与脂肪酸代谢有关,上调的主要基因网络富集在细胞分裂、炎症/免疫细胞功能和细胞粘附/细胞外基质(图三b)。定量PCR证实了趋化因子受体Cx3cr1的表达增加(图三c),以及促炎基因如Tnf的表达升高(图三d),这与H&E染色观察到的免疫浸润一致,表明F/F纯合突变肝脏中存在促炎环境。巨噬细胞标志物Cd68的免疫组织化学染色,也可以检测到F/F纯合突变肝脏中巨噬细胞数量的增加(图三 i);此外,在MASH模型和其他慢性疾病环境中定义的脂质相关巨噬细胞群的标志基因Trem2和Spp1也增加(图三e和f);而库普弗细胞标志物如Clec4f的表达减少(图三i);促纤维化基因表达也增加(图三g和h)。
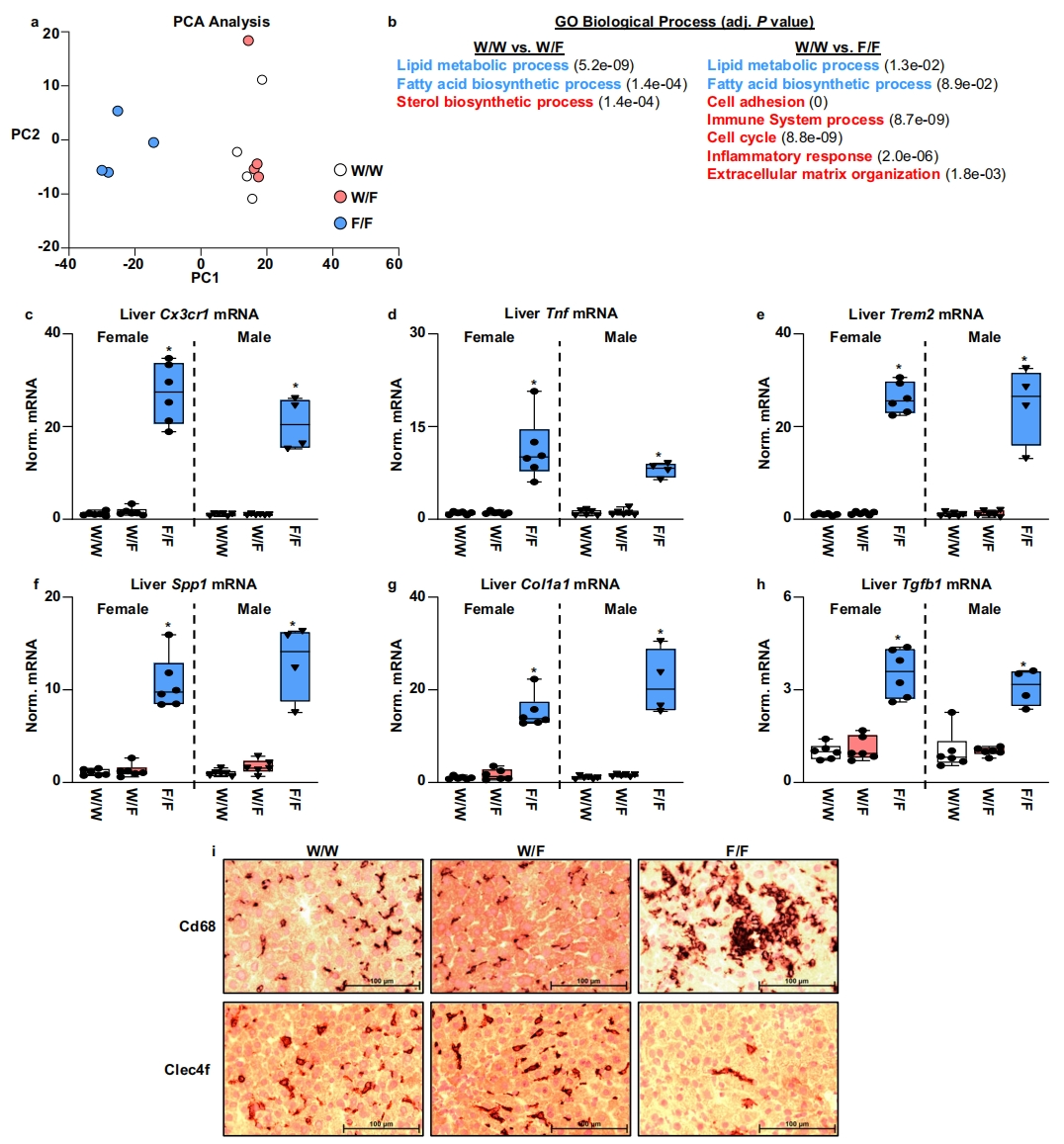
图三 LXRα W441F突变小鼠的肝脏基因表达检测[11]
为检查LXR信号传导对MASH进展的影响,MASH饮食(21%脂肪、1.25%胆固醇、34%蔗糖)喂养11周龄的W441F突变小鼠2周,部分收样后其余继续MASH饮食,并用激动剂T0901317处理2周。MASH饮食2周后,天狼星红染色在杂合和纯合突变小鼠肝脏中都检测到胶原蛋白沉积,在对照药物处理的小鼠中,胶原蛋白沉积在4周时进一步增加(图四a-c)。由于大多数高脂肪/高胆固醇饮食依赖性MASH模型需要几个月的时间才能发展为组织学可检测的纤维化[14],而W441F突变小鼠快速发展出纤维化,表明LXR活性在调节这一过程中起着关键作用。令人惊讶的是,与对照药物处理的小鼠相比,采用T0901317重新激活LXR信号后,胶原蛋白染色显著减少,与MASH饮食2周时水平相似。检测血浆ALT和AST的水平量化肝脏损伤,也遵循类似的轨迹,重新激活LXR活性也能大大减轻肝脏损伤(图四d-g)。

图四 LXRα W441F突变小鼠存在肝脏损伤和纤维化[11]
MASH饮食小鼠肝脏油红O染色(图五a)显示W441F突变小鼠与对照W/W小鼠相比脂质积累。对照小鼠具有相对较小的强烈染色的脂滴,并且在2至4周之间增加。此外,用已知促进脂肪酸合成的LXR激动剂T0901317处理对照小鼠进一步增加了脂滴的大小。相比之下,杂合和纯合突变小鼠的肝细胞表现出弥漫性脂质染色(图五a),体内的脂质负荷细胞似乎与H&E染色肝脏切片中检测到的气球样变肝细胞相关(图五b),推测这些细胞主要充满胆固醇。与这一假设一致,与W/W对照组相比,突变小鼠在MASH饮食2周和4周后肝脏胆固醇升高,而肝脏甘油三酯降低(图五c-f)。通过T0901317重新激活LXR信号传导可以降低杂合突变小鼠的肝脏胆固醇,但不会显著降低纯合突变小鼠的肝脏胆固醇(图五c-f)。

图五 LXRα W441F突变小鼠在MASH饮食后加重肝脏脂质积累[11]
研究者直接比较MASH饮食4周后,LXRα W441F突变小鼠和LXRα敲除小鼠(AKO)的表型。与W/W对照小鼠相比,AKO敲除小鼠的LXR靶基因下调,但mRNA水平的降低不如W441F突变小鼠明显(图六a-d)。与LXR依赖性基因表达减少相一致,敲除小鼠的肝脏胆固醇增加,肝脏甘油三酯降低(图六e-g)。通过Cd68 mRNA(图六h)测量的巨噬细胞含量在敲除小鼠中明显增加。然而,与敲除小鼠相比,突变小鼠的MASH分子标志物 Trem2和Col1a1的mRNA水平以及AST水平更高(图六i-k)。其他表型包括库普弗细胞标志物表达降低、细胞分裂增加、肝脏和脾脏与体重之比升高以及体重增加减少,在敲除小鼠中不太明显。MASH饮食4周后,敲除小鼠的肝脏胶原蛋白染色没有增加(图六l和m),这与不太严重的MASH表型一致。以上数据表明,敲除LXRα的效果不如W441F突变小鼠表型严重,敲除不会导致同样的纤维化加速发展。然而,LXRα基因缺失确实会产生促炎和促纤维化的环境,这可能有利于在稍长的时间内纤维化的发展。
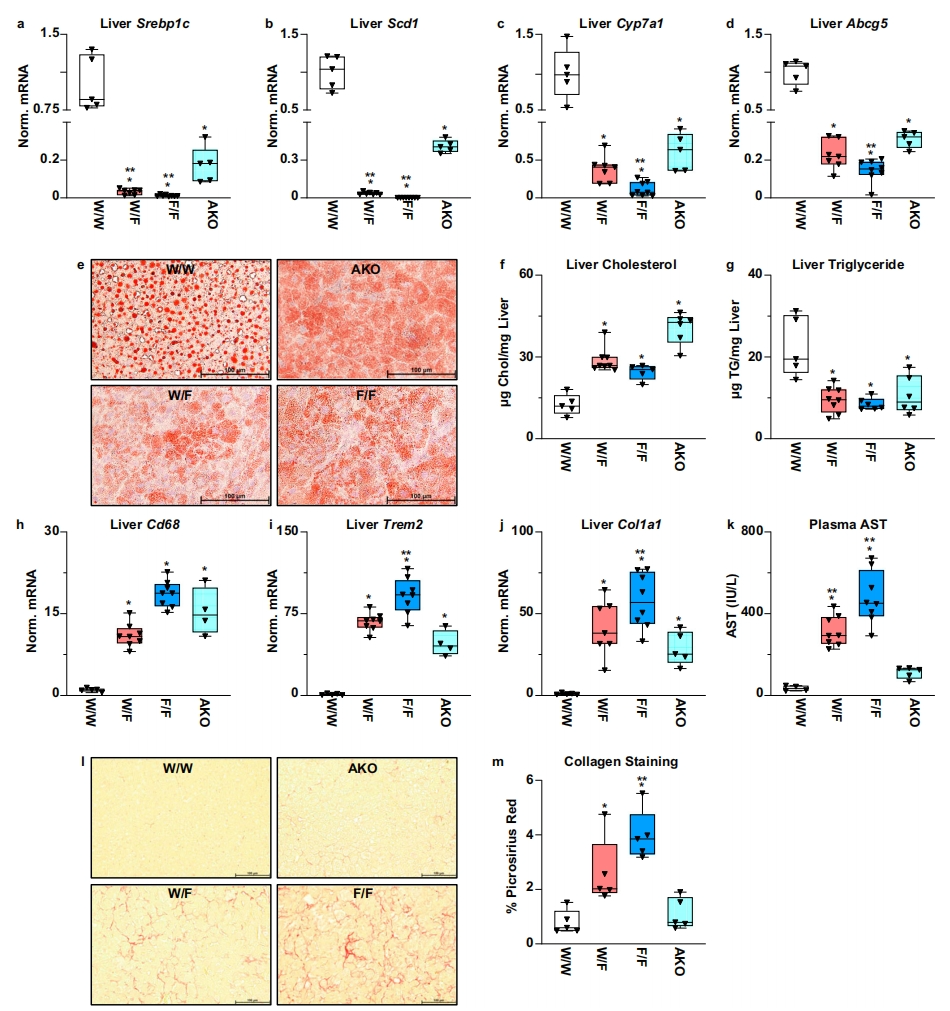
图六 LXRα W441F突变小鼠和LXRα敲除小鼠的比较[11]
LXRα在所有导致MASH的细胞类型中都有表达,包括肝细胞、库普弗细胞、浸润巨噬细胞和肝星状细胞[6]。然而,肝细胞中异常的脂质积累被认为是人类和小鼠模型中MASH的最初驱动因素[2]。为确定LXRα W441F在肝细胞中的选择性表达是否足以促进小鼠的MASH表型,使用CRISPR Cas9在Rosa26基因座插入Cre依赖性Lox-Stop-Lox盒控制表达的FLAG-LXRα W141F(Rosa26-LSL-FLAG-Lxrα W414F)。将Rosa26-LSL-FLAG-Lxrα W414F插入到Lxrαfl/fl小鼠,感染肝细胞特异性甲状腺素结合球蛋白(TBG)启动子驱动表达的Cre AAV,使得Cre介导LXRα W441F表达的同时切除野生型Lxrα等位基因(图七a)。该小鼠正常饮食2周,再换成MASH饮食4周。肝脏蛋白质印迹表明感染TBG-Cre的小鼠表达FLAG-W441F蛋白量是感染TBG-GFP对照组的10倍左右(图七b)。在MASH饮食4周后,该小鼠表现出与W441F突变小鼠基本相同的表型,包括脂质负荷的气球样变肝细胞(图七c和d)、肝脏甘油三酯降低(图七e)、肝脏胆固醇升高(图七f)、弥漫性脂质染色(图七g和h)、胶原蛋白沉积增加(图七i-k)、ALT升高(图七l)、LXR直接靶基因Srebp1c和Abcg5下调(图七m和n),以及浸润巨噬细胞、脂质相关巨噬细胞、纤维化和细胞分裂的标志物上调(图七o-t)。以上数据表明,特异性抑制肝细胞的LXR转录活性足以快速促进MASH相关表型。

图七 肝细胞特异性表达LXRα W441F促进MASH进展[11]
综上所述,研究者证明破坏LXRα感知胆固醇能力的LXRα W441F突变体,即使在杂合状态下也能抑制LXR依赖性转录。暴露于高脂肪、高胆固醇的MASH饮食2周后,W441F突变小鼠就能快速出现人类MASH的特征,表现为肝酶升高、炎症和纤维化,表明肝脏胆固醇积累是驱动MASH炎症和纤维化的一个关键触发因素。突变小鼠MASH饮食2周后,采用长效激动剂重新激活LXR信号,可阻断纤维化的进一步进展,并且完全(杂合子)或部分(纯合子)逆转肝脏损伤和炎症。该研究提供了一种LXRα W441F突变小鼠模型可快速实现MASH造模,助力鉴定促进MASH发展的因素,以及LXR信号下游的潜在治疗靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Hamid O, Eltelbany A, Mohammed A, Alsabbagh Alchirazi K, Trakroo S, Asaad I: The epidemiology of non-alcoholic steatohepatitis (NASH) in the United States between 2010-2020: a population-based study. Annals of hepatology 2022, 27(5):100727.
2. Schwabe RF, Tabas I, Pajvani UB: Mechanisms of Fibrosis Development in Nonalcoholic Steatohepatitis. Gastroenterology 2020,158(7):1913-1928.
3. Jensen T, Abdelmalek MF, Sullivan S, Nadeau KJ, Green M, Roncal C, Nakagawa T, Kuwabara M, Sato Y, Kang DH et al: Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. J Hepatol 2018, 68(5):1063-1075.
4. Puri P, Baillie RA, Wiest MM, Mirshahi F, Choudhury J, Cheung O, Sargeant C, Contos MJ, Sanyal AJ: A lipidomic analysis of nonalcoholic fatty liver disease. Hepatology 2007, 46(4):1081-1090.
5. Athyros VG, Alexandrides TK, Bilianou H, Cholongitas E, Doumas M, Ganotakis ES, Goudevenos J, Elisaf MS, Germanidis G, Giouleme O et al: The use of statins alone, or in combination with pioglitazone and other drugs, for the treatment of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis and related cardiovascular risk. An Expert Panel Statement. Metabolism: clinical and experimental 2017, 71:17-32.
6. Russo-Savage L, Schulman IG: Liver X receptors and liver physiology. Biochimica et biophysica acta Molecular basis of disease 2021, 1867(6):166121.
7. Zhang Y, Breevoort SR, Angdisen J, Fu M, Schmidt DR, Holmstrom SR, Kliewer SA, Mangelsdorf DJ, Schulman IG: Liver LXRα expression is crucial for whole body cholesterol homeostasis and reverse cholesterol transport in mice. The Journal of clinical investigation 2012, 122(5):1688-1699.
8. Griffett K, Burris TP: Development of LXR inverse agonists to treat MAFLD, NASH, and other metabolic diseases. Frontiers in medicine 2023, 10:1102469.
9. Hoffmann TJ, Theusch E, Haldar T, Ranatunga DK, Jorgenson E, Medina MW, Kvale MN, Kwok PY, Schaefer C, Krauss RM et al: A large electronic-health-record-based genome-wide study of serum lipids. Nature genetics 2018, 50(3):401-413.
10. Klarin D, Damrauer SM, Cho K, Sun YV, Teslovich TM, Honerlaw J, Gagnon DR, DuVall SL, Li J, Peloso GM et al: Genetics of blood lipids among ~300,000 multi-ethnic participants of the Million Veteran Program. Nature genetics 2018, 50(11):1514-1523.
11. Clark AT, Russo-Savage L, Ashton LA, Haghshenas N, Amselle NA, Schulman IG: A mutation in LXRα uncovers a role for cholesterol sensing in limiting metabolic dysfunction-associated steatohepatitis. Nature communications2025, 16(1):1102.
12. Liebergall SR, Angdisen J, Chan SH, Chang Y, Osborne TF, Koeppel AF, Turner SD, Schulman IG: Inflammation Triggers Liver X Receptor-Dependent Lipogenesis. Molecular and cellular biology 2020, 40(2):e00364-19.
13. Boergesen M, Pedersen T, Gross B, van Heeringen SJ, Hagenbeek D, Bindesbøll C, Caron S, Lalloyer F, Steffensen KR, Nebb HI et al: Genome-wide profiling of liver X receptor, retinoid X receptor, and peroxisome proliferator-activated receptor α in mouse liver reveals extensive sharing of binding sites. Molecular and cellular biology 2012, 32(4):852-867.
14. Van Rooyen DM, Larter CZ, Haigh WG, Yeh MM, Ioannou G, Kuver R, Lee SP, Teoh NC, Farrell GC: Hepatic free cholesterol accumulates in obese, diabetic mice and causes nonalcoholic steatohepatitis. Gastroenterology 2011, 141(4):1393-1403, 1403.e1391-1395.



