技术分享:肿瘤通过线粒体转移实现免疫逃逸
癌细胞在肿瘤微环境(TME)里可通过多种机制逃避免疫监视,如创造有利于肿瘤进程的免疫抑制分子和细胞[1]。抑制性免疫检查点分子,例如细胞毒性T淋巴细胞抗原-4(CTLA-4)、程序性死亡蛋白1(PD-1)及其配体PD-L1/2,在这一过程中起关键作用。免疫检查点抑制剂(ICI)包括抗PD-1、抗PD-L1和抗CTLA-4单克隆抗体,已在各种癌症类型中改善患者的生存率,但仍有许多患者无法受益或者疗效不能持久[2, 3]。因此,充分认识癌细胞的各种免疫逃逸机制对于提高ICI疗效至关重要。
肿瘤微环境的代谢重编程对于抗肿瘤免疫反应至关重要[4]。肿瘤内的低氧和低葡萄糖环境促进了糖酵解而非氧化磷酸化(OXPHOS)。这种转变影响了T细胞效应功能、耗竭、衰老和记忆形成,使其有助于癌细胞的生存。此外,肿瘤浸润性淋巴细胞(TIL)中的线粒体发生功能障碍,导致代谢不足,随后T细胞进入终末分化耗竭状态[5]。然而,造成TIL线粒体功能障碍的机制尚不清楚。
线粒体DNA(mtDNA)编码了重要蛋白质用于能量生成,但因其修复机制较弱而容易发生突变。mtDNA的许多突变会导致氧化磷酸化受损,促进各种癌症的肿瘤生长和转移[6]。然而,很少有研究探讨它们对于抗肿瘤免疫的影响。线粒体转移可发生在不同细胞之间,进而改变受体细胞的线粒体代谢。体内缺乏mtDNA导致氧化磷酸化受损的癌细胞会从宿主细胞获取线粒体基因组,以恢复线粒体呼吸[7]。有研究揭示癌细胞通过隧道纳米管(TNT)从T细胞获取线粒体,从而阻碍抗肿瘤反应[8]。此外,细胞外囊泡(EV)可以通过与细胞融合实现将线粒体运输到不同的细胞里[9]。尽管在肿瘤微环境中,线粒体可以从癌细胞转移到T细胞,但这一过程的发生率及其对于抗肿瘤免疫的影响尚不清楚。
2025年2月,Nature期刊发表了一项研究,发现肿瘤来源的线粒体转移到肿瘤浸润性淋巴细胞(TIL)中导致线粒体功能障碍以及损害抗肿瘤免疫反应。具体而言,通过分析多种癌症临床样本发现TIL中存在与癌细胞线粒体DNA(mtDNA)相同的突变,这种突变是由携带mtDNA突变的癌细胞通过线粒体转移所获得。T细胞获得癌细胞的mtDNA突变线粒体后,表现出代谢异常和衰老、效应功能和记忆形成缺陷,最终导致体内和体外的抗肿瘤免疫受损。该研究揭示了一种通过线粒体转移逃避癌症免疫的新机制,有助于发展未来癌症免疫疗法。
为理解肿瘤浸润性淋巴细胞(TIL)中线粒体功能障碍的机制,研究者首先对12名不同类型癌症患者的TIL mtDNA进行测序。分析显示,12名患者中有5人TIL存在mtDNA突变(图一a),TIL主要由CD45+ CD3+ T细胞组成,并且分选后的T细胞具有相同的突变(图一b和c)。从7名患者中建立了对应的癌细胞系,其中4名患者的TIL含有mtDNA突变。值得注意的是,这4个TIL中有3个与对应的癌细胞共享相同的突变(图一a和c)。另外,从携带突变mtDNA(3290T>C)的TIL04细胞中建立了一个野生型mtDNA的单个T细胞克隆TIL04#9。电子显微镜成像显示,不携带mtDNA突变的PBL04(匹配的外周血淋巴细胞)和TIL04#9可观察到正常形态的线粒体,而在携带mtDNA突变的TIL04和癌细胞MEL04中发现线粒体形态异常,表现为嵴减少(图一d)。为了确认mtDNA突变不是在培养过程中发生的,研究者分析患者04的甲醛固定石蜡包埋(FFPE)肿瘤组织,发现该组织样本也具有相同的突变(图一e)。以上数据表明,在TIL和对应的癌细胞中,它们的mtDNA存在相同的突变。
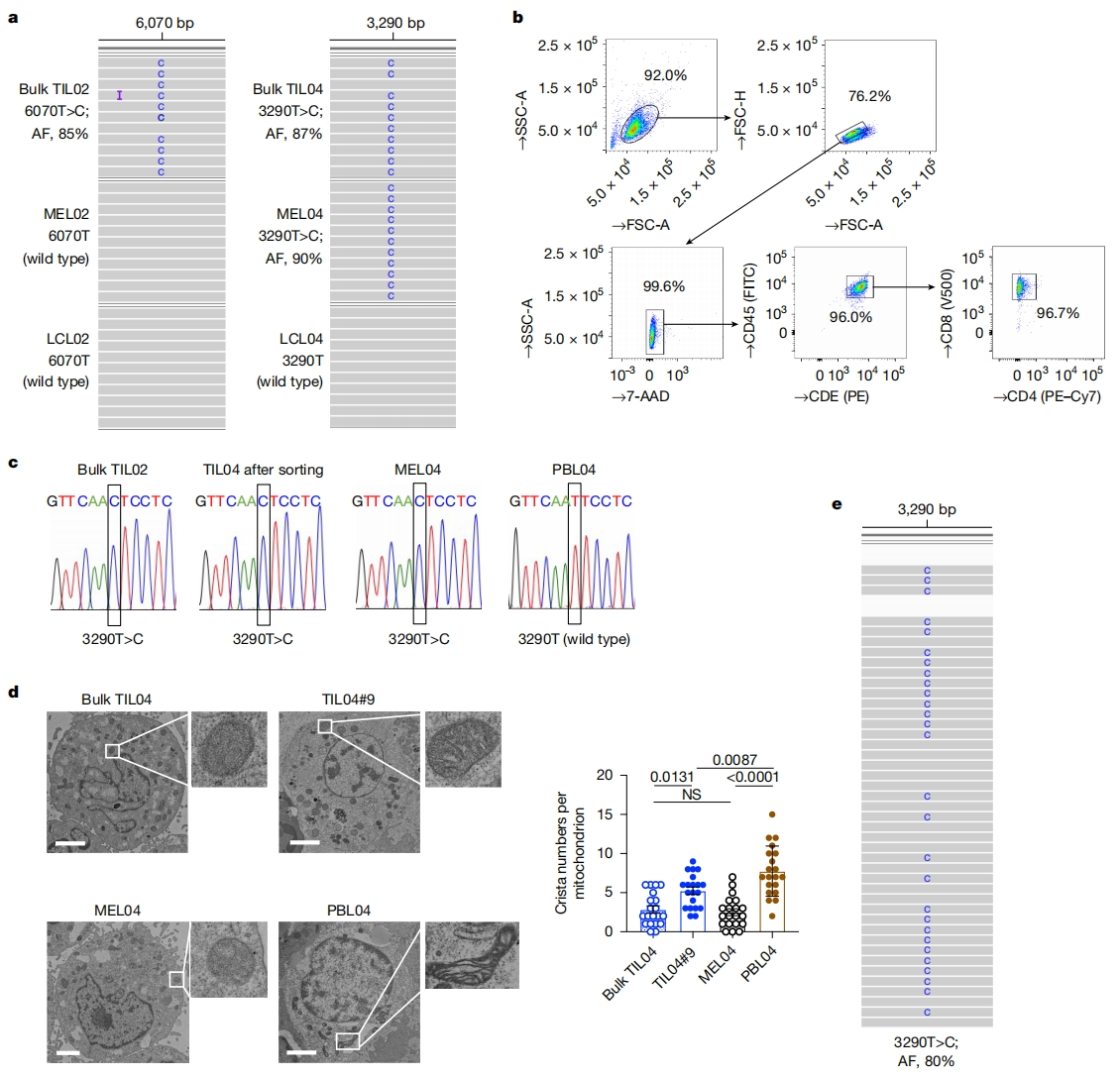
图一 TIL和对应癌细胞共享相同突变的mtDNA [10]
线粒体可以在不同细胞之间发生转移[9]。于是,研究者推测癌细胞和TIL中观察到的相同mtDNA突变可能是由于线粒体转移引起的。为了避免假阳性并准确评估转移过程,将特异性线粒体荧光蛋白MitoDsRed引入MEL02细胞(野生型mtDNA)和MEL04细胞(突变型mtDNA),分别称为MEL02-MitoDsRed和MEL04-MitoDsRed。将TIL与这些癌细胞共培养,24小时内几乎没有发生线粒体转移,而24小时后出现DsRed+ T细胞,表明发生了从癌细胞向T细胞的线粒体转移(图二a和b)。TNT的形成和EV的释放可以促进线粒体转移,研究者在不同条件下评估线粒体转移(图二c)。发现在TNT抑制剂细胞松弛素B处理、避免直接细胞-细胞接触的插入式细胞培养器(3 μm和0.4 μm)培养以及阻止小EV(约200 nm)释放的化合物GW4869处理,都能显著减少线粒体向TIL转移(图二c),表明肿瘤浸润性T细胞通过直接和间接的方式从癌细胞获得线粒体及其mtDNA。
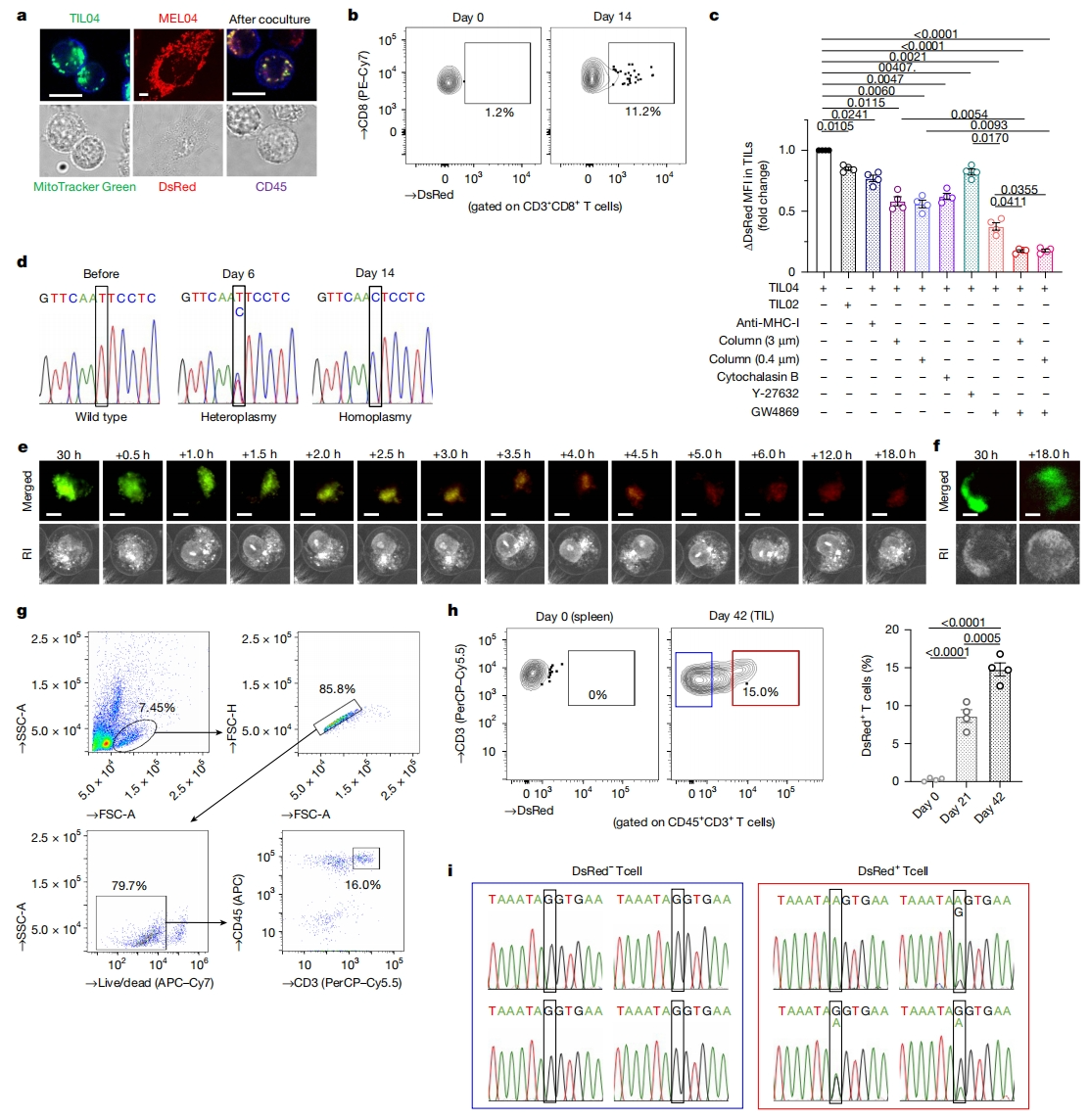
图二 携带mtDNA突变的癌细胞线粒体可转移到TIL中,并逐渐取代原线粒体[10]
接下来,研究者探究线粒体转移后是否发生同质化。在与MEL04细胞共培养后,分选TIL04#9细胞的单个CD45+ CD3+ T细胞,并在不同时间点对单个T细胞的mtDNA进行测序。共培养14天后,部分T细胞中发生了线粒体的同质化替换(图二d)。使用MitoTracker Green标记的TIL04#9细胞与MEL04-MitoDsRed细胞共培养,进行延时成像。在多个TIL中,MitoTracker Green水平逐渐降低,而来自癌细胞的DsRed信号在共培养后逐渐增加。最终,TIL的MitoTracker Green信号被DsRed取代,表明线粒体替换直至均质,并且这种效果得以维持(图二e和f)。进一步确认体内线粒体转移情况,使用携带mtDNA Nd6 13997G>A突变的LLC/A11细胞系,进行MitoDsRed标记。将这个癌细胞接种到C57BL/6J小鼠体内后,在第21天和第42天收集肿瘤并分析TIL,观察到TIL中DsRed+ T细胞的比例逐渐增加,这表明LLC/A11细胞发生了体内线粒体转移(图二g和h)。单细胞分选TIL中的DsRed+ T细胞进行mtDNA测序,发现DsRed+ T细胞中存在单细胞水平的mtDNA突变,其中一些为均质的纯合性突变(图二i)。相比之下,所有DsRed- T细胞都具有野生型mtDNA(图二i)。以上数据表明,线粒体从癌细胞转移到TIL后发生了同质化替代。
研究者进一步探究线粒体转移的同质替代机制。将表达MitoDsRed的癌细胞和T细胞共培养后,可见T细胞中的DsRed逐渐增加;相比之下,MitoTrackerGreen标记的T细胞线粒体数量在共培养后减少(图三a)。癌细胞产生的反应性氧化物(ROS)可在TME中引起周围细胞发生自噬,ROS可被N-乙酰半胱氨酸(NAC)处理所清除。在共培养条件下,NAC处理防止了T细胞原线粒体数量的减少(MitoTracker Green染色),并且未发生线粒体的同质化替代(图三b和c)。用LC3B染色显示,与MEL04-MitoDsRed细胞共培养增强了T细胞的自噬水平,而NAC处理则降低了自噬水平(图三d和e)。分析TIL在获得线粒体后的基因表达情况,与TIL04#9细胞或DsRed-TIL04#9细胞(野生型mtDNA)相比,DsRed+ TIL中与自噬和线粒体应激反应相关的基因表达水平更高(图三f)。采用自噬抑制剂巴佛洛霉素A1阻止了T细胞中原线粒体数量的减少(图三g)。以上结果表明,T细胞的原位线粒体对ROS诱导的自噬敏感,而来自癌细胞的线粒体则具有抗性,这种自噬敏感差异可能导致线粒体转移后的同质化替代。
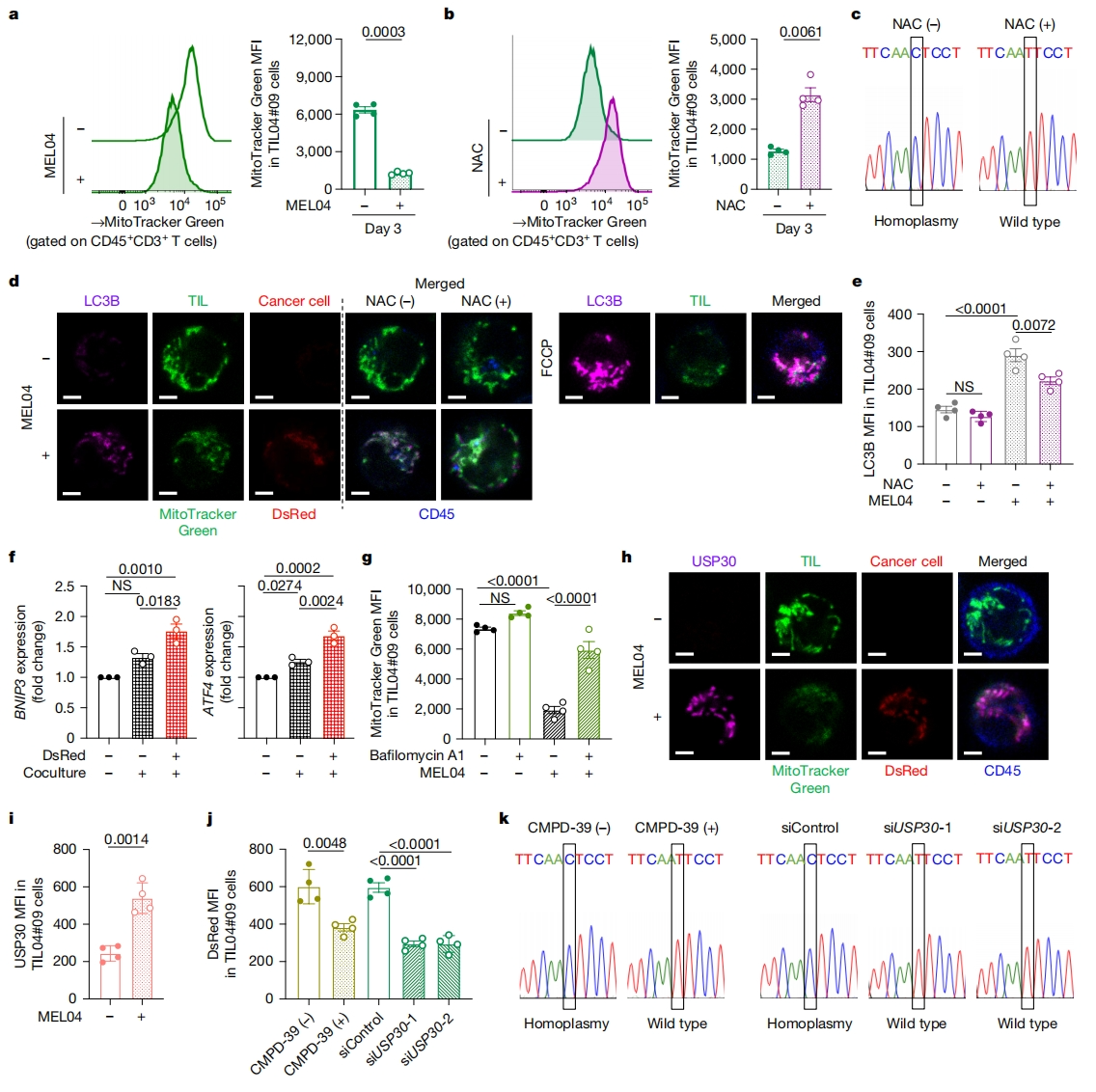
图三 癌细胞线粒体对自噬具有抗性得益于USP30[10]
随后,研究者详细研究造成线粒体自噬敏感性差异的原因,推测与线粒体一起转移的特定癌细胞因子可能赋予T细胞这种抗性。为此,研究者寻找附着在线粒体上的线粒体自噬抑制分子。Parkin介导的泛素化对于线粒体自噬至关重要,去泛素化酶USP30、USP33和USP35可以抑制Parkin介导的线粒体自噬并附着在线粒体上。根据癌症基因组图谱的数据,USP30在黑色素瘤中高表达,并且可以抑制线粒体自噬。正如预期,USP30在癌细胞的表达较高,在突变mtDNA的TIL略有增加,但在野生型mtDNA的TIL和PBL表达较低。与癌细胞共培养后,USP30与癌细胞的线粒体一起转移到TIL(图三h和i)。USP30抑制剂CMPD-39处理可部分减少癌细胞MitoDsRed向TIL的线粒体转移,从而部分阻止了同质化替代(图三j和k)。考虑到CMPD-39可能的非靶向效应,使用了两种针对USP30的siRNA(siUSP30-1和siUSP30-2),也得到了类似的结果(图三j和k)。以上结果表明,得益于抑制线粒体自噬的分子如USP30一同从癌细胞发生转移,使得癌细胞来源线粒体在转移后不会发生自噬,而T细胞的原线粒体由于ROS经历自噬,最终导致线粒体的同质替代。
接下来,研究者评估T细胞接受癌细胞线粒体后的线粒体功能变化。基于DsRed表达,研究与黑色素瘤细胞共培养后,携带野生型线粒体或者mtDNA突变线粒体的TIL功能(图四a)。由于建立的TIL主要由CD8+ T细胞组成,因此主要评估CD8+ T细胞的功能(图一b)。mtDNA突变TIL(DsRed+ TIL04#9/04细胞)膜电位显著降低(图四b),ROS生成显著增加(图四c),增加了β-半乳糖苷酶活性以及衰老分子p16和p53的水平(图四d-f),CD27– CD28– 衰老比例和衰老相关的分泌表型如IL6、CXCL8和IL1B,也有所增加(图四g-j)。一致地,其细胞分裂潜力降低,凋亡更多(图四k和l),CCR7highCD45RAlow中央记忆细胞比例和长寿KLRG1low细胞比例显著减少(图四m和n)。使用抗CD3和抗CD28单克隆抗体刺激T细胞,发现mtDNA突变TIL(DsRed+ TIL04#9/04细胞)的激活标记PD-1和CD69显著减少(图四o和p),表明线粒体功能受损,mtDNA突变TIL无法被有效激活。在乳腺癌细胞MDA-MB-231上重复实验显示出相似的结果。以上结果表明,接受癌细胞来源的mtDNA突变线粒体,使得T细胞变得衰老,且在效应功能和记忆形成方面存在缺陷,同时伴有代谢异常。
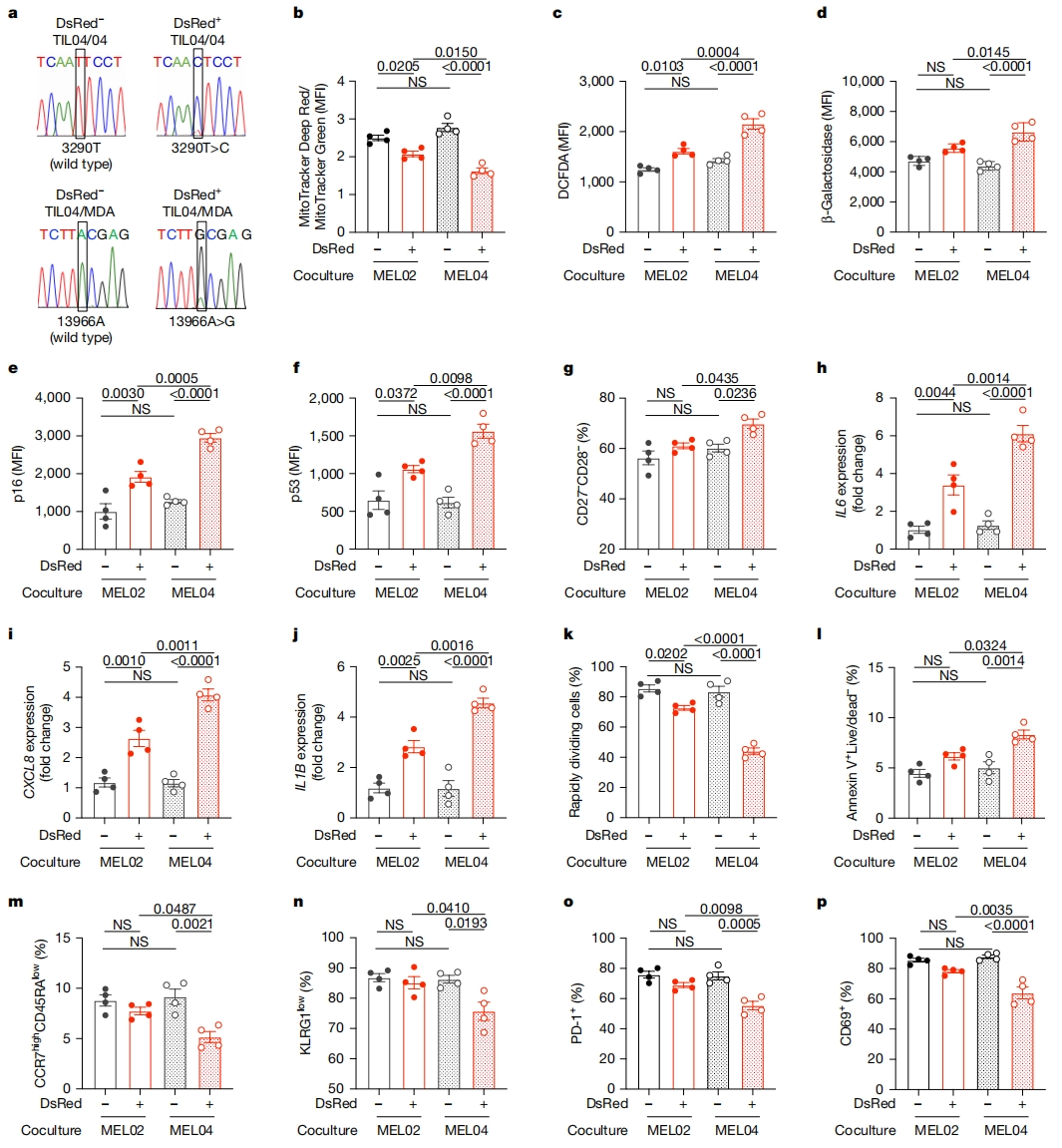
图四 突变mtDNA线粒体转移到TIL后削弱其功能[10]
最后,研究者评估体内效果。将MitoDsRed引入携带野生型mtDNA的小鼠Lewis肺癌LLC/P29细胞,在移植后第42天分析LLC/P29-MitoDsRed和LLC/A11-MitoDsRed(携带mtDNA突变)肿瘤中的TIL。LLC/P29和LLC/A11肿瘤中CD8+ T细胞浸润情况相当,肿瘤浸润CD8+ T细胞中DsRed的表达也相当(图五a)。与野生型mtDNA LLC/P29细胞相比,DsRed+ CD8+ T细胞在接受了LLC/A11肿瘤mtDNA突变线粒体后,表现出显著更高的β-半乳糖苷酶活性,更易发生凋亡(图五b和c),CD127highKLRG1low长寿记忆前体效应T细胞(MPEC)比例降低(图五d),PD-1表达显著降低(图五e),TIM3高表达而TCF1低表达的耗竭表型比例增多(图五f),与体外实验结果类似。此外,将LLC/P29或LLC/A11肿瘤移植到OT-1小鼠体内,从TIL中收集DsRed+ CD8+ T细胞,进行OVA过表达癌细胞的杀伤试验。与野生型mtDNA LLC/P29细胞相比,LLC/A11细胞mtDNA突变的线粒体转移显著降低了细胞毒性活性(图五g)。值得注意的是,LLC/P29肿瘤对PD-1阻断有反应,而mtDNA突变的LLC/A11肿瘤没有反应,且PD-1阻断不影响线粒体转移(图五h)。使用EV释放抑制剂GW4869处理这些肿瘤,减少了线粒体转移的发生,进而降低β-半乳糖苷酶活性和减少细胞凋亡(图五i-k),增加了TIL中MPEC和PD-1+ CD8+ T细胞的比例(图五l和m),逆转了耗竭表型(图五n)。GW4869处理抑制了LLC/A11肿瘤生长,但不影响LLC/P29肿瘤生长,并克服了LLC/A11肿瘤对PD-1阻断的抵抗(图五h)。以上结果表明,接受癌细胞转移的mtDNA突变线粒体导致T细胞功能障碍,降低其抗肿瘤免疫,包括PD-1阻断免疫。
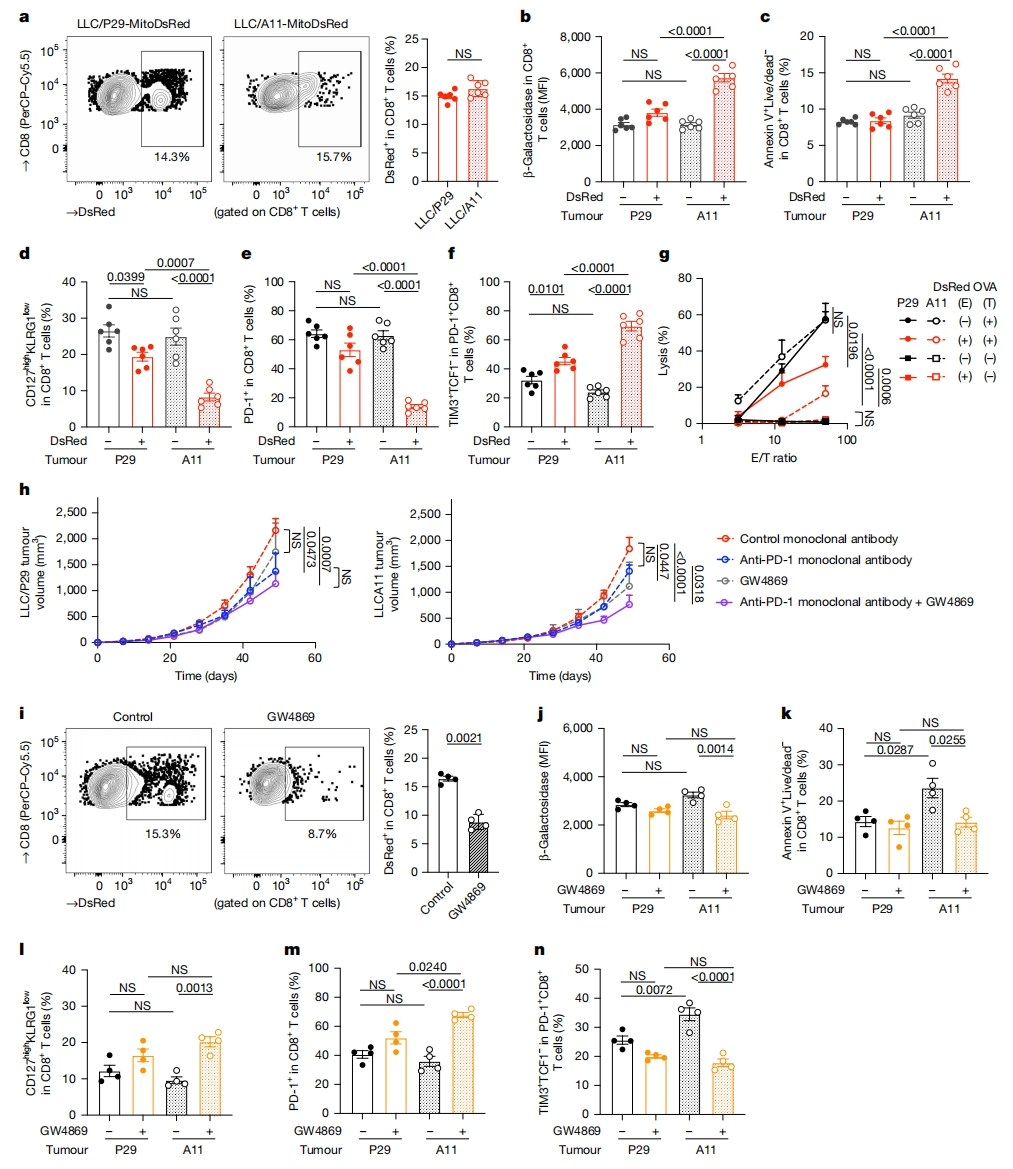
图五 接受mtDNA突变线粒体会降低体内抗肿瘤免疫[10]
综上所述,研究者分析了各种癌症类型的临床样本,发现肿瘤浸润性淋巴细胞(TIL)中存在和癌细胞一样的线粒体DNA(mtDNA)突变,证明了这种突变是通过癌细胞线粒体转移所获得。癌细胞将mtDNA突变线粒体转移到TIL中,导致TIL线粒体功能障碍并损害其体内抗肿瘤免疫。具体来说,携带mtDNA突变线粒体的T细胞表现出代谢异常和衰老,效应功能和记忆形成缺陷,进而影响PD-1阻断免疫。已知癌细胞可从宿主细胞劫持正常线粒体来支持自身生长,这一发现丰富了反向输出的结果,揭示了癌细胞也能将mtDNA突变的线粒体转移到宿主细胞来实现免疫逃逸,为未来开发免疫疗法提供了新的方向。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Schreiber RD, Old LJ, Smyth MJ: Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion. Science 2011, 331(6024):1565-1570.
2. Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, Powderly JD, Carvajal RD, Sosman JA, Atkins MB et al: Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. The New England journal of medicine 2012, 366(26):2443-2454.
3. Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A: Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell 2017, 168(4):707-723.
4. DePeaux K, Delgoffe GM: Metabolic barriers to cancer immunotherapy. Nature reviews Immunology 2021, 21(12):785-797.
5. Scharping NE, Menk AV, Moreci RS, Whetstone RD, Dadey RE, Watkins SC, Ferris RL, Delgoffe GM: The Tumor Microenvironment Represses T Cell Mitochondrial Biogenesis to Drive Intratumoral T Cell Metabolic Insufficiency and Dysfunction. Immunity 2016, 45(3):701-703.
6. Yuan Y, Ju YS, Kim Y, Li J, Wang Y, Yoon CJ, Yang Y, Martincorena I, Creighton CJ, Weinstein JN et al: Comprehensive molecular characterization of mitochondrial genomes in human cancers. Nature genetics 2020, 52(3):342-352.
7. Zhang H, Yu X, Ye J, Li H, Hu J, Tan Y, Fang Y, Akbay E, Yu F, Weng C et al: Systematic investigation of mitochondrial transfer between cancer cells and T cells at single-cell resolution. Cancer cell 2023, 41(10):1788-1802.e1710.
8. Saha T, Dash C, Jayabalan R, Khiste S, Kulkarni A, Kurmi K, Mondal J, Majumder PK, Bardia A, Jang HL et al: Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells. Nature nanotechnology 2022, 17(1):98-106.
9. Takenaga K, Koshikawa N, Nagase H: Intercellular transfer of mitochondrial DNA carrying metastasis-enhancing pathogenic mutations from high- to low-metastatic tumor cells and stromal cells via extracellular vesicles. BMC molecular and cell biology 2021, 22(1):52.
10. Ikeda H, Kawase K, Nishi T, Watanabe T, Takenaga K, Inozume T, Ishino T, Aki S, Lin J, Kawashima S et al: Immune evasion through mitochondrial transfer in the tumour microenvironment. Nature 2025, 638(8049):225-236.



