技术分享:抑制肝脏草酸过量生成可改善代谢功能障碍相关脂肪性肝炎(MASH)
代谢功能障碍相关脂肪性肝病(MASLD)已成为最常见的慢性肝病,影响了全球三分之一的人口[1]。MASLD包括一系列肝脏病理,从单纯的肝脏脂肪变性,到伴有肝纤维化的代谢功能障碍相关脂肪性肝炎(MASH),发展为肝硬化,最终导致肝细胞癌和肝功能衰竭[2]。在MASH发病机制中,肝脏脂质过载主要由于过度摄取脂肪组织释放的脂肪酸,过量摄入的碳水化合物导致脂肪从头生成的增强,或者脂肪酸β氧化(FAO)被抑制。这些都会导致活性氧积累、线粒体功能障碍和内质网应激,最终导致脂毒性[3]。进而,激活炎症小体使得促炎因子释放与积累,促进白细胞浸润和肝星状细胞活化,进一步加快MASH和肝纤维化[2]。尽管关于MASH的代谢分子机制研究已取得了重大进展,以及在开发针对脂质和碳水化合物代谢药物方面已投入相当大的努力,但是可用于治疗MASH的药物仍然有限。
脂质和碳水化合物的代谢异常是MASLD特征之一。越来越多的研究表明,氨基酸代谢受损也与MASH发病机制有关。在患者和小鼠疾病模型中,低的循环甘氨酸始终与恶化的MASH特征有关,缺乏甘氨酸加速了小鼠疾病进程[4]。肝脏特异表达的丙氨酸-乙醛酸转氨酶(AGXT)在催化乙醛酸形成甘氨酸方面起着重要的作用。转录组分析报道MASH患者和小鼠肝脏中AGXT被抑制表达[5]。AGXT功能丧失可导致乙醛酸积累[6],乙醛酸也可通过乙醇酸氧化酶(GO)产生,并被肝脏乳酸脱氢酶(LDHA)迅速转化为终端产物草酸,导致原发性高草酸尿症[7]。鉴于草酸在肾脏和心血管疾病中的有害作用[8],以及上升的MASH患病率和有限的可用治疗手段[1],最近研究将AGXT功能障碍与原发性高草酸尿症和肝病联系起来[5]。因此,深入了解MASH中草酸代谢受损情况,并评估针对这种失调代谢途径的治疗潜力显得尤为重要。
2024年10月,Nature metabolism期刊发表了一篇文章,系统性评估了多个人群队列、MASH小鼠模型和肝细胞体外系统中肝脏草酸的代谢水平和调节机制,发现抑制肝脏草酸过量生成可改善代谢功能障碍相关脂肪性肝炎(MASH)。具体而言,在MASH患者和小鼠的肝脏中,AGXT受到抑制,LDHA被激活,导致草酸过量生产。过量的草酸通过抑制过氧化物酶体增殖物激活受体α(PPARα)和脂肪酸β氧化(FAO)促进肝细胞脂肪变性,并通过C-C基序趋化因子配体2诱导单核细胞趋化。利用肝细胞特异性过表达AGXT和药理学抑制草酸生成,可增强FAO,抑制肝脏脂肪变性,减弱肝脏炎症和纤维化,改善MASH。该研究确定了MASH中新的代谢失调通路及其分子机制,为治疗MASH提供了新的潜在靶点[9]。
首先,研究者评估MASH肝脏中乙醛酸代谢和草酸形成关键调节因子的表达(图一a)。乙醇酸、甘氨酸和4-羟基-L-脯氨酸是乙醛酸的前体,乙醛酸可以被LDHA氧化为草酸盐。尽管人类没有能够降解草酸的酶,但特定的肝脏酶可以通过乙醛酸解毒防止草酸过量产生[7]。除了通过AGXT转化为甘氨酸外,乙醛酸还可以通过乙醇酸还原酶/羟基丙酮酸还原酶(GRHPR)转化为乙醇酸。在相反的反应中,乙醇酸可以被GO(由HAO1编码)氧化为乙醛酸。此外,4-羟脯氨酸脱氢酶(HYPDH,由PRODH2编码)将4-羟基-L-脯氨酸转化为4-羟基-2-酮戊二酸,再被4-羟基-2-酮戊二酸醛缩酶1(HOGA1)催化成乙醛酸[7]。研究者在206名肝移植供体(GSE26106)的队列中确定了上述基因的表达与肝脏脂肪变性之间的关系[5]。结果显示,AGXT和PRODH2的表达与肝脏脂肪含量呈负相关,其中AGXT的负相关最为显著(图一a)。通过回归模型和基于有或没有MASH(GSE83452和GSE61260)肝脏转录组学分析,进一步评估调节乙醛酸代谢或草酸形成的基因表达与MASH之间的关系,发现在所有乙醛酸盐/草酸盐酸代谢基因中,只有AGXT的表达与MASH呈显著负相关(图一a)。组织学证实终末期MASH患者肝脏标本中草酸代谢失调(图一b)。qRT-PCR分析显示,这些终末期MASH患者肝脏标本中AGXT显著下调,而其他调节乙醛酸代谢或草酸形成的基因GRHPR、PRODH2、HOGA1、HAO1和LDHA没有显著变化(图一c)。此外,AGXT蛋白的丰度显著降低(图一d和e),LDHA的活性显著增强(图一f),草酸浓度显著增加(图一g)。随后,研究者探究MASH小鼠肝脏中能否观察到这些现象,将雄性C57BL/6J小鼠喂食标准饮食(对照组)或高脂肪、高果糖、高胆固醇饮食(MASH饮食)24周(图一h)。MASH饮食模型会诱导早期MASH,表现为肝脂肪变性,在第12周会出现轻度炎症和纤维化,在第24周会出现晚期脂肪性肝炎和纤维化,这与人类疾病相似[5]。使用苏木精和伊红(H&E)和天狼星红染色证实了这一点(图一i)。在晚期MASH的小鼠肝脏中,发现AGXT的抑制(图一j-l)、LDHA的上调(图二j)、LDH活性的增强(图一m)和肝脏草酸的增加(图一n)更为显著。为进一步确定肝细胞中的脂质负荷是否足以抑制AGXT并增强体外草酸积累,研究者从正常饮食小鼠中分离出原代肝细胞,用BSA偶联的棕榈酸(PA)处理诱导肝细胞中脂质积累,发现原代肝细胞AGXT的蛋白质丰度显著降低(图一o和p)。在HepG2人肝癌细胞系中得到相同的结果,该细胞系在很大程度上保留了乙醛酸代谢的生化途径(图一o和p)。此外,脂质负荷在原代肝细胞中诱导了细胞内草酸的显著积累(图一q)。以上数据表明,在多个人群队列和MASH小鼠以及脂质负荷的肝细胞中都证实MASH患者和小鼠肝脏AGXT受到抑制,LDHA活性增强,草酸过量产生。
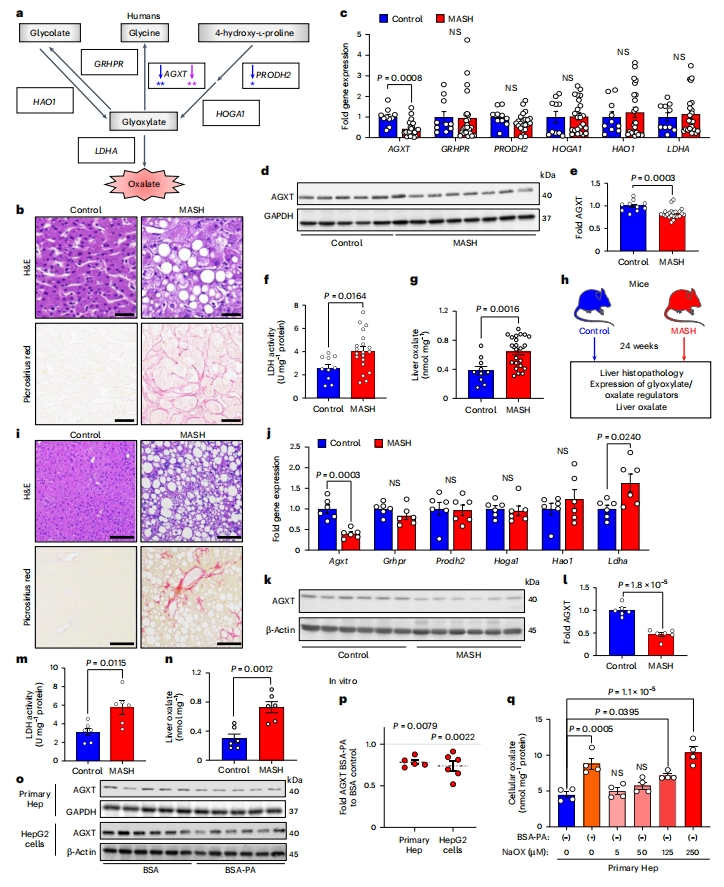
图一 MASH患者和小鼠肝脏的AGXT被抑制,LDHA被激活,草酸含量增加[9]
基于上述结果,研究者探究在肝细胞中过表达AGXT能否通过降低草酸来改善MASH。给C57BL/6J小鼠注射由肝细胞特异性甲状腺素结合球蛋白(TBG)启动子驱动的AAV8-AGXT或AAV8-GFP(对照组)[10],并进行MASH饮食喂养24周(图二a)。结果显示,AAV8-AGXT处理组小鼠肝脏中AGXT的过表达(图二b和c)与草酸盐的显著减少(图二d)相一致。虽然过表达AGXT组小鼠体重没有显著差异(图二e),但与对照小鼠相比,它们的肝脏重量(图二f)和肝脏与体重比(图二g)显著降低,肝损伤的生物标志物天冬氨酸氨基转移酶(AST;图二h)和丙氨酸氨基转移酶(ALT;图二i)显著降低。H&E染色组织病理学分析显示,肝脂肪变性、小叶炎症和整体NAS评分显著降低(图二j和k)。值得注意的是,在喂食标准食物的AAV8-AGXT或AAV8-GFP处理组小鼠之间,上述肝损伤指标没有显著差异,肝细胞特异性AGXT过表达导致肝草酸轻度减少,但没有统计学意义。以上数据表明,通过肝细胞特异性过表达AGXT来降低MASH中肝脏草酸的过量产生,可以显著降低MASH疾病的严重程度。
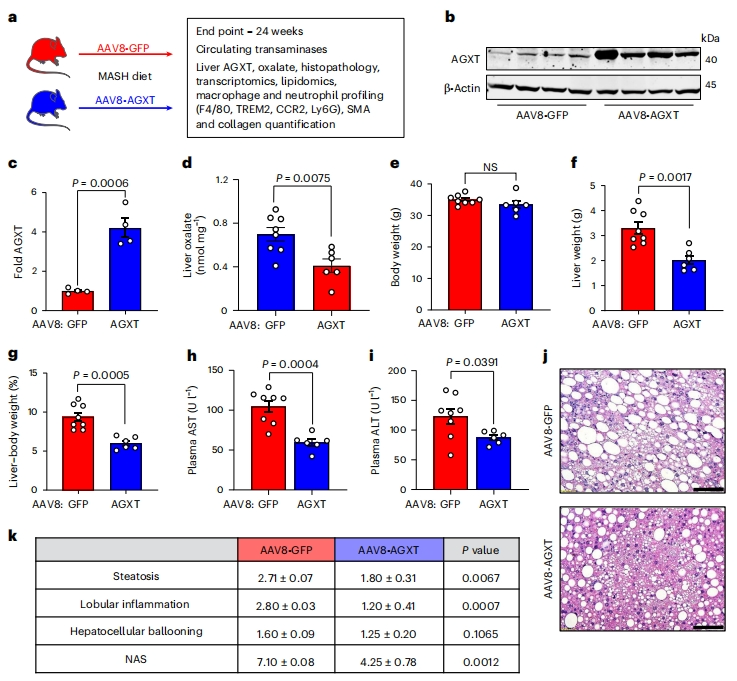
图二 通过肝细胞特异性过表达AGXT来降低草酸可改善MASH[9]
随后,研究者探索AGXT过表达降低草酸改善MASH的潜在机制。在MASH饮食24周后将AAV8-GFP或AAV8-AGXT处理组小鼠肝脏进行无偏倚的RNA测序。主成分分析(PCA)显示,AAV8-AGXT处理组小鼠肝脏的基因表达模式与对照小鼠不同(图三a),有707个差异表达基因(DEG),其中508个显著下调,199个显著上调(图三b)。KEGG通路分析显示,上调基因主要富集在过氧化物酶体通路以及与FAO相关的其他关键通路,包括脂肪酸降解和过氧化物酶体增殖物激活受体(PPAR)信号通路(图三c)。RNA测序分析(图三d)以及qRT-PCR(图三e)证实,驱动肝脏FAO的关键基因,包括FAO的主调节因子Ppara、PPARγ辅激活因子-1α(Ppargc1a)和许多PPARɑ靶基因Cpt1a、Acadm、Acadl、Acadvl、Acox1、Hadha、Hadhb、Acaa2和Acsl1 [11]在过表达AGXT小鼠肝脏中显著上调。油红O染色法发现,过表达AGXT组小鼠肝脏的中性脂质积累显著减少(图三f和g)。非靶向脂质组学PCA显示,AAV8-AGXT处理组小鼠肝脏的整体脂质组与对照小鼠不同(图三h),表现为饱和脂肪酸减少,不饱和脂肪酸(PUFA)增加(图三i)。研究者还探究了草酸对肝细胞脂质代谢的影响,发现在肝细胞中过量产生和积累的草酸是通过抑制PPARα和减弱线粒体呼吸中脂肪酸的转运和利用来诱导脂质积累。此外,诱导调节FAO和线粒体呼吸的基因可减少肝细胞的脂质积累。
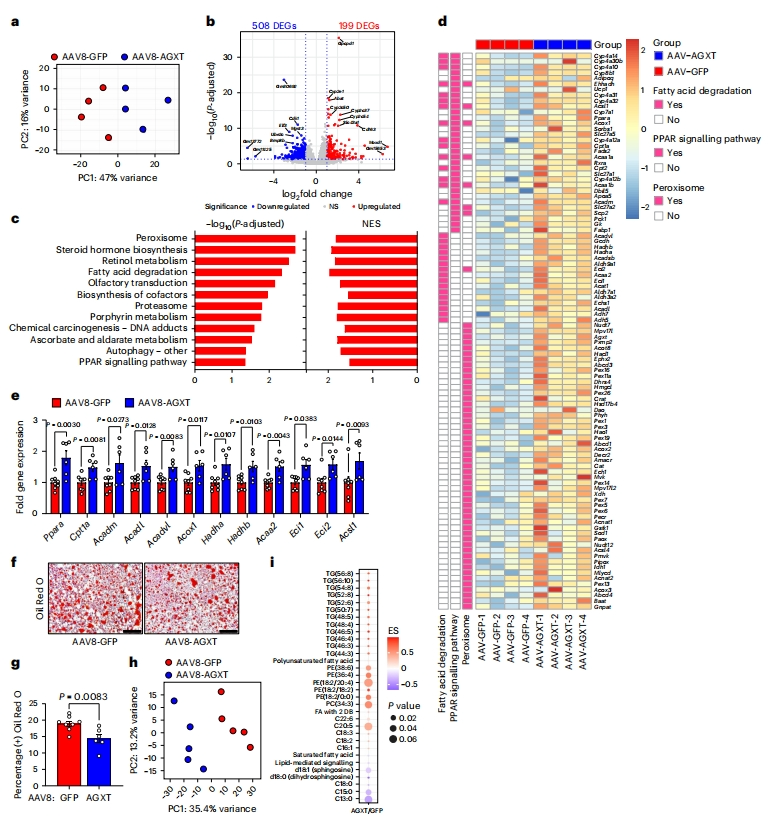
图三 肝细胞特异性过表达AGXT通过诱导脂肪酸β-氧化途径抑制肝脏脂肪变性[9]
与AAV8-GFP处理组小鼠相比,MASH饮食诱导AAV8-AGXT处理组小鼠表现出小叶炎症的显著减少(图二j和k)。因此,基于肝脏RNA测序的KEGG通路分析显示,炎症涉及的多种通路显著下调,包括趋化因子信号传导、细胞因子-细胞因子受体相互作用,以及核因子(NF)-κB和肿瘤坏死因子(TNF)信号传导通路(图四a)。RNA测序分析(图四b)和qRT-PCR(图四c)证实,过表达AGXT组小鼠肝脏中NF-κB和TNF信号通路的关键基因显著减少,包括Nfkb2、Relb、Tnf以及趋化因子(C-C基序)配体2(Ccl2)和Ccl5,它们被称为MASH的驱动和治疗靶点,与Ccr2一起调节MASH中单核细胞来源细胞的募集[12]。免疫荧光发现,AAV8-AGXT处理组小鼠肝脏的F4/80+CCR2+ 巨噬细胞和F4/80+ TREM2+巨噬细胞的水平显著降低,招募的单核细胞衍生巨噬细胞的不同亚群浸润肝脏并形成围绕肝细胞的冠状结构,周围有大的脂滴(图四d-g)[13]。这些结果表明,降低草酸会减缓单核细胞向肝脏的募集。于是研究者评估草酸的潜在趋化作用。将HepG2细胞经草酸钠(NaOX)处理置于Transwell的下层,测量荧光标记的人原代血单核细胞(hPBM)的向下迁移情况(图四i)。与对照细胞相比,经NaOX处理的HepG2细胞中CCL2上调(图四h),单核细胞向含NaOX处理HepG2细胞的下层孔迁移的数量显著增加(图四j)。为测试CCL2是否介导草酸的趋化作用,用siCCL2敲降HepG2细胞的CCL2,再次测量hPBM的迁移情况(图四i)。结果显示,在对照处理的HepG2细胞中,NaOX导致单核细胞迁移显著增加,而CCL2敲降显著减弱了这一作用(图四j)。以上数据表明,草酸盐通过上调肝细胞CCL2促进单核细胞趋化,而过表达AGXT可降低MASH中草酸盐的过量产生,进而减弱单核细胞浸润和肝脏炎症。
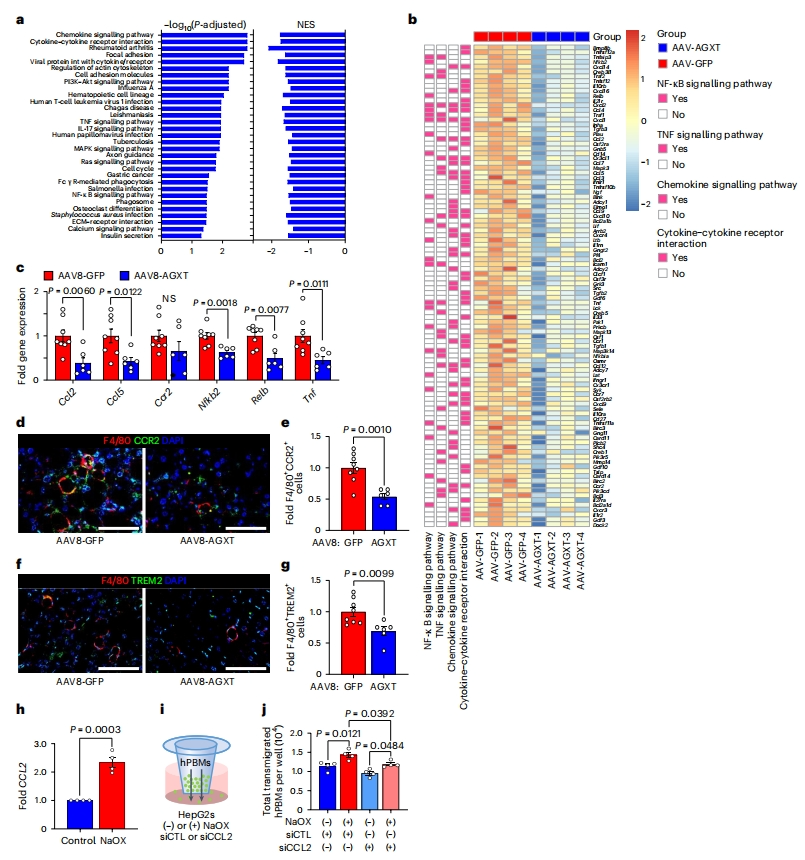
图四 过表达AGXT降低草酸可减弱MASH的单核细胞浸润和肝脏炎症[9]
肝纤维化是MASH患者肝脏相关事件和死亡率的主要决定因素[14]。RNA测序分析(图五a)和qRT-PCR(图五b)证实,在过表达AGXT组小鼠中,转化生长因子TGF-β信号通路基因以及与ECM重塑相关的关键基因显著下调[15]。天狼星红染色的组织病理学分析显示,过表达AGXT组小鼠胶原积聚相比对照组显著减少(图五c和d),纤维化评分降低(图五e)。这些发现通过测定肝脏羟脯氨酸含量得到了证实,过表达AGXT组小鼠肝脏羟脯氨酸含量显著降低(图五f)。同时,α-平滑肌肌动蛋白(SMA)的免疫荧光显示,在AAV8-AGXT处理组小鼠肝脏中,驱动纤维化的主要细胞肝星状细胞减少[15](图五g和h)。以上数据表明,在MASH中过表达AGXT降低草酸含量可以减少肝纤维化。
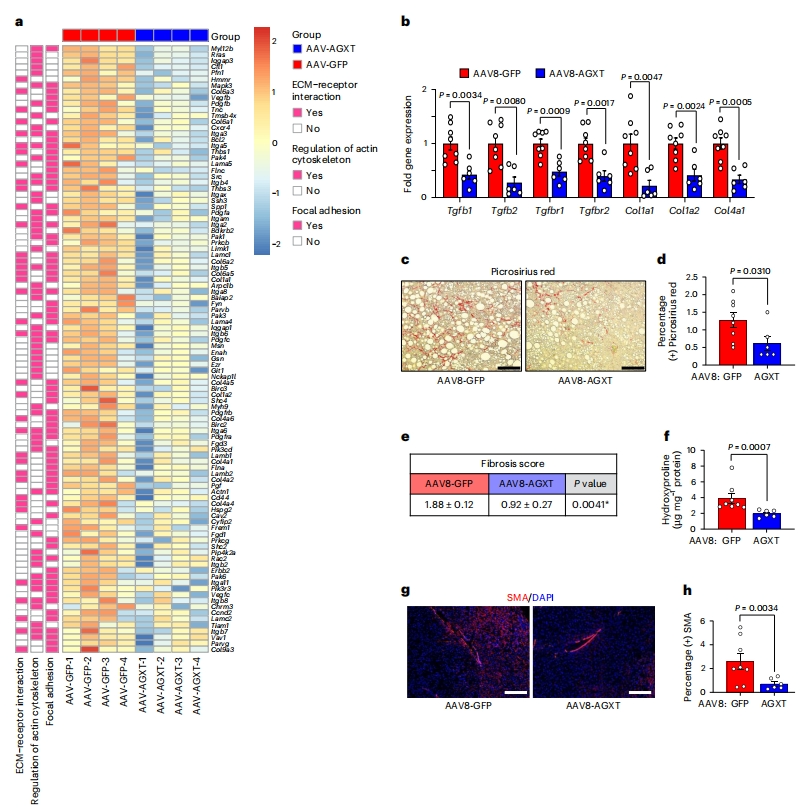
图五 过表达AGXT降低草酸可降低MASH的肝纤维化[9]
鉴于AGXT过表达降低了肝脏草酸过量产生并预防了MASH,研究者评估在已建立的MASH中药物靶向肝脏草酸过量产生的治疗价值。研究者利用其开发的水杨酸衍生物MDMG-935P(图六a),它通过抑制GO和LDHA来有效减少草酸的产生[16]。在已建立MASH的小鼠中测试MDMG-935P,小鼠MASH饮食12周后,治疗组每天服用5或10 mg/kg的MDMG-935P,持续12周(图六b)。在24周终点时,与对照组相比,10 mg/kg MDMG-935P治疗组显著降低了肝脏LDH活性(图六c)和草酸水平(图六d),虽然体重没有明显变化(图六e),但显著降低了肝脏与体重比(图六f)。此外,肝损伤的循环标志物AST(图六g)和ALT(图六h)显著降低,脂肪变性、小叶炎症、肝细胞气球样变和整体NAS显著减少(图六i和j), 肝脏甘油三酯显著降低(图六k), 调节FAO的基因显著上调(图六l)。以上数据表明,通过抑制GO和LDHA来抑制MASH中的肝脏草酸,可以增强FAO和降低肝脏脂肪变性。
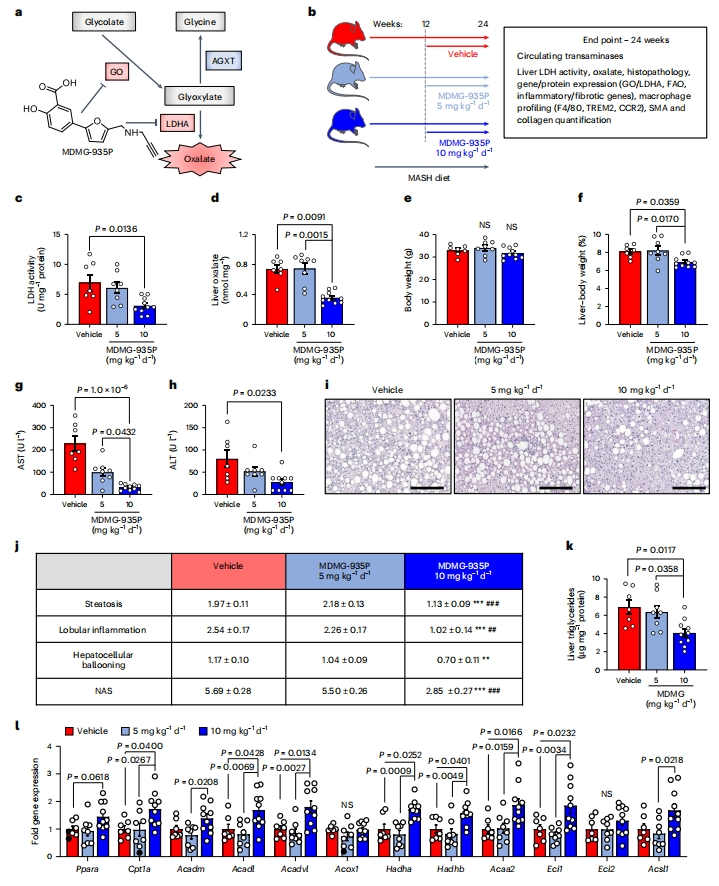
图六 药理学抑制肝脏草酸过量产生可改善MASH[9]
考虑到AGXT过表达减轻了MASH中的肝脏炎症和纤维化,最后研究者药理学抑制已建立MASH的肝脏草酸过量产生,检测是否足以抑制促炎和纤维化。与AGXT过表达小鼠组研究结果相一致,10 mg/kg MDMG-935P治疗组小鼠的驱动促炎反应的关键趋化因子和细胞因子的表达显著降低,包括Ccl2、Ccl5和Tnf(图七a)。F4/80的免疫荧光显示,10 mg/kg MDMG-935P治疗组小鼠相比对照组的肝脏巨噬细胞显著减少(图七b和c),巨噬细胞亚群的免疫荧光分析显示募集的单核细胞衍生的F4/80+CCR2+ 巨噬细胞显著减少(图七d和e)。此外,还显著降低了TGFβ信号传导和ECM重塑途径中关键基因的表达(图七f)。这些发现与组织病理学分析以及纤维化的生化评估相一致,天狼星红染色(图七g和i)、SMA免疫荧光(图七h和j)和肝脏羟脯氨酸含量(图七k)显著降低。纤维化评分评估显示呈下降趋势,但未达到统计学意义(图七l)。以上数据表明,在已建立MASH的小鼠中,药理学抑制草酸过量产生可以抑制草酸诱导的促炎反应和肝纤维化。
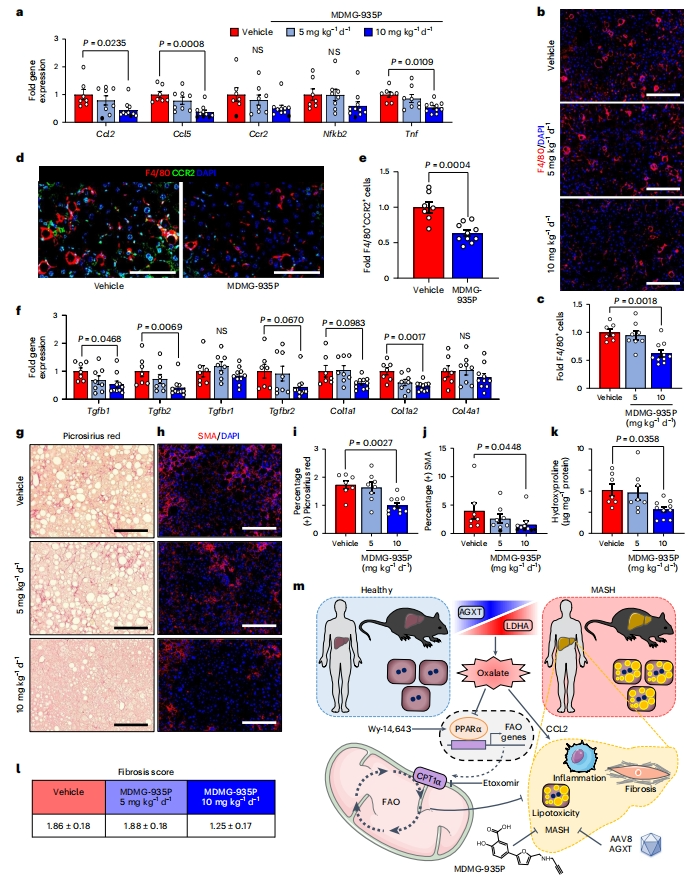
图七 药理学抑制肝脏草酸过量产生可减少肝脏炎症和纤维化[9]
综上所述,该研究利用多个人类队列、MASH小鼠模型和肝细胞系统,结合乙醛酸-草酸代谢的遗传学和药理学操纵,揭示了MASH期间肝细胞中草酸过量产生的分子和代谢机制。在MASH患者和小鼠肝脏中,AGXT被抑制,LDHA被激活,出现草酸过量生成。通过肝脏特异性过表达AGXT和药理学降低MASH中的肝脏草酸含量,可诱导PPARα驱动的FAO增强,抑制单核细胞趋化性、NF-κB和TGFβ靶点,最终改善肝脏脂肪变性、炎症和纤维化(图七m)。该研究确定了MASH中新的代谢失调通路及其分子机制,强调了抑制肝脏草酸过量生成是治疗MASH的一个潜在新靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Riazi K, Azhari H, Charette JH, Underwood FE, King JA, Afshar EE, Swain MG, Congly SE, Kaplan GG, Shaheen AA: The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis. The lancet Gastroenterology & hepatology 2022, 7(9):851-861.
2. Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K, Rinella M, Harrison SA, Brunt EM, Sanyal AJ: The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology 2018, 67(1):328-357.
3. Cusi K: Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications. Gastroenterology 2012, 142(4):711-725.e716.
4. Ghrayeb A, Finney AC, Agranovich B, Peled D, Anand SK, McKinney MP, Sarji M, Yang D, Weissman N, Drucker S et al: Serine synthesis via reversed SHMT2 activity drives glycine depletion and acetaminophen hepatotoxicity in MASLD. Cell metabolism 2024, 36(1):116-129.e117.
5. Rom O, Liu Y, Liu Z, Zhao Y, Wu J, Ghrayeb A, Villacorta L, Fan Y, Chang L, Wang L et al: Glycine-based treatment ameliorates NAFLD by modulating fatty acid oxidation, glutathione synthesis, and the gut microbiome. Science translational medicine 2020, 12(572).
6. Salido EC, Li XM, Lu Y, Wang X, Santana A, Roy-Chowdhury N, Torres A, Shapiro LJ, Roy-Chowdhury J: Alanine-glyoxylate aminotransferase-deficient mice, a model for primary hyperoxaluria that responds to adenoviral gene transfer. Proc Natl Acad Sci U S A 2006, 103(48):18249-18254.
7. Salido E, Pey AL, Rodriguez R, Lorenzo V: Primary hyperoxalurias: disorders of glyoxylate detoxification. Biochimica et biophysica acta 2012, 1822(9):1453-1464.
8. Ermer T, Nazzal L, Tio MC, Waikar S, Aronson PS, Knauf F: Oxalate homeostasis. Nature reviews Nephrology 2023, 19(2):123-138.
9. Das S, Finney AC, Anand SK, Rohilla S, Liu Y, Pandey N, Ghrayeb A, Kumar D, Nunez K, Liu Z et al: Inhibition of hepatic oxalate overproduction ameliorates metabolic dysfunction-associated steatohepatitis. Nature metabolism 2024, 6(10):1939-1962.
10. Liu Y, Zhao Y, Shukha Y, Lu H, Wang L, Liu Z, Liu C, Zhao Y, Wang H, Zhao G et al: Dysregulated oxalate metabolism is a driver and therapeutic target in atherosclerosis. Cell reports 2021, 36(4):109420.
11. Rakhshandehroo M, Knoch B, Müller M, Kersten S: Peroxisome proliferator-activated receptor alpha target genes. PPAR research 2010, 2010:612089.
12. Krenkel O, Puengel T, Govaere O, Abdallah AT, Mossanen JC, Kohlhepp M, Liepelt A, Lefebvre E, Luedde T, Hellerbrand C et al: Therapeutic inhibition of inflammatory monocyte recruitment reduces steatohepatitis and liver fibrosis. Hepatology 2018, 67(4):1270-1283.
13. Daemen S, Gainullina A, Kalugotla G, He L, Chan MM, Beals JW, Liss KH, Klein S, Feldstein AE, Finck BN et al: Dynamic Shifts in the Composition of Resident and Recruited Macrophages Influence Tissue Remodeling in NASH. Cell reports 2021, 34(2):108626.
14. Angulo P, Kleiner DE, Dam-Larsen S, Adams LA, Bjornsson ES, Charatcharoenwitthaya P, Mills PR, Keach JC, Lafferty HD, Stahler A et al: Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015, 149(2):389-397.e310.
15. Seki E, De Minicis S, Osterreicher CH, Kluwe J, Osawa Y, Brenner DA, Schwabe RF: TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nature medicine 2007, 13(11):1324-1332.
16. Moya-Garzon MD, Rodriguez-Rodriguez B, Martin-Higueras C, Franco-Montalban F, Fernandes MX, Gomez-Vidal JA, Pey AL, Salido E, Diaz-Gavilan M: New salicylic acid derivatives, double inhibitors of glycolate oxidase and lactate dehydrogenase, as effective agents decreasing oxalate production. European journal of medicinal chemistry 2022, 237:114396.



