技术分享:氨基酸是肝脏脂肪合成的主要碳源
代谢功能障碍相关脂肪变性肝病(MASLD),以前称为非酒精性脂肪性肝病(NAFLD),其主要特征是肝细胞内脂肪过度沉积、与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤。从甘油三酯过度积累开始,逐渐发展为代谢功能障碍相关的脂肪性肝炎(MASH,前称NASH)、纤维化和肝硬化[1-3]。MASLD的全球患病率已升至30%[4],截至2024年,市场上仅有1种药物可用于该疾病的治疗[5],治疗方案仍然具有非常大的局限性。
肥胖和胰岛素抵抗是MASLD的主要原因[6]。由于肥胖人群中作为脂肪酸(FA)来源的从头脂肪生成(DNL)显著增加[7],那么抑制DNL可能是一种新的治疗方法。然而,不加选择地靶向脂肪生成相关途径,例如对ACC/ACLY等限速酶的抑制[8],必定会受到药物疗效、选择性和安全性相关的影响。在传统的理解中,碳水化合物被认为是DNL的主要碳源,但葡萄糖或果糖在肝脏脂肪酸中的掺入率却很低[9, 10]。大鼠原代肝细胞体外示踪研究发现,作为DNL底物,葡萄糖的消耗量比乳酸、丙酮酸、乙酸和丙氨酸更低[11]。大多数多余的碳水化合物以糖原的形式储存,只有1%-2%的碳水化合物转化为脂肪。需要进一步的研究来重建这些次生代谢物的饮食来源。有研究者直接标记膳食葡萄糖,量化全身新合成的脂肪酸,发现与其他组织相比,葡萄糖的碳对肝脏DNL的贡献最小[12]。为了鉴定MASLD/MASH中的特定DNL靶点,有必要充分破译肝脏中脂肪酸合成的分子组成和过程,特别是肝脏DNL碳骨架的常量营养来源。
2024年11月,Cell Metabolism期刊发表了一篇文章,发现高膳食蛋白质摄入是MASLD/MASH的重要危险因素,氨基酸是促进肝脏脂肪生成的主要底物,其效率是葡萄糖的两倍。氨基酸衍生的碳很容易为肝脏中的三羧酸循环和脂肪酸合成提供碳源。低蛋白饮食或改变氨基酸分解代谢路线不仅可以防止肥胖小鼠的体重增加,还可以减少肝脏脂质积聚和肝脏损伤。该研究揭示了常量营养素底物对肝脏脂肪酸合成和肥胖患者肝脂肪变性发展的贡献,为MASLD营养干预提供新的方向[13]。
为研究常量营养素在MASLD/MASH中的作用,研究者首先对美国国家健康与营养检查调查数据集(NHANES)(共4693名参与者,图一A)进行流行病学分析。结果显示,与普遍的观点相反,碳水化合物、总脂肪摄入量均未显示出与MASLD发病率增加有显著的相关性;相反,膳食蛋白质含量与MASLD的风险呈正相关,中/高蛋白摄入分别增加了1.47倍和1.42倍。此外,高蛋白摄入会使患MASH的风险增加一倍,与中/高脂肪摄入的情况相似,这些关联仅在肥胖参与者中可见(图一B)。以上实验结果表明,膳食蛋白对肝脏脂肪积累有潜在影响。
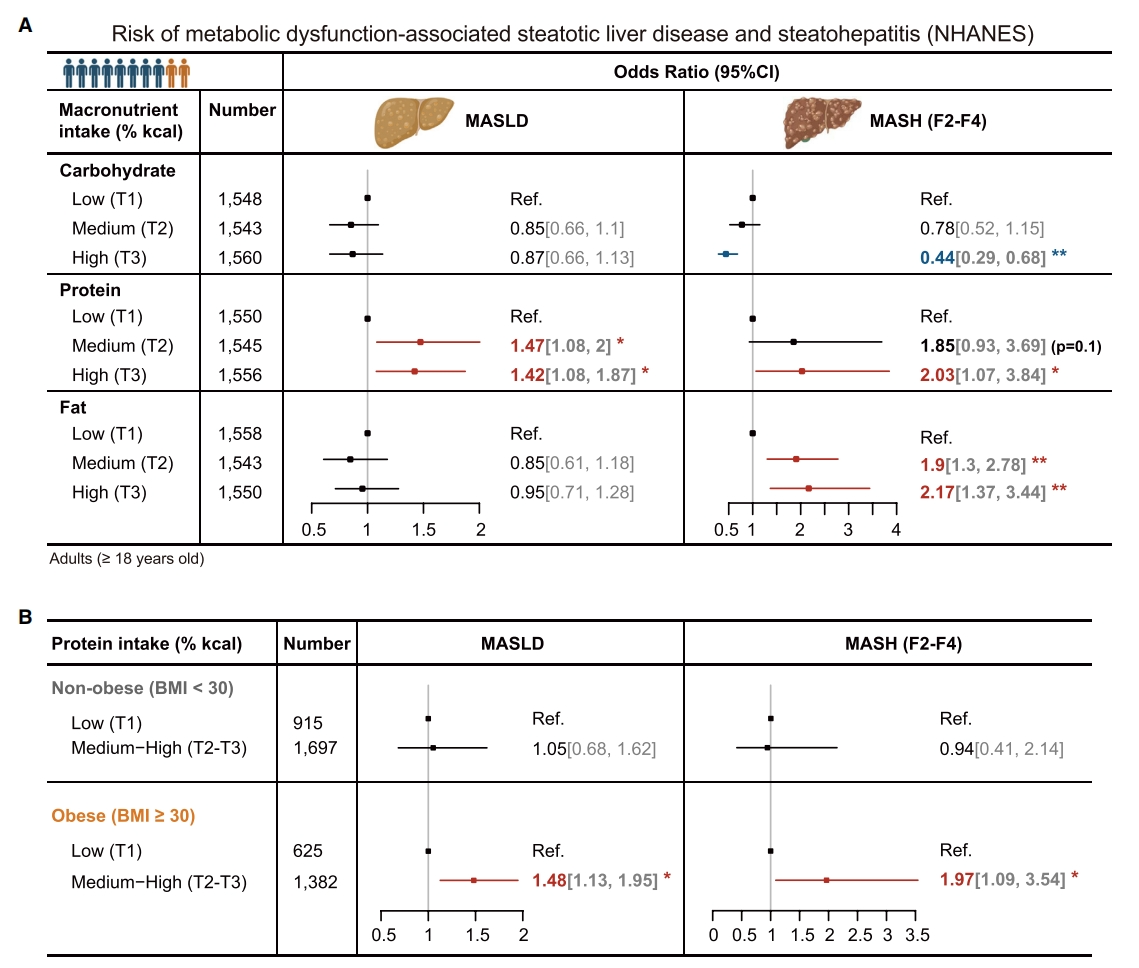
图一 常量营养素摄入量对MASLD/MASH风险的影响[13]
肝脏是体内氨基酸分解代谢的主要器官。基于公共人类组学数据库的转录组学分析显示,肝脏中氨基酸代谢途径相关基因比糖酵解途径相关基因丰富得多(图二A)。三羧酸(TCA)循环是为合成代谢途径提供能量和碳前体的中心代谢中枢。为确定氨基酸代谢在肝脏脂肪生成中的作用,研究者从体型瘦小的野生型小鼠中分离出原代肝细胞,测试TCA循环的底物偏好,进行细胞外通量分析。结果显示,对线粒体呼吸的贡献率,氨基酸氧化占约33%,其次是脂肪酸,约占12.4%,用作葡萄糖替代品的丙酮酸占4%,只有在添加线粒体呼吸解偶联试剂后,丙酮酸才显著进入TCA循环(图二B和C)。因此,在正常情况下,丙酮酸氧化不利于肝细胞。全面评估肝脏营养代谢的命运和通量,研究者使用13C标记葡萄糖和谷氨酰胺(体内最丰富的氨基酸),在小鼠原代肝细胞中进行平行同位素示踪(图二D)。结果显示,13C-葡萄糖完全标记了糖酵解代谢物而不是TCA中间产物,而13C-谷氨酰胺标记的TCA中间产物,比13C-葡萄糖高约10倍(图二E和F)。以上实验结果表明,氨基酸是肝脏TCA循环的主要底物。
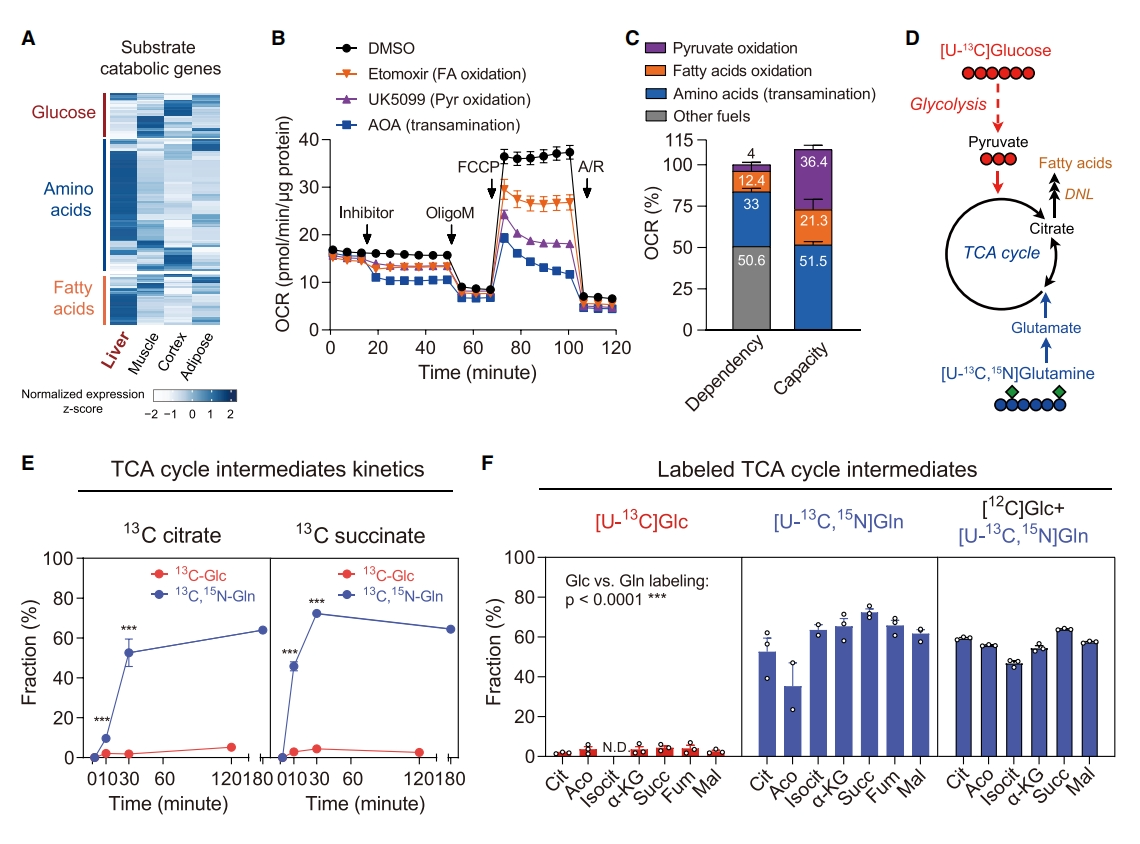
图二 氨基酸是肝脏TCA循环的主要底物[13]
基于上述发现,研究者推测肝细胞中的葡萄糖不太可能为DNL提供能量。对从野生型小鼠分离的原代肝细胞中的甘油三酯脂肪酸合成进行类似的通量分析。结果显示,谷氨酰胺而不是葡萄糖衍生的13C很容易被掺入肝细胞中的棕榈酸酯中,谷氨酰胺衍生的13C碳的脂肪酸同位素富集量比葡萄糖高8至40倍(图三A-C)。除了葡萄糖,研究者还比较了氨基酸与其他DNL底物如果糖、乳酸和醋酸盐的脂肪生成潜力,结果显示,氨基酸包括谷氨酰胺、丙氨酸、氨基酸混合物在脂肪酸中的掺入水平与果糖、乳酸盐和醋酸盐相当,均远超过葡萄糖(图三D和E)。通过使用新开发的“基于质量同位素富集(MIE)的DNL估计” 算法,估计新合成的棕榈酸盐含量占棕榈酸盐总量的17%,氨基酸、乙酸和乳酸是原代肝细胞棕榈酸合成的主要因素(图三F)。以上实验结果表明,氨基酸是肝脏DNL的重要碳源。
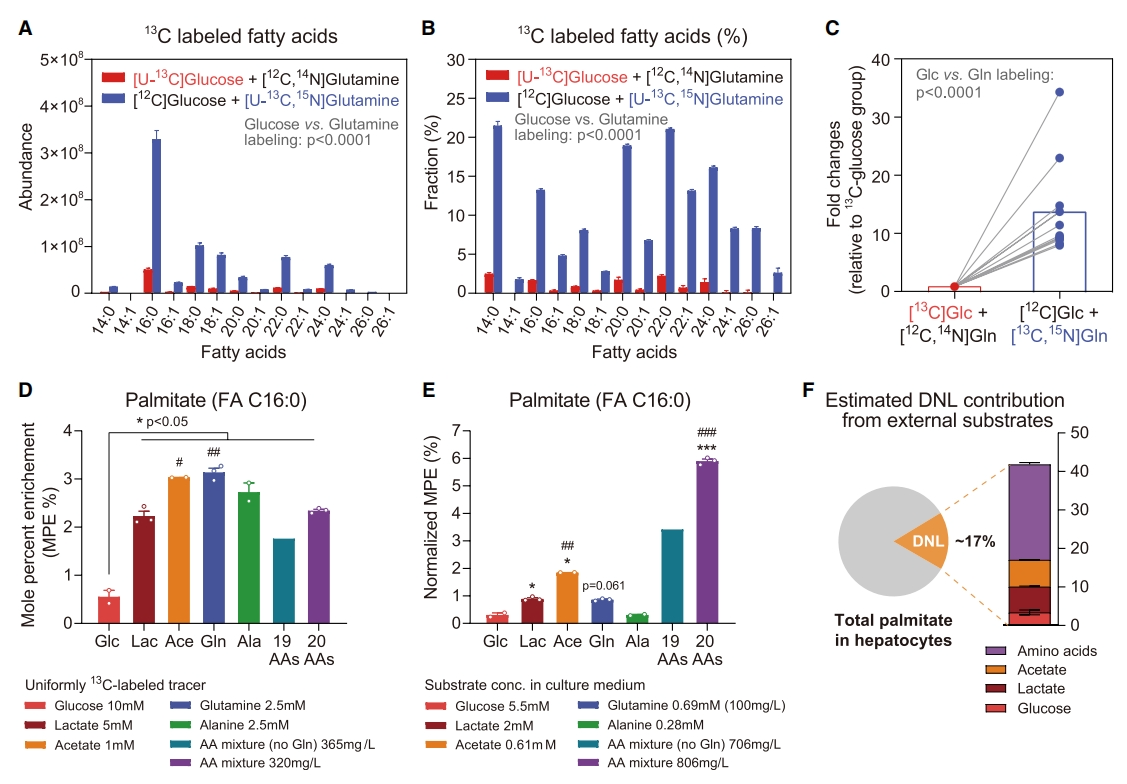
图三 氨基酸是肝脏脂肪从头合成途径中的重要碳源[13]
研究者通过给小鼠喂食含有13C标记的葡萄糖或氨基酸的混合食物(15%葡萄糖+5%氨基酸,3:1,w/w),24小时后采集血浆和肝脏样本,对代谢产物和脂肪酸进行分析,量化氨基酸对肝脏DNL的贡献(图四A)。从数量上讲,葡萄糖和氨基酸都对DNL做出了重大贡献,分别提供了约30%和约45%的碳(图四B)。考虑到小鼠食用的混合食物中氨基酸的量是葡萄糖的1/3,且膳食氨基酸的脂肪生成潜力是葡萄糖的2倍,经过摩尔比归一化的计算后,氨基酸参与DNL的量约为葡萄糖的1.25倍(图四C)。基于MIE的计算方法,研究者预估,小鼠肝脏中约30%的脂肪酸是由DNL产生的,氨基酸和葡萄糖提供的碳源占DNL碳骨架的约75%(图四D)。以上实验结果表明,膳食氨基酸和葡萄糖都是肝脏DNL底物的主要来源。
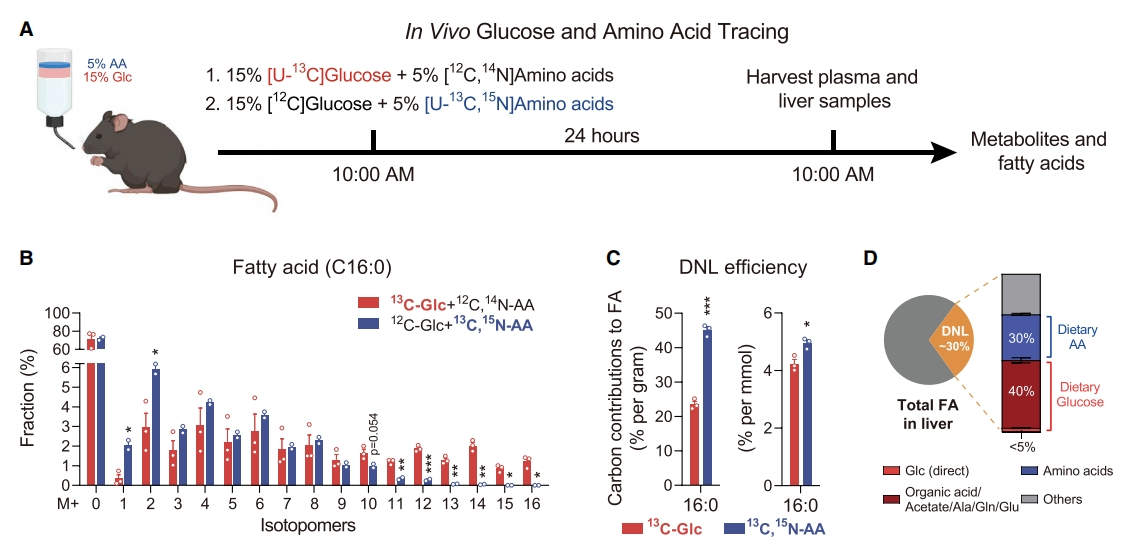
图四 氨基酸和葡萄糖都是肝脏DNL底物的主要来源[13]
饮食营养素与MASLD/MASH风险之间的关联在肥胖亚群中更为显著(图一B)。研究者从瘦和肥胖(ob/ob)小鼠分离的原代肝细胞中进行同位素示踪,发现肥胖小鼠肝脏氨基酸代谢发生了重编程,特别是谷氨酰胺。进一步确定氨基酸代谢重编程的生理意义,研究者采用化学和遗传学方法来评估谷氨酸和谷氨酰胺的代谢命运和对脂肪酸合成途径的影响(图五A)。结果显示,在小鼠原代肝细胞体外培养的过程中,添加L-γ-谷氨酰对硝基苯胺(GPNA)后,谷氨酰胺摄取受到抑制,导致原代肝细胞中甘油三酯积累显著减少,其减少程度与抑制脂肪酸合成的乙酰辅酶a羧化酶抑制剂ACCi相似(图五B)。更具体地说,上述通量分析揭示了ob/ob小鼠肝细胞中两种主要谷氨酰胺分解代谢途径的失调:转氨还原羧化升高,氧化脱氨受到抑制,表明前者可能是谷氨酸驱动DNL的主要途径(图五A)。通过氨氧乙酸盐(AOA)阻断转氨作用,导致原代肝细胞内甘油三酯的积累进一步减少(图五C)。此外,研究者在肥胖小鼠肝脏中进行病毒介导的敲降实验。结果表明,广泛抑制谷氨酰胺代谢(shGls2)和特异性抑制还原羧化(shIdh1),均显著降低了肝脏甘油三酯的积累(图五D)。接下来,研究者进行功能获得研究,评估恢复谷氨酸氧化脱氨基途径对体外谷氨酰胺代谢和体内肝脏甘油三酯积累的影响。发现过表达谷氨酸脱氢酶1(GLUD1OE)减少了谷氨酰胺的脂肪酸合成(图五E),减少了ob/ob小鼠模型中肝脏甘油三酯的积累(图五F和G)。以上实验结果表明,肥胖肝脏中氨基酸代谢重编程驱动肝脂肪变性,而增强谷氨酰胺氧化可抑制脂肪合成。
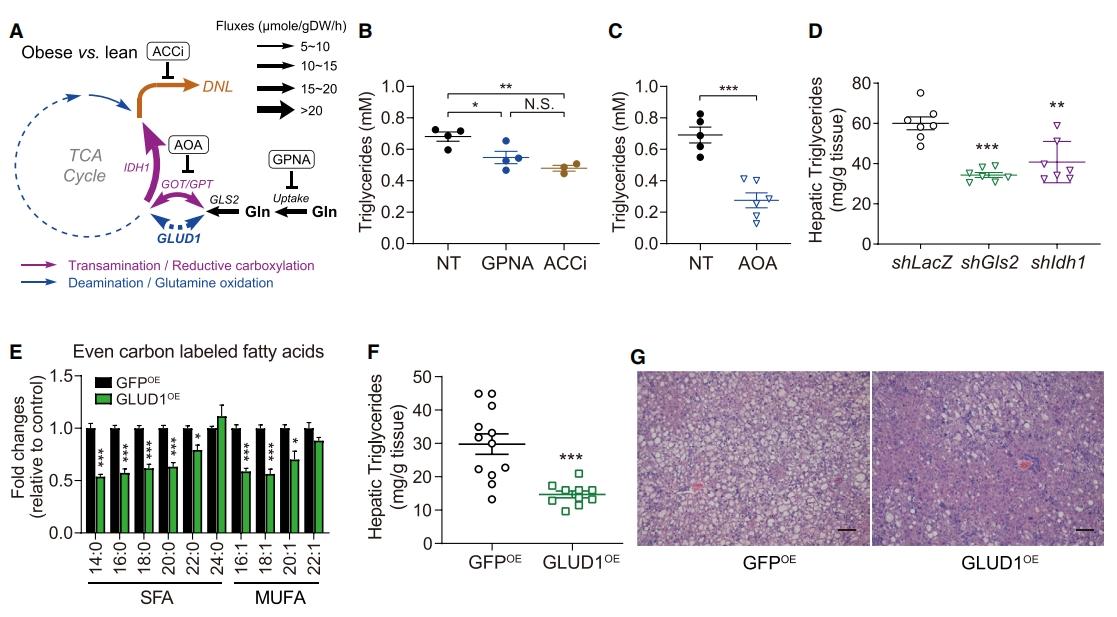
图五 肝脏氨基酸代谢重编程驱动肝脂肪变性[13]
最后,研究者探究氨基酸驱动的DNL对MASLD的影响。取患有肝脂肪变性的ob/ob小鼠,持续喂养三周的标准(25% kcal 蛋白)或低蛋白饮食(LPD,5% kcal 蛋白)(图六A)。结果发现,低蛋白饮食组小鼠体重显著减轻(图六B和C)。组织学分析显示,低蛋白饮食小鼠肝脏脂肪积累减少(图六D),肝损伤减轻(图六E)。从机制上讲,低蛋白饮食抑制了大多数脂肪生成基因的表达,包括Scd1/2、Acly、Acss2、Fasn和Fabp5(图六F)。MASLD风险基因Pnpla3的表达显著下调,氨基酸剥夺的标志基因Fgf21的表达被显著上调(图六F)。基因集富集分析(GSEA)表明,DNA复制和细胞周期显著减弱,脂肪酸代谢途径表达下调,与此同时,与核糖体和胆汁酸代谢相关的途径可能通过补偿机制上调(图六G和H)。肝脏不仅是氨基酸代谢的主要器官,也是葡萄糖和脂肪分流的中心(图六I)。以上实验结果表明,低蛋白饮食可有效改善肝脏脂肪变性。
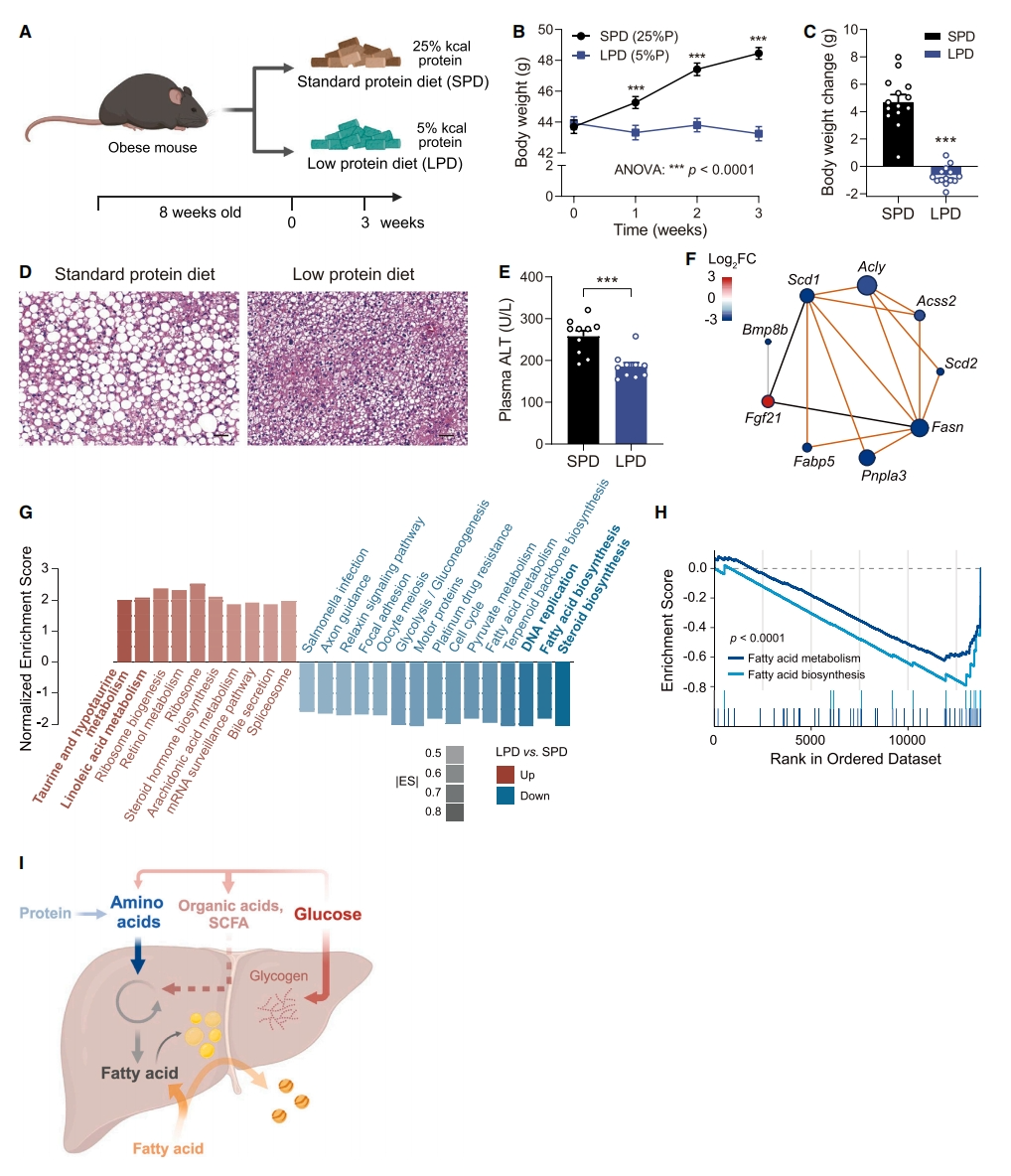
图六 低蛋白饮食可改善肝脏脂肪变性[13]
综上所述,研究者通过一系列通量分析、遗传干预和饮食操作,发现饮食中的蛋白质,而非碳水化合物或脂肪,是代谢功能障碍相关脂肪变性肝病(MASLD)的主要营养风险因素。具体而言,小鼠原代肝细胞体外同位素示踪发现,氨基酸是三羧酸循环(TCA)和脂肪生成的主要碳源。肝脏不仅是氨基酸代谢的主要器官,也是葡萄糖和脂肪酸分流的中心(图六I)。在体内,膳食氨基酸在促进肝脏脂肪酸合成方面的效率是葡萄糖的两倍,改变氨基酸分解代谢路线可改善肝脂肪变性。低蛋白饮食不仅可以抑制肥胖小鼠体重增加的趋势,还可以减少肝脏脂质积聚和肝脏损伤。总之,这项研究揭示了氨基酸在肝脏脂肪生成中的重要作用,为治疗MASLD提供新的营养干预目标。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR: Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol 1999, 94(9):2467-2474.
2. Angulo P: Treatment of nonalcoholic fatty liver disease. Ann Hepatol 2002, 1(1):12-19.
3. Rinella ME, Lazarus JV, Ratziu V, Francque SM, Sanyal AJ, Kanwal F, Romero D, Abdelmalek MF, Anstee QM, Arab JP et al: A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology 2023, 78(6):1966-1986.
4. Teng ML, Ng CH, Huang DQ, Chan KE, Tan DJ, Lim WH, Yang JD, Tan E, Muthiah MD: Global incidence and prevalence of nonalcoholic fatty liver disease. Clin Mol Hepatol 2023, 29(Suppl):S32-S42.
5. Ledford H: First US drug approved for a liver disease surging around the world. Nature 2024.
6. Younossi Z, Anstee QM, Marietti M, Hardy T, Henry L, Eslam M, George J, Bugianesi E: Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol 2018, 15(1):11-20.
7. Lambert JE, Ramos-Roman MA, Browning JD, Parks EJ: Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology 2014, 146(3):726-735.
8. Batchuluun B, Pinkosky SL, Steinberg GR: Lipogenesis inhibitors: therapeutic opportunities and challenges. Nat Rev Drug Discov 2022, 21(4):283-305.
9. Botion LM, Brito MN, Brito NA, Brito SR, Kettelhut IC, Migliorini RH: Glucose contribution to in vivo synthesis of glyceride-glycerol and fatty acids in rats adapted to a high-protein, carbohydrate-free diet. Metabolism 1998, 47(10):1217-1221.
10. Carvalho F, Duarte J, Simoes AR, Cruz PF, Jones JG: Noninvasive measurement of murine hepatic acetyl-CoA (1)(3)C-enrichment following overnight feeding with (1)(3)C-enriched fructose and glucose. Biomed Res Int 2013, 2013:638085.
11. Katz J, McGarry JD: The glucose paradox. Is glucose a substrate for liver metabolism? J Clin Invest 1984, 74(6):1901-1909.
12. Chen Q, Li H, Tian H, Lam SM, Liao Y, Zhang Z, Dong M, Chen S, Yao Y, Meng J et al: Global determination of reaction rates and lipid turnover kinetics in Mus musculus. Cell metabolism 2023, 35(4):711-721.e714.
13. Liao Y, Chen Q, Liu L, Huang H, Sun J, Bai X, Jin C, Li H, Sun F, Xiao X et al: Amino acid is a major carbon source for hepatic lipogenesis. Cell Metab 2024, 36(11):2437-2448 e2438.



