技术分享:MTFP1抑制线粒体内膜融合并维持mtDNA水平
线粒体是双膜结构细胞器,具有线粒体外膜(OMM)和内膜(IMM)。IMM伸入线粒体基质中,后者含有以蛋白质-DNA复合物形式存在的线粒体基因组,称为类核[1]。线粒体DNA(mtDNA)编码了呼吸链不同复合物的13个核心亚基,对维持细胞代谢和生命至关重要。维持细胞稳态仅需要两个拷贝的核DNA(nDNA),而mtDNA分子的数量可以从数百到数千个拷贝不等,具体取决于细胞类型和细胞需求[2]。与核DNA不同,mtDNA独立于细胞周期不断“松弛复制”,其拷贝数在细胞水平上受到严格调控,但对其潜在调控机制知之甚少。线粒体可通过分裂和融合,形成一个动态的、相互连接的网络。精准调控线粒体动力学是维持mtDNA水平所必需的,也是线粒体质量控制的关键[3]。线粒体分裂可将受损细胞器区域分离成小的线粒体,促进其自噬降解[4]。根据损伤的来源和严重程度,分离的线粒体可能与更健康的线粒体重新融合,以减轻功能障碍。线粒体分裂蛋白1(MTFP1)是一种整合的IMM蛋白,以前被认为是作用于动态相关蛋白1(DRP1)上游的促分裂因子[5],将分裂过程与驱动细胞命运的多种关键途径相耦合,如雷帕霉素复合物1(mTORC1)激活靶点、细胞死亡、癌症进展和线粒体生物能量[6, 7]。然而,MTFP1如何调节线粒体动力学以及如何影响mtDNA水平仍然未知。
2024年7月,Cell期刊报道了一项研究,发现线粒体内膜(IMM)蛋白MTFP1是IMM融合的负调控因子。机制上,MTFP1抑制线粒体融合,将受损的IMM亚结构域与其他部分相分离,通过外周分裂确保它们分离到富含MTFP1的小线粒体(SMEM),随后以自噬依赖的方式被降解。这是一个MTFP1依赖的IMM质量控制过程,细胞利用这一过程回收线粒体类核,以维持生理mtDNA水平[8]。
首先,为了深入了解MTFP1如何调节IMM的膜重塑,研究者进行了详细的线粒体形态学分析。在U2OS细胞中沉默DRP1发现少数但细长的线粒体,相反,沉默MTFP1诱导了广泛相互连接的线粒体网络,这与过度的线粒体分支有关(图一A-D)。使用超分辨晶格结构光照明显微系统(SR-SIM)活细胞成像在野生型(WT)和MTFP1-KO细胞中测量线粒体分裂(图一E)。尽管MTFP1-KO细胞的中区分裂不受影响,但外周分裂显著降低(图一F和G),表明MTFP1可能是外周线粒体亚结构分裂所必需的。与此一致,MTFP1-KO细胞显示出小圆形线粒体的数量减少(图一H)。相反,过表达MTFP1与小圆形线粒体的形成增加相关(图一I),表明MTFP1促进外周分裂。将MTFP1沉默细胞的线粒体表型与其他细胞线粒体表型进行比较,MFF沉默细胞具有与DRP1沉默细胞相似的细长表型,FIS1沉默细胞仅表现出适中的过度融合线粒体网络(图一J-L)。随后,研究者分析线粒体融合过程的动态,该过程有两种不同模式:完全融合形成单个稳定的线粒体,或者瞬时融合且在同一区域迅速发生DRP1驱动的分裂(图一M)。在MTFP1-KO细胞中,完全融合率增加,瞬时融合率降低(图一N和O)。随着时间的推移,线粒体融合能力增加(图一P-R)。以上数据表明,MTFP1缺失诱导的线粒体分支和相互连接与融合能力增加有关,而不是线粒体分裂减少,表明MTFP1是一种阻止线粒体融合的IMM蛋白。
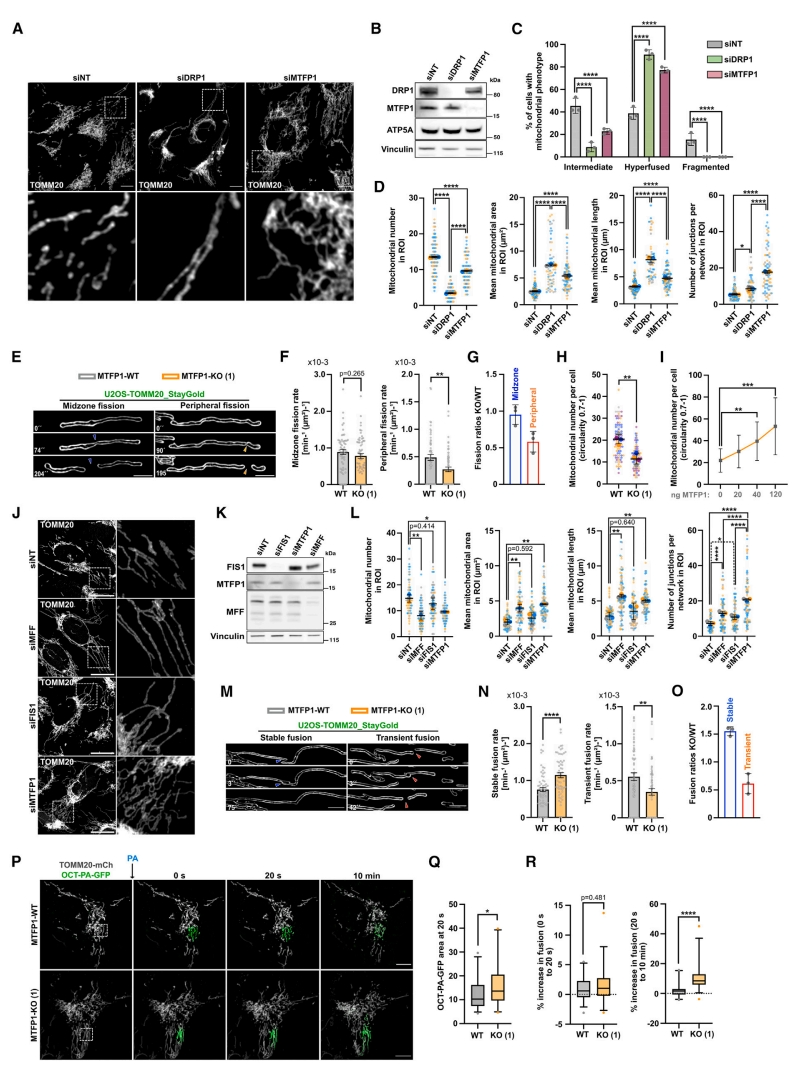
图一 MTFP1缺失增加线粒体融合[8]
接下来,研究者探究MTFP1如何同时调节线粒体融合和外周分裂。使用SR-SIM分析MTFP1分布发现该蛋白在线粒体亚区表现为不均匀定位。虽然MTFP1在小片段线粒体内均匀分布,但还观察到MTFP1向线粒体外周的特定分布,另外还沿着IMM亚结构域在线粒体中心区域积累,勾勒出“间隔样”结构(图二A)。当IMM融合受到抑制时积累的IMM融合中间体称为线粒体“隔膜”[9]。在隔膜处检测到微弱的残余TOMM20染色,表明之前发生了OMM融合(图二A)。TEM分析证实了这些结果,MTFP1过表达导致线粒体外周形成隔膜以及IMM亚区(图二B)。活细胞成像证实MTFP1在“间隔样”结构和线粒体接触部位的持续定位,其中两个相对的线粒体保持紧密贴壁,但没有完全融合(图二C)。虽然一些富含MTFP1的亚结构域发生外周分裂,形成小线粒体,但大多数MTFP1亚结构域在线粒体外周保持稳定(图二C和D)。值得注意的是,没有观察到富含MTFP1的亚结构域或者小线粒体发生线粒体融合(图二D和E)。以上数据表明,MTFP1本身不驱动不对称膜分裂,而是隔离和保护特定IMM亚结构域,使其不与其他网络相融合,从而指示这些区域进行外周分裂。
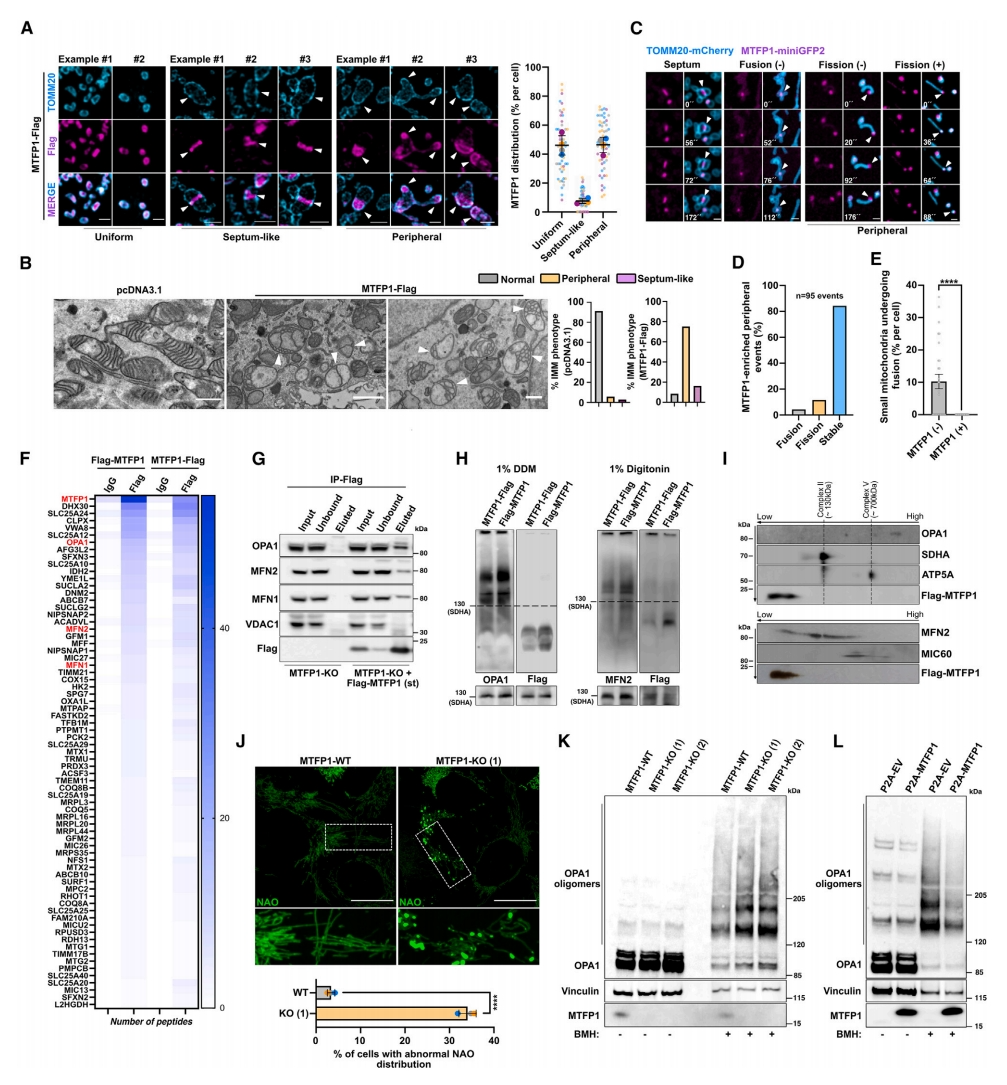
图二 MTFP1定位于线粒体外周并抑制IMM融合[8]
为研究MTFP1如何抑制线粒体融合,研究者富集线粒体组分,下拉MTFP1进行液相色谱-串联质谱(LC-MS/MS),发现其潜在结合蛋白有MFN1、MFN2、OPA1以及一些线粒体接触位点和嵴组织系统(MICOS)组分(图二F)。免疫沉淀证实MTFP1和这些融合机器之间的相互作用(图二G)。然而,1D和2D BN-PAGE分析揭示MTFP1和OPA1、MFN2、MIC60之间有着不同的迁移模式(图二H和I),表明MTFP1与融合机器或MICOS复合物都没有形成稳定的复合物。使用荧光染料10-N-壬基吖啶橙(NAO)结合线粒体阴离子磷脂,观察到MTFP1-KO细胞表现出异常的线粒体心磷脂(CL)分布,形成富含NAO的微区(图二J)。MTFP1-KO细胞显示出OPA1寡聚体形成增加,而MTFP1过表达降低了高寡聚体OPA1的组装水平(图二K和L)。以上数据表明,MTFP1通过创造非融合脂质环境来抑制线粒体融合,这会影响OPA1的寡聚化及其随后驱动的IMM融合能力。
有研究表明,充足的mtDNA 拷贝数(CN)与线粒体动力学有关[10]。荧光激活细胞分选(FACS)结合单细胞数字液滴(dd)PCR分析显示MTFP1过表达导致mtDNA拷贝数降低(图三A)。另一方面,MTFP1沉默或KO(图三B和C)诱导了mtDNA拷贝数增加,MTFP1过表达后得到了恢复(图三D)。相比之下,DRP1-KO细胞表现出mtDNA拷贝数减少,进一步证实线粒体分裂减少不是出现过度分支的主要原因,也不是mtDNA拷贝数增加的主要原因。MTFP1-KO细胞也对OPA1沉默引起的mtDNA耗竭具有部分抗性,进一步支持了它们在调节IMM融合和mtDNA拷贝数中的相反作用(图三E),表明MTFP1驱动了一种调控mtDNA含量的机制。抑制MTFP1能同时增加非复制以及复制的类核数量,而不影响复制mtDNA/总mtDNA比率(图三F–I),表明缺失MTFP1不会增加mtDNA的复制能力,但可能导致mtDNA清除效率降低,从而导致类核的积累。SR-SIM分析证实,MTFP1-KO细胞中含mtDNA的类核数量增加,但类核大小没有显著改变(图三J和K)。免疫印迹分析显示,MTFP1-KO细胞中积累了核心类核组分,如SSBP、TFAM和TWINKLE(图三L),还检测到IMM蛋白PHB2和线粒体呼吸链亚基水平升高(图三L),它们定位与mtDNA分子非常接近[11],提示MTFP1可能参与选择性降解含有mtDNA的IMM亚结构域。为阐明MTFP1是否不仅可以用于基础mtDNA降解,还可以用于处理受损的类核,用DNA插入剂溴化乙锭(EB)处理WT和MTFP1-KO细胞。一致地,MTFP1-KO细胞在基础条件下表现出mtDNA水平的增加,并且对EB诱导的类核降解具有部分抵抗力(图三M-O),进一步证实MTFP1对mtDNA清除的贡献。
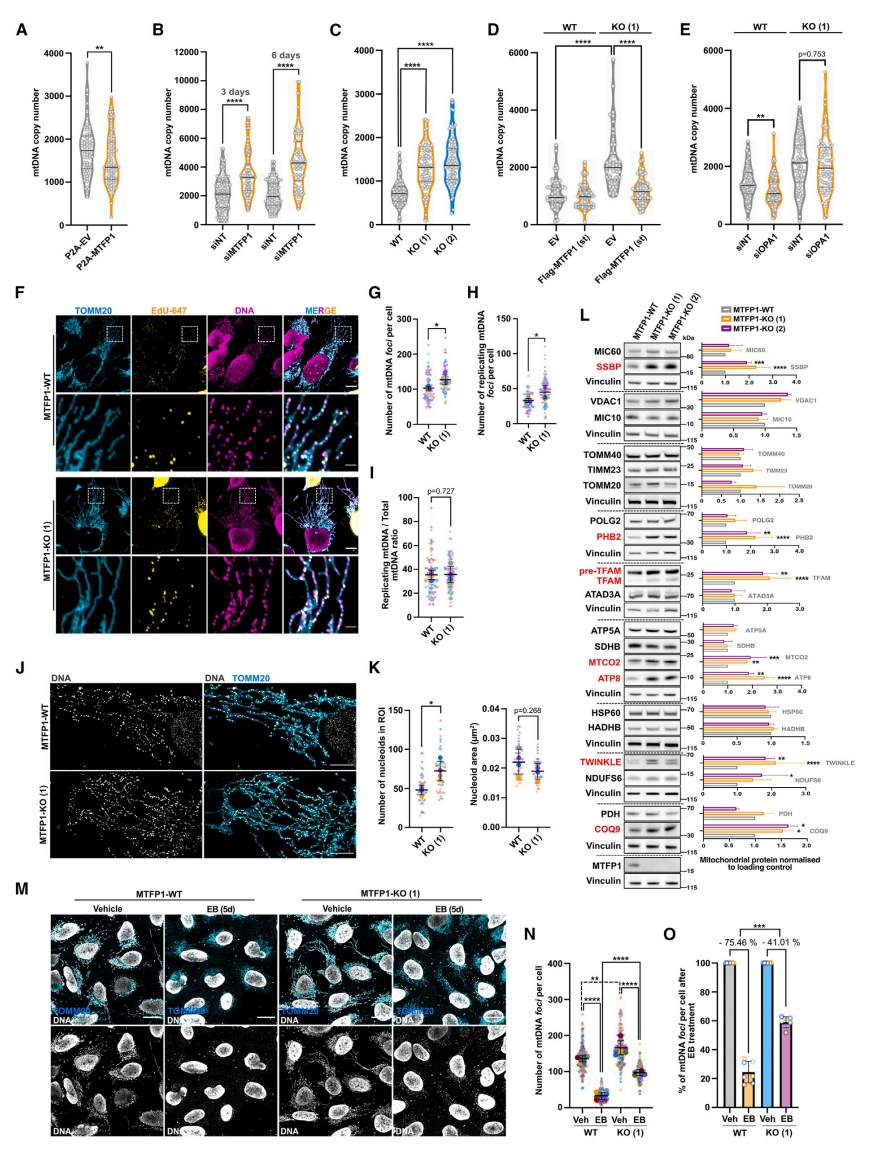
图三 MTFP1调节mtDNA拷贝数和类核丰度[8]
接下来,研究者探究MTFP1调节mtDNA水平的机制。SR-SIM分析显示,过表达MTFP1不仅促进其在外周积累,还促进形成不含OMM标志物TOMM20但MTFP1阳性的亚区室,其中可能含有mtDNA分子(图四A)。此外,观察到高的MTFP1水平与TOMM20蛋白的低水平相关(图四B)。进一步用两种不同的蛋白酶体抑制剂处理细胞,可减少MTFP1(+)/TOMM20(-)线粒体的数量(图四C),表明蛋白酶体依赖的OMM蛋白周转以及IMM亚结构域的早期降解过程。于是,将这些MTFP1(+)/TOMM20(-)线粒体称为富含MTFP1的小线粒体(SMEM)。为阐明降解途径,检测SMEM与不同溶酶体和自噬标志物的定位情况。观察到SMEM与LAMP1标记的降解溶酶体共定位(图四D和G),也可以在LC3B和p62阳性的自噬体中发现(图四E和F)。用自噬抑制剂氯喹(CQ)处理增加了SMEM的数量(图四H和I)。有报道称,一些IMM组分可以作为LC3受体[12]。事实上,检测到MTFP1和LC3B-II之间存在相互作用,但与细胞溶质LC3B-I之间没有相互作用(图四J),这种相互作用在不同的MTFP1 LIR突变体(mLIR)中被部分破坏,在MTFP1三重LIR突变体中被消除(mLIRx3)(图四K)。有趣的是,MTFP1 mLIRx3仍然能够诱导线粒体断裂(图四L和M)。尽管在MTFP1 mLIRx3过表达的细胞中,SMEM运输到自噬体的数量和百分比都有所减少,但这些结构中仍有一定比例的靶向LC3阳性膜(图四N-P),表明SMEM可被降解,至少部分是独立于MTFP1-LC3B相互作用的。由此,研究者提出线粒体质量控制中MTFP1的两步机制:首先,MTFP1驱动的融合活性丧失与DRP1协同作用,介导外周IMM亚结构选择性分离为小线粒体。由于它们无法进行融合,这些线粒体积累了不可逆的损伤,促进了自噬去除。最后,MTFP1和LC3B之间的相互作用可以提高该过程的效率。
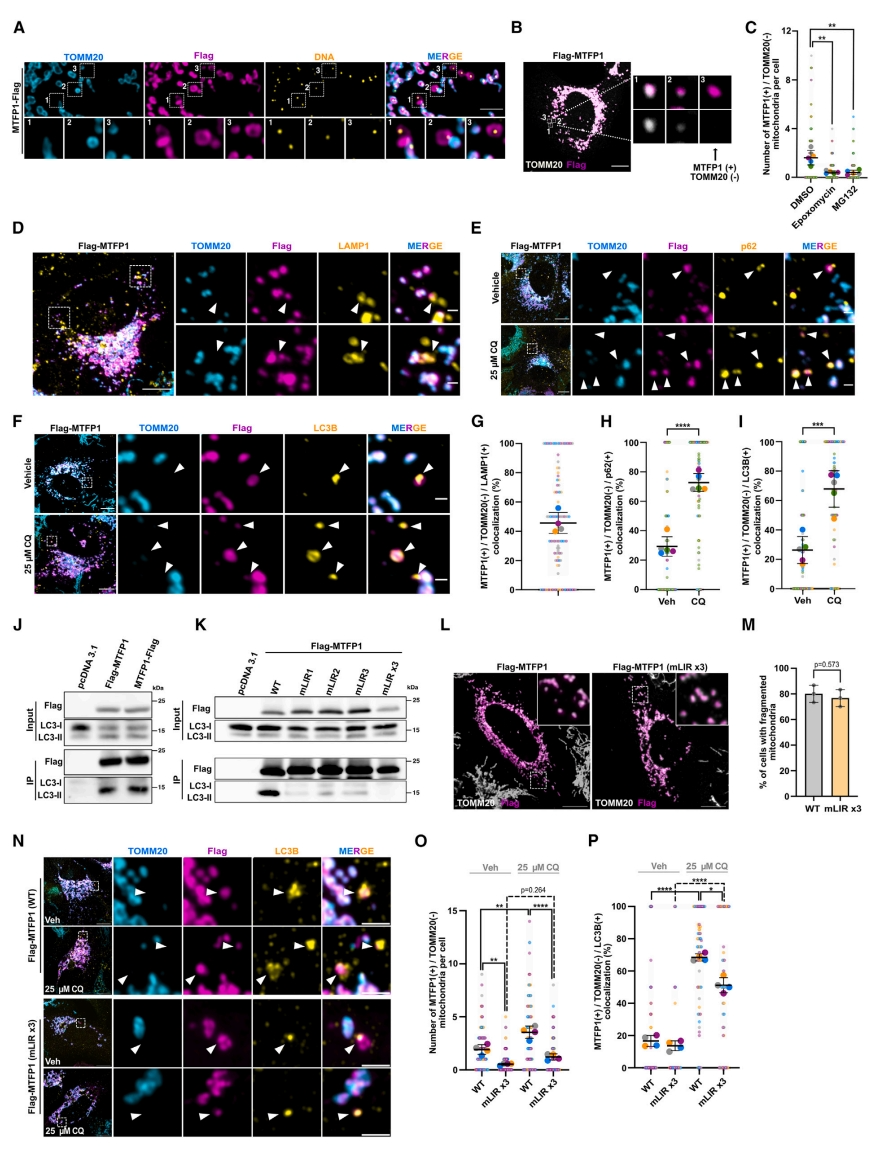
图四 MTFP1介导IMM重塑通过靶向IMM亚结构域的自噬降解[8]
最后,研究者探究MTFP1如何选择需要回收的mtDNA。在WT和MTFP1-KO U2OS细胞中进行二代测序(NGS)实验(图五A)。结果表明,在WT和MTFP1-KO细胞之间,同质或异质线粒体单核苷酸变体(mtSNV)的负荷没有差异(图五B),9种常见异质性mtSNV变异等位基因频率也没有差异(图五C),表明MTFP1驱动的mtDNA周转无法区分不同的mtDNA等位基因。使用稳定表达Flag-MTFP1的MTFP1-KO细胞监测mtDNA损伤期间MTFP1的动态。虽然MTFP1在未处理的细胞中沿IMM均匀定位,但在添加EB后,观察到MTFP1蛋白质向线粒体外周和小线粒体重新分布(图五D)。重要的是,只有约20%的MTFP1外周IMM亚结构域为DNA阳性(图五E),证实MTFP1的重分布不依赖于mtDNA的存在。值得注意的是,PHB2在这些亚结构域富集,但TIMM23没有(图五F),表明并非所有IMM蛋白都与这些外周区域有关。研究者推测MTFP1可能识别IMM的改变,而不是mtDNA本身。SR-SIM揭示MTFP1修饰了mtDNA分子周围的IMM,而不是在类核结构中积累(图五G)。通过瞬时抑制ATP5A或MICOS亚基MIC60来破坏嵴结构,增加了SMEM对自噬溶酶体结构的靶向性(图五H-K)。另一方面,添加羰基氰化物间氯苯腙(CCCP)或使用MitoParaquat增加线粒体内ROS引起的膜电位损失不会导致MTFP1分布的任何变化,也不会引发SMEM的形成(图五H-M)。以上结果表明,虽然mtDNA损伤会引发IMM改变和随后的MTFP1重新分布,但IMM结构缺陷不一定会导致mtDNA降解。
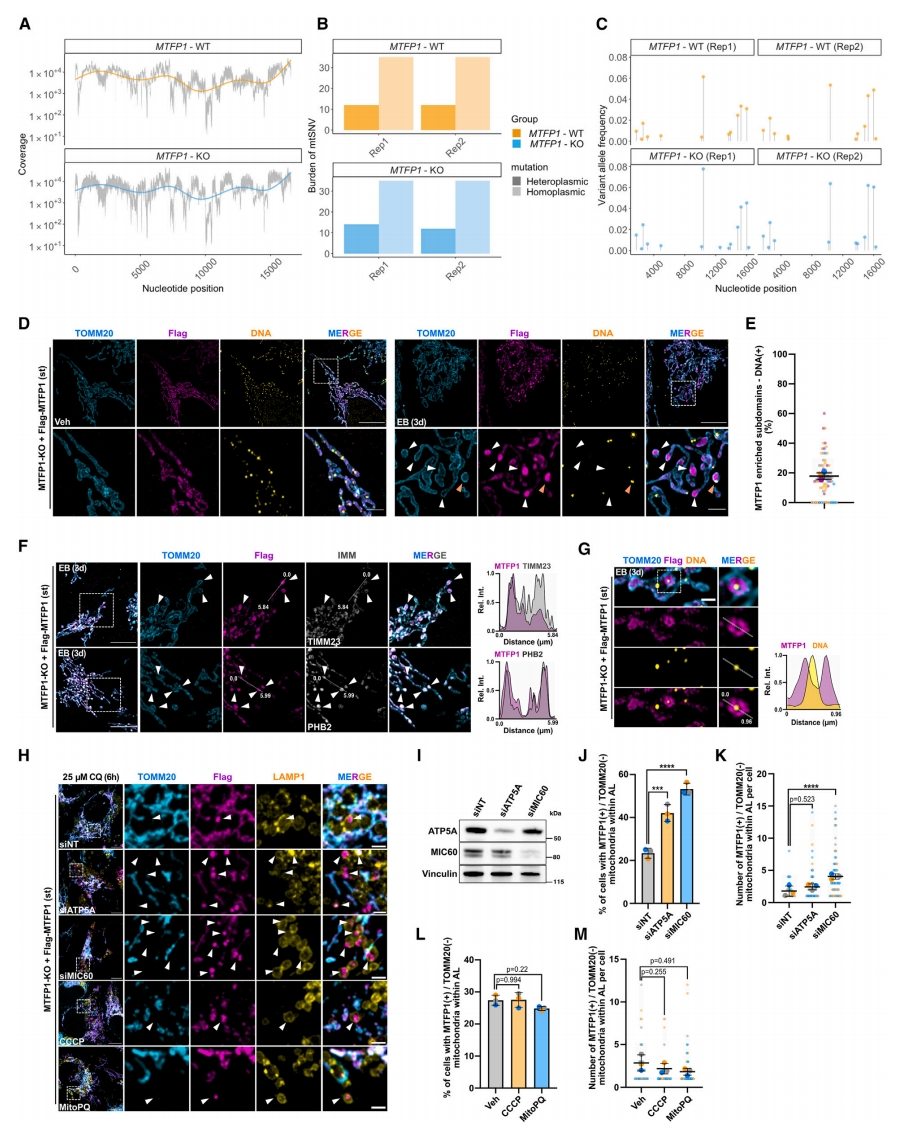
图五 IMM结构改变后MTFP1外周重分布和SMEM的形成与mtDNA无关[8]
综上所述,该研究揭示了线粒体分裂蛋白1(MTFP1)不是促分裂因子,而是线粒体内膜(IMM)融合的负调控因子。MTFP1阻止了缺陷IMM亚结构域的融合,从而确保其通过外周分裂分离成富含MTFP1的小线粒体(SMEM)。其中,FIS1也对融合过程进行负向控制[13]。一旦被分离出来,SMEM可通过自噬降解,MTFP1和LC3B之间的相互作用提高了这一过程的效率。MTFP1通过抑制IMM融合来调控线粒体内膜的质量控制并维持线粒体DNA(mtDNA)水平,对基础类核循环至关重要。该研究为线粒体质量控制和mtDNA拷贝数调控提供了新的见解。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Giacomello M, Pyakurel A, Glytsou C, Scorrano L: The cell biology of mitochondrial membrane dynamics. Nature reviews Molecular cell biology 2020, 21(4):204-224.
2. Stewart JB, Chinnery PF: The dynamics of mitochondrial DNA heteroplasmy: implications for human health and disease. Nat Rev Genet 2015, 16(9):530-542.
3. Ng MYW, Wai T, Simonsen A: Quality control of the mitochondrion. Developmental cell 2021, 56(7):881-905.
4. Burman JL, Pickles S, Wang C, Sekine S, Vargas JNS, Zhang Z, Youle AM, Nezich CL, Wu X, Hammer JA et al: Mitochondrial fission facilitates the selective mitophagy of protein aggregates. The Journal of cell biology 2017, 216(10):3231-3247.
5. Tondera D, Santel A, Schwarzer R, Dames S, Giese K, Klippel A, Kaufmann J: Knockdown of MTP18, a novel phosphatidylinositol 3-kinase-dependent protein, affects mitochondrial morphology and induces apoptosis. The Journal of biological chemistry 2004, 279(30):31544-31555.
6. Donnarumma E, Kohlhaas M, Vimont E, Kornobis E, Chaze T, Gianetto QG, Matondo M, Moya-Nilges M, Maack C, Wai T: Mitochondrial Fission Process 1 controls inner membrane integrity and protects against heart failure. Nature communications 2022, 13(1):6634.
7. Patitucci C, Hernández-Camacho JD, Vimont E, Yde S, Cokelaer T, Chaze T, Giai Gianetto Q, Matondo M, Gazi A, Nemazanyy I et al: Mtfp1 ablation enhances mitochondrial respiration and protects against hepatic steatosis. Nature communications 2023, 14(1):8474.
8. Tábara LC, Burr SP, Frison M, Chowdhury SR, Paupe V, Nie Y, Johnson M, Villar-Azpillaga J, Viegas F, Segawa M et al: MTFP1 controls mitochondrial fusion to regulate inner membrane quality control and maintain mtDNA levels. Cell 2024, 187(14):3619-3637.e3627.
9. Meeusen S, McCaffery JM, Nunnari J: Mitochondrial fusion intermediates revealed in vitro. Science 2004, 305(5691):1747-1752.
10. Parone PA, Da Cruz S, Tondera D, Mattenberger Y, James DI, Maechler P, Barja F, Martinou JC: Preventing mitochondrial fission impairs mitochondrial function and leads to loss of mitochondrial DNA. Plos One 2008, 3(9):e3257.
11. Kowald A, Kirkwood TB: Evolution of the mitochondrial fusion-fission cycle and its role in aging. Proceedings of the National Academy of Sciences of the United States of America 2011, 108(25):10237-10242.
12. Chu CT, Ji J, Dagda RK, Jiang JF, Tyurina YY, Kapralov AA, Tyurin VA, Yanamala N, Shrivastava IH, Mohammadyani D et al: Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nat Cell Biol 2013, 15(10):1197-1205.
13. Yu R, Jin SB, Lendahl U, Nistér M, Zhao J: Human Fis1 regulates mitochondrial dynamics through inhibition of the fusion machinery. The EMBO journal 2019,38(8):e99748.



