技术分享:泛素连接酶MARCH5调控线粒体来源过氧化物酶体前体的形成
过氧化物酶体的生物合成包含有两条不同途径:成熟过氧化物酶体的生长与分裂和在其他细胞器(内质网ER)上从头生物合成[1]。这两条途径在酵母和人类中都是保守的。此外,在某些情况下,线粒体可能参与过氧化物酶的从头生物合成。例如在过氧化物酶体生物合成障碍(PBD)患者来源的成纤维细胞中,新生成的过氧化物酶体是ER介导的PEX16囊泡和线粒体介导的PEX3囊泡的杂交体[2],提示了线粒体来源囊泡(MDV)在高等真核生物的过氧化物酶体从头生物合成中的关键作用。
线粒体稳态由多种细胞途径协同维持。错误折叠的外膜蛋白可被泛素连接酶所识别并清除[3]。受损线粒体可被自噬小体完全包裹,随后在溶酶体中进行降解[4]。此外,还能选择性地释放线粒体来源囊泡(MDV)以去除部分受损线粒体[5]。在氧化应激下,过度氧化的蛋白质聚集在线粒体基质,进而触发囊泡形成[6]。最近一项研究表明,TOMM20+ MDV在清除装配好的蛋白质复合物(如TOM复合物)方面发挥着至关重要的作用[7]。因此,MDV被认为是线粒体质量控制的选择途径之一。然而,溶酶体并不是MDV的唯一终点。据报道,含有泛素连接酶MAPL的MDV可特异性靶向过氧化物酶体,该过程依赖于线粒体分裂因子DRP1[8] 。这些发现将MDV与过氧化物酶体联系起来,提示了不同的机制可能调控形成不同的MDV。
泛素连接酶MARCH5对于线粒体稳态维持具有关键作用,通过调节参与分裂和融合的关键蛋白质的泛素化来动态调节线粒体[9]。破坏MARCH5介导的线粒体动态可导致细胞衰老或诱导细胞死亡[10]。此外,MARCH5通过MFN2调节内质网线粒体接触。表明MARCH5积极参与线粒体动力学、蛋白质量控制和细胞器接触位点调控。之前研究证明,MARCH5也定位于过氧化物酶体,在mTOR抑制下介导吞噬作用[11]。在过氧化物酶体缺失的细胞中,一些过氧化物酶体蛋白包括PEX3富集在线粒体上[2]。然而,线粒体定位的MARCH5在过氧化物酶体功能中的作用尚不清楚。
2024年10月,Developmental Cell期刊在线发表了一项研究,报道了位于线粒体的泛素连接酶MARCH5调控过氧化物酶体前体囊泡在线粒体的形成和分离,从而调控过氧化物酶体的从头生成。具体而言,MARCH5的缺失特异性地阻碍线粒体中PEX3囊泡的出芽,从而阻断了过氧化物酶体前体的形成。线粒体定位的PEX3有效富集在线粒体来源囊泡(MDV)中,这一过程依赖PEX3的核心结构域,也依赖于MARCH5。该研究强调了MARCH5调控线粒体来源的过氧化物酶体前体囊泡生成的作用,揭示其是一种维持过氧化物酶体稳态的调节因子[12]。
首先,研究者在过氧化物酶体缺陷细胞中重建过氧化物酶体从头生物合成。通过敲除内源性PEX3基因(PEX3 KO)建立过氧化物酶体缺陷的HeLa细胞。PEX3是一种组装功能性过氧化物酶体所必需的过氧化物酶体膜蛋白(PMP),其缺失会导致PMP的错误定位,最终导致功能性过氧化物酶体的缺失。检测GFP-SKL(GFP与过氧化物酶体靶向序列丝氨酸-赖氨酸-亮氨酸融合)的细胞质分布证实,PEX3 KO细胞中缺乏功能性过氧化物酶体。研究者通过回补PEX3-YFP来观察过氧化物酶体从头生物生成的不同阶段。最初,在PEX3存在的情况下观察到管状结构(阶段0),并逐渐转化为囊泡形成(阶段I)。最后,观察到斑点状结构,表明成熟的功能过氧化物酶体形成(阶段II,图一A和B)。使用MitoTracker或抗TOMM20抗体对线粒体进行染色,研究在此过程中PEX3与线粒体的亚细胞定位。在阶段0,PEX3-YFP仅位于线粒体上,表现为与MitoTracker和TOMM20共定位(图一C和D);在阶段II,PEX3-YFP位于成熟的过氧化物酶体上,与mCherry-SKL和ABCD3共定位(图一C和D)。而阶段I是一个中间过渡阶段,此时PEX3-YFP在线粒体(连续管状结构)和过氧化物酶体前体(点状结构)上双重定位。进一步验证阶段I细胞中含有PEX3-YFP的点状结构是否是过氧化物酶体前囊泡,对细胞进行另一种PMP PEX14的染色。在没有过氧化物酶体的情况下,PEX14定位在线粒体上;过表达PEX3-YFP后,PEX14与PEX3-YFP共定位在过氧化物酶体前体中(图一E)。结构光照明显微成像(SIM)发现PEX3-YFP为圆形结构,表明囊泡的形成(图一F)。以上数据表明,在PEX3敲除细胞中外源表达PEX3,可以从线粒体重建过氧化物酶体的从头生物合成。
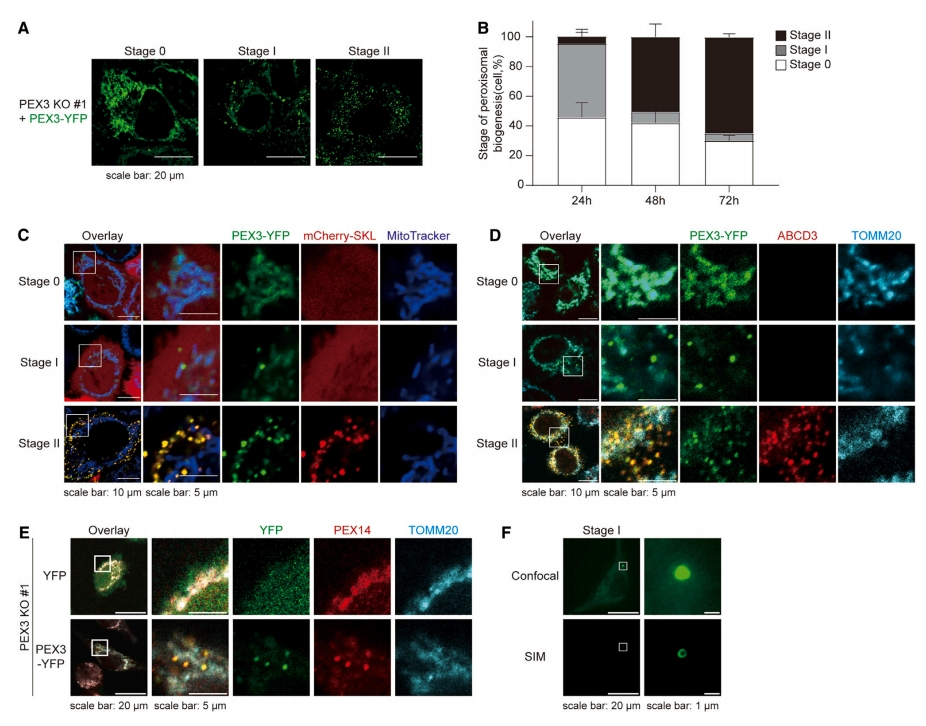
图一 PEX3-YFP可在过氧化物酶体缺陷细胞中恢复过氧化物酶体的从头合成[12]
接着,研究者探究MARCH5在过氧化物酶体从头生物合成中的作用。构建MARCH5和PEX3双敲除细胞系(DKO),比较过氧化物酶体在PEX3 KO和DKO细胞中的生物合成。当重新引入PEX3-YFP可以恢复PEX3 KO细胞中的过氧化物酶体,表现为PEX3-YFP和ABCD3在线粒体外的共定位(图二A-C)。然而,在没有MARCH5的情况下,PEX3-YFP和ABCD3都仅在线粒体上共定位(图二A-C),表明没有形成新的过氧化物酶体,mCherry-SKL检测进一步证实了这一点。在DKO细胞中,PEX3-YFP保留在线粒体上,mCherry-SKL均匀分布在细胞质中(图二D)。统计分析证实,在没有功能性MARCH5的情况下,过氧化物酶体的从头生物合成被完全抑制(图二C)。出乎意料的是,还观察到ABCD3在DKO细胞线粒体上表达和定位,而在PEX3 KO细胞中没有(图二A和E)。ABCD3在PEX3 KO细胞中无法检测到,可能是由于缺乏过氧化物酶体。新形成的过氧化物酶体恢复了ABCD3和另一种PMP PEX11b的表达。在缺乏MARCH5的DKO细胞中,观察到ABCD3而非PEX11b表现出内源性表达,与外源性PEX3表达无关(图二E)。MARCH5作为一种泛素连接酶,在过氧化物酶体上靶向ABCD3进行泛素化[11],提示很可能MARCH5介导了ABCD3在线粒体上的降解。MARCH5蛋白由三个不同的组成部分组成,研究者发现MARCH5蛋白的RING结构域和C端细胞质结构域(CTD)在MARCH5介导的过氧化物酶体从头生物生成中有着重要作用。以上数据表明,MARCH5是介导线粒体来源的过氧化物酶体从头生物合成所必需的。
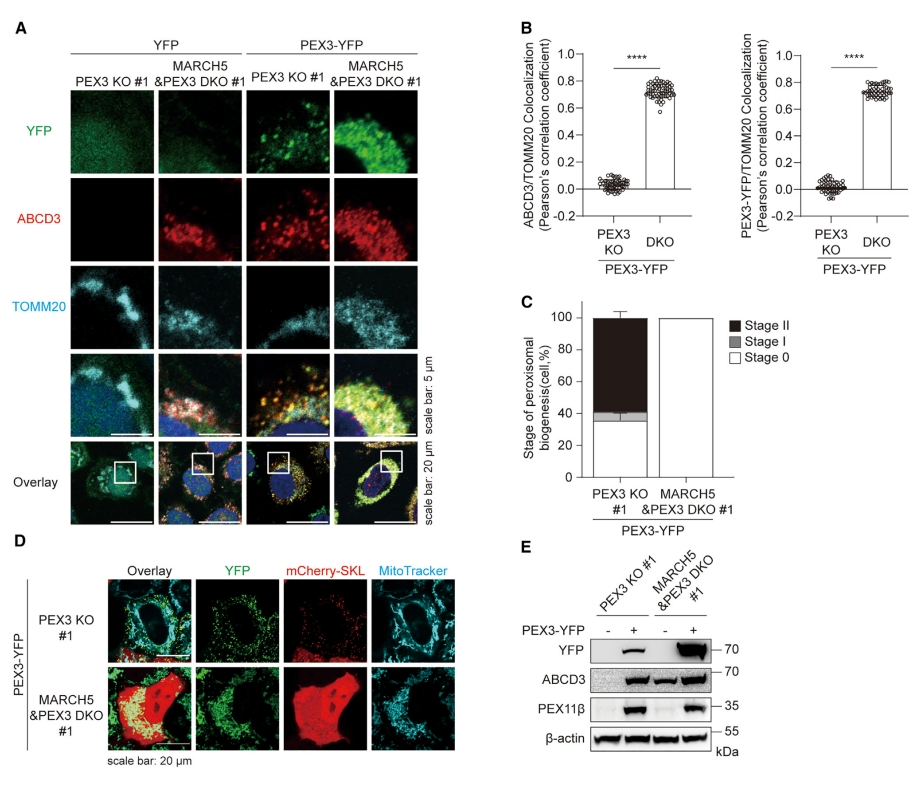
图二 MARCH5的缺失阻断了线粒体来源的过氧化物酶体从头生物合成[12]
来源于线粒体的过氧化物酶前体可被视为一种形式的MDV,因此过氧化物酶体缺陷细胞是研究MDV的良好模型。在没有过氧化物酶体的情况下,多种过表达的过氧化物酶体蛋白质会定位到线粒体,可能影响线粒体质量控制[13]。为了测试含有PEX3的过氧化物酶前体是否在线粒体质量控制的监测范围内,研究者用自噬抑制剂氯喹(CQ)处理细胞。在CQ存在的情况下,除了成熟的功能性过氧化物酶体,还有一部分PEX3阳性囊泡缺乏基质蛋白mCherry-SKL(图三A)。计算所有含PEX3的囊泡(YFP阳性)中过氧化物酶体前体(YFP阳性,mCherry阴性)的百分比(图三B),发现过氧化物酶体前体的数量随着CQ处理而增加。表明在正常条件下,这些含PEX3的囊泡在成熟为功能性过氧化物酶体之前会持续降解(图三C)。PEX19是一种与PEX3共同参与过氧化物酶体膜蛋白易位的胞质蛋白伴侣蛋白。为了进一步细化过氧化物酶体的出芽步骤和成熟步骤,研究者建立了PEX19敲除细胞系(PEX19 KO),由于缺乏PEX19,过氧化物酶体成熟应该被阻断。PEX3-YFP主要定位在PEX19 KO细胞的线粒体上,但在CQ处理后出现大量线粒体外PEX3-YFP囊泡(图三D和E)。这一结果进一步证实了PEX3从线粒体出芽,形成过氧化物酶体前体样囊泡,如果不能成熟为功能性过氧化物酶体,这些囊泡则会迅速降解(图三F)。在PEX19 KO细胞中实时监测含有PEX3的囊泡的形成。在72分钟的观测时长中,PEX3-YFP最初位于线粒体上,与MitoTracker信号重叠;随后,在同一位置YFP信号逐渐增加,同时MitoTracker信号减少;最终,含有PEX3的囊泡与线粒体分离(图三G)。SIM成像显示PEX3-YFP斑点的囊泡结构(图三H)。以上数据表明,含有PEX3的囊泡由线粒体主动形成,随后降解或成熟为过氧化物酶体。
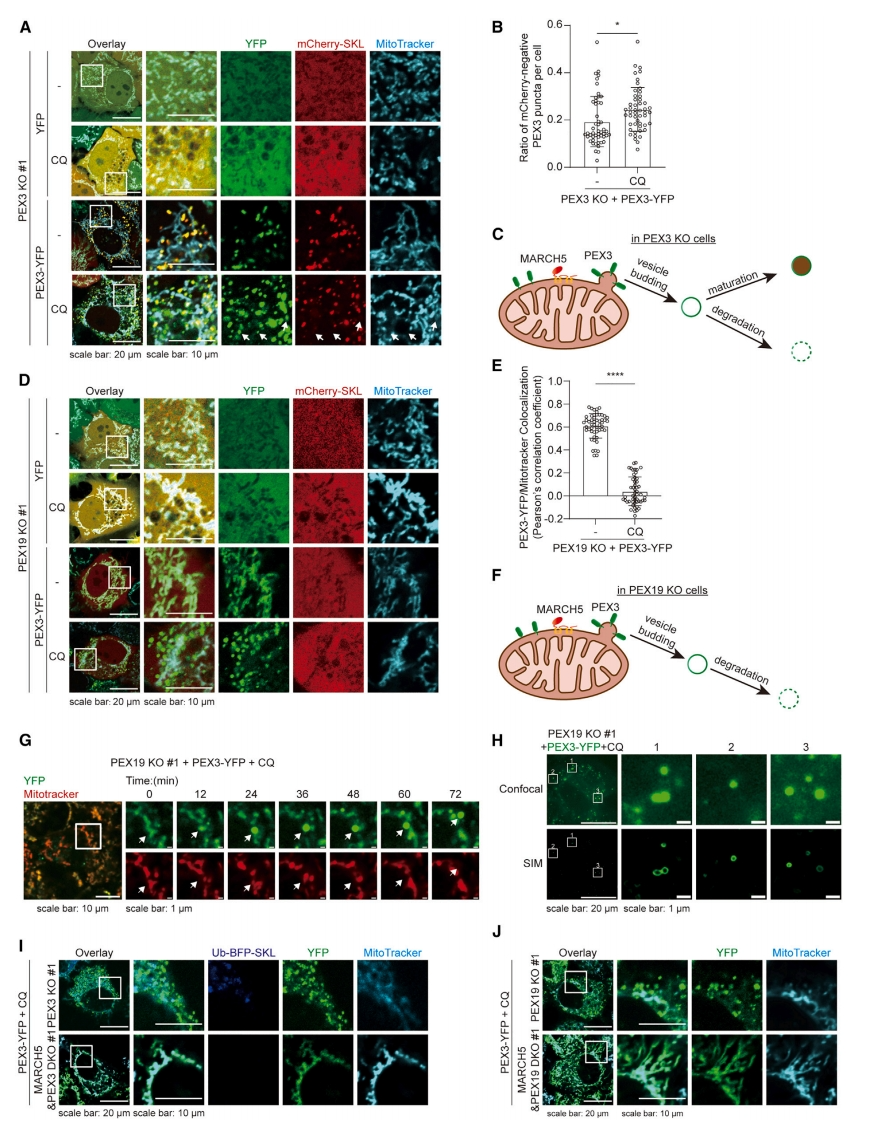
图三 PEX3从线粒体出芽形成囊泡[12]
在MARCH5和PEX3 DKO细胞中,没有形成过氧化物酶体。尚不清楚MARCH5的缺失是否会影响过氧化物酶体前体的产生或降解,从而导致过氧化物酶酶体前体的缺失。为了区分这两种可能性,研究者在MARCH5和PEX3 DKO细胞中引入了PEX3-YFP,并用CQ处理细胞,结果显示线粒体外未观察到PEX3-YFP斑点(图三I),表明MARCH5调节线粒体过氧化物酶体的生物合成。进一步探究MARCH5在线粒体介导过氧化物酶体生物合成中的具体作用,确定MARCH5是否参与了这一过程中的囊泡出芽或成熟。研究者构建了MARCH5和PEX19双敲除细胞系。在PEX19 KO细胞中,过表达的PEX3-YFP经CQ处理后能形成囊泡,但在MARCH5和PEX19 DKO细胞中仅定位于线粒体上(图三J),表明没有MARCH5就不能形成含PEX3的囊泡。以上数据表明,MARCH5调控线粒体的PEX3囊泡出芽。
最后,研究者探索其他过氧化物酶体膜蛋白能否诱导MDV的形成,表达荧光蛋白融合另外两种PMP,PEX12和PEX26。这两种蛋白质都靶向PEX3敲除细胞中的线粒体。然而 ,在CQ存在的情况下,观察到PEX26没有与线粒体共定位,形成了PEX26囊泡,但PEX12不能形成囊泡(图四A和B)。研究者构建了泛素化的Ub-GFP SKL,可防止内源性去泛素化酶的切割。在细胞质中,Ub-GFP SKL可被泛素-蛋白酶体系统快速降解,但一旦定位于过氧化物酶体/囊泡就受到保护。即只有形成成熟的过氧化物酶体,才会观察到GFP信号。尽管PEX26和PEX3都能形成线粒体外囊泡,但只有PEX3囊泡能成熟为过氧化物酶体(图四A)。MARCH5的缺失并不影响PEX26囊泡的形成(图四C和D)。SIM成像进一步验证含有PEX26的斑点是囊泡(图四E)。与PEX3囊泡相比,PEX26囊泡的形成独立于MARCH5(图四F)。以上数据表明,MARCH5特异性地控制线粒体来源PEX3阳性囊泡的形成,这是过氧化物酶体从头生物合成的主要步骤之一。
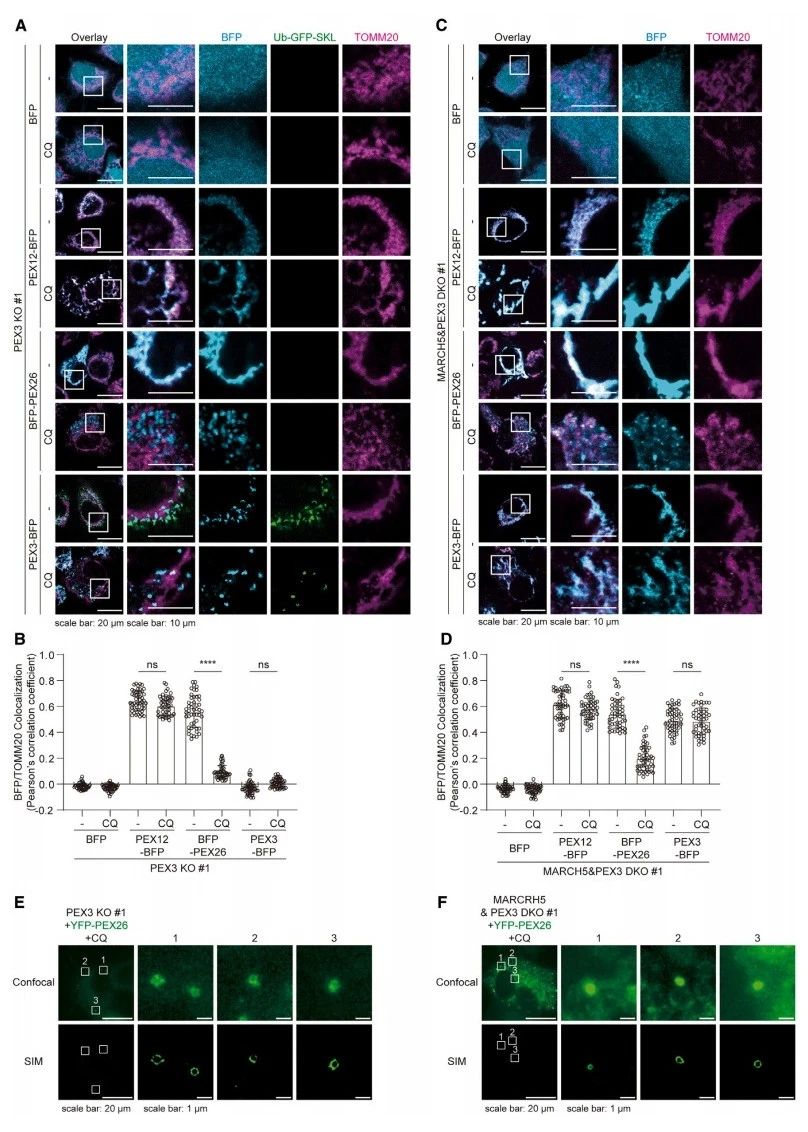
图四 MARCH5的缺失特异性抑制PEX3囊泡的出芽步骤[12]
综上所述,该研究发现了泛素连接酶MARCH5在过氧化物酶体从头生物合成中至关重要。MARCH5缺失通过阻断线粒体PEX3囊泡的出芽,进而阻断过氧化物酶体前体的形成。此外,MARCH5选择性调控线粒体中PEX3囊泡的出芽,而不影响其他的如线粒体来源PEX26囊泡。该研究揭示了MARCH5和PEX3在线粒体来源过氧化物酶体前体的形成中起着不可或缺的作用,丰富了过氧化物酶体从头生物合成的机制,为调控细胞内过氧化物酶体功能提供了潜在靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Hoepfner D, Schildknegt D, Braakman I, Philippsen P, Tabak HF: Contribution of the endoplasmic reticulum to peroxisome formation. Cell 2005, 122(1):85-95.
2. Sugiura A, Mattie S, Prudent J, McBride HM: Newly born peroxisomes are a hybrid of mitochondrial and ER-derived pre-peroxisomes. Nature 2017, 542(7640):251-254.
3. Uoselis L, Nguyen TN, Lazarou M: Mitochondrial degradation: Mitophagy and beyond. Molecular cell 2023, 83(19):3404-3420.
4. Youle RJ, Narendra DP: Mechanisms of mitophagy. Nature reviews Molecular cell biology 2011, 12(1):9-14.
5. McLelland GL, Soubannier V, Chen CX, McBride HM, Fon EA: Parkin and PINK1 function in a vesicular trafficking pathway regulating mitochondrial quality control. Embo J 2014, 33(4):282-295.
6. Soubannier V, Rippstein P, Kaufman BA, Shoubridge EA, McBride HM: Reconstitution of mitochondria derived vesicle formation demonstrates selective enrichment of oxidized cargo. PloS one 2012, 7(12):e52830.
7. König T, Nolte H, Aaltonen MJ: MIROs and DRP1 drive mitochondrial-derived vesicle biogenesis and promote quality control. 2021, 23(12):1271-1286.
8. Neuspiel M, Schauss AC, Braschi E, Zunino R, Rippstein P, Rachubinski RA, Andrade-Navarro MA, McBride HM: Cargo-selected transport from the mitochondria to peroxisomes is mediated by vesicular carriers. Current biology : CB 2008, 18(2):102-108.
9. Kim HJ, Nagano Y, Choi SJ, Park SY, Kim H, Yao TP, Lee JY: HDAC6 maintains mitochondrial connectivity under hypoxic stress by suppressing MARCH5/MITOL dependent MFN2 degradation. Biochemical and biophysical research communications 2015, 464(4):1235-1240.
10. Fang L, Hemion C, Goldblum D, Meyer P, Orgül S, Frank S, Flammer J, Neutzner A: Inactivation of MARCH5 prevents mitochondrial fragmentation and interferes with cell death in a neuronal cell model. PloS one 2012, 7(12):e52637.
11. Zheng J, Chen X, Liu Q, Zhong G, Zhuang M: Ubiquitin ligase MARCH5 localizes to peroxisomes to regulate pexophagy. 2022, 221(1).
12. Zheng J, Chen J, Cao Z, Wu K, Wang J, Guo Y, Zhuang M: Ubiquitin ligase MARCH5 controls the formation of mitochondria-derived pre-peroxisomes. Developmental cell 2024.
13. Nuebel E, Morgan JT: The biochemical basis of mitochondrial dysfunction in Zellweger Spectrum Disorder. 2021, 22(10):e51991.



