技术分享:肝脏X受体促进肠道损伤再生并抑制肠癌发生
机体的屏障组织持续不断受到环境压力的挑战,因此必须适应和建立相应程序来保护组织的完整性。例如,感知损伤后,肠道屏障会触发促进组织修复的分子和细胞程序。为实现这一目标,位于隐窝基底部的肠道干细胞(ISC)与生态位上的邻近细胞进行动态相互作用,进而提供信号来调节ISC功能[1]。这种调节对于开发基于ISC再生治疗肠道屏障缺失相关慢性疾病的疗法至关重要,如炎症性肠病和移植物抗宿主病[2]。然而,过度再生与肿瘤转化密切相关[3],拟制定出仅促进再生却无肿瘤发生风险的治疗策略十分有限。目前尚不清楚ISC及其生态位是如何适应损伤并随后触发再生进程,同时又不引起肿瘤发生。
2024年11月,Nature期刊在线报道了一项研究,发现肝脏X受体(LXR)通路激活是一种组织对损伤的适应,可调节肠道再生和抑制肿瘤发生。具体来说,肠上皮细胞中LXR的激活可诱导双向调节蛋白Areg,增强再生反应。该反应是由LXR配体产生酶CYP27A1所协调,其在损伤肠隐窝生态位中表达上调。敲除Cyp27a1会损害肠道再生,而补充外源性LXR激动剂可以挽救其肠道再生。在肿瘤模型中,Cyp27a1缺陷导致肿瘤生长增加,而LXR激活可引起依赖于适应性免疫的抗肿瘤反应。该研究确定了一种上皮细胞对损伤的适应机制,其中LXR起着变阻器的作用,一边促进组织修复,一边限制肿瘤发生[4]。
首先,研究者推测不同组织和损伤模型之间可能共享着一种保守的调控机制,既能促进损伤再生又能限制肿瘤发生。为挖掘肠道损伤再生的核心特征,将经辐照和右旋糖酐硫酸钠盐(DSS)损伤诱导再生的小肠(SI)和结肠与其稳态进行转录组学比较。两种损伤诱导模型之间共享245个差异表达基因(DEG),进行KEGG通路分析发现胆固醇代谢在损伤反应中保守上调,其中Abca1、Apoc3、Apoa1和Apoa4四个基因受到核受体LXR的转录调控。LXR是胆固醇稳态的核心调节因子。与小肠的稳态条件(0 d.p.i.)相比,辐照后3天(3 d.p.i.)Abca1转录被广泛诱导(图一a)。使用Lgr5和Abca1的RNA原位杂交(RNAscope)分析,观察到在3 d.p.i.时小肠隐窝中Abca1转录本的显著诱导(图一b),并通过定量PCR(qPCR)在辐射和DSS诱导的损伤再生小肠隐窝得到了证实(图一c和d)。为评估LXR激活在损伤反应中的作用,研究者给野生型(WT)小鼠饮食中添加LXR激动剂GW3965,分析损伤后的肠道组织。与标准饮食小鼠相比,喂食GW3965的小鼠在辐照和DSS诱导损伤后,隐窝面积增加,组织病理学评分降低(图一e和f)。为确定这种保护作用是由于损伤减少还是再生增强,研究者分别分析了隐窝细胞的死亡和增殖。在1 d.p.i.,观察到两个饮食组中切割的半胱氨酸天冬氨酸蛋白酶3阳性(cCASP3+)细胞数量显著增加,ISC标志物Olfm4表达降低,表明无论体内LXR激活如何,辐照后隐窝损伤相似。与标准饮食小鼠相比,GW3965喂养小鼠在3 d.p.i时小肠隐窝中Olfm4转录显著上调,同时存活隐窝增加约10%,5 d.p.i时每个隐窝的BrdU+ 细胞数量增加(图一g)。此外,仅在DSS停药后的恢复阶段给予GW3965饮食也能诱导结肠隐窝细胞增殖(图一h)和结肠长度增加(图一i), 表明LXR激活促进了肠道隐窝细胞的增殖,而不是保护其免受损伤。为了在功能上证实LXR激活在损伤反应中的促再生作用,用DSS处理小鼠7天,同时喂食标准或GW3965饮食。在第9或10天,在没有额外刺激的情况下体外培养远端小肠隐窝,评估其形成类器官的能力。使用新生类器官出芽作为再生生长的指标,观察到体内LXR激活增强了肠上皮再生,每个类器官的新生芽数量增加,且相对富集在具有更多新生芽的类器官上(图一j)。以上数据表明,LXR激活是对损伤的适应性反应,可促进小肠和结肠的肠上皮再生。
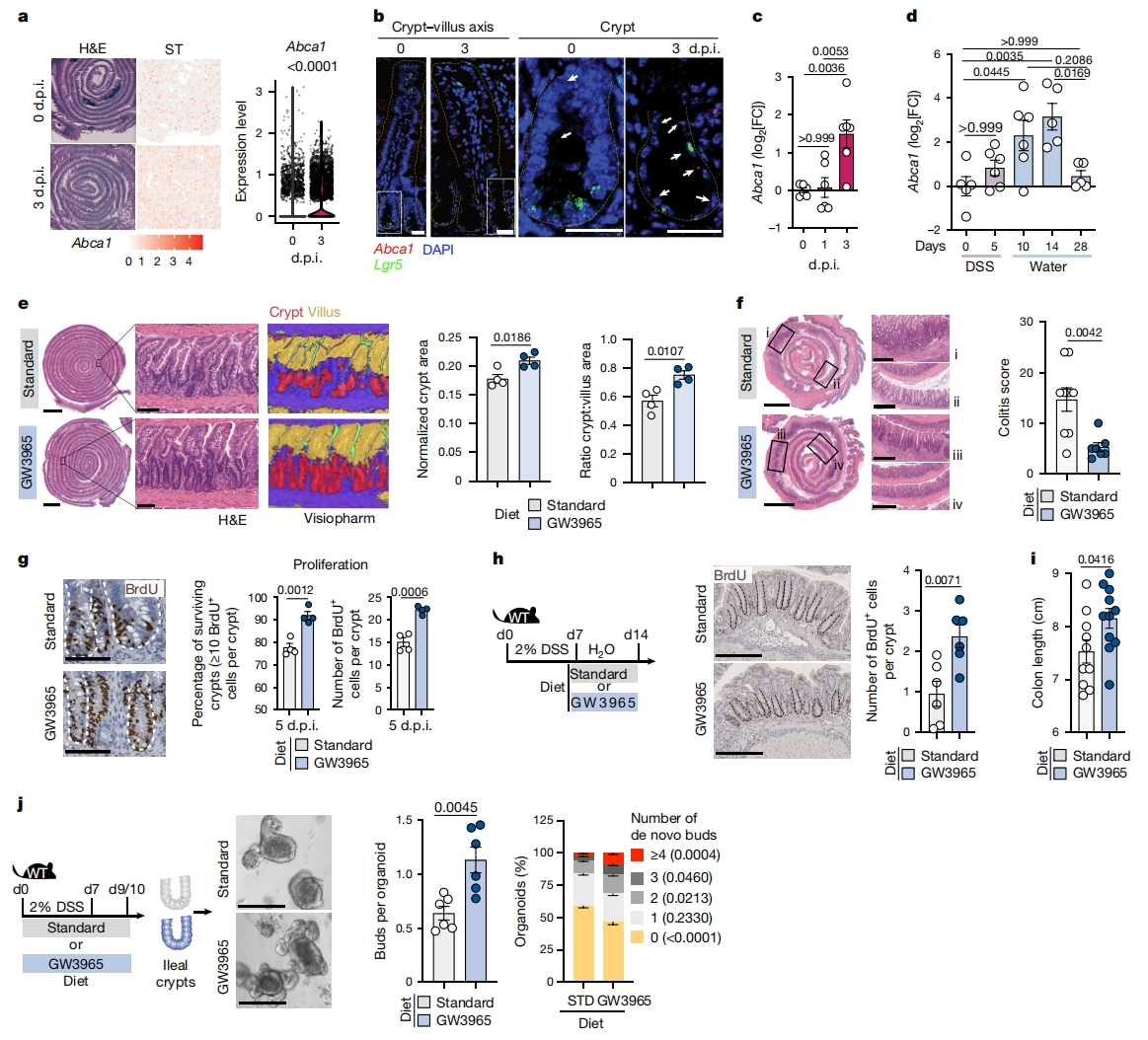
图一 LXR的体内激活可促进损伤后的肠道再生[4]
接下来,研究者测试LXR激活是否以肠上皮细胞(IEC)自主的方式驱动肠道再生。构建IEC特异性缺失两种LXR亚型的条件性敲除小鼠Villin-cre:Nr1h3fl/flNr1h2fl/fl(简称LXRΔIEC小鼠,Nr1h3和Nr1h2分别编码LXRα和LXRβ)。LXRΔIEC小鼠肠道在稳定状态下没有任何表型变化。然而,当暴露于辐照诱导损伤时,LXRΔIEC小鼠的存活隐窝数量与对照相比显著减少(图二a)。为从机理上剖析IEC内在LXR激活如何诱导再生,体外培养小肠隐窝类器官,并用GW3965或DMSO进行刺激[5]。GW3965处理导致Abca1表达增加,再生生长增强,具有较多新生芽的类器官显著富集(图二b),并排除了非上皮细胞的污染。在体外LXR激活后,表皮生长因子(EGF)家族配体Areg、Ereg、Tgfa和Egf的表达持续且显著增加(图二c)。由于标准的类器官培养基中包含EGF,如果从培养基中去除EGF,LXR的激活可能会弥补EGF的缺乏。事实上,LXR激活诱导了仅用NR培养基(noggin和R-spondin)培养类器官的再生增强(图二d-f)。以上数据表明,LXR激活促进了EGFR家族配体的表达,推动了肠上皮再生。
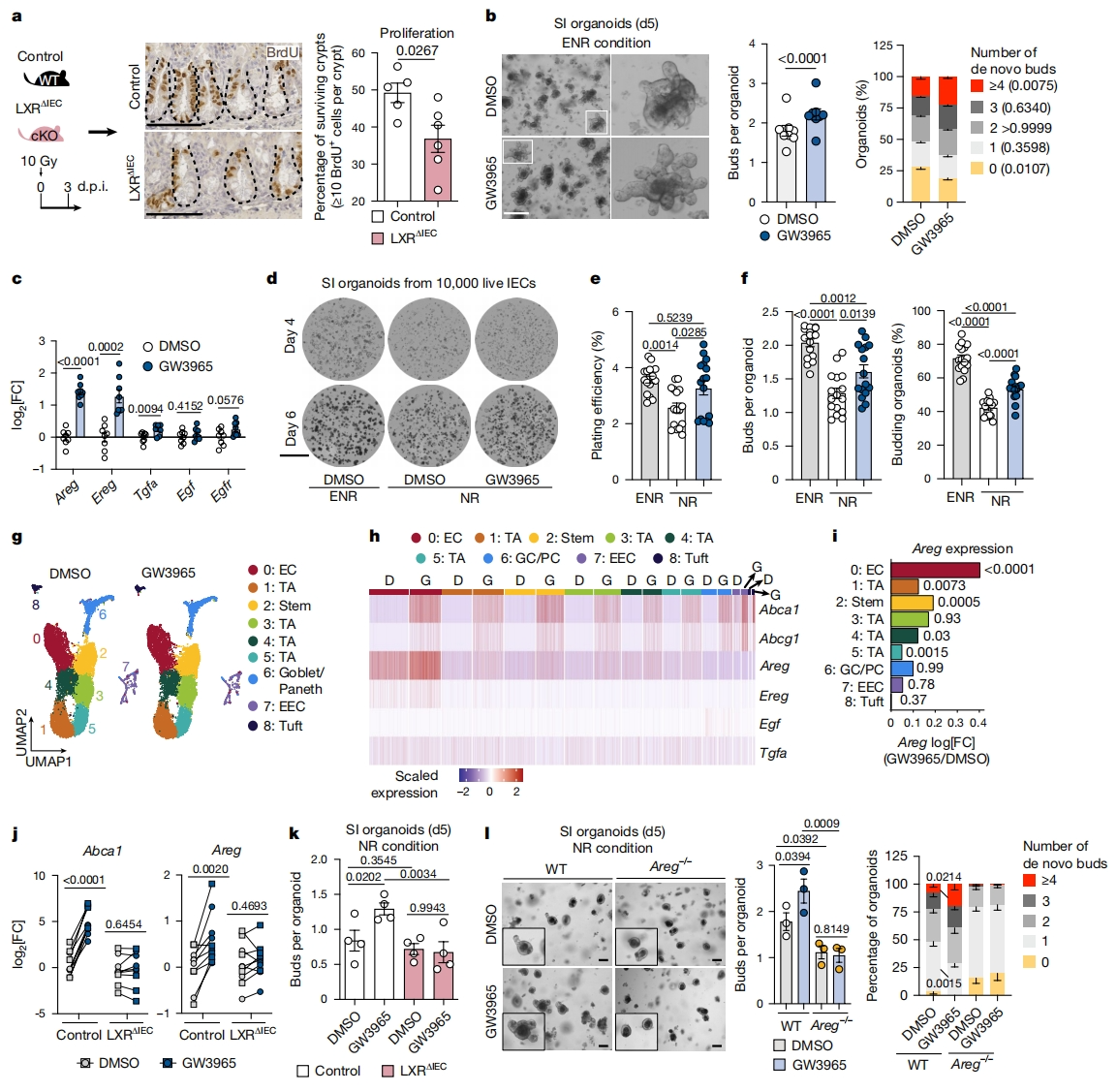
图二 LXR通过诱导上皮双向调节蛋白促进肠道再生[4]
随后,研究者探索在NR条件培养类器官中LXR介导的促再生机制。对DMSO和GW3965处理的小肠类器官的EPCAM+ IEC进行scRNA-seq分析,显示了九种不同的细胞类群,包含了所有主要的IEC类型(图二g)。对Abca1表达分析表明,所有IEC类型都对LXR激活有反应,不同细胞簇之间没有显著差异(图二h)。对scRNA-seq数据集中最常见的生态位途径,即WNT、notch和EGFR家族配体调查显示,Areg是最突出的上调基因,广泛在IEC中GW3965刺激后差异表达(图二h-i)。而来自LXRΔIEC小鼠的类器官在用GW3965刺激后没有上调Areg(图二j),同时消除了再生(图二k)。表明IEC中LXR活性对于诱导Areg表达和促进肠道再生是必要的。研究者还在WT小鼠的小肠类器官中使用AREG中和抗体,并获得Areg-/-小鼠隐窝类器官,观察到无论是阻断还是由于缺乏AREG,LXR诱导的促再生效应都会被消除(图二l)。以上数据表明,LXR激活通过转录调控促再生介质如Areg来促进再生。
下一步, 研究者深入探究损伤后可能激活LXR的内源性配体。研究产生羟固醇的途径,这些羟固醇是由细胞色素P450单加氧酶家族成员Cyp27a1、Cyp46a1、Cyp1a1和Ch25h从胆固醇中合成的[6](图三a)。重新审视再生小肠隐窝scRNA-seq数据集(图三b)、已发表的结肠活检RNA测序(RNA-seq)数据集[7](图三c)以及DSS诱导的损伤修复过程中回肠隐窝的qPCR(图三d),观察到这些再生阶段Cyp27a1表达的选择性增加。小肠免疫组化显示,在辐照诱导的肠损伤后,CYP27A1被诱导上调(图三e)。在持续辐照诱导损伤修复的小肠中,采用FACS分选上皮(EPCAM+CD45−)、免疫(EPCAM−CD45+)和DN(EPCAM-CD45-)细胞进行检测,发现1 d.p.i.时IEC中Cyp27a1的表达显著上调(图三f),同时LXR靶基因Abca1也增加(图三g)。进一步研究CYP27A1是否是促进体内LXR依赖性肠再生所必需的。与同窝对照组相比,全身辐照Cyp27a1-/-小鼠的IEC显示出Cyp27a1和Abca1减少(图三h),存活隐窝减少,而GW3965饮食激活LXR挽救了隐窝细胞增殖(图三i)。此外,研究者测试该通路对人类损伤的保守反应,观察到与缓解期患者相比,在活动性溃疡结肠炎患者的末端回肠和结肠中CYP27A1和ABCA1的表达都有所增加(图三j)。以上数据表明,ISC对损伤生态位具有适应性,其中Cyp27a1在损伤反应中上调,驱动IEC中LXR激活并促进肠道再生。
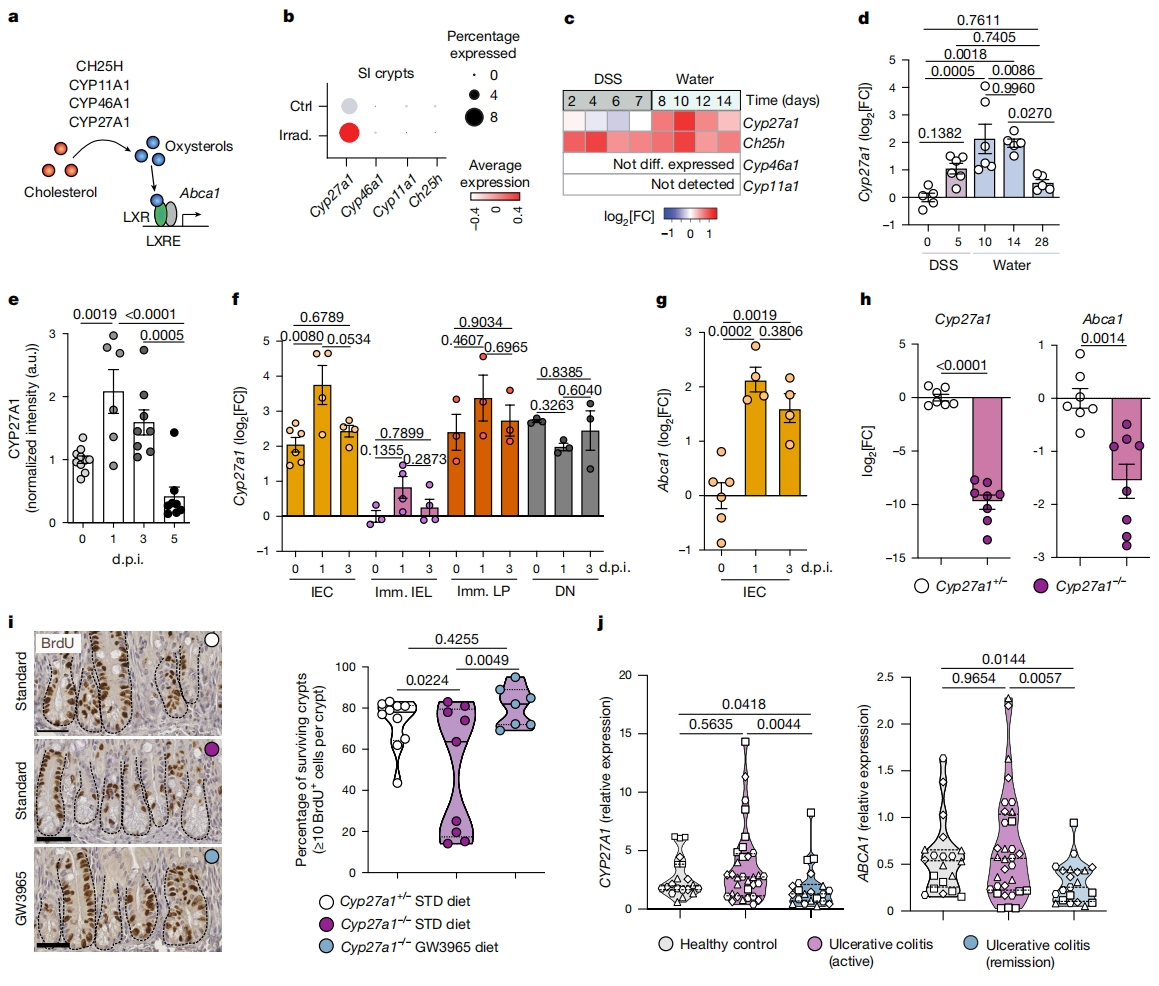
图三 CYP27A1在肠道损伤期间上调,促进肠道再生[4]
最后,研究者探索LXR对肠道肿瘤发生的影响。使用氮氧甲烷(AOM)-DSS炎症驱动的癌症(CRC)模型,观察到WT 小鼠中LXR激活后肿瘤数量和大小的减少(图四a)。而用AOM-DSS处理的Cyp27a1-/-小鼠显示出更多且更大的肿瘤,对其使用GW3965处理可挽救这种表型(图四b)。为研究LXR介导的抗肿瘤机制,研究者对标准或GW3965饮食的AOM-DSS WT小鼠结肠组织进行RNA-seq分析。根据宏观的肿瘤情况选择分析时间点,第22天两组都没有肿瘤,第43天几乎只在标准饮食小鼠中观测到肿瘤,第70天在GW3965和标准饮食喂养的小鼠中都观测到肿瘤的发展。通过差异表达基因的聚类分析,获得九个不同的模块(图四c)。每个模块(m1–m9)由一组在时间点和饮食组中显示相似表达模式的基因定义,使用KEGG通路分析来确定每个模块的富集通路(图四c)。其中,富集在造血细胞谱系和用于IgA产生的肠道免疫网络途径的m5,在22天差异表达上调,后期持续在喂食GW3965的小鼠中上调(图四c)。为评估GW3965喂养的m5基因持续表达是否与三级淋巴结构(TLS)形成和浆细胞特征的增强相关,研究者对AOM-DSS处理第22天和第43天小鼠的结肠组织进行空间转录组学分析,发现AOM-DSS处理的LXR激活在第22天促进了富含B细胞的TLS形成,且在第43天更为显著;GW3965处理结肠在第43天浆细胞的特征广泛表达(图四d)。B细胞标记物B220的免疫组化染色显示,在AOM-DSS处理第70天,喂食GW3965小鼠结肠中B细胞滤泡显著增加(图四e)。为评估适应性免疫的扩展/激活是否在功能上使得LXR激活后观察到的肿瘤形成减少,从第22天开始,在AOM-DSS给药过程中的重复时间点,给两种饮食小鼠的腹腔注射抗CD19和/或抗CD8抗体(图四f)。结果发现,GW3965处理后,同时阻断CD19和CD8显著增加了肿瘤的形成(图四f-g),表明B和T淋巴细胞有助于LXR介导的抗肿瘤反应。以上数据表明,LXR激活可抑制肿瘤发生。
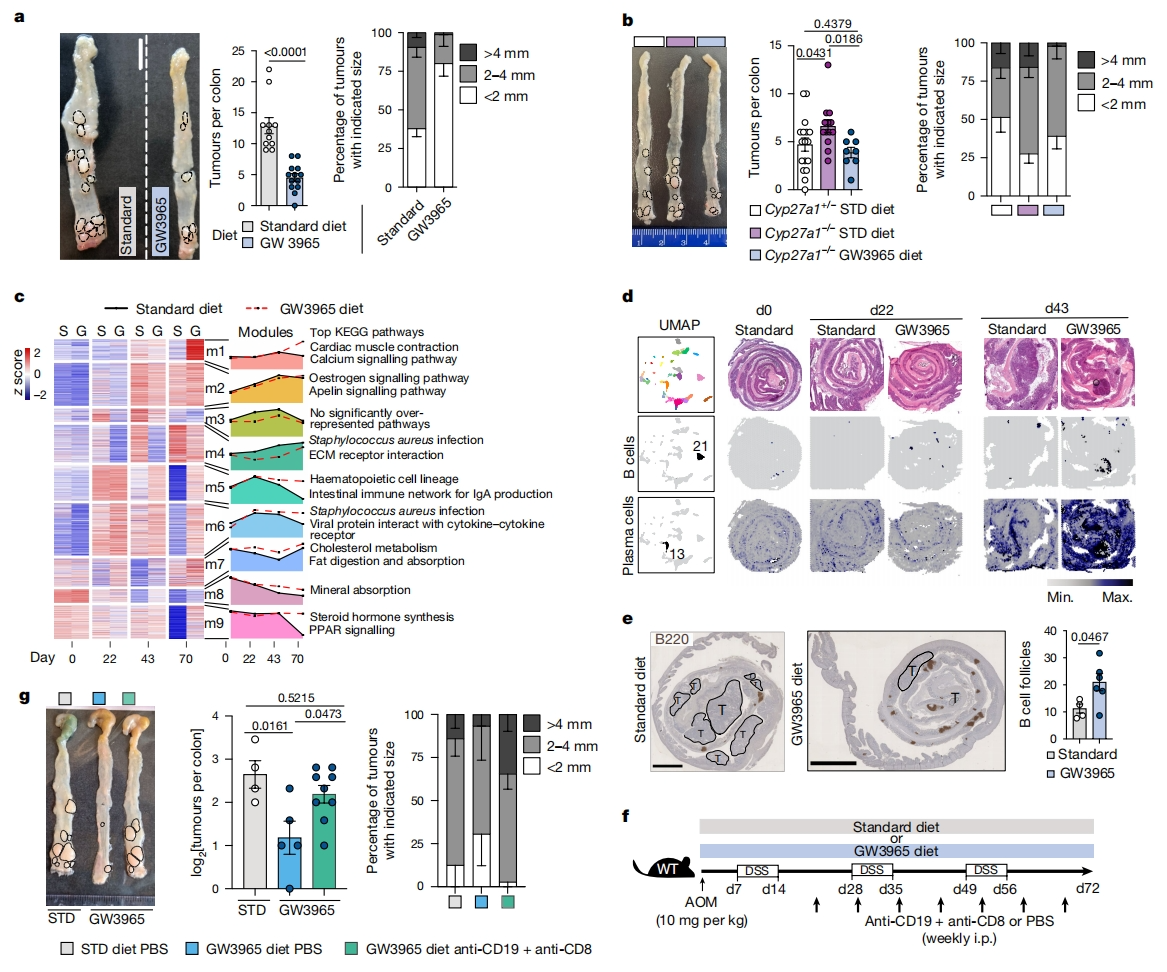
图四 体内激活LXR可抑制肠道肿瘤的发生[4]
综上所述,该研究发现了一种肠上皮细胞对损伤的适应性机制。其中LXR激活起着变阻器的作用,通过降低肿瘤发生的风险,在不损害宿主适应性的情况下修复损伤。肠道损伤诱导LXR激活不仅通过调节ISC生态位衍生的信号如AREG来促进再生,而且通过诱导适应性免疫细胞介导的肿瘤抑制机制来检查其他转化细胞不受控制的增殖,这些反应是由屏障损伤引起的CYP27A1上调来调控的。LXR激活可能代表了一种跨组织、跨损伤模型和跨物种的保守通路,维持体内稳态的平衡。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Bankaitis ED, Ha A, Kuo CJ, Magness ST: Reserve Stem Cells in Intestinal Homeostasis and Injury. Gastroenterology 2018, 155(5):1348-1361.
2. Lindemans CA, Calafiore M, Mertelsmann AM, O'Connor MH, Dudakov JA, Jenq RR, Velardi E, Young LF, Smith OM, Lawrence G et al: Interleukin-22 promotes intestinal-stem-cell-mediated epithelial regeneration. Nature 2015, 528(7583):560-564.
3. Ge Y, Gomez NC, Adam RC, Nikolova M, Yang H, Verma A, Lu CP, Polak L, Yuan S, Elemento O et al: Stem Cell Lineage Infidelity Drives Wound Repair and Cancer. Cell 2017, 169(4):636-650.e614.
4. Das S, Parigi SM, Luo X, Fransson J, Kern BC, Okhovat A, Diaz OE, Sorini C, Czarnewski P, Webb AT et al: Liver X receptor unlinks intestinal regeneration and tumorigenesis. Nature 2024.
5. Sato T, van Es JH, Snippert HJ, Stange DE, Vries RG, van den Born M, Barker N, Shroyer NF, van de Wetering M, Clevers H: Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature 2011, 469(7330):415-418.
6. Heo GY, Liao WL, Turko IV, Pikuleva IA: Features of the retinal environment which affect the activities and product profile of cholesterol-metabolizing cytochromes P450 CYP27A1 and CYP11A1. Archives of biochemistry and biophysics 2012, 518(2):119-126.
7. Czarnewski P, Parigi SM, Sorini C, Diaz OE, Das S, Gagliani N, Villablanca EJ: Conserved transcriptomic profile between mouse and human colitis allows unsupervised patient stratification. Nat Commun 2019, 10(1):2892.



