技术分享:基质粘弹性促进肝硬化前期肝癌进展
2型糖尿病(T2DM)和肥胖是肝细胞癌(HCC)的重要风险因素。据估计,非酒精性脂肪性肝炎(NASH)中高达30%的HCC发生在肝硬化前期阶段,此时基质刚度仍然很低,这些患者往往血糖控制较差[1]。2型糖尿病的特征是在细胞外基质(ECM)中伴有晚期糖基化终末产物(AGE)的积累,然而,这是如何影响非肝硬化条件下的HCC,目前尚不清楚。AGE是由T2DM期间血清或组织蛋白的非酶促糖基化产生的,也可以通过食用高温制备的食物而摄入[2]。随着时间的推移,AGE由于清除和代谢减少而在基质中积累,并可以通过生物化学方法修饰胶原蛋白和ECM蛋白[3]。虽然NASH中的AGE没有显著增加刚度,但它们可能会影响ECM的粘弹性。组织和ECM通常具有粘弹性,表现出对机械扰动和随时间变化的机械响应的粘性能量耗散,如响应变形时的应力松弛[4]。有研究表明,ECM粘弹性的变化,独立于刚度,影响细胞行为,包括癌症细胞的增殖和迁移[5]。粘弹性可以调节组织生长动力学、对称性和癌症细胞的生长[6]。AGE介导的ECM机械性能变化在NASH和HCC进展中的作用还有待阐明。
2024年1月,Nature期刊报道了一项研究,发现AGE促进胶原结构的改变,增强ECM的粘弹性,使其具有更大的粘性耗散和更快的应力松弛,但不改变刚度。高AGE和粘弹性促进HCC,而抑制AGE的产生或破坏AGE介导的胶原交联会降低粘弹性,从而抑制HCC。从机制上讲,增强的粘弹性通过整合素-β1–TNS1–YAP轴的机械转导通路促进HCC细胞的增殖和侵袭[7]。
首先,研究者评估AGE的变化对ECM的潜在作用。研究了T2DM、非T2DM和NASH/T2DM患者的肝脏样本的力学特性(图一a)。与非T2DM患者相比,T2DM或NASH/T2DM患者肝脏AGE显著升高(图一b)。原子力显微镜(AFM)发现T2DM患者具有相似的刚度(图一c和d),但在加载-卸载循环下的迟滞面积较高,对应于粘性能量耗散或损耗,表明具有较高的粘弹性(图一e和f)。使用流变学证实非肝硬化NASH/T2DM患者的肝脏具有相似的储能模量,但在恒定变形下具有更高的损耗切线和更快的应力松弛(图一g-k)。研究者构建喂食高AGE饮食(HiAD)的小鼠模型,探究AGE与粘弹性之间的联系。结果发现,与普通饮食或快餐饮食(FFD)的对照小鼠相比,HiAD小鼠表现出脂肪变性、肝细胞膨胀、胰岛素抵抗和更高的肝脏AGE(图一l和m)。AFM和流变学分析显示,HiAD小鼠与对照小鼠的刚度相似(图一n-q),但粘弹性增加(图一o、p、r-t)。值得注意的是,用吡哆胺(PM)抑制AGE的产生或阻止AGE-胶原交联(ALT-711)逆转了粘弹性的变化(图一o和p、r-t)。以上数据表明,肝硬化前ECM中的AGE导致粘弹性增加。
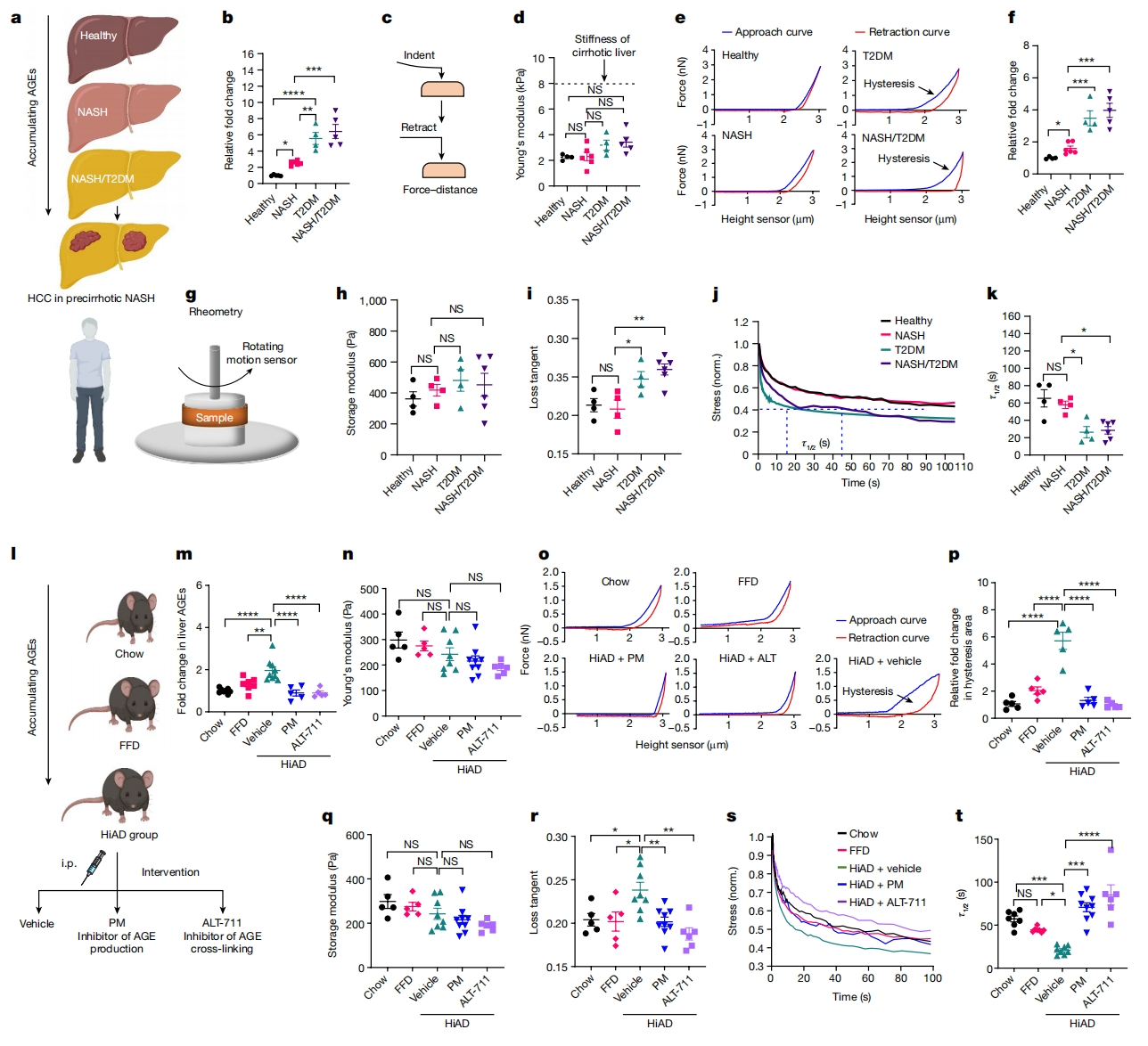
图一 NASH/T2DM患者以及HiAD小鼠的肝脏粘弹性增加[7]
接着,研究者探索ECM粘弹性与HCC进展之间的潜在因果关系。NASH相关HCC的研究通常使用高脂肪饮食结合致癌物二乙基亚硝胺、转基因模型或CDAA饮食[8]。重要的是要遵循HCC发生前以细胞损伤和炎症为特征的典型发病机制。为实验模拟HCC发病前ECM应力松弛增加的情况,研究者使用一个更相关的模型来模拟肿瘤接种前的代谢/基质环境。将含有突变β-catenin或对照载体的人MET(hMET)以流体动力学注射(HDI)方式递送到喂养普通食物、FFD或HiAD小鼠。与普通食物和FFD小鼠相比,HiAD小鼠出现转化病灶更早和生长更快(图二a-c)。在PM抑制AGE或破坏胶原蛋白-AGE交联后,肿瘤生长减少,存活率提高(图二d-g)。接着在HDI之前先递送AAV8-AGER1清除受体来逆转这一情况(图二h)。与对照相比,递送AGER1小鼠具有更高水平的AGER1(图二i)和更低水平的AGE(图二j),表现为刚度相似(图二k),但应力松弛较低(图二l和m)以及转化灶生长减少(图二n和o)。以上数据表明,ECM中的AGE可创造一个更具粘弹性和更具致瘤性的环境,促进HCC发生。
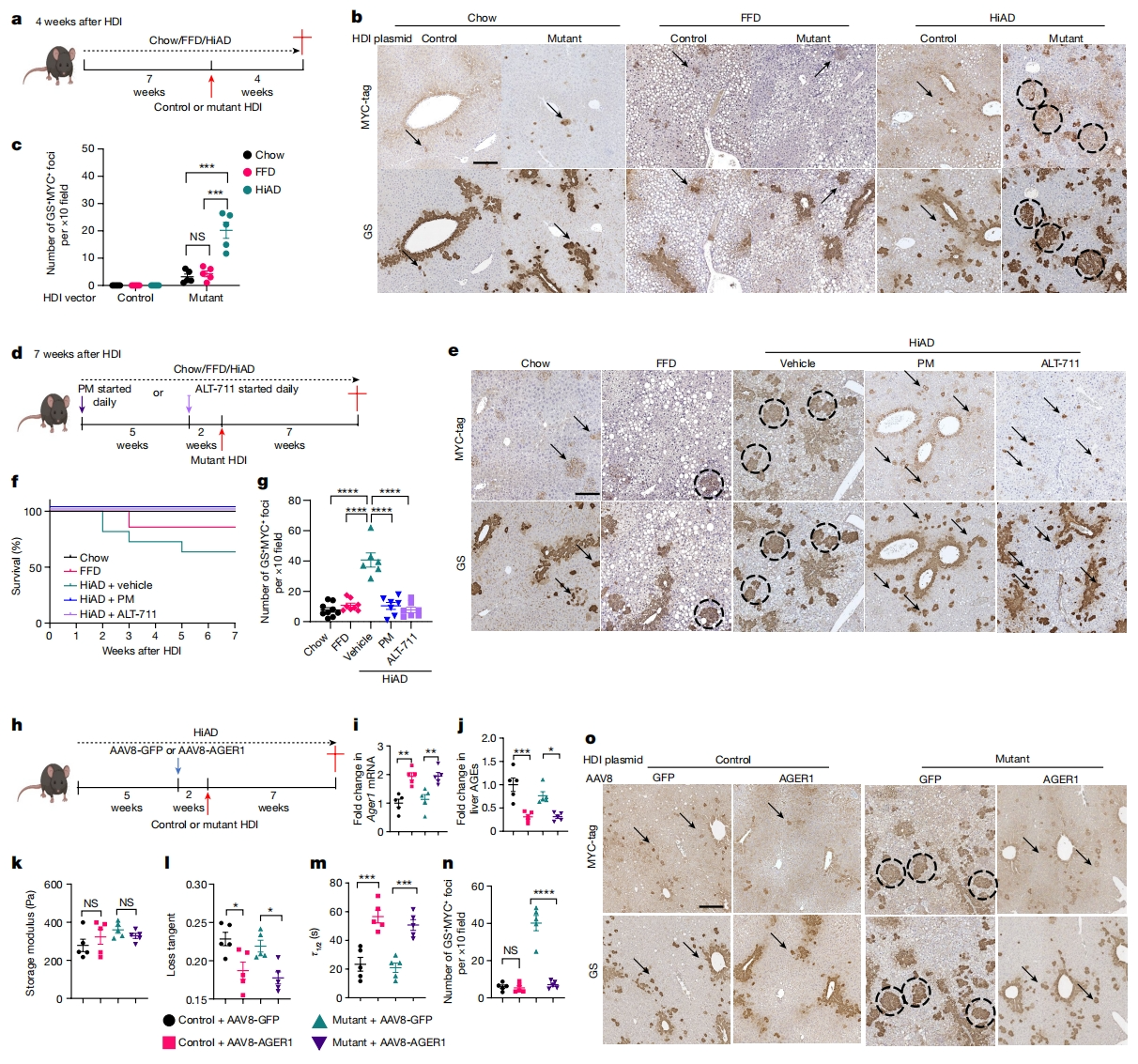
图二 HiAD小鼠出现更多的转化病灶,并表现出AGE依赖性的更高粘弹性[7]
接下来,研究者探究高粘弹性导致肿瘤生长和侵袭的机械传导通路。对正常饮食、FFD、HiAD、HiAD+PM和RAGEHepKO(肝细胞特异性促炎AGE受体RAGE缺失小鼠)小鼠肝脏样本进行RNA测序(RNA-seq)和生物信息学分析,以确定潜在的通路。对HiAD和FFD组之间的差异表达基因进行KEGG分析(图三a)。在Hippo信号通路组中,YAP/TAZ调节的基因在HiAD小鼠中富集,在PM处理后和RAGEHepKO小鼠中减少(图三a)。为证实YAP和TAZ促进了高粘弹性ECM中的HCC,通过HDI将显性负TEA结构域转录因子2(dn-TEAD2)或对照质粒与hMET和突变β-catenin共注射(图三b)。TEAD转录因子家族是YAP和TAZ的重要结合伴侣,尤其是TEAD2与HCC进展有关。结果发现,与对照相比,dn-TEAD2/HDI联合注射后,GS/MYC双阳性病灶数量显著减少,这些病灶对活性核YAP呈阴性(图三c-d)。注射dn-TEAD2后,下游靶点CTGF和CYR61表达下调(图三e)。以上数据表明,YAP促进了高粘弹性ECM中的HCC。
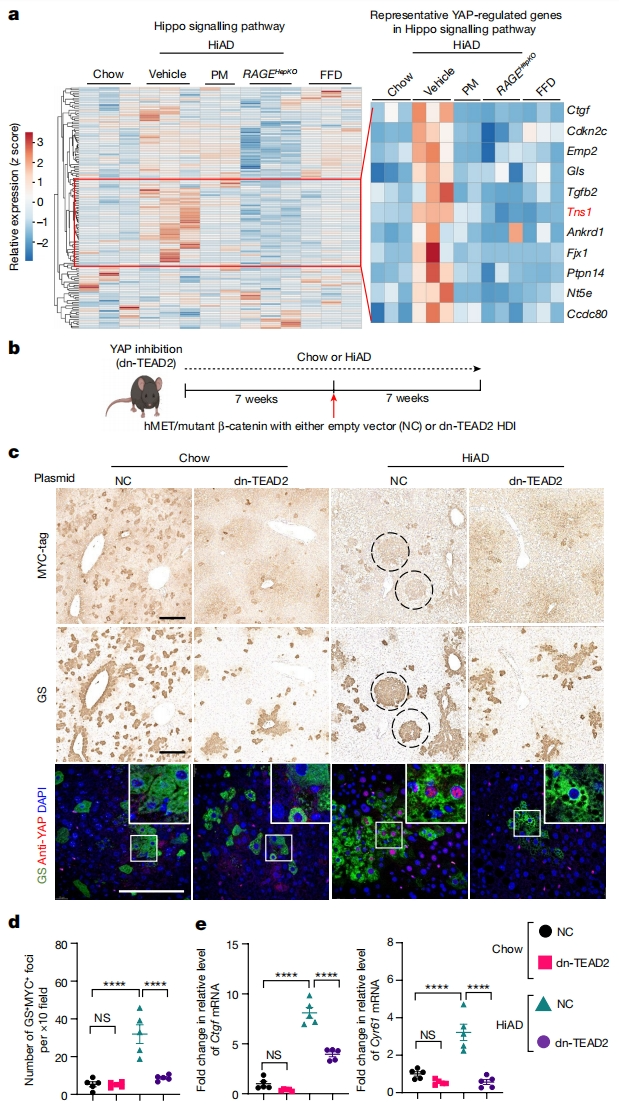
图三 YAP与高粘弹性ECM促进HCC生长有关[7]
最后,研究者探索了粘弹性ECM如何传递增殖和侵袭信号。利用海藻酸盐制成的互穿聚合物网络重建基底膜(rBM)基质水凝胶(rBM-IPN)用于3D培养。HCC细胞被包裹在粘弹性不同的rBM-IPN水凝胶中,具有相同的刚度(图四a)。在高粘弹性凝胶中,细胞表现出增殖增加(图四b-e)、YAP活化(图四c和f)、癌症细胞侵袭和迁移的典型标志物TKS5阳性(也称为SH3PXD2A)和MT1-MMP阳性侵袭性类似结构的形成,以及更细长的形状(图四d和g)。据报道,在处于高粘弹性凝胶的乳腺癌症细胞中,整合素-β1-基质相互作用调节了机械传导[5]。实验证实使用整合素-β1特异性阻断抗体减少了增殖(图四h),下调YAP靶点CTGF(图四i),并增加了细胞圆度(图四j)。根据RNA-seq数据,TNS1以AGE和粘弹性依赖的方式被显著诱导(图三a和图四k)。TNS1是分子离合器的一部分,该离合器调节ECM结合的整合素和肌动球蛋白细胞骨架之间的机械连接,以产生牵引力[9]。因此,为研究在机械信号传导中的作用,研究者在低粘弹性水凝胶和高粘弹性水凝胶中的HCC细胞中进行邻近连接试验(PLA),以捕捉TNS1和整合素-β1之间的潜在相互作用。结果发现,高粘弹性条件促进了它们的相互作用(图四l和m)。利用CRISPR-Cas9敲除TNS1或整合素-β1,发现降低了高粘弹性ECM中的细胞增殖(图四n)以及YAP和靶基因的激活(图四o),侵袭膜形成减少,细胞圆度增加(图四p)。总之,这些数据表明TNS1是分子离合器的一部分,该离合器介导ECM结合的整合素和对高粘弹性作出反应的肌动球蛋白细胞骨架之间的机械连接(图四q)。
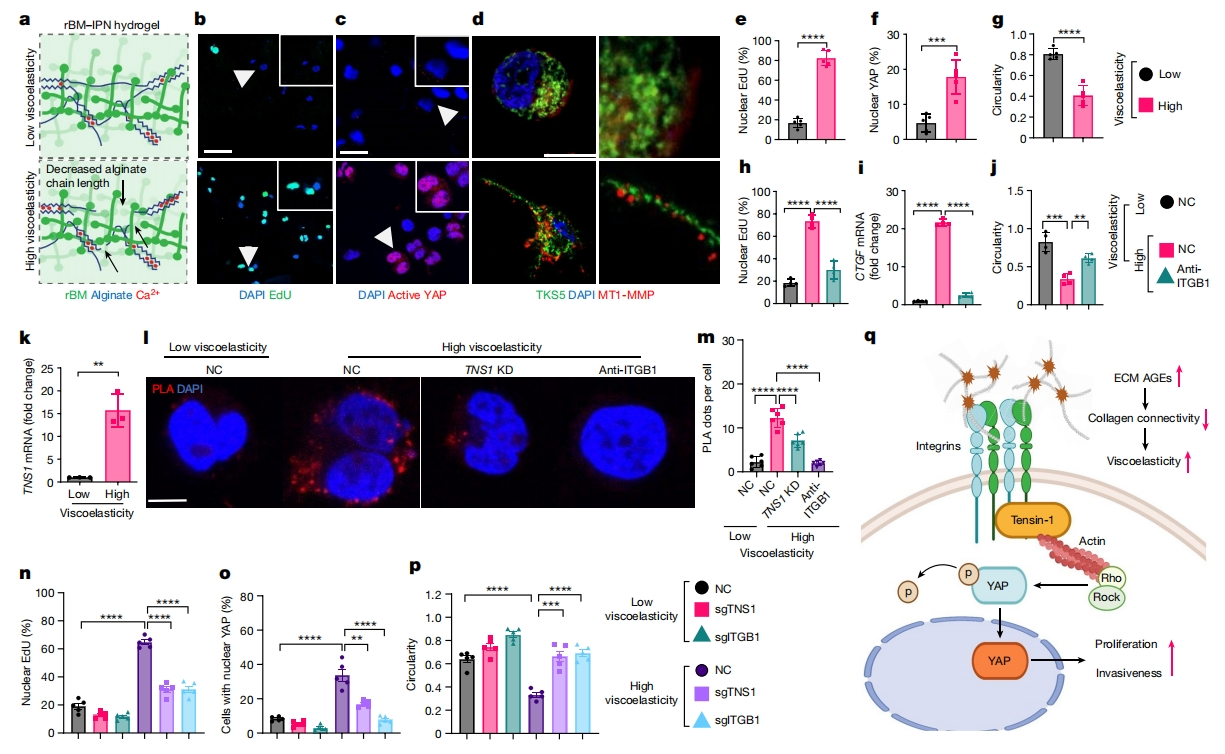
图四 整合素-β1-TNS1-YAP轴介导HCC细胞侵袭的粘弹性特异性机械细胞通路[7]
综上所述,该研究发现肝脏细胞外基质(ECM)中的糖基化终末产物(AGE)产生了一个具有更快应力松弛和高粘弹性的生态位。AGE介导的结构变化增强了ECM的粘弹性,且与刚度无关。增强的粘弹性通过整合素-β1-TNS1-YAP轴的机械转导通路促进HCC的激活。该研究确定了粘弹性在肝肿瘤生态位中的核心作用,粘弹性激活的机械细胞通路有望成为NASH/T2DM相关HCC及其他领域的诊断和/或治疗靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Negro F: Natural history of NASH and HCC. Liver international : official journal of the International Association for the Study of the Liver 2020, 40 Suppl 1:72-76.
2. Henning C, Smuda M, Girndt M, Ulrich C, Glomb MA: Molecular basis of maillard amide-advanced glycation end product (AGE) formation in vivo.J Biol Chem2011, 286(52):44350-44356.
3. Andriotis OG, Elsayad K, Smart DE, Nalbach M, Davies DE, Thurner PJ: Hydration and nanomechanical changes in collagen fibrils bearing advanced glycation end-products. Biomedical optics express 2019, 10(4):1841-1855.
4. Chaudhuri O, Cooper-White J, Janmey PA, Mooney DJ, Shenoy VB: Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature 2020, 584(7822):535-546.
5. Wisdom KM, Adebowale K, Chang J, Lee JY, Nam S, Desai R, Rossen NS, Rafat M, West RB, Hodgson L et al: Matrix mechanical plasticity regulates cancer cell migration through confining microenvironments. Nat Commun 2018, 9(1):4144.
6. Elosegui-Artola A, Gupta A, Najibi AJ, Seo BR, Garry R, Tringides CM, de Lázaro I, Darnell M, Gu W, Zhou Q et al: Matrix viscoelasticity controls spatiotemporal tissue organization. Nature materials 2023, 22(1):117-127.
7. Fan W, Adebowale K, Váncza L, Li Y, Rabbi MF, Kunimoto K, Chen D, Mozes G, Chiu DK, Li Y et al: Matrix viscoelasticity promotes liver cancer progression in the pre-cirrhotic liver. Nature 2024, 626(7999):635-642.
8. Farrell G, Schattenberg JM, Leclercq I, Yeh MM, Goldin R, Teoh N, Schuppan D: Mouse Models of Nonalcoholic Steatohepatitis: Toward Optimization of Their Relevance to Human Nonalcoholic Steatohepatitis. Hepatology 2019, 69(5):2241-2257.
9. Blangy A: Tensins are versatile regulators of Rho GTPase signalling and cell adhesion. Biology of the cell 2017, 109(3):115-126.



