技术分享:交替高脂饮食重编程中性粒细胞加速动脉粥样硬化
由于肥胖和糖尿病的发病率上升,预计未来15年内,动脉粥样硬化相关心血管疾病仍将是全球死亡的主要原因之一[1]。动脉粥样硬化是一种大中型动脉的慢性炎症性疾病,是由含ApoB的脂蛋白(低密度脂蛋白)在内皮下滞留及修饰所引起的反应[2]。炎症激活的内皮细胞协调着不同类型的循环白细胞募集到血管壁,特别是单核细胞。招募的单核细胞随后分化、活化及增殖产生巨噬细胞,促进动脉粥样硬化斑块的生长。已有研究表明,循环中性粒细胞也参与了动脉粥样硬化的早期阶段和斑块破裂[3]。
目前,对于动脉粥样硬化的病理生理学机制研究大部分依赖于连续高脂饮食喂养(HFD)的动物实验,导致慢性高胆固醇血症[4],其引起的全身免疫反应促进动脉粥样硬化的发生、进展和并发症[2]。但是,这一模型与实际患者并不一致,由于季节、社会行为等各种因素的变化,人类饮食习惯变化频繁,致使实际血浆胆固醇水平发生波动。然而,关于交替的高脂饮食(HFD)及其重新暴露在高胆固醇血症对动脉粥样硬化的影响尚不清楚。
2024年9月,Nature期刊报道了一项研究,比较连续的和交替的高脂饮食(HFD)对全身免疫反应和动脉粥样硬化发展的影响,揭示了IL-1β依赖性中性粒细胞祖细胞重编程在交替HFD诱导的促动脉粥样硬化中的作用。该研究发现交替HFD加速了Ldlr-/-和Apoe-/-小鼠动脉粥样硬化的疾病进程。在缺乏T、B和自然杀伤T细胞的Apoe-/-Rag2-/-小鼠中,也能观察到交替HFD的促动脉粥样硬化,排除了适应性免疫系统的影响。机制上,当停止HFD时下调了RUNX1,促进了骨髓髓系祖细胞的炎症信号传导;当重新暴露于HFD后,这些细胞产生IL-1β,导致紧急骨髓细胞生成和血液中性粒细胞水平升高。进而中性粒细胞浸润斑块并释放中性粒细胞胞外陷阱(NET),加剧动脉粥样硬化。特异性耗竭中性粒细胞或抑制IL-1β通路,可消除紧急骨髓细胞生成,并逆转交替HFD的促动脉粥样硬化作用[5]。
首先,研究者探究高胆固醇血症再暴露对动脉粥样硬化的影响。将Ldlr-/-小鼠分为两组:连续高脂饮食(HFD)喂养组先持续8周常规饮食喂养,再连续8周HFD喂养;交替HFD喂养组先进行4周HFD喂养,然后8周常规饮食喂养,最后再4周HFD喂养(图一a)。结果发现,交替HFD会导致血浆胆固醇水平随时间变化,但由于胆固醇总暴露量一样,两组之间的累积胆固醇负荷相似(图一b);两组小鼠体重增加也相似(图一c)。但与连续HFD相比,交替HFD雌鼠动脉粥样硬化程度加剧,主动脉窦(图一d)和胸主动脉(图一e)的粥样硬化斑块更大。交替HFD也加重了Ldlr-/-雄鼠(图一f)以及Apoe-/-雄鼠(图一g)的动脉粥样硬化发展;诱导了向更晚期斑块表型的转变,表现为巨噬细胞含量增加(图一h),坏死核心大小增加(图一i)。以上实验结果表明,交替HFD促进了动脉粥样硬化的发展进程。
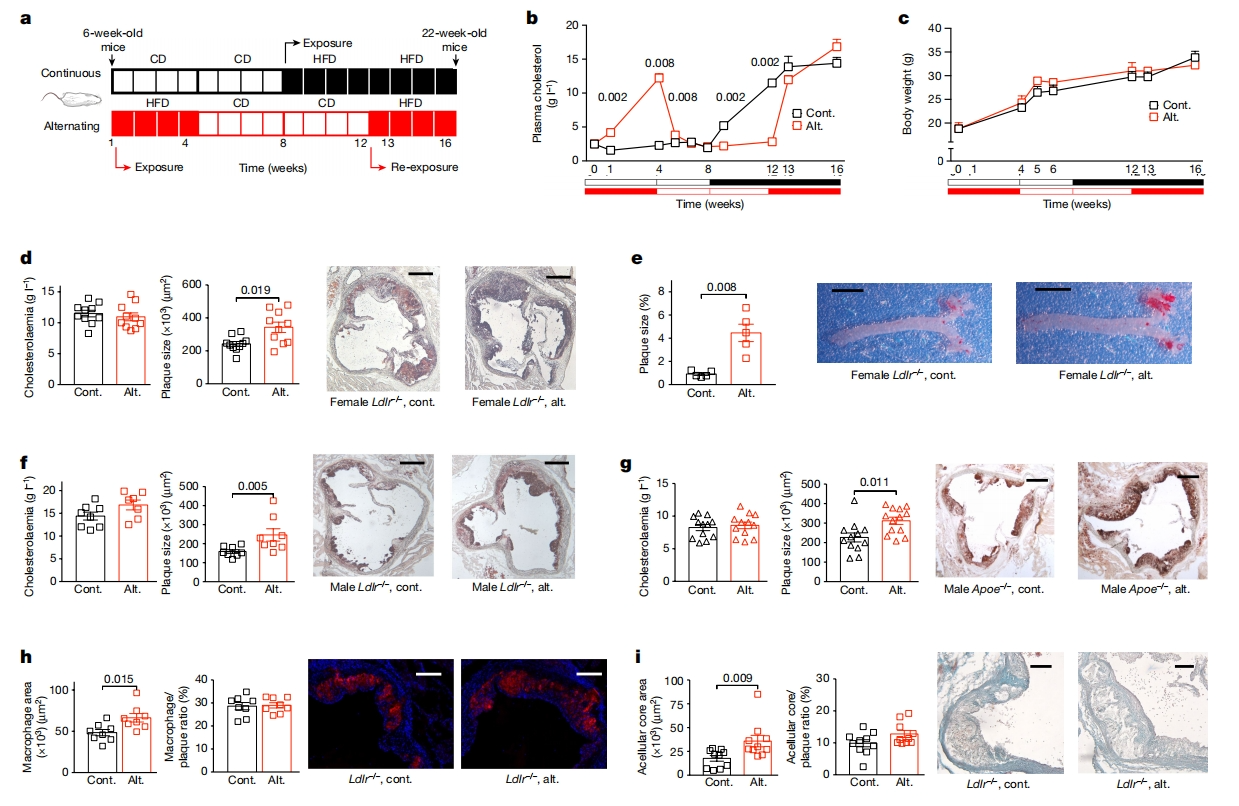
图一 交替HFD加速实验性动脉粥样硬化[5]
随后,研究者探究交替HFD加速动脉粥样硬化的机制。近期研究表明肠道微生物群是心血管疾病的关键驱动因素,其组成受饮食调节[6]。研究者首先检测肠道微生物群,使用基于16S rRNA测序对6至10周龄Ldlr-/-小鼠交替或连续HFD的微生物群组成进行分析。结果显示,两组之间的α多样性没有显著差异,但β多样性存在显著差异(图二a)。在整个方案期间,小鼠口服抗生素混合物(图二b)。发现尽管肠道微生物群减少,但交替HFD仍然能加速主动脉窦动脉粥样硬化的发展(图二c),表明肠道微生物群并没有介导交替HFD对动脉粥样硬化的影响。先前研究表明高胆固醇血症也会引起机体的免疫炎症反应。研究者其次探究全身免疫反应,发现交替HFD的Ldlr-/-小鼠脾脏中Il6和Tnf的mRNA水平显著升高(图二d),体外刺激脾细胞产生的IL-6、IL-18和TNF的表达水平也较高(图二e)。使用流式细胞术对小鼠血液和脾脏的白细胞类群进行分析,没有观察到两组之间髓系免疫细胞有任何显著差异,但交替HFD小鼠血液B细胞略有增加,脾脏T细胞和B细胞的比例较高(图二f-h)。在交替HFD的小鼠动脉粥样硬化斑块中,CD3+ T细胞浸润数量较多(图二i)。为评估脾脏免疫细胞和淋巴细胞在交替HFD促动脉粥样硬化中的作用,研究者使用两种不同策略:一是在4周龄Ldlr-/-小鼠中进行脾切除术(图二j),二是构建缺乏成熟T和B淋巴细胞的Apoe-/-Rag2-/-小鼠(图二l)。结果发现,两种策略的交替HFD均加剧了动脉粥样硬化发展(图二k和m),另外交替HFD的Apoe-/-Rag2-/-小鼠离体刺激脾细胞产生了更高的IL-6和IL-18的表达(图二n)。以上实验结果排除了适应性免疫在交替HFD促动脉粥样硬化中的作用。
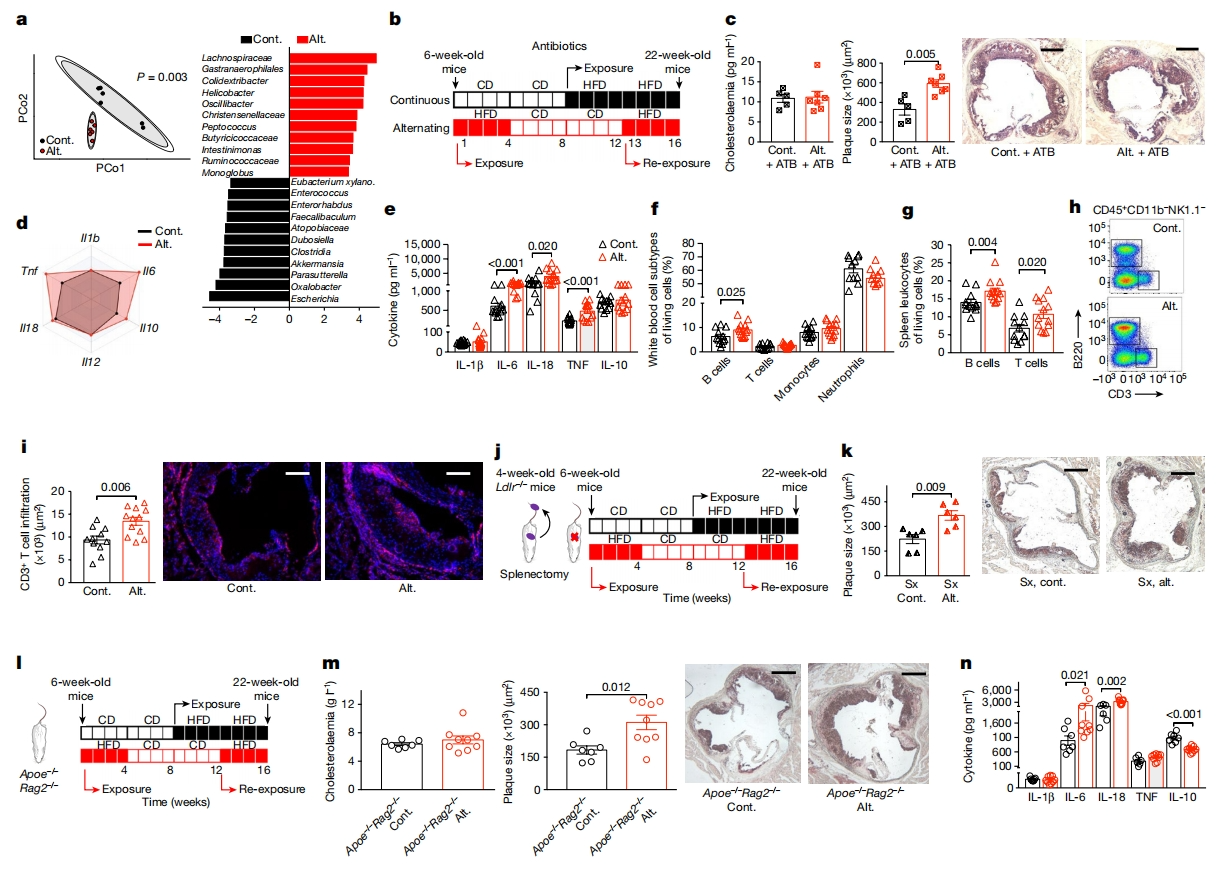
图二 交替HFD加速动脉粥样硬化的发展,与肠道微生物群或适应性免疫无关[5]
研究者对连续或交替HFD的Ldlr-/-小鼠主动脉进行RNA测序(RNA-seq),选择在HFD再次暴露后1周(第13周)进行,此时两组间动脉粥样硬化组织的斑块大小相似(图三a)。尽管病变大小没有差异,但交替HFD显著改变了主动脉的整个转录组谱式,主成分分析显示两种饮食之间有明显区别(图三b左)。对两种饮食之间175个差异表达基因的GO分析显示,主要富集在骨髓稳态相关途径(图三b右)。分析血液中髓系细胞动力学,发现循环单核细胞计数的变化与血浆胆固醇水平的变化相匹配(图三c)。在HFD开始和血浆胆固醇水平升高后,血液单核细胞计数缓慢增加,从HFD切换到常规饮食后保持较高水平,然后降至基线水平,血浆胆固醇水平也是如此。再次暴露HFD后,血液单核细胞计数再次增加,第二次暴露HFD引起的变化与第一次暴露后观察到的变化相似(图三d)。两组动脉粥样硬化斑块中的MOMA+巨噬细胞占比相似(图三e)。鉴于交替HFD组主动脉中髓系和氧化应激途径的上调(图三b右),研究者重点研究中性粒细胞。发现交替HFD组首次HFD喂养后,血液中性粒细胞计数也缓慢增加,切换到常规食物饮食后,血液中性粒细胞计数减少(图三f)。二次HFD喂养后,血液中性粒细胞再次增加,且第二次的变化比第一次扩大五倍(图三f和g),可能与CD62L+未成熟血中性粒细胞的增加有关(图三h)。这些观察结果与HFD再暴露期间CXCL1、CXCL2和CCL3的血浆水平升高一致(图三i),它们是调节中性粒细胞运输的主要趋化因子[7]。主动脉白细胞的scRNA-seq分析确定了两个离散的中性粒细胞群,包括一个具有高度促炎性特征(Il1a、Il1b、Nlrp3和Tnf)的亚型(Neutro2),在交替HFD组主动脉中的数量丰富(图三j)。在第13周时间点, 交替HFD的小鼠动脉粥样硬化斑块中的中性粒细胞胞外陷阱(NET)含量明显较高(图三k),表明中性粒细胞正处于坏死或者凋亡阶段。为评估急性中性粒细胞增多对加速动脉粥样硬化的影响,再暴露期间研究者用同种型或小鼠抗Ly6G单克隆抗体处理小鼠(图三l)。每48小时进行一次腹腔注射(i.p.)小鼠抗Ly6G单克隆抗体几乎将循环中性粒细胞消耗殆尽(图三m-o)。注射同种型对照的交替HFD组小鼠在HFD再暴露后出现急性和短暂的中性粒细胞增多(图三n),与动脉粥样硬化斑块中MPO+中性粒细胞的大量浸润(图三o)以及动脉粥样硬化的增加(图三p)有关。在用小鼠抗Ly6G单克隆抗体处理的小鼠中,研究期间几乎所有循环中性粒细胞都被耗尽,血管病变中的中性粒细胞含量也被耗尽(图三n和o),交替HFD的促动脉粥样硬化作用被消除(图三p)。以上数据表明,交替HFD选择性地影响中性粒细胞的运输和成熟,从而加速动脉粥样硬化的发展。
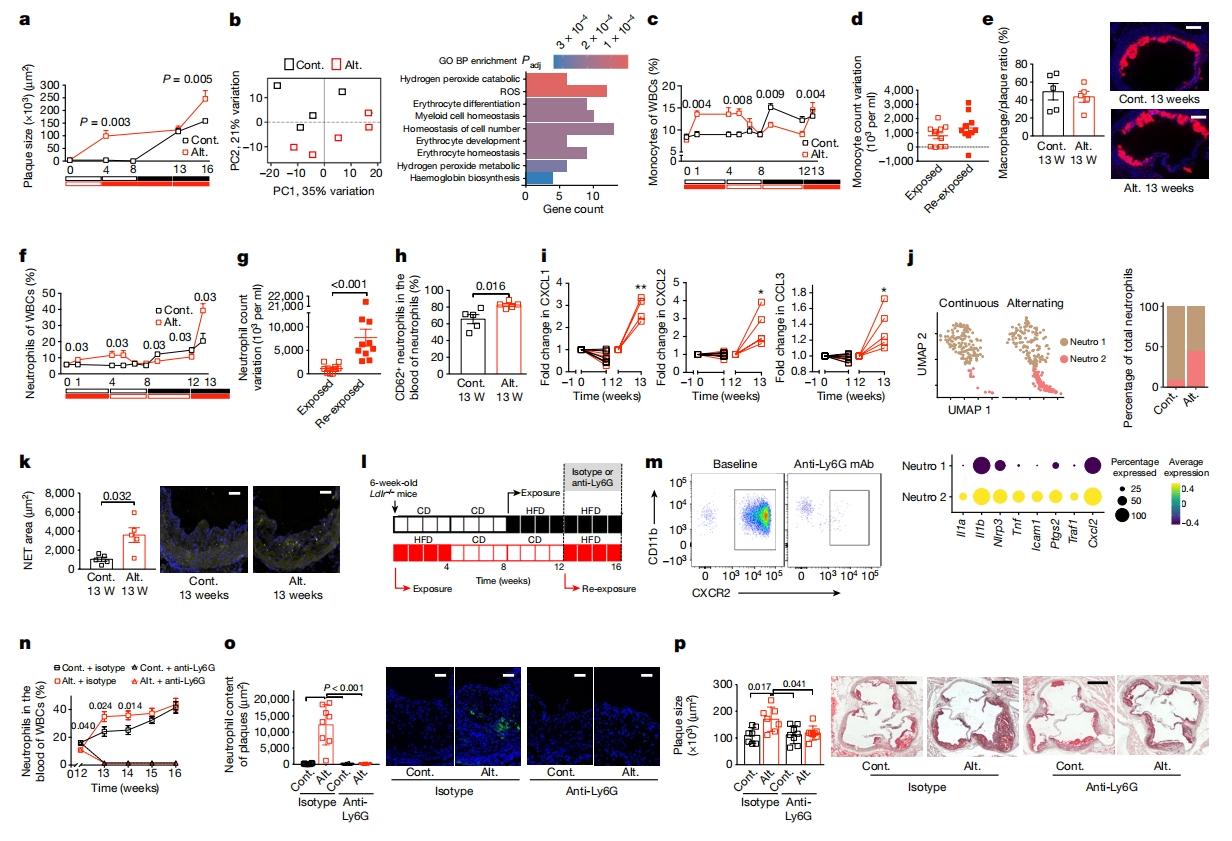
图三 HFD再暴露诱导急性中性粒细胞增多及炎性细胞死亡,加速动脉粥样硬化[5]
有先前研究表明,动物预先接触β-葡聚糖或西方饮食会导致骨髓粒细胞(BM)/巨噬细胞祖细胞(GMP)的功能和表观遗传重编程,这一过程称为训练性免疫[8, 9]。于是研究者评估BM细胞的贡献。6-10周龄Ldlr-/-小鼠短暂暴露于HFD 4周,然后正常饮食8周(图四a)。与正常饮食对照组相比,HFD组BM中的GMP和中性粒细胞明显更高(图四b-d),Il1b、Il6、Il18和Tnf mRNA水平显著升高(图四e)。scRNA-seq结果显示,短期HFD喂养对中性粒细胞祖细胞谱有显著影响,包括28个基因表达上调,29个基因表达下调,包括一个造血过程中关键转录因子Runx1(图四f)。接下来,研究者将2组小鼠(图四a)的BM细胞移植到辐照后Ldlr-/-小鼠体内,4周常规喂养后,再进行8周HFD喂养(图四g)。结果显示,尽管两组之间血浆胆固醇水平相似(图四i),但与嵌合对照组小鼠相比,嵌合HFD组小鼠动脉粥样硬化的程度更为严重(图四h),表明HFD促进了BM细胞重编程,使其朝着促动脉粥样硬化的方向发展。另外,嵌合HFD组小鼠IL-6的表达显著增高,表明其炎症特征明显(图四j)。
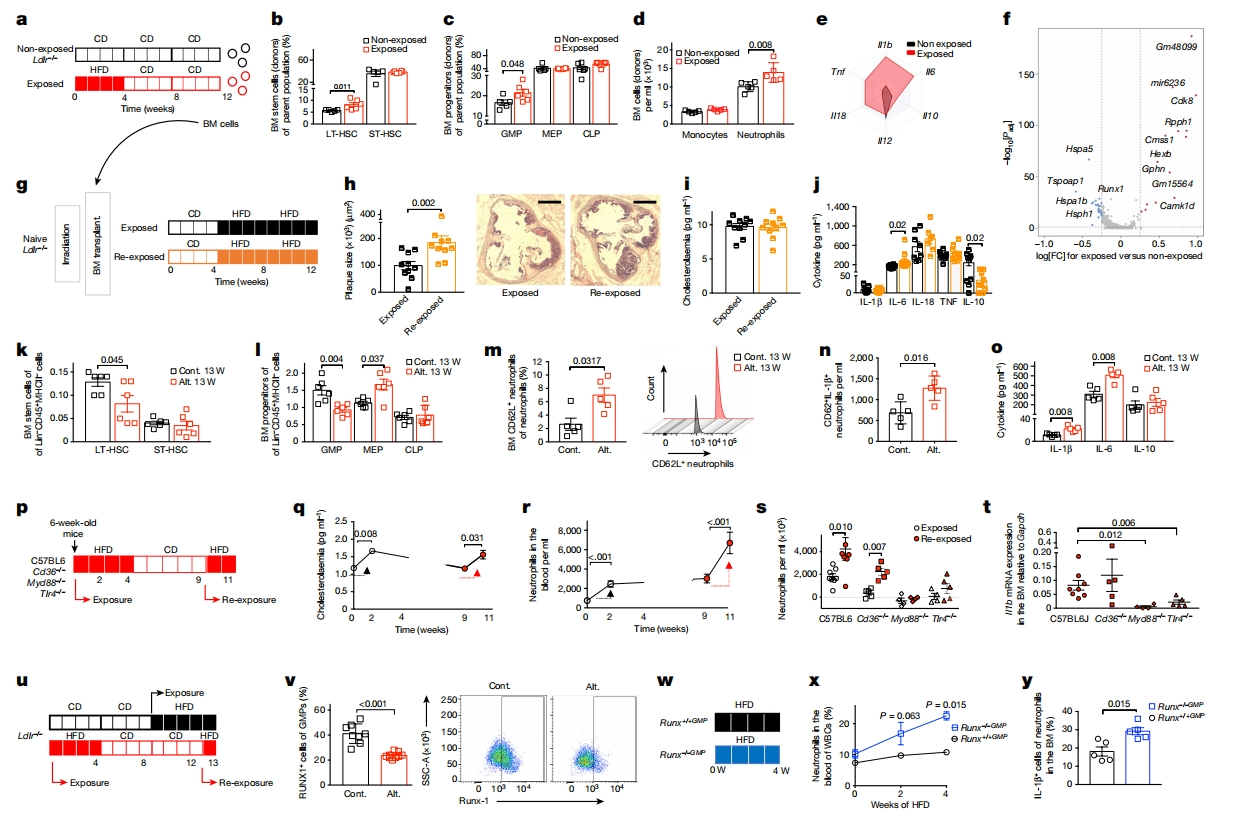
图四 交替HFD促进中性粒细胞祖细胞重编程[5]
接下来,研究者探究交替HFD喂养(图一a)是否特异性地调节造血和骨髓祖细胞。在Ldlr-/-小鼠再次暴露HFD后1周进行分析,发现交替HFD组小鼠BM中的GMP群体减少(图四k和l),而未成熟的CD62L+中性粒细胞增加(图四m),表明髓系祖细胞的快速成熟和紧急骨髓细胞生成[10]。交替HFD组小鼠骨髓中产生IL-1β的未成熟CD62L+中性粒细胞比例也显著增加(图四n);相反地,BM中的巨核细胞-红系祖细胞比例较高(图四l),表明分化受阻;并且BM细胞产生更多的IL-1β和IL-6(图四o)。然后,研究者使用转基因小鼠模型研究哪些脂质上游受体可能参与紧急骨髓细胞生成。尽管血浆胆固醇水平存在微小变化,但C57BL6小鼠在再次暴露HFD后也观察到急性中性粒细胞增多症(图四p-r)。值得注意的是,由HFD再暴露诱导的急性中性粒细胞增多症在Cd36-/-小鼠中得以维持,但在Myd88-/-和Tlr4-/-小鼠中被消除(图四s)。分析骨髓中IL-1β水平,在再次暴露期间,Myd88-/-小鼠和Tlr4-/-小鼠骨髓中的Il1β mRNA水平显著降低(图四t),表明TLR4受体在紧急骨髓细胞生成及BM细胞产生IL-1β过程中起关键作用。
GMP需要RUNX1转录因子来负调控中性粒细胞炎性细胞因子的表达[11]。首次HFD喂养结束后,GMP中Runx1基因表达下调(图四f),也在HFD再暴露后第13周的交替饮食小鼠中证实了这一点(图四u和v)。研究者推断,如果Runx1水平降低导致暴露于HFD的小鼠出现中性粒细胞增多症,那么完全消除Runx1可能会加剧这一现象。与Runx1+/+GMP对照组小鼠相比,GMP中缺失Runx1的小鼠(Runx1-/-GMP)在HFD 4周后出现了中性粒细胞增多症(图四w和x),产生IL-1β的中性粒细胞也显著增加(图四y)。以上数据表明Runx1在抑制中性粒细胞炎症表型中的关键作用。
最后,研究者评估BM中产生过量IL-1β在交替HFD中的作用。将Ldlr-/-小鼠进行致死性辐照后,移植Il1b-/- BM细胞,生成嵌合Il1b-/-Ldlr-/-小鼠。移植4周后,Il1b-/-Ldlr-/-小鼠进行连续或交替HFD喂养(图五a)。结果发现,在没有IL-1β的情况下,交替HFD诱导的急性中性粒细胞增加作用被消除(图五b)。实验结束后,两组血浆胆固醇水平相似(图五c),BM细胞和脾细胞产生的IL-6也没有显著区别(图五e),交替HFD加速动脉粥样硬化被消除(图五d)。为评估髓系细胞中Il1b下游通路的贡献,将Ldlr-/-小鼠进行致死性辐照后,移植LysM-cre+/-Il1rlox/lox小鼠的BM细胞,构建嵌合Ldlr-/-LysM-cre+/-Il1rlox/lox小鼠(在髓系细胞和BM祖细胞中特异性缺失IL-1受体,阻断了IL-1β下游信号通路[12]),然后进行连续或交替HFD喂养(图五f)。结果显示,阻断IL-1β下游信号通路消除了交替HFD诱导的急性中性粒细胞增多症(图五g)和动脉粥样硬化促进作用(图五h和i)。Ldlr-/-LysM-cre+/-Il1rlox/lox小鼠的BM细胞和脾细胞产生的IL-6在两组之间也没有显著区别(图五j)。测试免疫调节药理学方法能否逆转交替HFD的致病作用。在连续或交替HFD的Ldlr-/-小鼠再暴露期间给予IL-1β中和抗体处理(图五k)。同样地,IL-1β中和抗体消除了交替HFD的促炎作用(图五l-o)和促动脉粥样硬化的作用(图五m和n)。以上实验结果都证明IL-1β在交替HFD的促动脉粥样硬化作用中起关键作用。
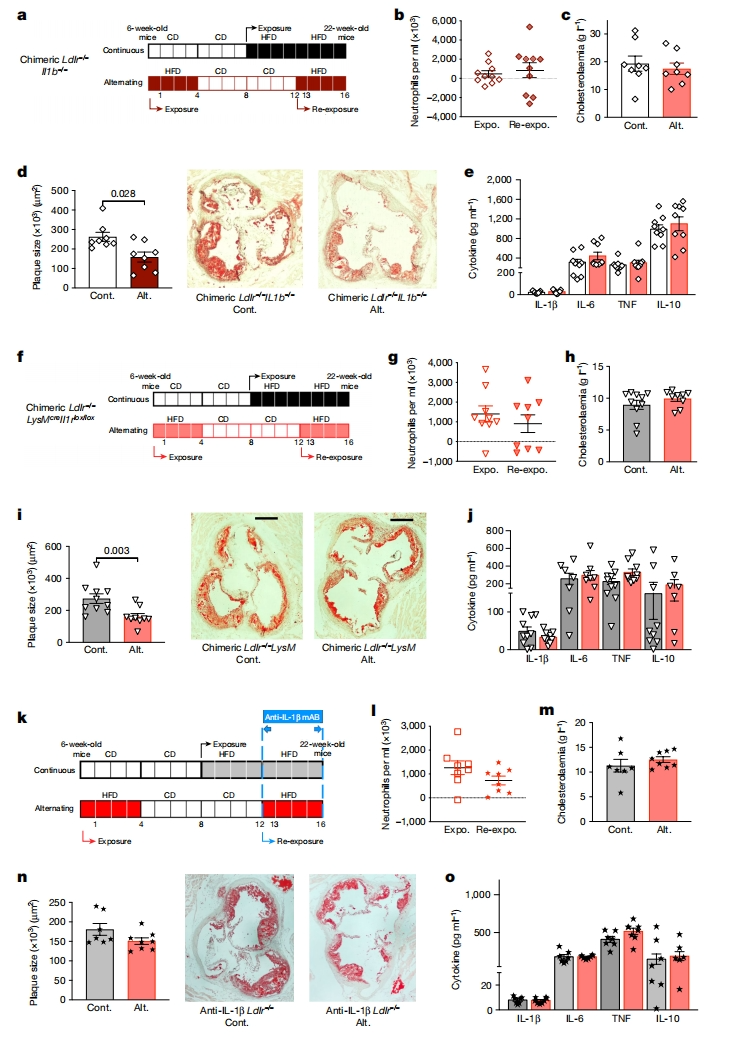
图五 阻断IL-1β信号通路可消除交替HFD的促动脉粥样硬化作用[5]
综上所述,该研究证明了交替高脂饮食(HFD)显著加速Ldlr-/-和Apoe-/-小鼠主动脉包括主动脉窦、升主动脉和降主动脉的动脉粥样硬化,并诱导更晚期的斑块表型,该过程与肠道微生物群和适应性免疫无关。这种促动脉粥样硬化作用是由IL-1β依赖的骨髓中性粒细胞祖细胞分化引起的,这些祖细胞负责HFD再暴露时诱导的中性粒细胞增多和中性粒细胞胞外陷阱(NET)。该研究还确定了RUNX1是HFD再暴露期间紧急骨髓细胞生成的关键调节因子,强调了IL-1β依赖性中性粒细胞祖细胞重编程在交替HFD诱导的加速动脉粥样硬化中的作用,为预测、预防和治疗动脉粥样硬化提供了新的靶点与方向。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Roth GA, Mensah GA, Johnson CO, Addolorato G, Ammirati E, Baddour LM, Barengo NC, Beaton AZ, Benjamin EJ, Benziger CP et al: Global Burden of Cardiovascular Diseases and Risk Factors, 1990-2019: Update From the GBD 2019 Study. J Am Coll Cardiol 2020, 76(25):2982-3021.
2. Libby P: The changing landscape of atherosclerosis. Nature 2021, 592(7855):524-533.
3. Silvestre-Roig C, Braster Q, Ortega-Gomez A, Soehnlein O: Neutrophils as regulators of cardiovascular inflammation. Nat Rev Cardiol 2020, 17(6):327-340.
4. Zadelaar S, Kleemann R, Verschuren L, de Vries-Van der Weij J, van der Hoorn J, Princen HM, Kooistra T: Mouse models for atherosclerosis and pharmaceutical modifiers. Arterioscler Thromb Vasc Biol 2007, 27(8):1706-1721.
5. Lavillegrand JR, Al-Rifai R, Thietart S, Guyon T, Vandestienne M, Cohen R, Duval V, Zhong X, Yen D, Ozturk M et al: Alternating high-fat diet enhances atherosclerosis by neutrophil reprogramming. Nature 2024, 634(8033):447-456.
6. Tang WHW, Li DY, Hazen SL: Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol 2019, 16(3):137-154.
7. Capucetti A, Albano F, Bonecchi R: Multiple Roles for Chemokines in Neutrophil Biology. Front Immunol 2020, 11:1259.
8. Riksen NP, Bekkering S, Mulder WJM, Netea MG: Trained immunity in atherosclerotic cardiovascular disease. Nat Rev Cardiol 2023, 20(12):799-811.
9. Mitroulis I, Ruppova K, Wang B, Chen LS, Grzybek M, Grinenko T, Eugster A, Troullinaki M, Palladini A, Kourtzelis I et al: Modulation of Myelopoiesis Progenitors Is an Integral Component of Trained Immunity. Cell 2018, 172(1-2):147-161 e112.
10. Boettcher S, Ziegler P, Schmid MA, Takizawa H, van Rooijen N, Kopf M, Heikenwalder M, Manz MG: Cutting edge: LPS-induced emergency myelopoiesis depends on TLR4-expressing nonhematopoietic cells. J Immunol 2012, 188(12):5824-5828.
11. Zezulin AU, Yen D, Ye D, Howell ED, Bresciani E, Diemer J, Ren JG, Ahmad MH, Castilla LH, Touw IP et al: RUNX1 is required in granulocyte-monocyte progenitors to attenuate inflammatory cytokine production by neutrophils. Genes Dev 2023, 37(13-14):605-620.
12. Al-Rifai R, Vandestienne M, Lavillegrand JR, Mirault T, Cornebise J, Poisson J, Laurans L, Esposito B, James C, Mansier O et al: JAK2V617F mutation drives vascular resident macrophages toward a pathogenic phenotype and promotes dissecting aortic aneurysm. Nat Commun 2022, 13(1):6592.



