技术分享:靶蛋白重定位的调控新策略
蛋白质的亚细胞定位可调节其功能,而这种亚细胞定位的时空调控一同协调着细胞的生理学功能[1]。当蛋白质转运和定位出现异常往往与许多疾病相关,包括癌症[2]、神经退行性疾病[3]和遗传疾病[4]。例如突变造成肿瘤抑制蛋白从细胞核被转运到细胞质,是促进肿瘤发生的常见机制。TDP43和FUS等RNA结合蛋白被易位到细胞质是肌萎缩侧索硬化症(ALS)的标志[5],使得出现许多有害表型如增加细胞质聚集物[6]。然而,试图通过抑制这些蛋白质的转运来纠正其有害表型具有很大的挑战性。由于细胞核输入或输出机制具有保守性,使得抑制它们容易造成全局毒性[7]。核输出抑制剂Selinexor已成功获批用于临床治疗,表明针对性控制蛋白质转运可成为一种替代性治疗策略[8]。
利用药理学阻断单个蛋白质亚细胞定位的方式,仅能解决少数疾病的相关活动[9]。而功能获得性分子可直接驱动蛋白质形成新的复合物,使其运用更加广泛[10]。直接纠正蛋白错误定位所造成的疾病表型,或者促进蛋白质重定位的有益功能均能大大拓宽治疗选择性。通过将蛋白质与核激素受体的配体结合域[11]、LOV2结构域[12]、或者含有定位序列纳米抗体的结合位点[13]相融合,已被开发用于改变蛋白质的定位。利用雷帕霉素诱导FRB和FKBP12融合蛋白,也已证明了小分子调控蛋白质定位的潜力[14]。通过与细胞内穿梭蛋白或锚定蛋白相偶联,将为调控靶蛋白的亚细胞定位提供一种新的可能。
2024年9月,Nature报道了一项研究,通过一种双功能分子——靶向重定位激活分子(TRAM),将穿梭蛋白与靶蛋白转运结合起来,实现对靶蛋白亚细胞重定位的调控(图一a)。研究者利用了一组具有强效配体的穿梭蛋白,其中核激素受体可以将疾病相关突变蛋白如SMARCB1Q318X,TDP43ΔNLS和FUSR495X重新核定位。通过TRAM靶向重定位,在神经退行性疾病模型中产生功能获得性保护表型。该研究利用药物分子将穿梭蛋白和靶蛋白偶联,在蛋白质转运的概念基础上提出了调节细胞生理的治疗性新思路[15]。
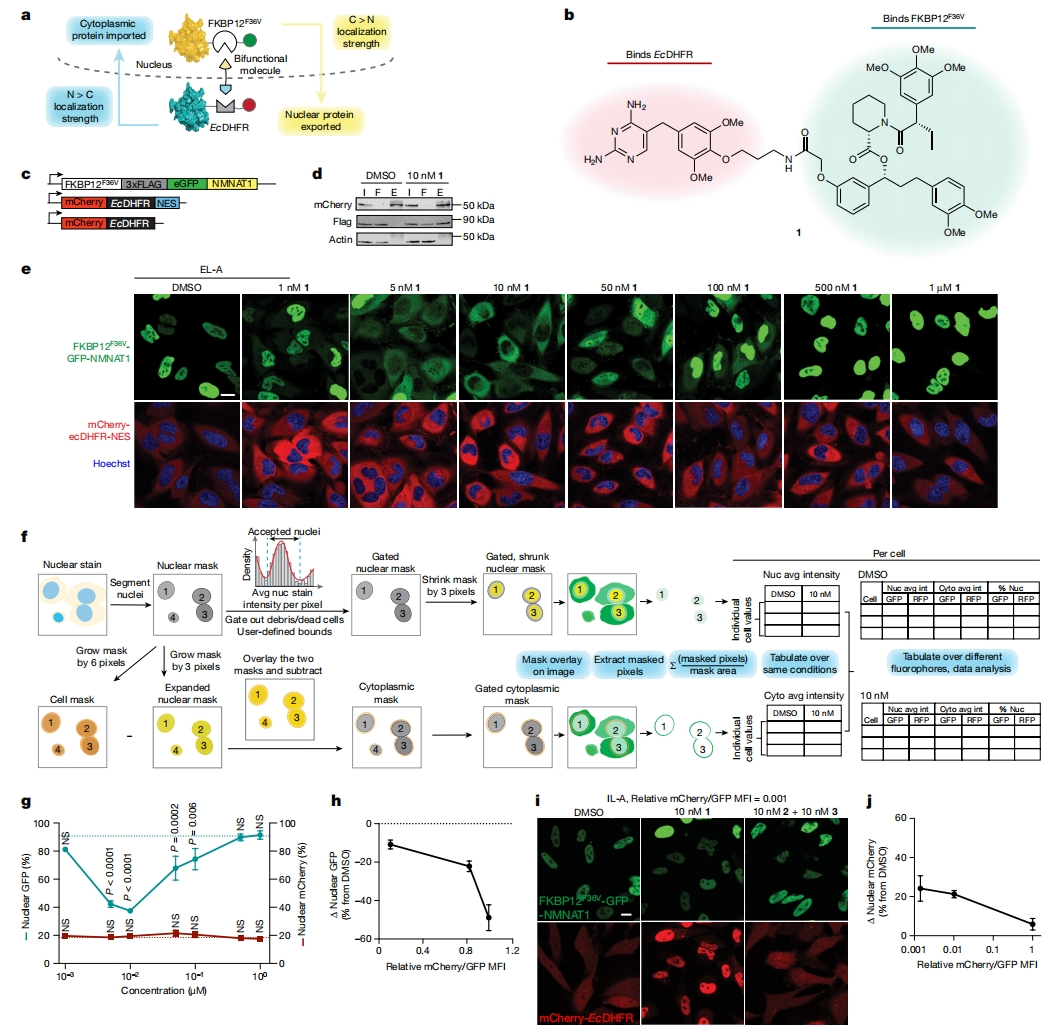
图一 细胞定量分析流程的开发及其在靶向重定位的应用[15]
细胞核定位序列(NLS)和核输出序列(NES)可被karyopherin蛋白家族成员所识别,调节着蛋白质在细胞核和细胞质的双向运输[16]。研究者推断通过偶联蛋白质转运的方式来改变靶蛋白的固有细胞定位,需要满足:(1)穿梭蛋白上有足够强的反向定位序列和(2)穿梭蛋白的化学计量比。于是,研究者首先选择烟酰胺核苷酸腺苷基转移酶1(NMNAT1)作为测试靶蛋白,它只具有一个预测的NLS且没有已知的DNA结合域,使得它可能易于响应小分子介导的重定位。研究者合成了双功能分子1(图一b),其一端与大肠杆菌二氢叶酸还原酶结构域(EcDHFR)结合,另一端与FKBP12F36V结构域结合。接着,构建mCherry-EcDHFR-NES作为穿梭蛋白,FKBP12F36V-3Flag-GFP-NMNAT1作为靶蛋白,共转染HeLa细胞,并添加双功能分子1进行调控(图一c)。免疫共沉淀证明双功能分子1可介导两个蛋白形成复合物(图一d)。挑选单克隆细胞EL-A检测荧光定位情况,在双功能分子1存在的情况下,靶蛋白NMNAT1逐渐向细胞质易位且呈剂量依赖性,而这种效应在较高浓度下被消除(图一e)。
研究者设计的开源计算成像分析流程可以独立地对细胞核和细胞质中两种不同荧光蛋白进行单细胞水平分析,从而衡量蛋白质定位的变化(图一f)。结果显示,双功能分子1对NMNAT1转运的浓度依赖性钩状效应(图一g),表明NMNAT1很容易被双功能分子1转运到细胞质中,却没有足够能力将mCherry-EcDHFR-NES转运到细胞核中。于是,研究者调节NMNAT1和EcDHFR-NES之间化学计量比,另外挑选两个单克隆细胞系,使其具有不同mCherry/GFP相对MFI比值。当用双功能分子1处理时,较高mCherry/GFP比值表现为NMNAT1重定位到细胞质中,中等比值的细胞系表现为弥漫性NMNAT1定位(图一h)。进一步挑选mCherry/GFP比值为0.001的细胞系(IL-A),核mCherry的初始百分比约为50%,与弥漫性定位相一致。双功能分子1处理后,mCherry显著入核,包括比值为0.01的细胞系(图一i和j)。以上数据表明,只要具有合适的定位强度、表达水平和有效的偶联分子,任何蛋白质的转运都可以重定位另一种蛋白质。研究者将这种双功能分子称为靶向重定位激活分子(TRAM)。
核激素受体如雌激素受体(ERα)和糖皮质激素受体(GR),均表现出配体依赖性的细胞质向细胞核的易位,进而发挥下游转录激活作用。研究者基于地塞米松和雷洛昔芬合成了TRAM 4-7,实验证明这些分子可以介导GR和ERα作为FKBP12和FKBP12F36V的核输入穿梭蛋白。
转录调控因子和RNA结合蛋白的错误定位是多种癌症和神经退行性疾病的标志,靶向这些蛋白质转运回细胞核的方法可能有助于改善疾病表型。研究者选择了三种异常定位的突变蛋白,SMARCB1Q318X是SMARCB1的突变型C末端截短,发现于非典型畸胎样和横纹肌样肿瘤中,定位于细胞质中[17];TDP43ΔNLS是ALS的保守生物标志物,是缺失NLS序列的TDP43突变体,异常聚集在细胞质中[18];FUSR495X与侵袭性疾病表型有关,并在神经元中形成与其致病功能相关的细胞质应激颗粒[19]。研究者改造HeLa细胞,在强力霉素(Dox)诱导的启动子组成型表达每个突变体和ERα(图二a)。在添加Dox并用TRAM 5处理后,发现ERα与每个突变体达到最大重定位所需的必要剂量比例和TRAM 5浓度效应(图二b-d)。最佳拟合曲线提取每个突变体的理论最大重定位,得出每个突变体与ERα配对时的相对重定位能力和定位强度(图二e),发现TDP43ΔNLS和FUSR495X比SMARCB1Q318X更容易被ERα重定位。推测TRAM诱导FUSR495X重定位到细胞核,则FUSR495X阳性细胞质颗粒可能会溶解。研究者用亚砷酸钠处理表达mCherry-FKBP12F36V-FUSR495X的HeLa细胞,以刺激应激颗粒形成(图二f),接着用TRAM 5处理细胞并连续成像(图二g)。处理后2小时内,发现FUSR495X颗粒从细胞质重定位到细胞核(图二h),FUSR495X和G3BP1应激颗粒也显著减少(图二i-l),表明TRAM处理可以使得FUSR495X从细胞质应激颗粒重定位到细胞核,进而减少FUSR495X和G3BP1阳性颗粒。以上数据表明,TRAM可以介导错误定位的突变蛋白实现重定位。
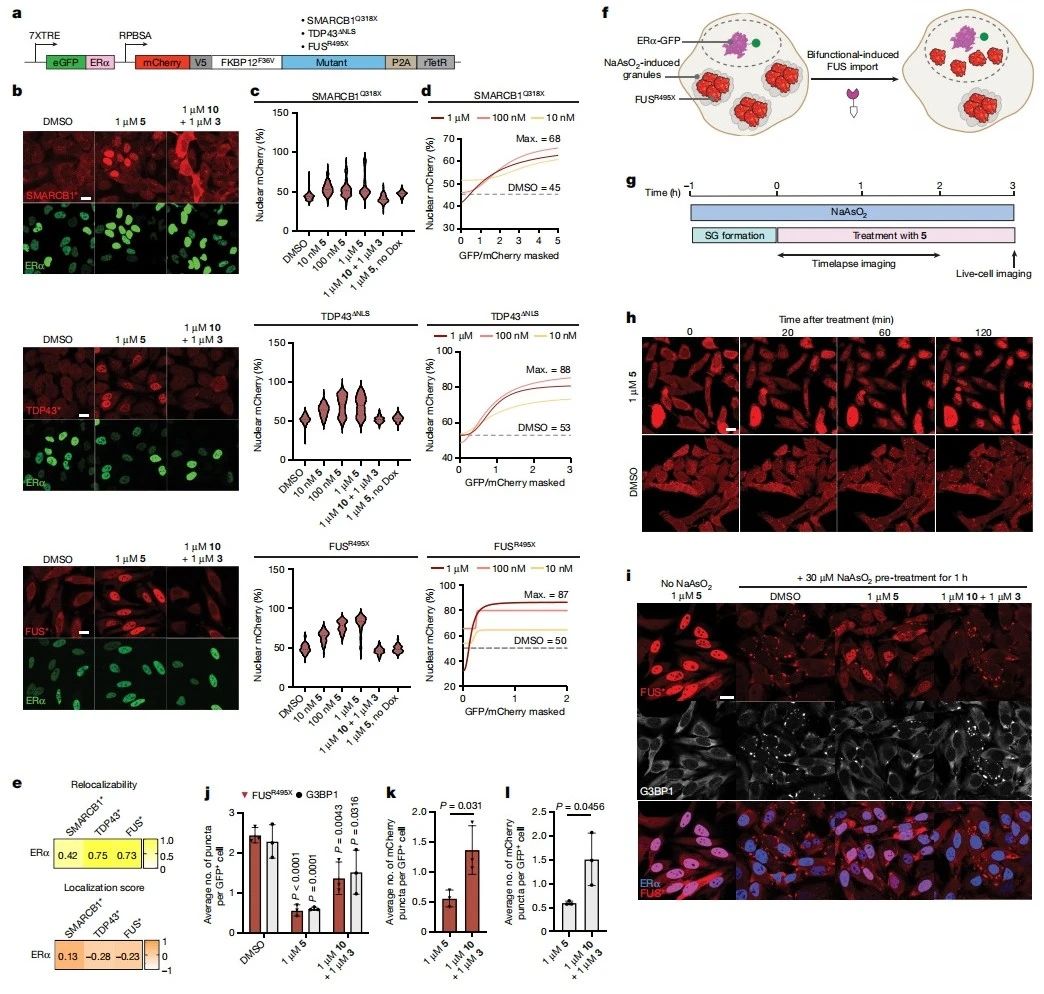
图二 靶向重定位可以将突变蛋白转入细胞核及减少应激颗粒[15]
通过与穿梭蛋白偶联实现靶蛋白的重定位,可以模拟有益功能获得突变的药理学方法。WldS是一种突变蛋白,由小鼠NMNAT1(mNMNAT1)融合到UBE4B的截短N端区域组成,已被证明对沃勒变性具有保护作用[20]。携带WldS突变的小鼠对神经病变和ALS[21]的抵抗力有所增强。少量WldS运输到轴突对其保护功能至关重要,在轴突损伤的早期阶段,它可在轴突NMNAT2丧失时维持NAD+ 的水平。研究者推断小分子介导NMNAT1从细胞核沿轴突向下运输可能具有与WldS相似的功能。于是,研究者从大鼠胚胎中收集背根神经节(DRG)神经元,用腺相关病毒(AAV)递送FKBP12F36V-mNMNAT1和EcDHFR-GAP43at(轴突定位的GAP43的截短序列)(图三a和b)。当用TRAM 1处理这些神经元时,观察到mNMNAT1沿轴突的明显重定位(图三c)。为评估重定位的保护功能,在TRAM 1处理后进行轴突切断术并去除细胞体。相比对照,仅在TRAM 1处理组观察到轴突切断后轴突中mNMNAT1的持续表达,至少72小时轴突健康和轴突末端保护都得到了维持,只有在96小时后才观察到轴突死亡(图三d-f)。以上数据表明,通过TRAM介导的NMNAT1重定位能够在体外模型中减缓轴突退化的过程,TRAM介导的蛋白质重定位可以驱动功能获得表型。
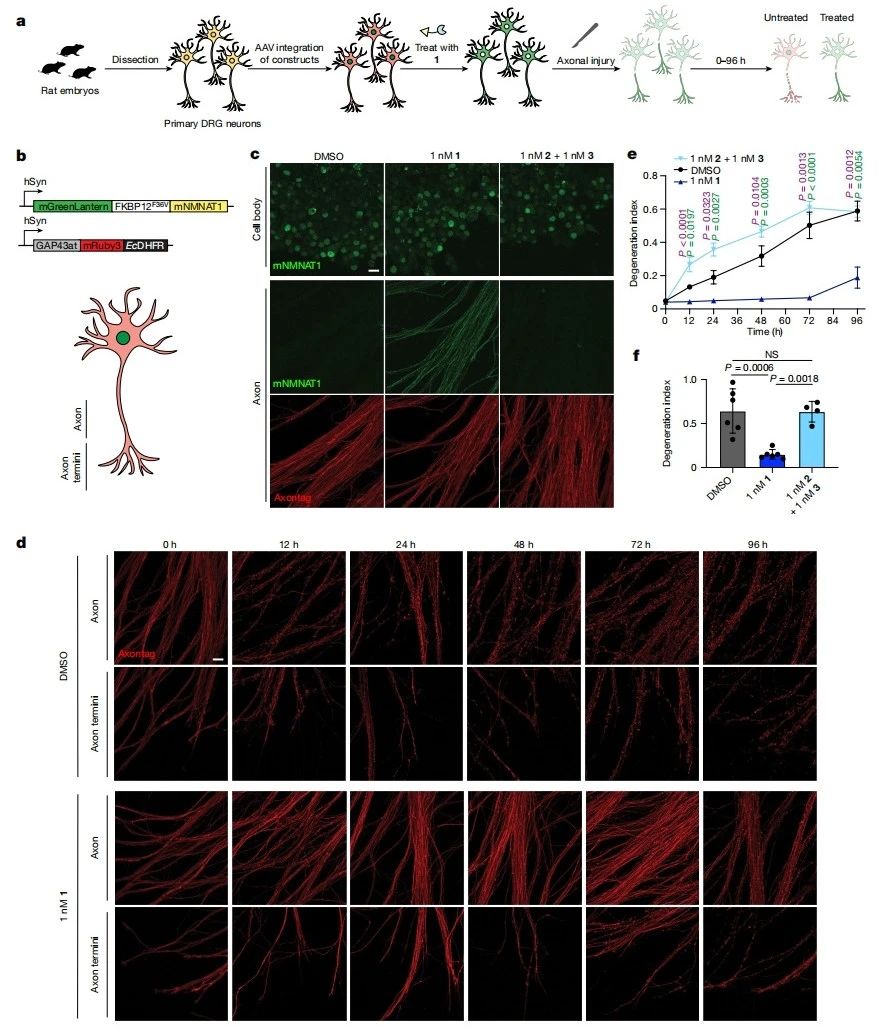
图三 NMNAT1的靶向重定位可以保护轴突损伤[15]
综上所述,研究者利用了一组具有强效配体的穿梭蛋白,在靶向重定位激活分子(TRAM)介导下调控靶蛋白的亚细胞重定位。其中使用核激素受体作为穿梭蛋白可以重定位突变蛋白,如SMARCB1Q318X、TDP43ΔNLS和FUSR495X,改善疾病相关的蛋白错位现象及其表型。此外,研究者还证明甲氧基氨基肽酶2(METAP2)和聚ADP核糖聚合酶1(PARP1)作为内源性穿梭蛋白,可以重定位内源性PRMT9、SOS1和FKBP12。研究者还开发了一种定量单细胞分析方法,以检测TRAM介导的靶蛋白与穿梭蛋白偶联的潜力,并证明这两种蛋白质的相对表达水平是驱动靶蛋白重定位能力的主要参数。该研究为靶向蛋白质重定位来治疗疾病提供了新的方向。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Thul PJ, Åkesson L, Wiking M, Mahdessian D, Geladaki A, Ait Blal H, Alm T, Asplund A, Björk L, Breckels LM et al: A subcellular map of the human proteome. Science 2017, 356(6340).
2. Wang X, Li S: Protein mislocalization: mechanisms, functions and clinical applications in cancer. Biochimica et biophysica acta 2014, 1846(1):13-25.
3. Pasha T, Zatorska A: Karyopherin abnormalities in neurodegenerative proteinopathies. 2021, 144(10):2915-2932.
4. Yu Y, Nakagawa T, Morohoshi A, Nakagawa M, Ishida N, Suzuki N, Aoki M, Nakayama K: Pathogenic mutations in the ALS gene CCNF cause cytoplasmic mislocalization of Cyclin F and elevated VCP ATPase activity. Human molecular genetics 2019, 28(20):3486-3497.
5. Suk TR, Rousseaux MWC: The role of TDP-43 mislocalization in amyotrophic lateral sclerosis. Molecular neurodegeneration 2020, 15(1):45.
6. Birsa N, Bentham MP, Fratta P: Cytoplasmic functions of TDP-43 and FUS and their role in ALS. Seminars in cell & developmental biology 2020, 99:193-201.
7. Wang AY, Liu H: The past, present, and future of CRM1/XPO1 inhibitors. Stem cell investigation 2019, 6:6.
8. Syed YY: Selinexor: First Global Approval. Drugs 2019, 79(13):1485-1494.
9. Griffith M, Griffith OL, Coffman AC, Weible JV, McMichael JF, Spies NC, Koval J, Das I, Callaway MB, Eldred JM et al: DGIdb: mining the druggable genome. Nat Methods 2013, 10(12):1209-1210.
10. Burslem GM, Crews CM: Small-Molecule Modulation of Protein Homeostasis. 2017, 117(17):11269-11301.
11. Dixon AS, Constance JE, Tanaka T, Rabbitts TH, Lim CS: Changing the subcellular location of the oncoprotein Bcr-Abl using rationally designed capture motifs. Pharmaceutical research 2012, 29(4):1098-1109.
12. Yumerefendi H, Lerner AM, Zimmerman SP, Hahn K, Bear JE, Strahl BD, Kuhlman B: Light-induced nuclear export reveals rapid dynamics of epigenetic modifications. Nature chemical biology 2016, 12(6):399-401.
13. Jayanthi B, Bachhav B, Wan Z, Martinez Legaspi S, Segatori L: A platform for post-translational spatiotemporal control of cellular proteins. 2021, 6(1):ysab002.
14. Raschbichler V, Lieber D, Bailer SM: NEX-TRAP, a novel method for in vivo analysis of nuclear export of proteins. Traffic (Copenhagen, Denmark) 2012, 13(10):1326-1334.
15. Ng CSC, Liu A: Targeted protein relocalization via protein transport coupling. 2024, 633(8031):941-951.
16. Wing CE, Fung HYJ: Karyopherin-mediated nucleocytoplasmic transport. 2022, 23(5):307-328.
17. Pathak R, Zin F, Thomas C, Bens S, Gayden T, Karamchandani J, Dudley RW, Nemes K, Johann PD, Oyen F et al: Inhibition of nuclear export restores nuclear localization and residual tumor suppressor function of truncated SMARCB1/INI1 protein in a molecular subset of atypical teratoid/rhabdoid tumors. 2021, 142(2):361-374.
18. de Boer EMJ, Orie VK, Williams T, Baker MR, De Oliveira HM, Polvikoski T, Silsby M, Menon P, van den Bos M: TDP-43 proteinopathies: a new wave of neurodegenerative diseases. 2020, 92(1):86-95.
19. Bosco DA, Lemay N, Ko HK, Zhou H, Burke C, Kwiatkowski TJ, Jr., Sapp P, McKenna-Yasek D, Brown RH, Jr., Hayward LJ: Mutant FUS proteins that cause amyotrophic lateral sclerosis incorporate into stress granules. Human molecular genetics 2010, 19(21):4160-4175.
20. Coleman MP, Freeman MR: Wallerian degeneration, wld(s), and nmnat. Annual review of neuroscience 2010, 33:245-267.
21. Fischer LR, Culver DG, Davis AA, Tennant P, Wang M, Coleman M, Asress S, Adalbert R, Alexander GM, Glass JD: The WldS gene modestly prolongs survival in the SOD1G93A fALS mouse. Neurobiology of disease 2005, 19(1-2):293-300.



