技术分享:新型膜蛋白降解剂——转铁蛋白受体靶向嵌合体
膜蛋白是大多数细胞功能的核心,开发针对膜蛋白的通用型调控策略对于基础研究和治疗应用具有重要意义。调控膜蛋白的传统方法包括基因操作或者药理学阻断受体活性的抑制剂,但各有不足之处,如有些组织细胞无法进行基因操作,以及只有小部分膜蛋白具有高效且特异的拮抗剂。此外,一些具有组成性活性的膜蛋白家族无法通过拮抗剂方法进行调节。近年来,使用异双功能分子进行靶向降解的方法已成为调节膜蛋白水平和活性的新机制。这些分子通常一端与感兴趣蛋白质(POI)相结合,另一端与膜E3连接酶或内部效应器结合,以诱导溶酶体介导的蛋白质降解,如PROTAC和LYTAC[1]。然而,它们也有一定的局限性,例如效应器的组织特异性表达,或者当需要激动剂驱动内吞作用时,可能意外激活其他内源性通路等。此外,许多此类方法的蛋白质降解效率较低,不足以产生所需的治疗效应[2]。
转铁蛋白受体1(TfR1)是一种有前景的细胞效应物。TfR1调节细胞的铁摄取,在大多数人类细胞中表达水平较低。而在快速分裂的细胞如癌细胞或活化T细胞中,由于对铁的需求增加,TfR1的表达显著上调[3]。TfR1的另一个特征是它持续采用网格蛋白介导的内吞作用,不需要激动剂来诱导内化作用。此外,转铁蛋白受体显示出快速的内化速度,提示利用TfR1进行靶向蛋白质的内化作用可能同样具有高效性[4]。
2024年9月,Nature期刊报道了一项研究,开发了一种适用于广泛组织类型的高效降解膜蛋白的新方法,称为转铁蛋白受体靶向嵌合体(TransTAC)。TransTAC是一种工程改造的双特异性抗体,利用细胞表面的TfR1驱动靶蛋白的快速内化,从而进入溶酶体降解途径,实现膜蛋白的靶向性降解(图一a-b)。TransTAC可以降解各种类型的膜蛋白,包括EGFR、PD-L1、CD20和嵌合抗原受体(CAR),能够可逆地控制人类原代嵌合抗原受体T细胞,以及在小鼠异种移植模型中靶向具有耐药EGFR驱动的肺癌。TransTAC是一种有前途的新型双功能抗体,可用于精准调控膜蛋白和癌症靶向治疗[5]。
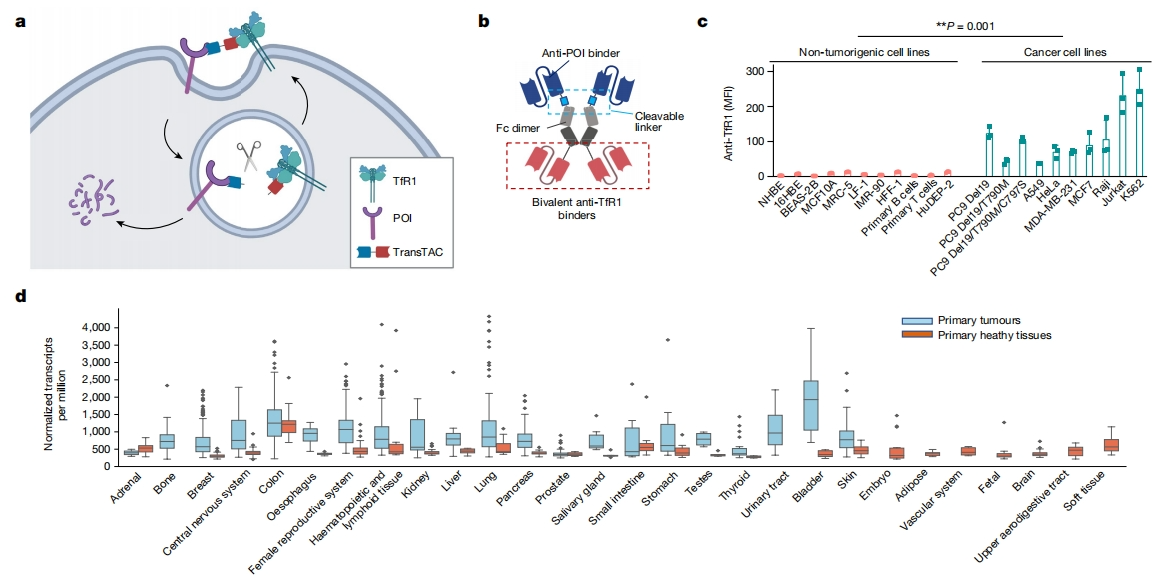
图一 TransTAC概述[5]
首先,研究者测量了11种非致瘤性细胞系和10种癌细胞系(包括肺癌、乳腺癌、宫颈癌、淋巴瘤和白血病)的细胞表面TfR1水平。结果显示,TfR1在癌细胞系中的表达明显高于非致瘤性细胞(图一c)。其中,Jurkat和K562白血病细胞的TfR1表达量最高,比正常细胞高出20倍以上。与正常组织相比,编码TfR1的基因TFRC在原发肿瘤中的表达也大多显著性上调(图一d)。分析DICE人类原代免疫细胞数据库[6],发现大多数免疫细胞表达低水平的TFRC;然而,活化CD4+和CD8+ T细胞中TFRC的表达约为失活T细胞的6倍。以上数据表明,TfR1是一种有前途的调节癌症和活化T细胞的效应物。
接下来,研究者设计不同版本的TransTAC来降解CD19 CAR。首先比较单价(v0.1)和二价(v0.2)版本。v0.1是一种KIH-Fc双特异性抗体,包含一个与CAR结合的 CD19NT.1,一个与TfR1结合的TF。而v0.2是一种同源二聚体Fc融合物,具有两个CD19NT.1和两个TF(图二a)。这些蛋白被重组表达,并与表达myc标记CAR的Jurkat细胞孵育过夜。结果显示,v0.1和v0.2均能显著降低细胞表面CAR水平,二价设计形式比单价形式更有效(图二b)。对照CD19NT.1-Fc没有降低细胞表面CAR水平,表明内化是由结合TfR1驱动的(图二b)。尽管能有效去除细胞表面的CAR,但v0.2并没有导致CAR的降解(图二c)。
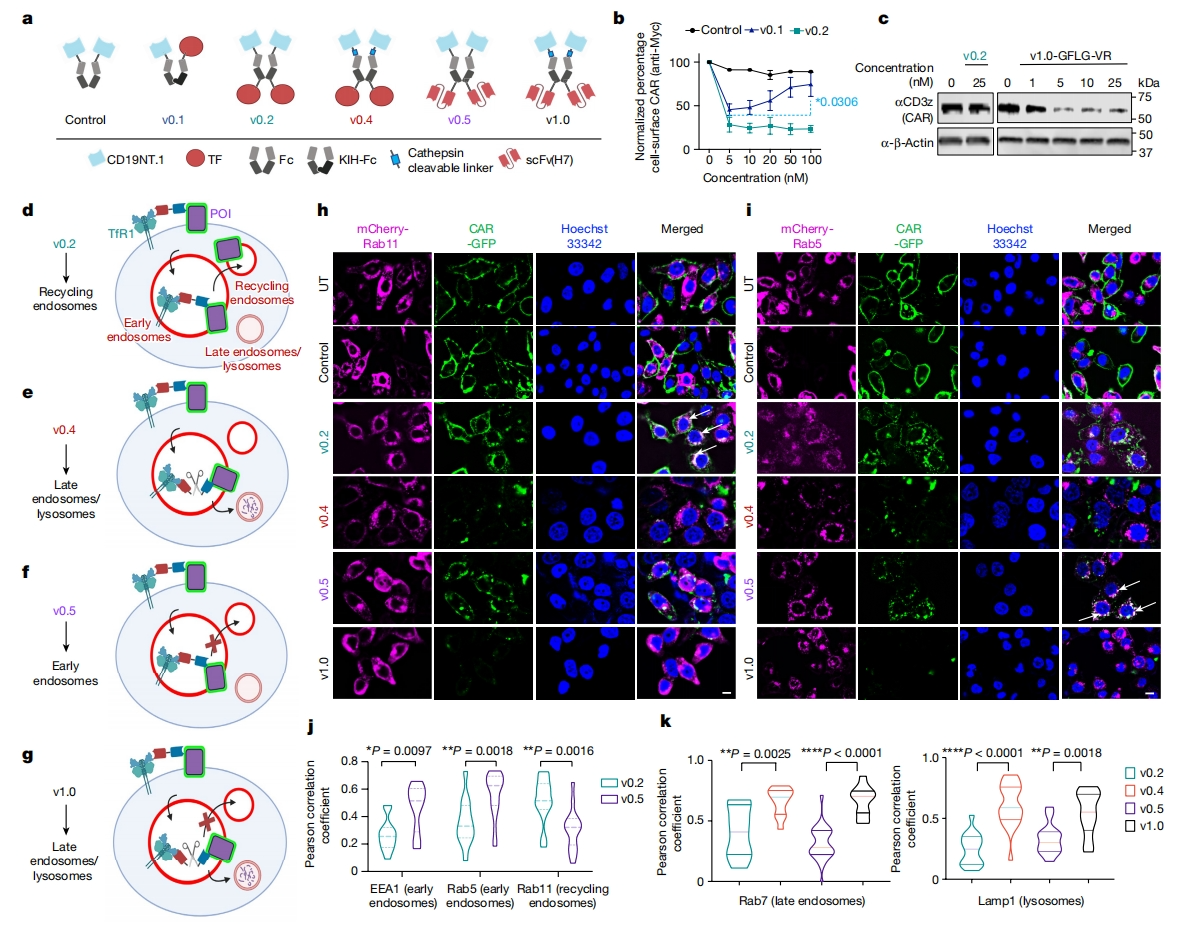
图二 TransTAC的设计策略[5]
为了解内化CAR的亚细胞定位,研究者在HeLa细胞中表达CAR-GFP以及mCherry-Rab11,Rab11是内体和溶酶体的标志物。荧光显微镜观察显示,v0.2处理细胞后CAR-GFP与mCherry-Rab11共定位,表明CAR被转移到再循环内体(图二d和h)。内化的TfR1通过循环内体被运回细胞表面,POI可能与TfR1共同进入再循环而不是降解途径[7]。为了解决这个问题,研究者提出引入组织蛋白酶B可切割的接头(Linker),允许在早期内体中蛋白水解切割TransTAC,将POI与TfR1分离,促进其进入溶酶体降解途径(图二e)。研究者在Fc和TF之间(v0.3)或CD19NT.1和Fc之间(v0.4)插入组织蛋白酶B敏感性甘氨酸-苯丙氨酸-亮氨酸-甘氨酸(GFLG)底物序列(图二a)。CAR Jurkat细胞的蛋白质印迹分析显示,v0.4处理后CAR的降解率约为40-50%,v0.3也发生了降解但效果较低。此外,用v0.4处理的表达CAR-GFP的HeLa细胞显示GFP荧光显著降低,表明蛋白质降解程度很高(图二h和i)。CAR-GFP与mCherry标记物共定位的Pearson相关性分析证实,具有可切割接头的TransTAC,促使CAR向晚期内体和溶酶体的运输增强(图二k)。研究者进一步筛选接头序列,选择GFLG-缬氨酸-精氨酸(GFLG-VR)接头和谷氨酸-缬氨酸-粗氨酸(EVR)接头,用于后续的TransTAC设计。
接着,研究者用单链可变片段(scFv)H7取代TF,这是一种TF竞争性TfR1抗体[8]。构建并表达了含有scFv(H7)但不含可切割接头的变体v0.5或者含可切割接头的变体v1.0。用v0.5处理的细胞显示出CAR-GFP与早期内体标志物Rab5和EEA1的强烈共定位,但与循环内体标志物Rab11没有共定位,蛋白质降解效率显著提高(图二h-j)。在v1.0中,蛋白质印迹观察到超过80%的CAR被降解,在荧光图像中几乎没有检测到CAR-GFP信号(图二c、h和i),表明scFv(H7)替代增强了蛋白质降解,可能是通过减少或减缓POI运输到循环内体中(图二f和g)。以上数据表明,TransTACv1.0可用于高效降解膜蛋白(图一b和二a)。
下一步,研究者开发针对不同天然受体的TransTAC(图三a),测试降解多种膜蛋白。第一个靶点是一种免疫检查点配体PD-L1,用PD-L1阻断剂atezolizumab的scFv与v1.0-GFLG-VR相连(图三b)。在用PD-L1-TransTAC处理的MDA-MB-231乳腺癌细胞中观察到高达85%的PD-L1降解(图三b)。EGFR是一种驱动各种类型癌症的受体酪氨酸激酶[9]。用EGFR-TransTACv1.0-GFLG-VR处理的A549肺癌细胞显示出高达80-90%的EGFR减少,而对照组几乎没有(图三c)。用CD20-TransTACv1.0-EVR处理Raji淋巴瘤细胞导致CD20减少高达98%,而对照组没有或不明显(图三d)。以上数据表明,TransTAC可成功地推广到这些结构和功能多样的靶点,证明了TransTAC的普适性。研究者进一步表征内化和降解的动力学。时间过程测量显示,TransTAC介导的CAR从CAR Jurkat细胞中快速去除,v1.0-GFLG-VR处理10分钟后仅剩下17%,20分钟后只剩下13%(图三e)。相比之下,CD20和EGFR的降解速度较慢,在8-12小时后达到最大降解(图三f和四f)。TransTAC洗脱后17-24小时,CD20蛋白质水平恢复到70%以上,表明TransTAC能可逆控制蛋白质降解(图三g)。为评估TfR1是否与POI共降解,在10 nM PD-L1 TransTAC处理的MDA-MB-231细胞中,TfR1水平保持不变,而PD-L1水平显著降低(图三h),证明内化的TfR1进入了再循环途径。
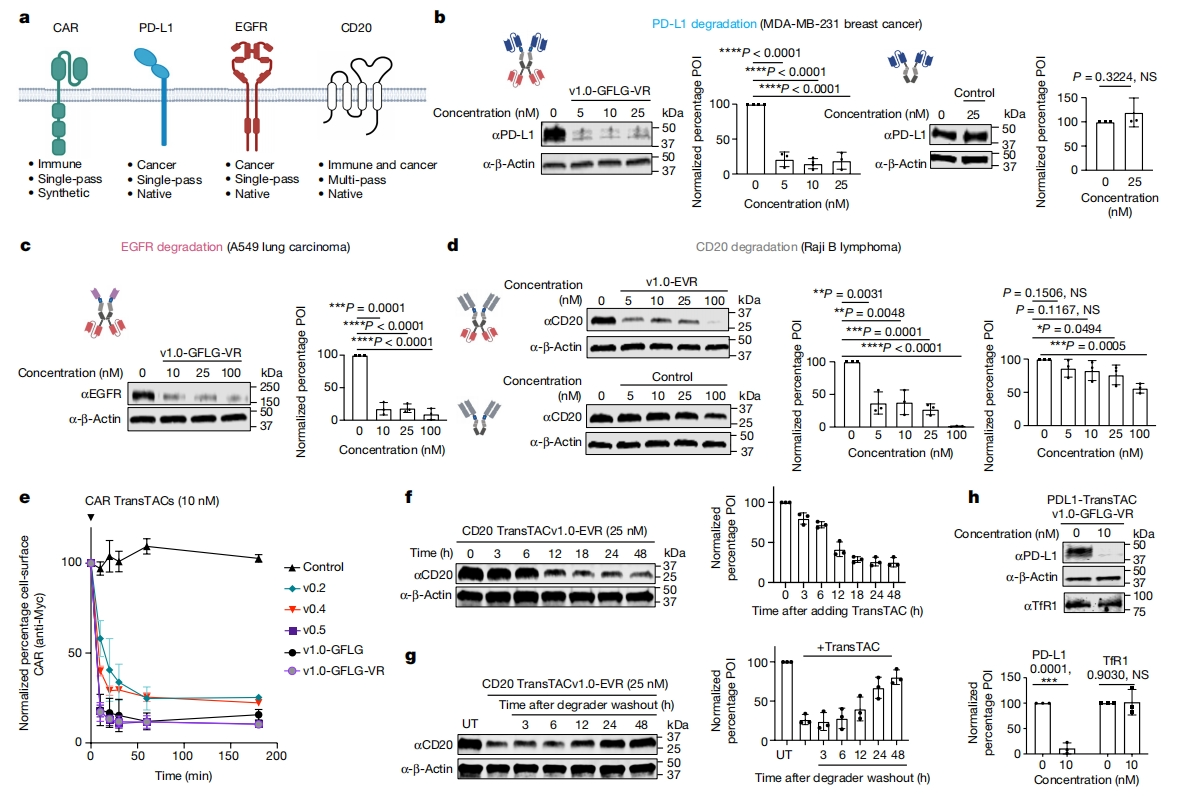
图三 TransTAC可高效降解多种膜蛋白[5]
在癌基因驱动的癌症中,获得性耐药性是靶向药物治疗的一大挑战。在接受第一代和第二代EGFR酪氨酸激酶抑制剂(TKI)治疗的非小细胞癌症(NSCLC)患者中,近一半的患者出现T790M突变,第三代TKI会发生C797突变(C797X,主要是C797S)(图四a)。研究者使用了三种不同EGFR突变和耐药性模式的癌症细胞系:PC9 Del19、PC9 Del19/T790M和PC9 Del19/T790M/C797S,比较EGFR-TransTAC与EGFR-TKI和单克隆抗体的细胞抑制活性。正如预期,PC9-Del19细胞对所有三种TKI都敏感;PC9 Del19/T790M细胞对阿法替尼的敏感性降低,对吉非替尼完全耐药,PC9 Del19/T790M/C797S细胞对三种抑制剂均无反应(图四b)。相比之下,EGFR-TransTAC显著抑制了所有三种细胞系(图四b)。研究者还对正常细胞(表达mCherry)和癌症细胞(表达GFP)进行共培养试验,使用活细胞荧光成像表征药物的作用(图四c-d)。结果显示,EGFR-TransTAC对PC9 Del19和Del19/T790M/C797S细胞显示出高效抑制能力,但对HFF-1细胞没有影响;Affibody Fc对两种细胞系均无影响;TKI抑制了PC9 Del19细胞,但没能抑制PC9 Del19/T790M/C797S(图四c-d)。研究者进一步评估EGFR-TransTAC靶向患者来源细胞系DFCI243的疗效,后者具有EGFR Del19/T790M突变(图四e),观察到细胞表面EGFR、总EGFR和磷酸化EGFR随时间逐渐减少(图四f)。在细胞毒性试验中,细胞对吉非替尼表现出预期的耐药性,但对EGFR-TransTAC敏感(图四g)。以上数据表明,EGFR-TransTAC可用于靶向肺癌且具有高敏感性。
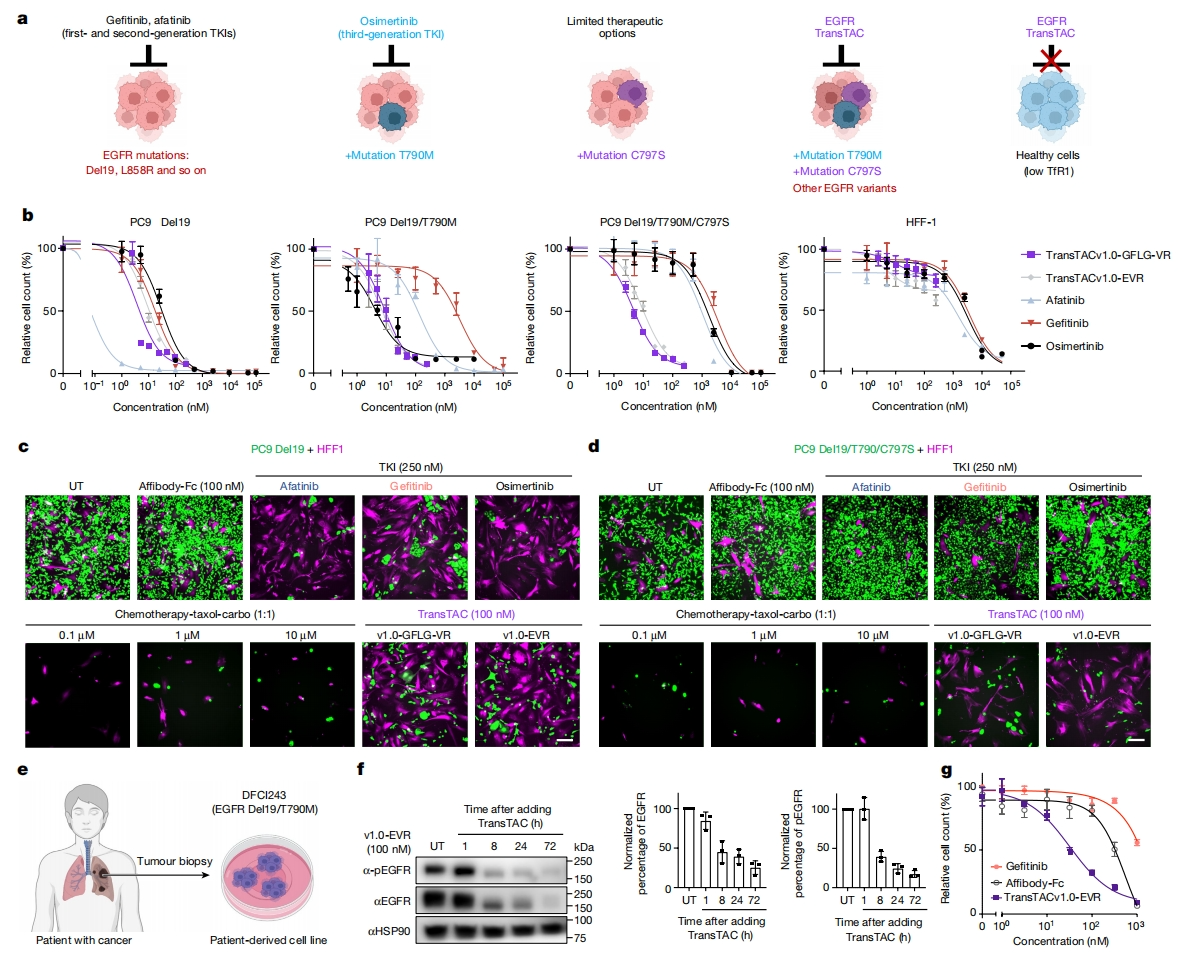
图四 EGFR-TransTAC可靶向耐药性非小细胞癌[5]
最后,研究者对EGFR TransTACv1.0-EVR的疗效进行小鼠体内表征。先给小鼠注射10 mg/kg体重的TransTAC,监测体重变化和血液毒性(图五a)。在15天内没有观察到小鼠体重减轻(图五b)。全血细胞计数(CBC)分析显示,未处理、EGFR抗体或EGFR TransTAC处理的小鼠之间没有差异,包括红细胞计数和血红蛋白水平(图五c)。接着检测血清半衰期和组织分布,显示EGFR TransTAC循环半衰期延长至16.6天,约为Affibody Fc对照组(8.5天)的两倍(图五d)。此外,在PC9 Del19/T790M/C797S异种移植小鼠模型中,EGFR TransTAC在肿瘤中检测到的水平比在脾、肺、心脏、肾脏和肝脏组织高4-27倍(图五e-f)。对PC9 Del19/T790M/C797S异种移植小鼠每2-3周进行一次10 mg/kg的EGFR TransTAC治疗,并评估抗肿瘤疗效(图五g),观察到强烈的抗肿瘤作用,9只小鼠中有4只在第42天几乎检测不到肿瘤大小(图五h和i)。于第三次注射后两天(D42)收集肿瘤,仅在EGFR TransTAC治疗组小鼠肿瘤中检测到EGFR的有效降解(图五j)。以上数据表明,EGFR TransTAC在体内具有良好的药代动力学、安全性、组织分布和抗肿瘤疗效。
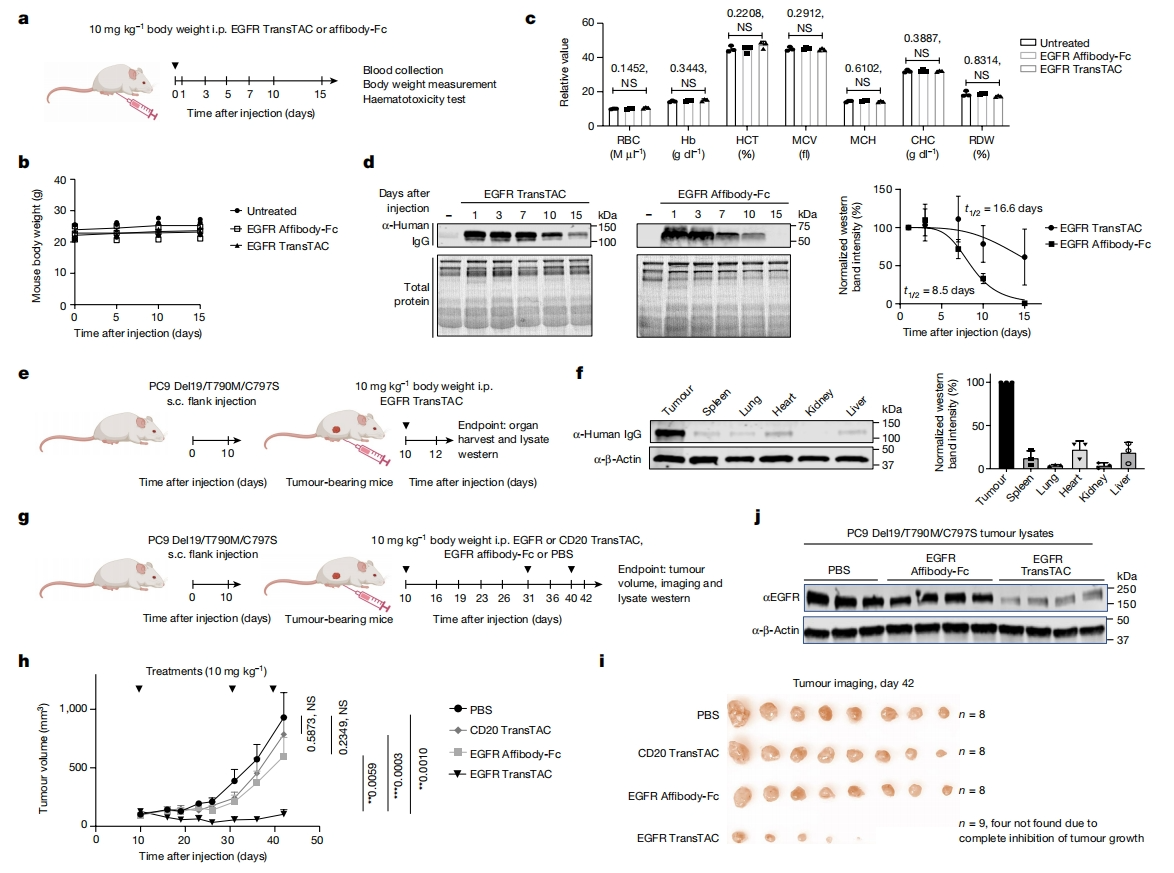
图五 TransTAC的体内疗效表征[5]
综上所述,该研究利用蛋白质工程改造开发了一种新型膜蛋白降解剂——转铁蛋白受体靶向嵌合体(TransTAC)。TransTAC是一种双特异性抗体,可通过细胞表面的转铁蛋白受体1 (TfR1)驱动POI膜蛋白的有效内化,使其能够进入内溶酶体途径进行靶向膜蛋白的降解。该研究证明了TransTAC可以高效降解各种类型的膜蛋白,在不同的细胞系统中对POI的降解效率超过80%,且具有可逆性。其中,EGFR TransTAC已在体内外实验中证明能有效抑制耐药性EGFR驱动的肺癌,有望成为一种抗药性非小细胞肺癌的潜在治疗策略,为克服现有疗法的局限性提供了新的途径。该研究开发的TransTAC适用于广泛组织类型,为膜蛋白的精准调控和癌症靶向治疗提供了一种具有广阔前景的新策略。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Wells JA, Kumru K: Extracellular targeted protein degradation: an emerging modality for drug discovery. Nat Rev Drug Discov 2024, 23(2):126-140.
2. Shen F, Dassama LMK: Opportunities and challenges of protein-based targeted protein degradation. Chemical science 2023, 14(32):8433-8447.
3. Kawabata H: Transferrin and transferrin receptors update. Free radical biology & medicine 2019, 133:46-54.
4. Iacopetta BJ, Morgan EH: The kinetics of transferrin endocytosis and iron uptake from transferrin in rabbit reticulocytes. J Biol Chem 1983, 258(15):9108-9115.
5. Zhang D, Duque-Jimenez J, Facchinetti F, Brixi G, Rhee K, Feng WW, Jänne PA, Zhou X: Transferrin receptor targeting chimeras for membrane protein degradation. Nature 2024.
6. Schmiedel BJ, Singh D, Madrigal A, Valdovino-Gonzalez AG, White BM, Zapardiel-Gonzalo J, Ha B, Altay G, Greenbaum JA, McVicker G et al: Impact of Genetic Polymorphisms on Human Immune Cell Gene Expression. Cell 2018, 175(6):1701-1715.e1716.
7. Mayle KM, Le AM, Kamei DT: The intracellular trafficking pathway of transferrin. Biochimica et biophysica acta 2012, 1820(3):264-281.
8. Goenaga AL, Zhou Y, Legay C, Bougherara H, Huang L, Liu B, Drummond DC, Kirpotin DB, Auclair C, Marks JD et al: Identification and characterization of tumor antigens by using antibody phage display and intrabody strategies. Molecular immunology 2007, 44(15):3777-3788.
9. Friedman M, Orlova A, Johansson E, Eriksson TL, Höidén-Guthenberg I, Tolmachev V, Nilsson FY, Ståhl S: Directed evolution to low nanomolar affinity of a tumor-targeting epidermal growth factor receptor-binding affibody molecule. Journal of molecular biology 2008, 376(5):1388-1402.



