技术分享:发现肝脏胆汁酸合成反馈抑制信号FGF4及其调控机制
胆汁酸(BA)是一类在肝脏合成的类固醇物质,对亲脂性营养物质的消化和吸收至关重要,也可作为信号分子调节代谢和能量稳态[1]。胆汁酸稳态或相关信号通路的破坏会导致胆汁淤积、肝胆损伤和代谢紊乱[2]。胆汁酸稳态主要通过负反馈机制和时空调控的肠肝循环来维持的[3]。胆汁酸合成调控主要依赖于肝脏和肠道中法尼醇X受体(FXR,NR1H4)的激活,该受体感知胆汁酸水平并控制胆汁酸合成、转换、转运和信号转导相关基因的转录[4]。
研究表明,在餐后肠内胆汁酸增加的情况下,激活的FXR促进肝脏中小异二聚体伴侣(SHP)或v-maf禽类肌肉腱膜纤维肉瘤癌基因同源物G(MAFG)[5]和回肠中成纤维细胞生长因子15(FGF15,人FGF19)的转录[6]。分泌的FGF15/19选择性地结合并激活肝脏FGF受体4(FGFR4)-β-klotho(KLB)复合物,启动一个尚不完全了解的途径,最终导致编码肝脏胆汁酸合成关键酶基因Cyp7a1和Cyp8b1的转录受到抑制[7]。这一内分泌途径与食物消化的生理反应相结合,促使在餐后停止新的胆汁酸合成,这种强制性的生理机制有效防止了过量胆汁酸对肝胆和肠系统的潜在毒性和损害。胆汁酸合成主要在肝脏进行,回肠FGF15/19通路的功能滞后于肝脏,这种空间和时间上的限制提出了一个关键问题:当内分泌FGF15/19信号通路尚未发挥作用时,肝内胆汁酸的合成以及总胆汁酸的含量是如何在肝脏环境中受到调控的?
2024年10月,Cell Metabolism在线报道了一项研究,发现了在非餐后或肝内胆汁淤积的情况下,肝脏Fgf4是FXR的直接靶点,通过旁分泌信号下调Cyp7a1和Cyp8b1来调控肝脏的胆汁酸合成量。FXR-FGF4的作用是由此前未知的细胞内FGFR4-LRH-1信号所介导。这种以肝脏为中心的通路充当着在外周FXR-FGF15/19通路上游的肝内和肝外胆汁酸通量的一线检查点,通过微调胆汁酸稳态以防止胆汁淤积和肝胆损伤,共同构成了一个完整的肝肠调控机制。这一发现为设计胆汁淤积和相关疾病的治疗策略打开了一扇新的大门[8]。
已知FGF15作为一种肠源性激素,作用于肝细胞FGFR4抑制Cyp7a1和Cyp8b1的表达,从而调节餐后胆汁酸的稳态[9]。研究者推测,在FXR激活下,可能还存在另一个与FGF15平行的FGF能激活肝脏FGFR4信号通路,从而有效抑制胆汁酸合成。为了验证这一假设,研究者对小鼠肝脏和肠道中所有对FXR激动剂GW4064或0.5% 胆酸(CA)饮食敏感的FGF成员进行基因表达分析。与预期的一样[9],激活的FXR显著增加了肠道中Fgf15 mRNA的表达,而肝脏中没有(图一A和B)。RT-qPCR、RNAscope和免疫荧光(IF)显示,在所有FGF成员中,FGF4在肝脏和肠道中均表现出明显的增加(图一A-D)。为确定FXR诱导的FGF4在胆汁酸合成调控中的潜在作用,研究者构建肝脏(Fgf4-LKO)或肠道(Fgf4-IKO)特异性缺失Fgf4的小鼠,发现肝脏缺失Fgf4不仅导致Cyp7a1和Cyp8b1的表达水平更高,而且也消除了激活的FXR抑制Cyp8b1的作用(图一E和F),而肠道Fgf4的缺失则没有这种影响。腺相关病毒(AAV)介导的肝细胞特异性FGF4重新导入Fgf4-LKO小鼠,又恢复了激活FXR对Cyp8b1的抑制作用(图一G和H)。相比之下,在Fgf15-/-敲除小鼠中,进一步敲降肝脏Fgf4消除了激活FXR抑制Cyp8b1的作用,但对Cyp7a1没有进一步影响(图一I)。以上结果表明,肝内FGF4可能通过激活肝脏FGFR4,调节FXR对CYP8B1和CYP7A1的差异表达,这可能是对肠源性外周FGF15严格控制肝脏CYP7A1和CYP8B1表达的一个重要补充。
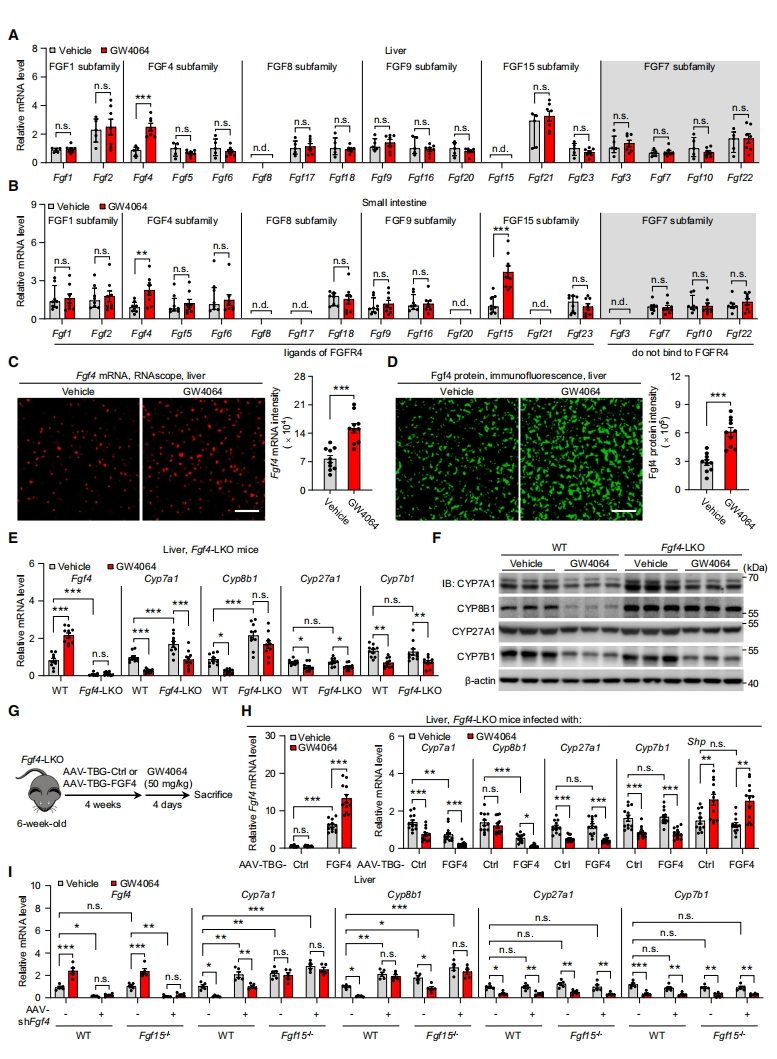
图一 FXR激活通过上调肝脏FGF4的表达来抑制经典的胆汁酸合成途径[8]
随后,研究者探索FXR是如何调节肝脏FGF4的表达。在Fgf4基因的近端启动子区域发现了一个假定的FXR响应元件(FXRE)序列(图二A)。Fgf4启动子中的WT FXRE对FXR过表达高度敏感,进而驱动荧光素酶报告基因的高表达,而该元件的缺失或突变则消除了这种效应(图二B)。染色质免疫沉淀测序(ChIP-seq)分析显示在21 kb区域的Fgf4基因内发现了另外几个FXRE元件,其中一个FXR的结合峰位于Fgf4基因转录起始位点附近(图二C)。ChIP-qPCR分析验证了激活的FXR在Fgf4基因近端启动子区域的富集(图二D)。此外,Fxr缺失导致小鼠肝脏对FXR激动剂诱导的Fgf4和Shp表达以及抑制Cyp8b1和其他FXR靶基因无响应(图二E-G)。以上数据表明,肝脏中的FGF4直接受到FXR的转录调控。
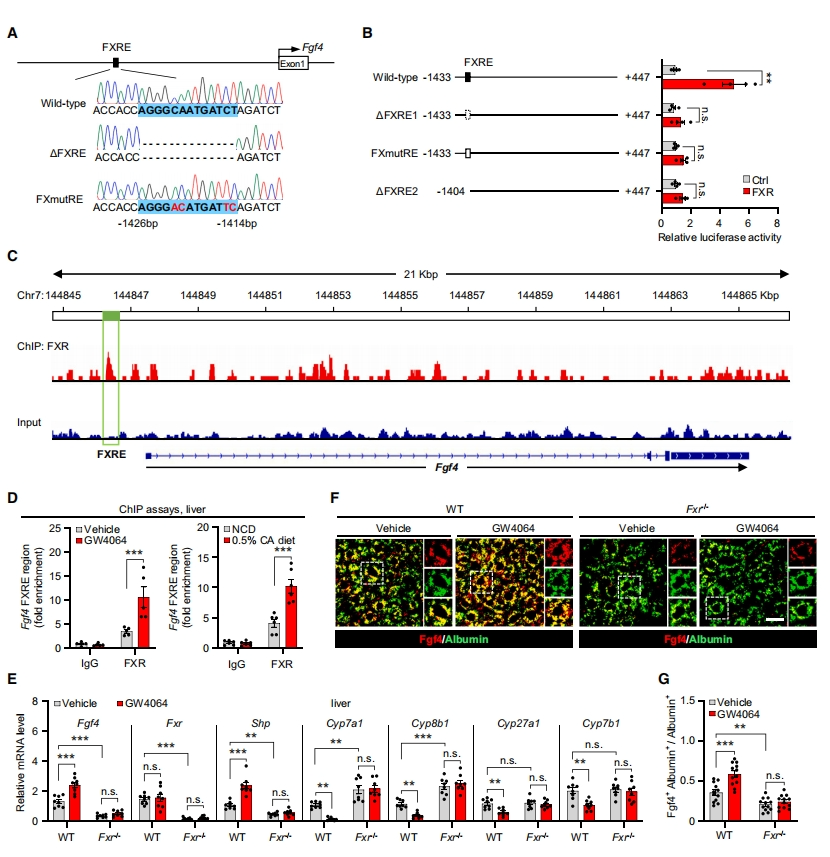
图二 Fgf4是FXR的直接下游转录靶基因[8]
接下来,研究者探究肝脏FGF4在FXR介导的胆汁酸稳态调节中的作用。分析FXR、SHP(FXR激活的一个指标)和FGF4在人胆汁淤积性肝组织中的表达水平,发现在胆汁淤积条件下,肝脏FXR-FGF4信号轴被减弱或解除调控(图三A和B)。Fgf4-LKO小鼠与野生型(WT)小鼠分别接受橄榄油或异硫氰酸萘酯(ANIT)处理,发现Fgf4-LKO小鼠表现出更严重的肝坏死,血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平升高(图三C-E)。同时,也伴随着Cyp7a1和Cyp8b1的mRNA和蛋白水平的增加,肝脏、肠道和胆囊中胆汁酸含量增加,血清总胆红素升高(图三F和G)。参与胆汁酸合成替代途径(Cyp27a1和Cyp7b1)和胆汁酸转运(Mdr2、Bsep、Mrp2、Ntcp和Oatp1/2)的基因表达水平不受影响(图三F)。人类MDR2突变是进行性家族性肝内胆汁淤积症发展的原因[10]。因此,研究者建立一个肝脏Mdr2和Fgf4双敲除小鼠(Mdr2-/-;Fgf4-LKO),发现肝脏Fgf4缺失显著加重Mdr2缺失引起的胆汁淤积性肝损伤和纤维化(图三H)。一致地,血清ALT和AST水平进一步升高,Cyp7a1和Cyp8b1的表达和活性更高,肝脏、血清和小肠胆汁酸含量更高,血清总胆红素升高,而Cyp27a1、Cyp7b1、Bsep、Mrp2、Ntcp和Oatp1/2的表达均无变化(图三I-K)。以上数据表明,肝脏特异性的Fgf4缺失会加剧胆汁淤积和肝损伤。
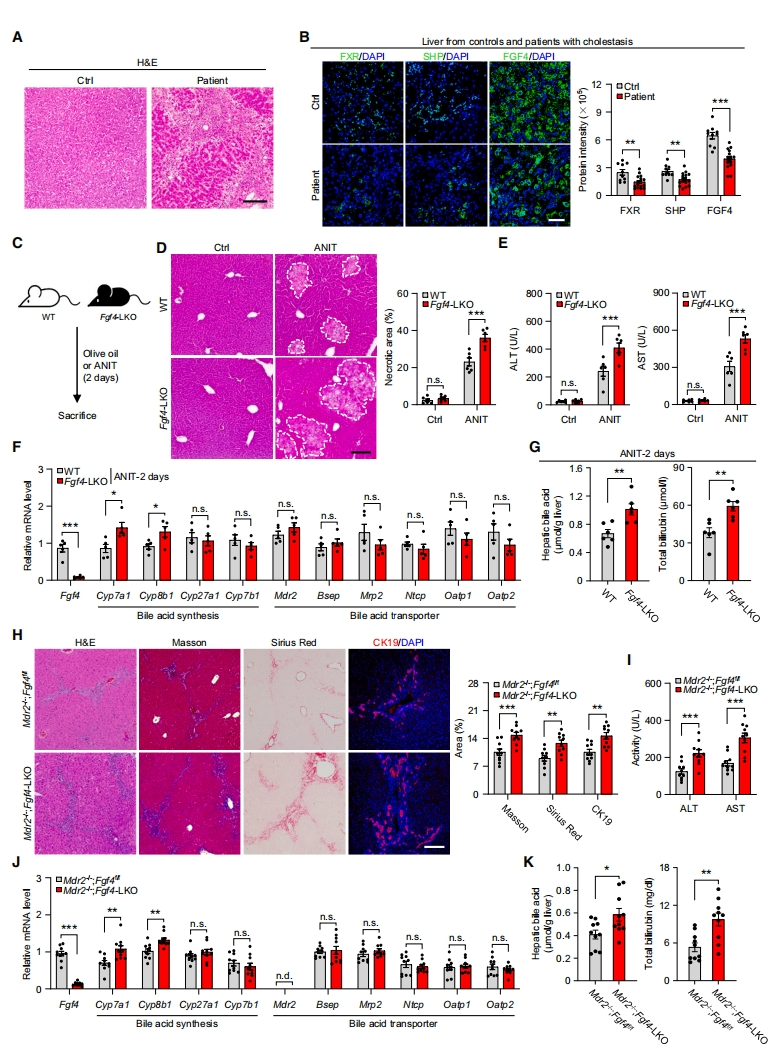
图三 肝脏特异性Fgf4缺失通过增加胆汁酸合成加剧胆汁淤积性肝损伤[8]
与之前的报道一致[11],FXR激动剂GW4064对ANIT诱导的肝坏死有显著的保护作用(图四A),同时肝脏FGF4表达显著升高,胆汁酸表达显著降低(图四B)。Fgf4 mRNA的表达水平升高与血清肝损伤标志物、ALT和AST呈负相关(图四C),表明FGF4在FXR激动剂的抗胆汁淤积作用中起着中介作用,提示其在胆汁淤积和相关肝损伤方面具有药理潜力。研究者评估重组FGF4(rFGF4)对ANIT处理和Mdr2缺失诱导的胆汁淤积小鼠的治疗效果(图四D和K)。与对照组相比,rFGF4导致肝脏、血清和小肠中胆汁酸以及血清总胆红素显著降低(图四E和L),这与肝脏Cyp7a1和Cyp8b1的表达和活性降低相吻合(图四F-H和M)。这些变化与血清ALT和AST水平的降低以及组织病理学参数的改善一致,包括坏死、胆道纤维化和胆管细胞增殖(图四I和J,N和O)。以上数据表明,药理学FGF4治疗可通过抑制胆汁酸合成保护肝脏免受胆汁淤积性肝损伤。
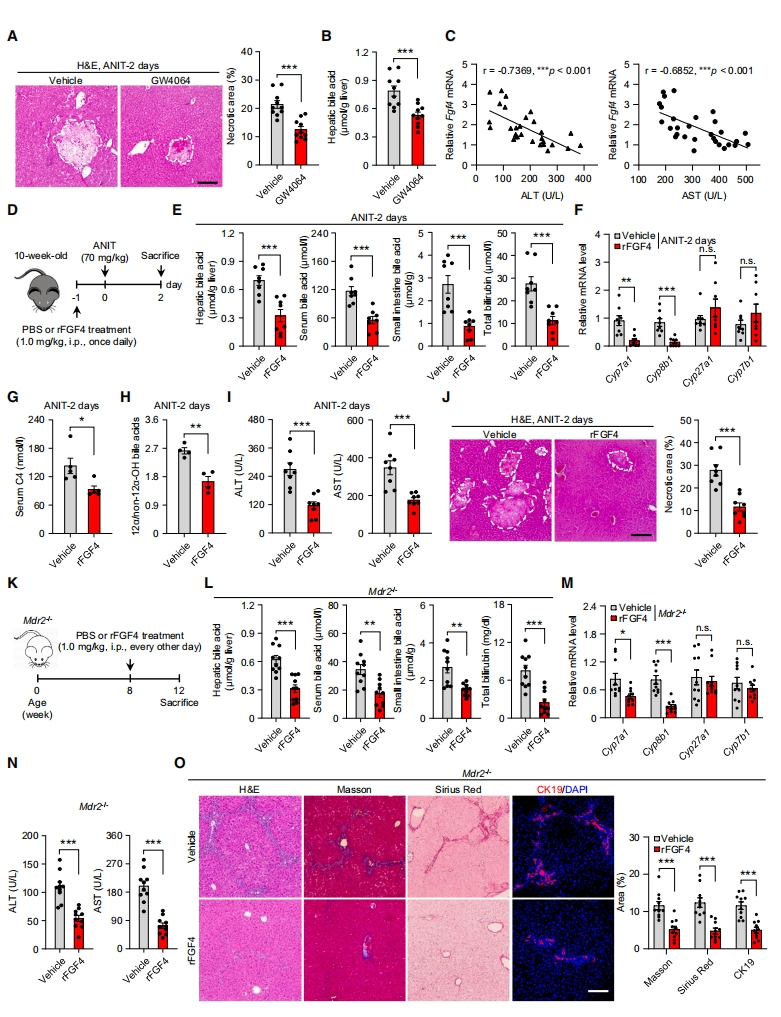
图四 药理学FGF4抑制胆汁酸合成并保护小鼠免受胆汁淤积和肝损伤[8]
FGFR4是已知的调节肝脏胆汁酸合成的主要FGF受体 [12]。Fgfr4的缺失减弱了rFGF4对肝脏和分离的原代肝细胞中Cyp7a1和Cyp8b1的抑制作用(图五A),表明肝脏FGFR4是FGF4负调控胆汁酸合成的直接作用靶点。为确定FGF4激活的FGFR4下游潜在介质,研究者检测了FGFR4与胆汁酸合成的几种已知细胞内调节因子的潜在相互作用[5]。有趣的是,尽管SHP、MAFG、LRH-1和HNF4a被FGFR4下调,但在体内肝脏和体外无细胞体系中,只有Cyp7a1和Cyp8b1的已知上游调节因子LRH-1被FGFR4磷酸化(图五B-E)。GST下拉试验和近端连接试验(PLA)均证实了这种相互作用(图五D和F)。rFGF4显著增加了WT小鼠肝脏中LRH-1的磷酸化,但Fgfr4缺陷小鼠没有(图五G)。这些结果表明,LRH-1是新鉴定到的肝脏FGF4激活FGFR4信号通路的直接下游细胞内介质。
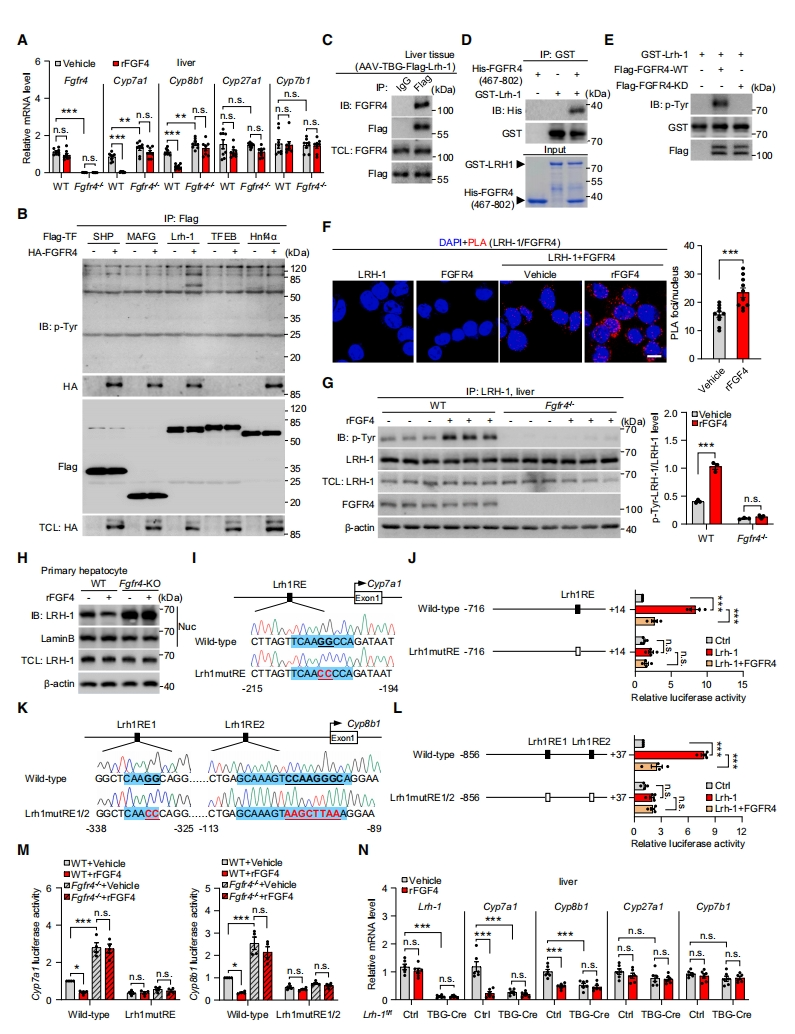
图五 FGF4-FGFR4-LRH-1通路调控胆汁酸的合成[8]
肝脏LRH-1是一种转录因子,在FXR介导的抑制基因Cyp7a1和Cyp8b1从细胞质转移到细胞核中起关键作用[13]。鉴于LRH-1磷酸化与肝脏FGF4-FGFR4通路的关联,研究者探究FGF4-FGFR4-LRH-1通路激活对胆汁酸合成的下游影响。结果显示,rFGF4处理降低了原代肝细胞中LRH-1的核定位,而这种效应因Fgfr4缺失而消除(图五H)。此外,在HEK293T细胞中,LRH-1的过表达显著增加了Cyp7a1和Cyp8b1启动子上的WT LRH-1反应元件(Lrh1RE)的荧光素酶报告基因的活性,但不是突变型Lrh1RE(图五I-L)。然而,FGFR4与LRH-1共表达导致了报告基因活性的丧失,而Fgfr4的缺失则促进了比WT细胞更高的活性(图五I-M)。rFGF4处理可以抑制WT Cyp7a1和Cyp8b1启动子驱动的报告基因活性的增加,但在没有Fgfr4的情况下则不能抑制(图五M)。此外,Lrh-1的肝细胞特异性KO不仅导致Cyp7a1和Cyp8b1的基础mRNA水平显著降低,而且对rFGF4处理无反应(图五N)。以上数据表明,LRH-1在FGF4-FGFR4通路介导的抑制Cyp7a1和Cyp8b1表达的作用中是必不可少的。
为理解LRH-1在介导FGF4-FGFR4作用中的机制,研究者分离超磷酸化条带,并进行磷酸化位点分析。突变分析和体外激酶分析显示,将LRH-1上Tyr292、Tyr296和Tyr547突变为苯丙氨酸的组合突变体(3YF)消除了FGFR4催化的酪氨酸磷酸化(p-Tyr)信号(图六A和B)。此外,与WT-LRH-1相比,在Lrh-1-KO或KD细胞中过表达磷酸化缺陷的3YF-LRH-1,即使在rFGF4刺激下,也显示出最小的p-Tyr信号(图六C)。序列比对结果表明,LRH-1中的这些酪氨酸残基在不同物种中高度保守(图六D)。与WT-LRH-1相比,在LRH-1-/- AML12肝细胞中,非磷酸化的3YF-LRH-1经rFGF4处理后向核易位的敏感性要低得多(图六E)。与磷酸化依赖的LRH-1核易位相一致,磷酸化缺陷的3YF提高了Cyp7a1和Cyp8b1启动子中具有WT Lrh1RE的荧光素酶报告基因的转录活性,但突变型Lrh1RE没有(图六F)。假定的Tyr模拟物3YE和3YD(将Y分别变为E和D),其转录活性与3YF LRH-1相似,表明这些替代物无法模拟被激活的FGFR4磷酸化的酪氨酸WT-LRH-1(图六F)。将WT-LRH-1重新引入LRH-1缺陷的AML12和HepG2细胞中,而不引入联合突变体3YF、3YE或3YD,不仅促进了FGF4刺激的LRH-1磷酸化水平,也促进了FGF4-诱导的Cyp7a1和Cyp8b1表达的抑制(图六C和G)。同样,在肝细胞特异性缺失Lrh-1的小鼠中,WT-LRH-1的重新表达,而不是3YF,恢复了肝脏中FGF4诱导的对Cyp7a1和Cyp8b1表达的抑制(图六H和I)。以上数据表明,FGF4介导的胆汁酸合成抑制依赖于特定的酪氨酸磷酸化,从而通过激活的FGFR4使LRH-1失活。
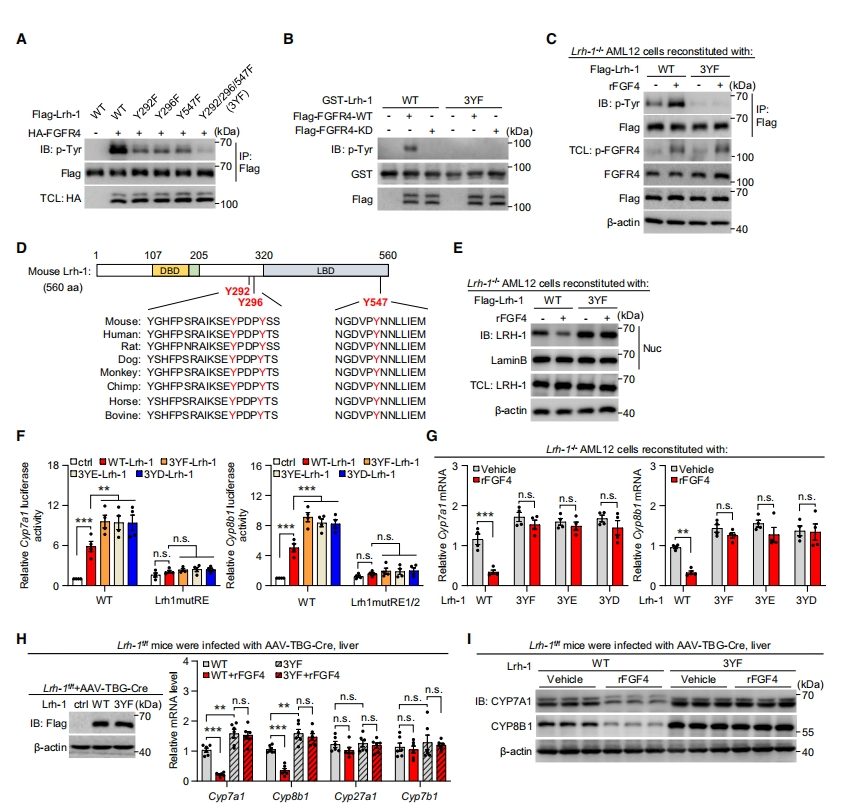
图六 磷酸化LRH-1对于肝脏FGF4-FGFR4通路介导的胆汁酸合成抑制至关重要[8]
最后,研究者探究FGFR4介导的酪氨酸磷酸化和LRH-1失活在胆汁酸扰动适应性反应中的意义。在肝细胞特异性LRH-1缺失小鼠中通过AAV在肝脏过表达WT或3YF-LRH-1并给与ANIT处理(图七A)。与WT-LRH-1相比,3YF突变体加重了ANIT诱导的胆汁淤积性肝病理,如肝细胞坏死和结构异常(图七B和C)。相比之下,3YF突变体的表达消除了rFGF4诱导的改善胆汁淤积性病变、血清ALT、AST和总胆红素水平以及肝脏、血清、小肠和胆囊中胆汁酸总量(图七D和E)。与这些变化相一致,3YF也消除了rFGF4诱导的Cyp7a1和Cyp8b1下调(图七F和G)。过表达WT-LRH-1的LRH-1缺陷小鼠的肝脏在rFGF4处理后,酪氨酸磷酸化的LRH-1显著增加,而过表达3YF-LRH-1几乎完全消失(图七G)。以上数据表明,由FGF4-FGFR4通路引发的LRH-1磷酸化在肝脏对肝胆损伤的适应性反应中起重要作用,从而调控胆汁酸的合成,这提供了一种对抗胆汁淤积的防御机制。
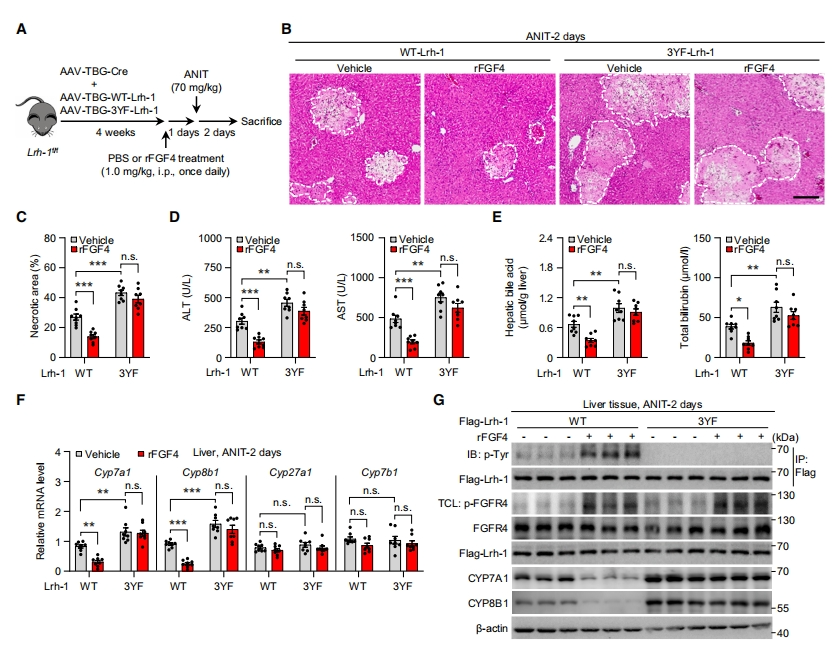
图七 rFGF4对胆汁淤积性肝损伤的治疗效果依赖于FGFR4介导的LRH-1磷酸化[8]
综上所述,该研究通过系统性筛选分析对FXR诱导效应有差异的FGF家族成员,发现肝脏Fgf4是肝脏FXR下游的一个新的旁分泌信号,调控肝脏中初级胆汁酸的合成。FXR-FGF4的作用是通过靶向肝脏FGFR4-LRH-1信号抑制胆汁酸合成。这一新发现的肝脏FXR-FGF4-FGFR4-LRH-1通路为胆汁酸稳态增加了另一个检查点,是外周FGF15/19通路上游肝脏胆汁酸合成的负反馈因子。这一发现对设计胆汁淤积和相关肝病的潜在药物疗法具有关键的战略意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Perino A, Schoonjans K: Metabolic Messengers: bile acids. 2022, 4(4):416-423.
2. Fuchs CD, Trauner M: Role of bile acids and their receptors in gastrointestinal and hepatic pathophysiology. 2022, 19(7):432-450.
3. Russell DW: The enzymes, regulation, and genetics of bile acid synthesis. Annu Rev Biochem 2003, 72:137-174.
4. Calkin AC, Tontonoz P: Transcriptional integration of metabolism by the nuclear sterol-activated receptors LXR and FXR. Nature reviews Molecular cell biology 2012, 13(4):213-224.
5. de Aguiar Vallim TQ, Tarling EJ, Ahn H, Hagey LR, Romanoski CE, Lee RG, Graham MJ, Motohashi H, Yamamoto M, Edwards PA: MAFG is a transcriptional repressor of bile acid synthesis and metabolism. Cell metabolism 2015, 21(2):298-311.
6. Inagaki T, Moschetta A, Lee YK, Peng L, Zhao G, Downes M, Yu RT, Shelton JM, Richardson JA, Repa JJ et al: Regulation of anti胆汁酸cterial defense in the small intestine by the nuclear bile acid receptor. Proc Natl Acad Sci U S A 2006, 103(10):3920-3925.
7. Gadaleta RM, Moschetta A: Metabolic Messengers: fibroblast growth factor 15/19. 2019, 1(6):588-594.
8. Song L, Hou Y, Xu D, Dai X, Luo J, Liu Y, Huang Z, Yang M, Chen J, Hu Y et al: Hepatic FXR-FGF4 is required for bile acid homeostasis via an FGFR4-LRH-1 signal node under cholestatic stress. Cell metabolism 2024.
9. Inagaki T, Choi M, Moschetta A, Peng L, Cummins CL, McDonald JG, Luo G, Jones SA, Goodwin B, Richardson JA et al: Fibroblast growth factor 15 functions as an enterohepatic signal to regulate bile acid homeostasis. Cell metabolism 2005, 2(4):217-225.
10. Trauner M, Fickert P, Wagner M: MDR3 (ABCB4) defects: a paradigm for the genetics of adult cholestatic syndromes. Seminars in liver disease 2007, 27(1):77-98.
11. Liu Y, Binz J, Numerick MJ, Dennis S, Luo G, Desai B, MacKenzie KI, Mansfield TA, Kliewer SA, Goodwin B et al: Hepatoprotection by the farnesoid X receptor agonist GW4064 in rat models of intra- and extrahepatic cholestasis. The Journal of clinical investigation 2003, 112(11):1678-1687.
12. Song L, Wang L, Hou Y, Zhou J, Chen C, Ye X, Dong W, Gao H, Liu Y, Qiao G et al: FGF4 protects the liver from nonalcoholic fatty liver disease by activating the AMP-activated protein kinase-Caspase 6 signal axis. 2022, 76(4):1105-1120.
13. Meinsohn MC, Smith OE, Bertolin K, Murphy BD: The Orphan Nuclear Receptors Steroidogenic Factor-1 and Liver Receptor Homolog-1: Structure, Regulation, and Essential Roles in Mammalian Reproduction. Physiological reviews 2019, 99(2):1249-1279.



