技术分享:非人灵长类DMD疾病模型建立及其早期病理变化表征
杜氏肌营养不良症(DMD)是一种隐性遗传的X连锁严重肌肉退行性疾病,其特征是进行性肌肉无力和肌肉损失。该疾病是由DMD基因突变引起的,导致抗肌萎缩蛋白缺失或显著减少。抗肌萎缩蛋白在维持肌肉细胞膜的稳定性方面起着至关重要的作用,它是连接细胞内肌动蛋白、细胞骨架网络和细胞外基质(ECM)的连接点[1]。抗肌萎缩蛋白的缺失会导致各种后果,包括炎症、纤维化、线粒体功能障碍以及钙和活性氧失调,所有这些影响都被认为在DMD的病因中起着重要作用[1, 2]。最近的研究还表明,DMD导致肌肉干细胞(MuSC)的功能失调,使得肌肉再生潜能受损[3, 4]。
目前,该领域的研究主要集中在研发DMD基因治疗和药物干预治疗。然而,关于DMD发病的细胞和分子机制了解仍然有限,特别是早期发生的变化。因此,建立DMD动物模型一直是该领域的研究重点。现已构建了几种哺乳动物模型如mdx小鼠、GRMD犬和DMD猪[4-9],尽管这些模型已被广泛用于研究DMD疾病机制和测试基因治疗效果,但是它们所表现的疾病表型与人类患者相比更加温和,无法忠实模拟人类DMD的发病机制。非人灵长类动物在进化上与人类最为接近,两个物种在遗传学、精细运动技能、肌肉结构和功能、以及免疫和代谢系统方面具有很高的相似性。因此,利用CRISPR-Cas9介导基因编辑来构建非人灵长类DMD动物模型,对于深入了解DMD患者发病的分子和细胞机制具有重要的临床意义。
2024年9月,Cell期刊在线报道了一项杜氏肌营养不良症(DMD)的恒河猴模型研究,该模型具有进行性肌肉退化和运动功能受损表型,可重现DMD患者中观察到的大多数早期病理表型。利用单细胞RNA测序(scRNA-seq)分析,揭示了该模型的DMD疾病免疫细胞景观变化,成纤维/成脂肪祖细胞(FAP)谱系进展方向逆转,FAP和肌肉干细胞(MuSC)对TGF-β的抵抗。此外,MuSC表现出细胞固有缺陷,导致分化缺陷。该研究提供了一种更先进的DMD疾病动物模型,为DMD疾病的发病机制提供了新的见解,对于开发早期治疗方案以及疗效评价具有重要意义[10]。
此前,研究者基于CRISPR-Cas9构建了携带DMD基因5号外显子突变的F0雌性恒河猴[11]。由于突变基因的嵌合表达,F0雌性恒河猴中仍然可以检测到正常的抗肌萎缩蛋白的表达,且肌肉病理特征不明显(图一A)。由此,研究者对F0雌性恒河猴进行超排获得足够数量的野生型(WT)或DMD突变型卵母细胞(图一B)。使用辅助生殖技术,将体外获得的胚胎移植到代孕猴体内,最终获得6只DMD基因移码突变的F1雄性恒河猴(图一C和D)。肢体和背部肌肉取样的免疫印记和免疫染色结果表明,在WT和DMD突变嵌合表达F0中,仍可以检测到抗肌萎缩蛋白的表达,但F1 DMD猴中几乎检测不到抗肌萎缩蛋白的表达(图一E和F)。DMD患者由于抗肌萎缩蛋白的显著减少或缺失,其结合伴侣syntrophin的表达水平也会降低[12]。一致地,DMD猴的syntrophins蛋白表达水平也显著降低(图一F)。6月龄(m)和1岁(y)猴的肌肉活检HE染色结果显示,与WT猴相比,DMD猴的肌肉变化和肌纤维横截面积(CSA)显著增加;且与6月龄 DMD猴相比,1岁 DMD猴的肌肉纤维面积的变异性更大(图一G和H)。位于肌肉纤维中心的细胞核表明损伤后的再生。在DMD猴中,中心有核纤维(CNF)的百分比急剧增加,CNF从6月龄持续增加到1岁;与背部肌肉相比,四肢肌肉的CNF百分比更高,表明1岁时肢体肌肉的肌肉损伤更为严重(图一G和I)。骨骼肌纤维化的发展是DMD患者的另一个典型表型[13, 14]。研究者对肌肉冷冻切片进行天狼星红染色,发现6月龄和1岁DMD猴肌肉中都有很明显的纤维化,随着年龄的增长,纤维化程度逐渐加重,肢体肌肉的纤维化程度显著高于背部肌肉(图一J和K)。血清肌酸激酶(CK)是临床上用于诊断DMD的常见生化标志物,特别是在疾病的早期[14]。生化检测结果显示,DMD猴的CK水平持续大幅上升,与WT相比增加了约30到100倍(图一L)。研究者还测量了人类DMD诊断中常用的几种循环血清生物标志物的水平,包括丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST),乳酸脱氢酶(LDH)和α-羟基丁酸脱氢酶(α-HBDH)。结果显示,与人类DMD患者情况类似,DMD猴的ALT、AST、LDH和α-HBDH水平均显著升高(图一M-P),表明DMD猴再现了人类患者中出现的高转氨酶血症和代谢缺陷。以上数据表明,F1 DMD猴与人类DMD患者具有共同的组织学和血清生物标志物的改变,并显示出与人类患者相似的致病进展。
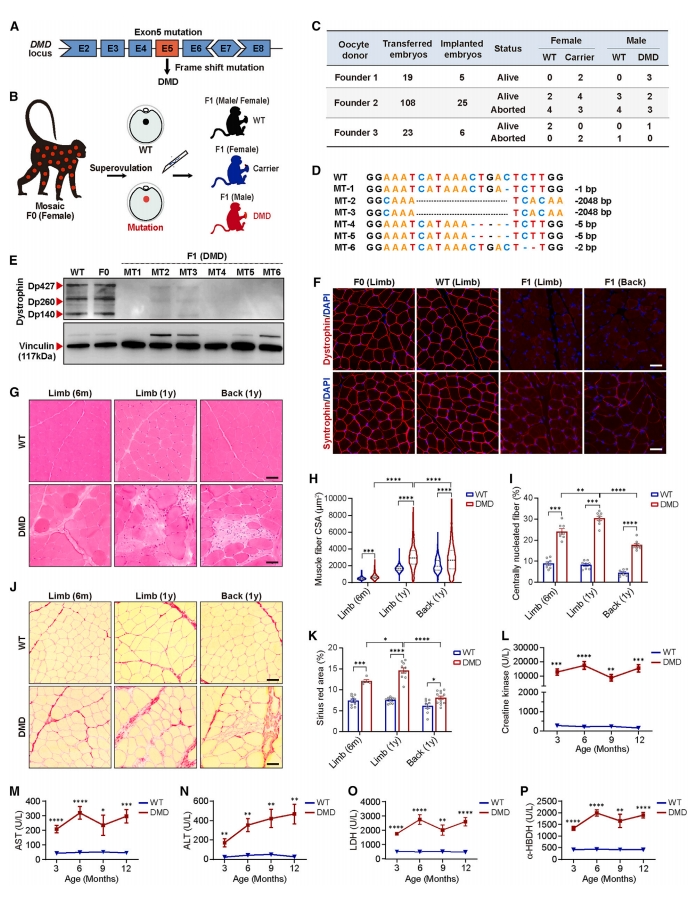
图一 DMD恒河猴模型构建及其病理表征[10]
1岁猴子相当于3-4岁的儿童,这正是人类DMD患者表现出肌肉无力早期症状的关键时期[15]。于是,研究者对1岁DMD猴的四肢肌肉、横膈肌和心肌功能进行检测,评估DMD猴的疾病表型是否与人类患者相似。足趾行走是DMD患者的特征症状,是由小腿肌无力引起的。研究者记录DMD猴在跑步机上行走的步态(图二A),发现DMD猴行走足迹缺乏与脚跟接触,导致脚步间距缩短(图二B和C),行走距离和总行为计数显著减少(图二D和E),站立相关行为的总数和持续时间以及需要肌肉力量的垂直悬挂时间也显著减少(图二F和G)。使用站立测试实验进一步对DMD猴的肌肉力量进行评估,将猴双手限制在后方并置于仰卧姿势,站起来需要多个肌肉群共同协作。结果发现,WT猴均能在2秒内迅速从仰卧位起身,但DMD猴从仰卧位起身时表现得十分困难(图二H),只有40%的DMD猴在6秒内起身,而其余60%的DMD猴在评估期间未能站起来(图二I)。心肺衰竭是DMD患者晚期死亡的主要原因。正如预期,超声心动图检查没有观察到1岁DMD猴的心脏结构或功能发生显著变化,膈肌缺陷也没有显著变化。以上实验结果证实DMD猴肌无力的疾病表型与人类DMD患者中观察到的早发性肌肉无力相一致,表明该DMD猴可以作为研究DMD疾病进展的非人灵长类模型。
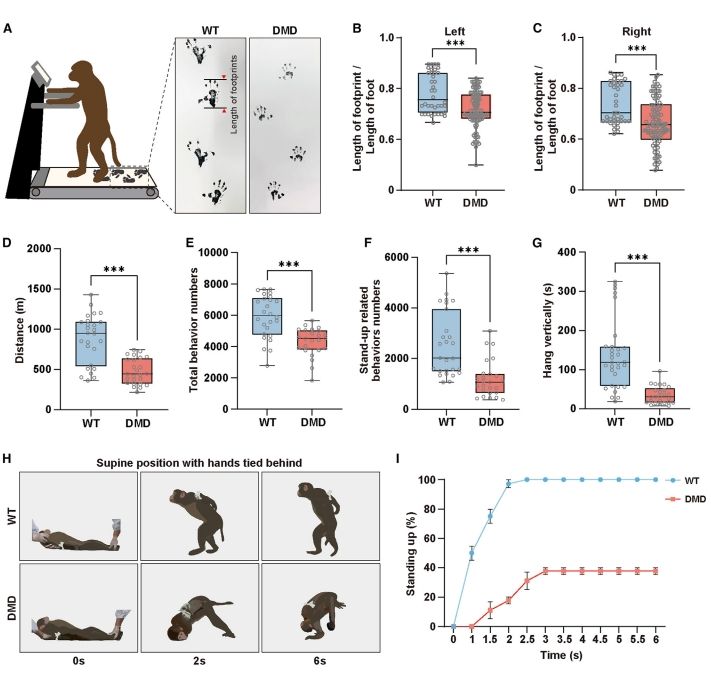
图二 DMD猴的运动功能评估[10]
接下来,研究者通过单细胞RNA测序(scRNA-seq)对1岁DMD和WT雄猴骨骼肌中单核细胞组成进行分析。共鉴定出9个细胞簇,WT猴的所有细胞类型也在DMD猴中也能检测到(图三A)。通过使用先前报道的分子标志物来注释细胞簇,发现猴骨骼肌中鉴定的细胞类型与人类和小鼠骨骼肌相似[16-19]。例如,内皮细胞(EC)的特征是PECAM1基因的表达,成纤维/成脂肪祖细胞(FAP)的特征是PDGFRA基因的表达,肌腱细胞的特征是TNMD和TNC基因的表达,MuSC的主要特征是PAX7的表达(图三A-C)。进一步分析表明,DMD猴肌肉中FAP的百分比显著下降,而免疫细胞百分比增加(图三A和D)。以上实验结果揭示了DMD猴骨骼肌组织中的细胞组成发生动态变化,表明在疾病进展过程中存在持续的炎症反应和细胞重塑。
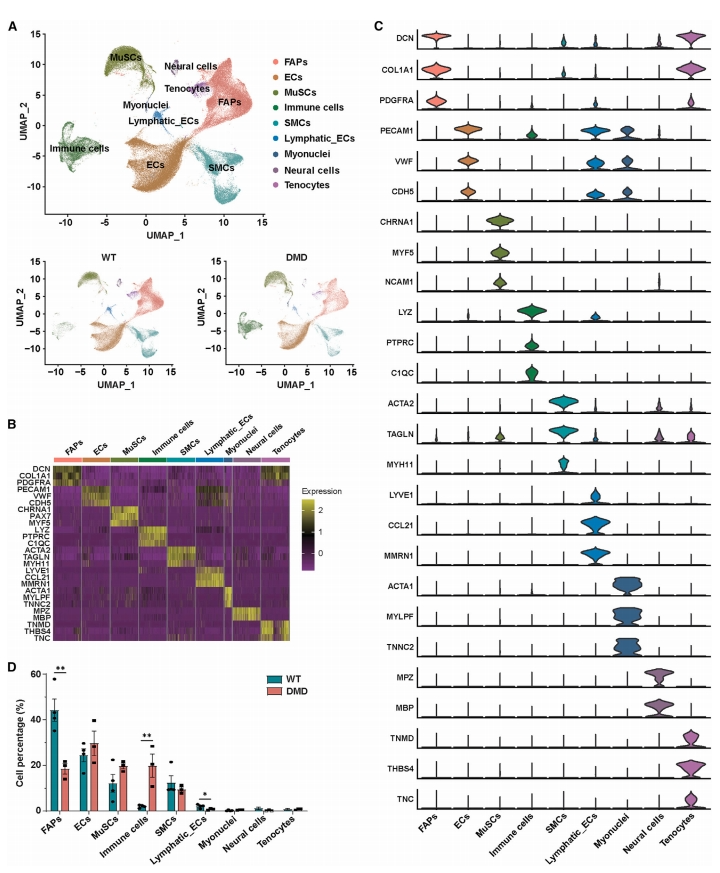
图三 DMD猴骨骼肌的scRNA-seq分析[10]
由于慢性肌肉损伤引起的炎症,DMD患者骨骼肌中常检测到免疫细胞数量的增加[20]。研究者进一步分析骨骼肌中的免疫细胞成分,在WT猴中只检测到中等数量的免疫细胞,主要为肌肉驻留巨噬细胞(Mph)(图四A-C)。而DMD猴中免疫细胞的数量显著升高,增加了10倍以上(图三A-D)。Mph细胞百分比急剧增加,共鉴定了5个不同的Mph亚群以及2个循环Mph亚群,所有Mph亚群都急剧增加(图四C),包括促炎和抗炎亚群(图四D),表明抗炎机制在DMD的早期也被激活。一致地,在DMD猴中特异性检测到抗炎T调节(Treg)细胞(图四C和D)。这些结果表明,在DMD发病的早期阶段,抗炎调节系统积极平衡慢性肌肉损伤所诱导的促炎免疫细胞增加。此外,表达CLEC9A的树突状细胞(CLEC9A_DC)特异性地存在于DMD猴骨骼肌中(图四C和D),其可识别受损细胞和死细胞[21],表明DMD猴骨骼肌存在损伤和再生缺陷。另外,DMD猴骨骼肌中特异性缺失CD40LG+(CD40配体)T细胞亚型和PLCG1+(磷脂酶Cγ1)T细胞亚型(图四C和D),这两种亚型均处于T细胞成熟过程的中间阶段[22, 23]。在WT和DMD猴中都检测到一小部分循环T细胞亚型,DMD比例更高些(图四C和D),表明由于DMD猴骨骼肌中激活的炎症微环境,T细胞的成熟水平提高。以上实验结果表明,DMD猴骨骼肌中出现了炎症的过度激活,再现了人类DMD患者的炎症症状。
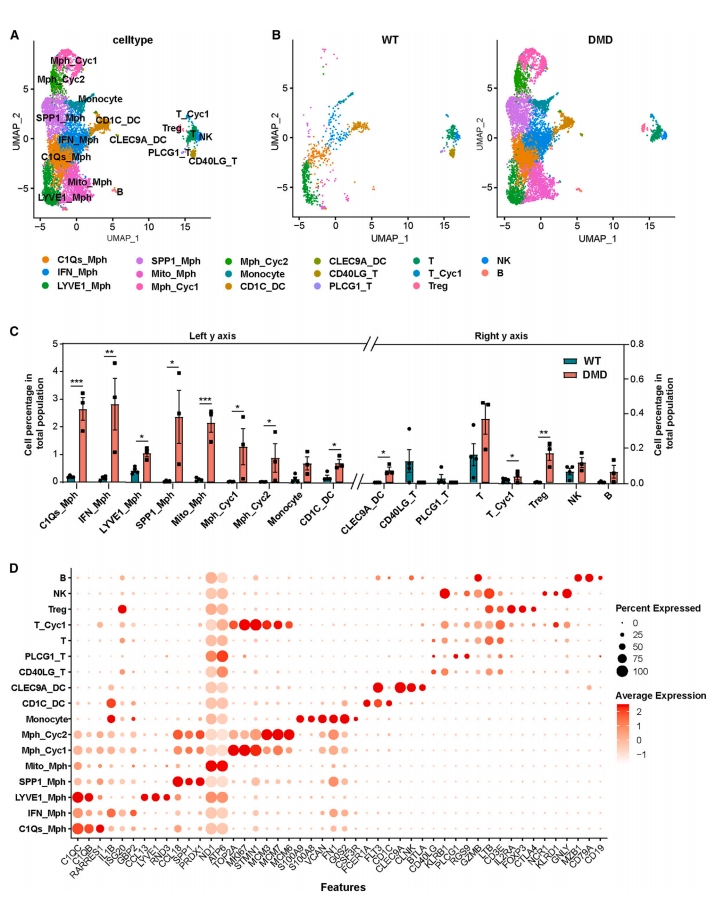
图四 DMD猴骨骼肌的免疫细胞景观变化[10]
FAP是位于骨骼肌间隙间充质区的细胞群,在调节骨骼肌再生的微环境中起着关键作用,负责肌肉中成纤维细胞和脂肪细胞的积累[24, 25]。研究者进一步分析FAP的细胞组成,根据表达谱将其分为7个亚型,即FAP 1-7(图五A-C)。在小鼠骨骼肌中,Dpp4和Cxcl14可以标记两种不同亚型的FAP [26],在猴骨骼肌中也检测到Dpp4-Cxcl14+ FAP(FAP3)和Cxcl14-Dpp4+ FAP(FAP1)(图五B和C)。与小鼠相似,猴骨骼肌FAP1细胞以几种信号分子的高表达为标志,如WNT2和BMP5,表明这些细胞是骨骼肌中的信号源。同时,一些成纤维细胞标志基因如POSTN、COL1A1和FBN1,在FAP1中高度表达,表明它们是纤维化FAP(图五C)。与小鼠FAP3细胞高度表达ECM基因不同,猴FAP3表达免疫细胞的分子标记,如C3、C7、Cxcl14和TNFSF13b(图五C),提示这些细胞可能在调节FAP和免疫细胞之间的相互作用中发挥作用,也可能作为细胞信号的来源。猴肌肉里大多数FAP同时表达CXCL14和DPP4(图五B)。FAP4处于脂肪生成分化的中间阶段(图五C和F)。FAP5亚型高表达ECM相关基因如MME、COL15A1和COL4A1(图五C),这些基因与脂肪生成有关[27]。FAP7表达脂肪细胞相关基因如FABP4和CD36,表明FAP7是另一组脂肪生成相关的FAP(图五C)。FAP6表达成纤维细胞相关基因如COL1A1、POSTN和THBS4(图五C),表明FAP6是另一组纤维化FAP。并且FAP6是所有FAP亚群中唯一在DMD猴中细胞百分比增加的亚群(图五D和E)。分析骨骼肌中FAP谱系转化途径的动态变化,发现DMD猴FAP谱系转化途径与WT有所不同(图五F)。在WT猴中,FAP2有向FAP1、FAP4、FAP5和FAP6分化的潜力。而DMD猴FAP1和FAP4都可向FAP2分化,FAP2向FAP5的分化潜力较弱;FAP3向FAP2的分化潜力减弱,但向FAP4的分化潜力增强;FAP6获得了向FAP5细胞分化的潜力(图五F),提示DMD猴中额外的脂肪生成分化途径可能有助于DMD患者肌肉组织中观察到的脂肪细胞浸润。WT猴子中FAP7可以进一步分化为FAP5脂肪细胞,而DMD猴失去了这种分化途径。这些结果表明,FAP细胞类群在DMD猴的病理条件下发生了显著的分化方向和分化潜力的改变。
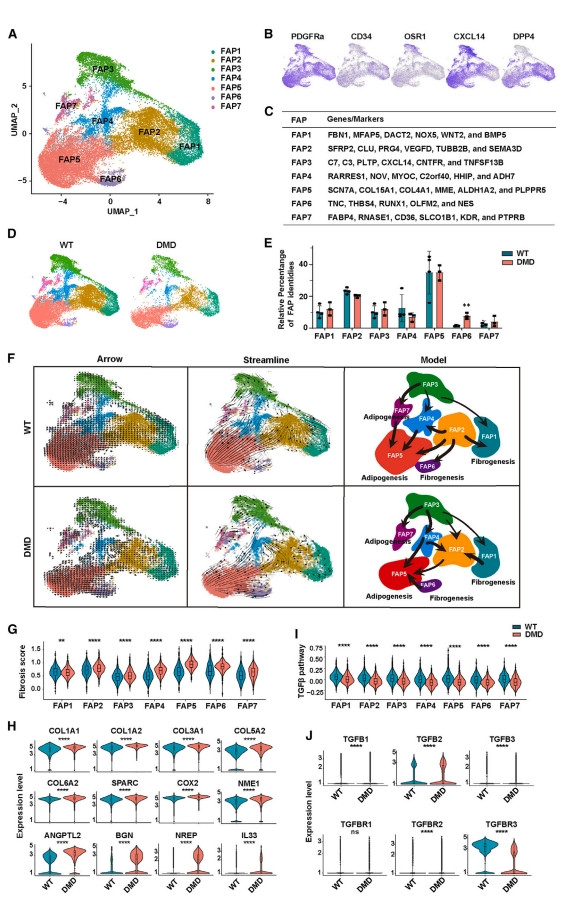
图五 DMD猴模型中FAP细胞类群的动态变化[10]
进一步对FAP基因表达谱进行分析,发现所有FAP亚群中ECM和ECM受体相互作用相关基因的上调,纤维化相关基因如COL1A2、COL3A1、COL5A2、COL6A2、BGN和THBS4都上调(图五G和H),表明FAP有助于肌肉纤维化ECM表达的增加。转化生长因子β(TGF-β)是肌肉纤维化的关键激活因子[28],但在DMD猴的FAP中,TGF-β配体和受体的表达有所降低(图五I和J),表明DMD猴的FAP纤维化是TGF-β非依赖性的。研究者通过实验证实DMD猴FAP的TGF-β信号通路存在功能障碍或耐药性。
肌肉干细胞(MuSC)是肌肉生长和再生的主力军,且在人类DMD患者发病早期阶段数量激增[29]。研究者对DMD猴的MuSC表达谱进行分析,发现大多数MuSC失去静息状态,出现异常激活。评估MuSC亚群谱系转变的动态变化,发现DMD中大部分MuSC存在细胞固有缺陷,发生致病性变化,无法实现正常的增殖和分化。尽管DMD猴中有更多的MuSC被激活与分化,但只有部分增殖的成肌细胞可以成功分化,剩余的成肌细胞在分化过程中出现衰老、凋亡和纤维化。表明在DMD早期,尽管MuSC的数量增加,但是其再生潜能下降,导致DMD猴的肌肉功能受损。
综上所述,研究者使用CRISPR-Cas9介导的基因编辑和卵胞浆内单精子注射(ICSI)技术获得了DMD基因移码突变的雄性半合子恒河猴,该模型再现了DMD患者中观察到的大多数早期病理表型。DMD猴表现出进行性肌肉退化和运动功能受损,骨骼肌中免疫细胞经历了高度动态的变化,成纤维/成脂肪祖细胞(FAP)谱系分化异常导致TGF-β非依赖性纤维化,肌肉干细胞(MuSC)也存在细胞固有缺陷导致肌肉功能受损。该研究为DMD的发病机制提供了重要的见解,为进一步探索潜在发病机制提供了有价值的动物模型和数据集信息,为开发和评估DMD治疗干预措施提供了一个最佳的平台。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Bez Batti Angulski A, Hosny N, Cohen H, Martin AA, Hahn D, Bauer J, Metzger JM: Duchenne muscular dystrophy: disease mechanism and therapeutic strategies. Front Physiol 2023, 14:1183101.
2. Zablocka B, Gorecki DC, Zablocki K: Disrupted Calcium Homeostasis in Duchenne Muscular Dystrophy: A Common Mechanism behind Diverse Consequences. Int J Mol Sci 2021, 22(20):11040.
3. Chang NC, Chevalier FP, Rudnicki MA: Satellite Cells in Muscular Dystrophy - Lost in Polarity. Trends Mol Med 2016, 22(6):479-496.
4. Dumont NA, Wang YX, von Maltzahn J, Pasut A, Bentzinger CF, Brun CE, Rudnicki MA: Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nat Med 2015, 21(12):1455-1463.
5. Kornegay JN: The golden retriever model of Duchenne muscular dystrophy. Skelet Muscle 2017, 7(1):9.
6. Selsby JT, Ross JW, Nonneman D, Hollinger K: Porcine models of muscular dystrophy. ILAR J 2015, 56(1):116-126.
7. Bulfield G, Siller WG, Wight PA, Moore KJ: X chromosome-linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci U S A 1984, 81(4):1189-1192.
8. Cooper BJ, Winand NJ, Stedman H, Valentine BA, Hoffman EP, Kunkel LM, Scott MO, Fischbeck KH, Kornegay JN, Avery RJ et al: The homologue of the Duchenne locus is defective in X-linked muscular dystrophy of dogs. Nature 1988, 334(6178):154-156.
9. Klymiuk N, Blutke A, Graf A, Krause S, Burkhardt K, Wuensch A, Krebs S, Kessler B, Zakhartchenko V, Kurome M et al: Dystrophin-deficient pigs provide new insights into the hierarchy of physiological derangements of dystrophic muscle. Hum Mol Genet 2013, 22(21):4368-4382.
10. Ren S, Fu X, Guo W, Bai R, Li S, Zhang T, Liu J, Wang Z, Zhao H, Suo S et al: Profound cellular defects attribute to muscular pathogenesis in the rhesus monkey model of Duchenne muscular dystrophy. Cell 2024.
11. Chen Y, Zheng Y, Kang Y, Yang W, Niu Y, Guo X, Tu Z, Si C, Wang H, Xing R et al: Functional disruption of the dystrophin gene in rhesus monkey using CRISPR/Cas9. Human molecular genetics 2015, 24(13):3764-3774.
12. Ito M, Ehara Y, Li J, Inada K, Ohno K: Protein-Anchoring Therapy of Biglycan for Mdx Mouse Model of Duchenne Muscular Dystrophy. Hum Gene Ther 2017, 28(5):428-436.
13. Serrano AL, Munoz-Canoves P: Fibrosis development in early-onset muscular dystrophies: Mechanisms and translational implications. Semin Cell Dev Biol 2017, 64:181-190.
14. Cardone N, Taglietti V, Baratto S, Kefi K, Periou B, Gitiaux C, Barnerias C, Lafuste P, Pharm FL, Pharm JN et al: Myopathologic trajectory in Duchenne muscular dystrophy (DMD) reveals lack of regeneration due to senescence in satellite cells. Acta Neuropathol Commun 2023, 11(1):167.
15. Birnkrant DJ, Bushby K, Bann CM, Apkon SD, Blackwell A, Brumbaugh D, Case LE, Clemens PR, Hadjiyannakis S, Pandya S et al: Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management. Lancet Neurol 2018, 17(3):251-267.
16. Giordani L, He GJ, Negroni E, Sakai H, Law JYC, Siu MM, Wan R, Corneau A, Tajbakhsh S, Cheung TH et al: High-Dimensional Single-Cell Cartography Reveals Novel Skeletal Muscle-Resident Cell Populations. Mol Cell 2019, 74(3):609-621 e606.
17. Oprescu SN, Yue F, Qiu J, Brito LF, Kuang S: Temporal Dynamics and Heterogeneity of Cell Populations during Skeletal Muscle Regeneration. iScience 2020, 23(4):100993.
18. De Micheli AJ, Laurilliard EJ, Heinke CL, Ravichandran H, Fraczek P, Soueid-Baumgarten S, De Vlaminck I, Elemento O, Cosgrove BD: Single-Cell Analysis of the Muscle Stem Cell Hierarchy Identifies Heterotypic Communication Signals Involved in Skeletal Muscle Regeneration. Cell Rep 2020, 30(10):3583-3595 e3585.
19. Chemello F, Wang Z, Li H, McAnally JR, Liu N, Bassel-Duby R, Olson EN: Degenerative and regenerative pathways underlying Duchenne muscular dystrophy revealed by single-nucleus RNA sequencing. Proc Natl Acad Sci U S A 2020, 117(47):29691-29701.
20. Tsai CY, Hsieh SC, Wu TH, Li KJ, Shen CY, Liao HT, Wu CH, Kuo YM, Lu CS, Yu CL: Pathogenic Roles of Autoantibodies and Aberrant Epigenetic Regulation of Immune and Connective Tissue Cells in the Tissue Fibrosis of Patients with Systemic Sclerosis. Int J Mol Sci 2020, 21(9):3069.
21. Schreibelt G, Klinkenberg LJ, Cruz LJ, Tacken PJ, Tel J, Kreutz M, Adema GJ, Brown GD, Figdor CG, de Vries IJ: The C-type lectin receptor CLEC9A mediates antigen uptake and (cross-)presentation by human blood BDCA3+ myeloid dendritic cells. Blood 2012, 119(10):2284-2292.
22. Zeng L, Palaia I, Saric A, Su X: PLCgamma1 promotes phase separation of T cell signaling components. J Cell Biol 2021, 220(6):e202009154.
23. Elgueta R, Benson MJ, de Vries VC, Wasiuk A, Guo Y, Noelle RJ: Molecular mechanism and function of CD40/CD40L engagement in the immune system. Immunol Rev 2009, 229(1):152-172.
24. Molina T, Fabre P, Dumont NA: Fibro-adipogenic progenitors in skeletal muscle homeostasis, regeneration and diseases. Open Biol 2021, 11(12):210110.
25. Kastenschmidt JM, Coulis G, Farahat PK, Pham P, Rios R, Cristal TT, Mannaa AH, Ayer RE, Yahia R, Deshpande AA et al: A stromal progenitor and ILC2 niche promotes muscle eosinophilia and fibrosis-associated gene expression. Cell Rep 2021, 35(2):108997.
26. Contreras O, Harvey RP: Single-cell transcriptome dynamics of the autotaxin-lysophosphatidic acid axis during muscle regeneration reveal proliferative effects in mesenchymal fibro-adipogenic progenitors. Front Cell Dev Biol 2023, 11:1017660.
27. Fitzgerald G, Turiel G, Gorski T, Soro-Arnaiz I, Zhang J, Casartelli NC, Masschelein E, Maffiuletti NA, Sutter R, Leunig M et al: MME(+) fibro-adipogenic progenitors are the dominant adipogenic population during fatty infiltration in human skeletal muscle. Commun Biol 2023, 6(1):111.
28. Meng XM, Nikolic-Paterson DJ, Lan HY: TGF-beta: the master regulator of fibrosis. Nat Rev Nephrol 2016, 12(6):325-338.
29. Kottlors M, Kirschner J: Elevated satellite cell number in Duchenne muscular dystrophy. Cell Tissue Res 2010, 340(3):541-548.



