技术分享:肝脏缺失Bmal1和Hif1α小鼠表现出肝肺综合征
生物钟调节着哺乳动物的生理和新陈代谢的各个方面,使得能够适应与同步每日昼夜节律的环境变化[1]。生物钟的调节在分子层面上依赖于转录-翻译的反馈回路,转录因子CLOCK和BMAL1是正向调节因子,PERIODs和CRYPTOCHROMESs是抑制因子。近年来,越来越多的证据支持昼夜节律和氧气信号之间存在着分子和功能上的相互作用,特别是核心节律蛋白BMAL1和缺氧诱导因子HIF[2]。生物钟主要通过休息-活动和进食-禁食两种周期来调节氧气消耗和组织氧合的日常振荡,同时节律性的氧气水平作为一个时间信号,以HIF1α依赖的方式同步生物钟[3]。此外,对缺氧的转录反应,特别是分子钟的反应,是具有组织特异性和昼夜依赖性的。因此,缺氧如阻塞性睡眠呼吸暂停,会引发内部昼夜节律失调[4]。在分子水平上,BMAL1和HIF1α之间存在相互作用,也有其他节律蛋白被证明可以结合HIF,在培养的细胞中与缺氧反应相关[5]。尽管越来越多的证据表明生物钟和氧气信号之间存在相互作用,但在体内的分子基础和生理意义尚不清楚。
2024年9月,Cell Metabolism上报道了一项研究,揭示了肝脏Bmal1和Hif1α在小鼠缺氧的昼夜节律反应中的作用。研究发现,小鼠肝脏对缺氧的转录反应在很大程度上依赖于Bmal1或Hif1α。缺氧诱导因子Hif1α在缺氧时的积累是受时间调控的,并依赖于核心节律蛋白Bmal1。肝脏缺乏Bmal1和Hif1α 的小鼠在缺氧暴露时表现出昼夜依赖性的死亡率增加,并出现肝肺综合征(HPS)特征,表现为低氧血症、轻度肝功能障碍、肺一氧化氮增加和肺血管舒张。该研究揭示了肝脏Bmal1和Hif1α是缺氧反应的关键时间依赖性调节因子,在低氧的转录反应中起着主要作用,为肝肺综合征的病理生理学提供了新的见解[6]。
研究者前期发现,夜行性动物小鼠肝脏里有一些生物钟基因和Hif1α的经典靶基因以昼夜依赖的方式响应缺氧反应[4]。于是,研究者首先探索这些靶基因在体内的缺氧转录反应是否受到核心节律蛋白Bmal1和缺氧诱导因子Hif1α的调节。将肝脏特异性Bmal1敲除小鼠(BLKO;AlbCre+Bmal1fl/fl)和Hif1α 敲除小鼠(HLKO;AlbCre+Hif1αfl/fl)以及AlbCRE对照小鼠,分别在光照(昼夜节律时间[CT]4-8)或黑暗(CT16-20)下暴露于常氧(21%氧气)或缺氧(6%氧气)4小时(图一A)。通过qPCR分析各组小鼠的转录水平,发现生物钟基因Per1和Cry2在CT4-8和CT16-20对缺氧表现出相似的反应,这种反应仅依赖于CT16-20的Bmal1和Hif1α。而对缺氧表现出昼夜依赖性反应的生物钟基因Dbp和Chrono,它们的基础表达和对缺氧的反应在BLKO小鼠肝脏里大多降低(图一B)。HIF1α靶基因Egln3、Glut1和Pdk1的缺氧反应在敲除小鼠中仅在CT16-20时降低(图一C)。在各自的肝脏特异性敲除小鼠中,Bmal1和Hif1α 的表达确实减少(图一D)。以上数据表明Bmal1和Hif1α在缺氧转录反应中具有复杂的时间依赖性作用,Hif1α主要在黑暗期(小鼠活动期)控制生物钟基因和Hif1α靶基因的缺氧反应,而Bmal1则参与基础表达和缺氧反应。
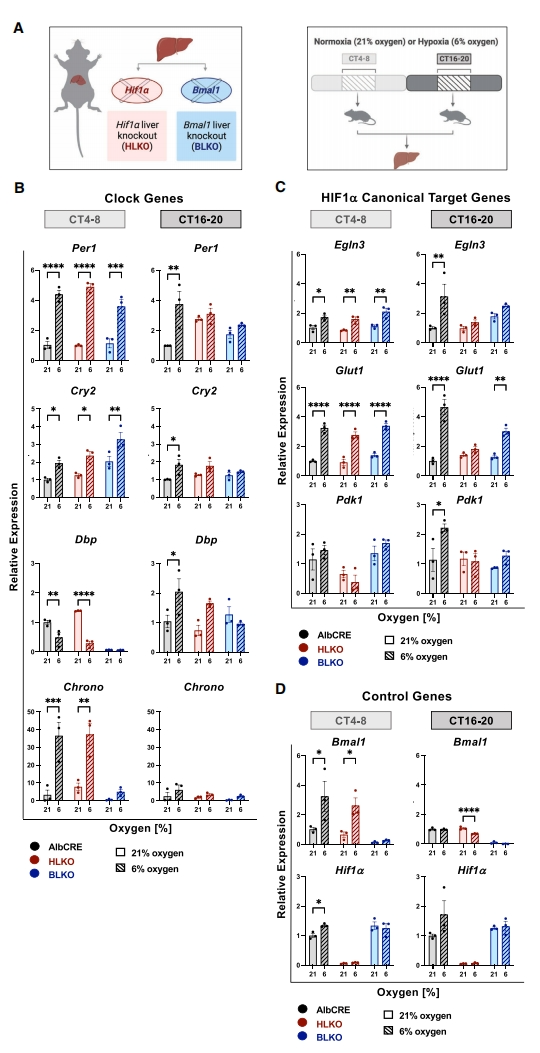
图一 生物钟基因和Hif1α靶基因的缺氧反应受到Bmal1和Hif1α的时间调控[6]
接下来,研究者对各组小鼠的肝脏进行转录组分析。主成分分析(PCA)显示,不同敲除小鼠及其缺氧和常氧条件之间存在明显的分离,同种处理的相同基因型小鼠在一天不同时间点之间存在较小的差异(图二A)。根据缺氧基因的表达谱进行聚类(图二B),确定了以下3个分组:(I)敲除组中对缺氧反应与对照组相似的基因,(II)对照组中有缺氧反应但在BLKO或HLKO敲除组中无反应的基因,(III)仅在BLKO或HLKO敲除组中对缺氧有反应的基因。聚焦在对照组小鼠(即I组和II组)CT4-8和CT16-20有缺氧反应的基因,它们响应缺氧的转录反应大部分是Bmal1或Hif1α依赖性的,分别为77%和84%(图二C-D)。依赖于Bmal1或Hif1α的交集基因主要富集在组蛋白修饰和脂质代谢相关途径(图二E),特异性依赖于Hif1α的基因主要富集在细胞因子介导的信号传导(图二F),而特异性依赖于Bmal1的基因主要富集在昼夜节律和RNA聚合酶相关途径(图二G)。以上数据表明,Bmal1和Hif1α在缺氧的全局转录反应中起着主要作用,并且共享大部分基因。而一部分基因特异性受Bmal1或Hif1α以昼夜依赖的方式所调控。Bmal1在光照期起着更突出的作用,而Hif1α在黑暗期(小鼠活动期)更占主导地位。
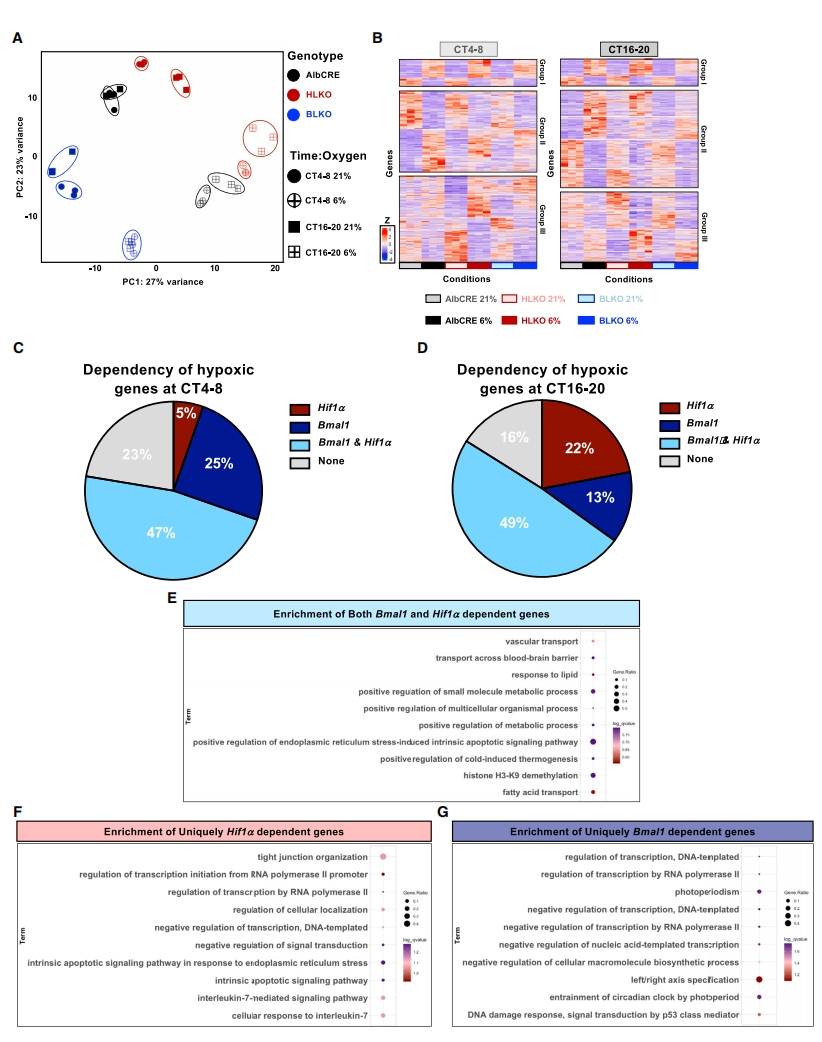
图二 Bmal1和Hif1α以昼夜依赖的方式调节全局缺氧转录反应[6]
研究者进一步获得Bmal1和Hif1α的肝脏特异性双敲除小鼠(BHLKO;AlbCre+Bmal1fl/flHif1αfl/fl),同样分别在光照CT4-8或黑暗CT16-20下暴露于常氧或缺氧4小时。出乎意料的是,BHLKO双敲小鼠在CT16-20缺氧4小时后均未存活,而CT4-8缺氧组还有77%的存活率(图三A)。缩短缺氧时间仅在CT16-16.5缺氧30分钟,BHLKO双敲小鼠出现50%的死亡率,而CT4-4.5缺氧组小鼠均存活(图三B),表明肝脏Bmal1和Hif1α的缺失以昼夜依赖的方式降低小鼠应对缺氧暴露的能力。检测小鼠肝功能,与对照组小鼠相比,BHLKO双敲小鼠的总胆红素、总蛋白、白蛋白和球蛋白水平发生了显著变化,但这些变化都在正常生理范围内(图三C和D)。尽管BHLKO双敲小鼠在关键血液电解质如钾、氯和磷酸盐方面也表现出一些轻微的差异,主要发生在CT16,但仍在生理范围内(图三E和F)。以上数据表明,肝脏特异性Bmal1和Hif1α双敲除小鼠在CT16暴露于缺氧环境时死亡率会显著增加。
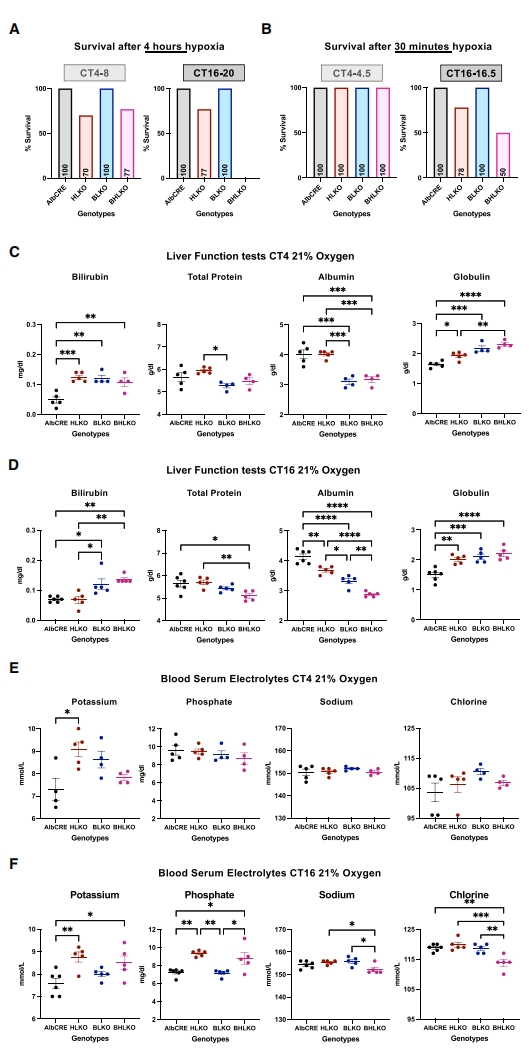
图三 肝脏特异性Bmal1和Hif1α双敲除小鼠在缺氧反应中表现出昼夜依赖性死亡[6]
基于Bmal1和Hif1α 肝脏特异性双敲除小鼠表现出轻度肝功能障碍,且在缺氧暴露后的死亡率增加,提示存在氧代谢受损,研究者推测可能患有肝肺综合征(HPS)。肝肺综合征表现为肝功能障碍、动脉低氧血症和肺内血管舒张三联征[7],且在不同程度的肝病患者中很常见。混合血气分析显示,与对照组和单基因敲除小鼠相比,BHLKO双敲小鼠的血氧饱和度水平严重降低、CO2分压升高,但仍然在正常的生理范围内(图四A)。检测人类肺血管舒张的一个金标准是在外周静脉血管中注入微气泡进行超声心动图监测[8],通常微气泡无法通过肺循环并被肺泡吸收。然而,存在肺血管舒张的情况下,超声心动图可以检测到微气泡避开肺部捕获更快地到达心脏(图四B)。于是,研究者在小鼠中建立类似的检测方法,通过超声心动图监测发现与对照组小鼠相比,BHLKO双敲小鼠的微气泡到达心脏的速度更快(图四C),表明BHLKO双敲小鼠存在肺血管舒张。以上数据表明,肝脏缺乏Bmal1和Hif1α 的小鼠出现与肝肺综合征一致的特征,表现为轻度肝功能障碍,低氧血症和肺内血管舒张。
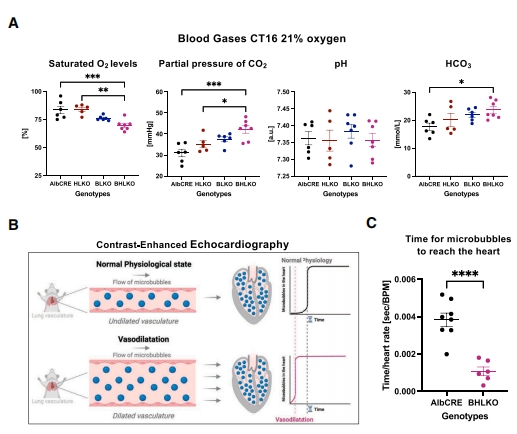
图四 肝脏特异性Bmal1和Hif1α 双敲除小鼠表现出肝肺综合征特征[6]
最后,研究者进一步表征肺部的分子特征。检测BHLKO双敲小鼠肺中Bmal1和Hif1α的表达,没有发现任何显著差异。肝肺综合征与内皮型一氧化氮合酶(eNOS)的积累有关,eNOS是产生一氧化氮(NO)的关键酶,可引发肺内血管舒张[9]。因此,研究者检测常氧状态下肺eNOS的蛋白水平,发现BHLKO双敲小鼠在CT16时eNOS和NO水平显著升高(图五A和B),诱导型一氧化氮合酶(iNOS)在任何小鼠品系中都没有受到影响(图五C)。在胆总管结扎(CBDL)诱导的肝肺综合征大鼠中,血清内皮素-1(ET1)水平升高被认为可以刺激eNOS[10]。常氧条件下在CT16检测ET1血清水平,发现HLKO单敲和BHLKO双敲小鼠的ET1水平升高(图五D)。细胞外信号调节激酶(ERK)和蛋白激酶B(AKT)通路已报道在胆总管结扎诱导肝肺综合征大鼠的肺血管舒张中发挥作用[11]。研究者发现,在不同小鼠模型同只小鼠的肝脏和肾脏样本中没有检测到ERK和AKT基础磷酸化水平的显著影响(图五E和F),仅出现肺特异性的影响(图五A),提示没有广泛的全身性影响。转录组学分析显示,在CT16的常氧条件下,BHLKO双敲小鼠肺中有204个基因差异表达,包括72个上调基因和132个下调基因(图五G和H)。差异基因主要富集在许多免疫相关途径(图五I)。以上数据表明,肝脏特异性Bmal1和Hif1α 双敲除小鼠在肺部表现出显著的分子变化,包括ERK激活、eNOS和NO积累,以及多个免疫相关途径的异常调节,提示它们可能在肝肺综合征的病理生理学中发挥重要作用。
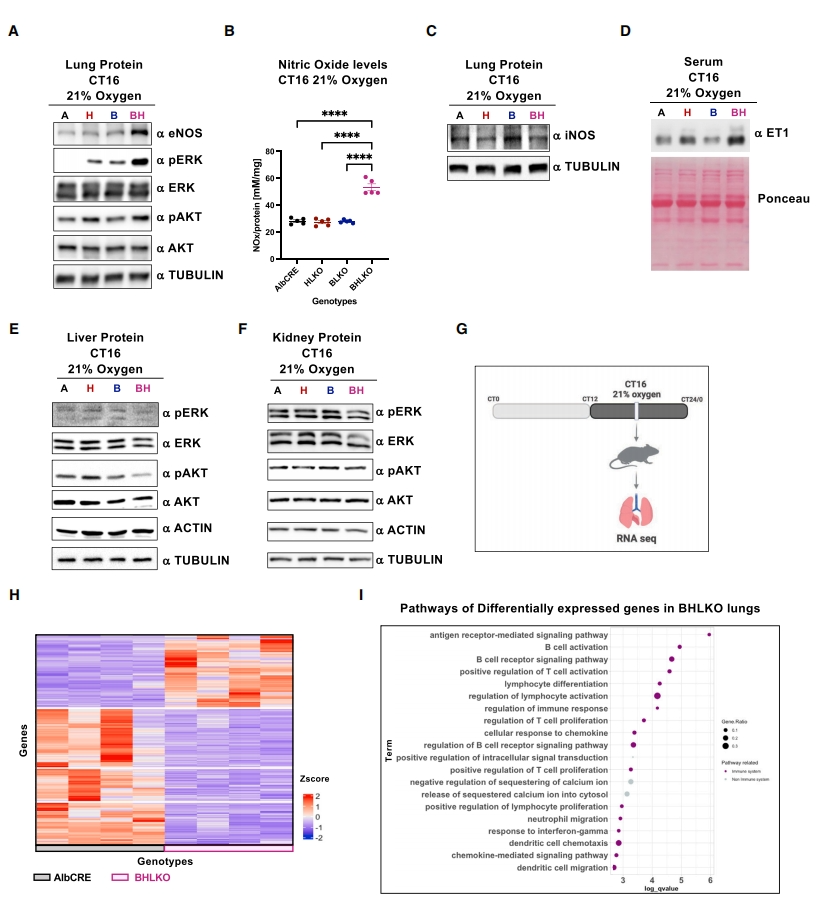
图五 肝脏特异性Bmal1和Hif1α 敲除小鼠的肺部分子表征[6]
综上所述,研究者利用肝脏特异性的Bmal1和Hif1α单敲除和双敲除小鼠来探究它们对缺氧的昼夜依赖性反应。肝脏中的缺氧转录反应很大程度上依赖于Bmal1或Hif1α。Hif1α在缺氧时的积累受时间调控并依赖于Bmal1。肝脏缺乏Bmal1和Hif1α 的小鼠在缺氧时表现出昼夜依赖性的死亡率增加,以及肝肺综合征的病理生理和分子特征。该研究表明了肝脏Bmal1和Hif1α是缺氧反应的关键时间依赖性调节因子,以及在分子学层面上为肝肺综合征的病理生理学提供了新见解。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Bass J, Lazar MA: Circadian time signatures of fitness and disease. Science 2016, 354(6315):994-999.
2. Peek CB: Metabolic Implications of Circadian-HIF Crosstalk. Trends Endocrinol Metab 2020, 31(6):459-468.
3. Adamovich Y, Ladeuix B, Sobel J, Manella G, Neufeld-Cohen A, Assadi MH, Golik M, Kuperman Y, Tarasiuk A, Koeners MP et al: Oxygen and Carbon Dioxide Rhythms Are Circadian Clock Controlled and Differentially Directed by Behavioral Signals. Cell Metab 2019, 29(5):1092-1103.e1093.
4. Manella G, Aviram R, Bolshette N, Muvkadi S, Golik M, Smith DF, Asher G: Hypoxia induces a time- and tissue-specific response that elicits intertissue circadian clock misalignment. Proc Natl Acad Sci U S A 2020, 117(1):779-786.
5. Adamovich Y, Ladeuix B, Golik M, Koeners MP, Asher G: Rhythmic Oxygen Levels Reset Circadian Clocks through HIF1α. Cell Metab 2017, 25(1):93-101.
6. Dandavate V, Bolshette N, Van Drunen R, Manella G, Bueno-Levy H, Zerbib M, Kawano I, Golik M, Adamovich Y, Asher G: Hepatic BMAL1 and HIF1α regulate a time-dependent hypoxic response and prevent hepatopulmonary-like syndrome. Cell Metab 2024, 36(9):2038-2053.e2035.
7. Kumar P, Rao PN: Hepatopulmonary Syndrome. N Engl J Med 2020, 382(10):e14.
8. Abrams GA, Jaffe CC, Hoffer PB, Binder HJ, Fallon MB: Diagnostic utility of contrast echocardiography and lung perfusion scan in patients with hepatopulmonary syndrome. Gastroenterology 1995, 109(4):1283-1288.
9. Tran N, Garcia T, Aniqa M, Ali S, Ally A, Nauli SM: Endothelial Nitric Oxide Synthase (eNOS) and the Cardiovascular System: in Physiology and in Disease States. American journal of biomedical science & research 2022, 15(2):153-177.
10. Ling Y, Zhang J, Luo B, Song D, Liu L, Tang L, Stockard CR, Grizzle WE, Ku DD, Fallon MB: The role of endothelin-1 and the endothelin B receptor in the pathogenesis of hepatopulmonary syndrome in the rat. Hepatology 2004, 39(6):1593-1602.
11. Raevens S, Boret M, Fallon MB: Hepatopulmonary syndrome. JHEP reports : innovation in hepatology 2022, 4(9):100527.



