技术分享:运动产生乳酸化皮层突触蛋白提高应激韧性
体育锻炼是一种被广泛接受能缓解焦虑症的非药物治疗方法,可极大地改变体内各种代谢物的稳态[1]。然而,这些代谢物在运动缓解焦虑中的潜在作用尚未得到充分认识。有研究表明,体育锻炼后所产生的血液代谢物,如犬尿氨酸[2]、N-乳酰基苯丙氨酸[3]和β-羟基丁酸酯[4],可以调节精神功能。除了这些新发现的分子外,乳酸是一种细胞糖酵解的常见代谢产物,剧烈运动后在几乎所有组织中都显著增多[5]。乳酸还参与各种分子过程,例如,它可以调节组蛋白去乙酰化酶的活性,为调节应激韧性(stress resilience)提供了一种表观遗传途径[5]。在神经系统疾病中,组蛋白乳酸化修饰受到神经兴奋的显著影响[6],并与神经退行性疾病或脑损伤有关[7]。然而,体育锻炼导致血液和大脑中乳酸水平的显著升高是否改变了大脑蛋白质的乳酸化修饰,这与运动提高应激韧性缓解焦虑是否直接相关还有待研究。
2024年8月,Cell Metabolism期刊报道了一项研究,发现运动后产生的乳酸,通过增强皮层突触蛋白的乳酸化修饰,改善突触结构及功能,进而缓解压力应激导致的焦虑行为。突触小体相关蛋白91(SNAP91)是突触功能的关键分子,运动后显著增多的乳酸化修饰SNAP91可增强内侧前额叶皮层(mPFC)的突触结构形成和神经元活动,从而提高抵抗慢性束缚应激(CRS)的韧性。更有趣的是,乳酸化修饰SNAP91对于预防CRS小鼠的焦虑样行为是必要的。该研究表明,大脑中存在一种新的非组蛋白乳酸化修饰,发挥调节精神功能的非代谢作用,为运动模式下大脑的代谢性适应提供了新的证据[8]。
首先,研究者探索乳酸和运动缓解焦虑之间的潜在关系。使用4-5周龄的慢性束缚应激(CRS)造模小鼠,平行进行每天1小时、为期14天的跑步机运动(图一A)。发现运动后,能有效预防焦虑样行为,小鼠循环乳酸水平升高,肝脏和肌肉组织以及内侧前额叶皮层(mPFC)中的乳酸水平都显著升高(图一B)。此外,运动后mPFC组织中乳酸生物合成的关键酶乳酸脱氢酶A/B(LDHA/B)在mRNA和蛋白质水平上一致上调(图一C-E),表明运动训练增强了大脑的乳酸生物合成。随后,研究者探究大脑乳酸水平升高是否是运动介导抗焦虑作用的直接原因。使用相同的CRS模型,每天静脉注射L-乳酸(1 g/kg),持续14天(图一F)。行为测试表明,尽管乳酸处理没有改变一般的行为活动,但焦虑样行为明显减弱(图一G-K)。二氯乙酸(DCA)可调节丙酮酸脱氢酶和LDH的活性以抑制乳酸产生[9]。当注射DCA后,运动介导的抗焦虑作用被显著减弱(图一L-Q)。以上数据表明,运动可提高循环乳酸水平,进而提高应激韧性。
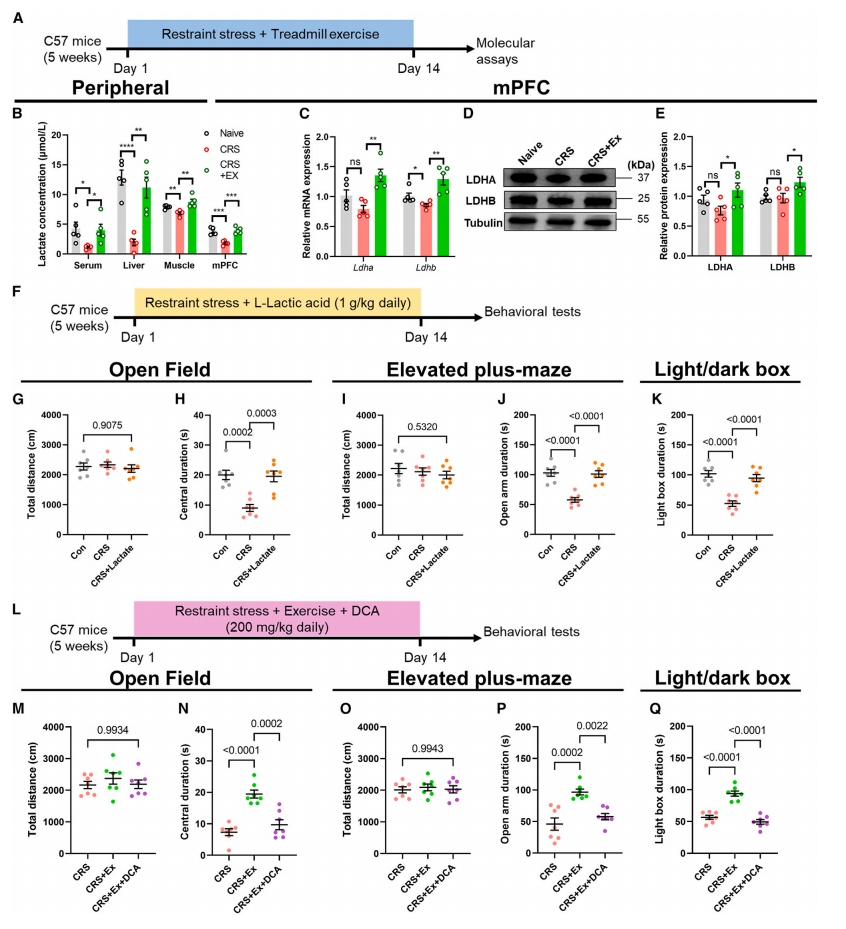
图一 跑步机运动通过增强乳酸生物合成来预防焦虑样行为[8]
乳酸会驱动大脑中组蛋白的乳酸化修饰[7],但关于神经组织的非组蛋白乳酸化修饰知之甚少。于是,研究者使用泛乳酸化(pan-Kla)抗体进行总蛋白免疫印迹,观察到乳酸化修饰水平呈上升趋势(图二A)。采用基于乳酸化修饰的蛋白质组学分析,发现几个具有差异调节蛋白质的不同集群(图二B)。研究者着重关注集群5,这些蛋白质的乳酸化修饰在CRS小鼠中被下调,而在CRS小鼠运动后丰度升高(图二B)。GO富集分析发现,集群5的细胞骨架和突触发生了显著变化(图二C)。进一步筛选出59个乳酸化修饰水平受CRS和运动训练双向调控的蛋白(图二D)。KEGG分析发现,这些差异调控蛋白质主要富集在突触和突触囊泡通路(图二E)。相对乳酸化水平数据表明,SNAP91(也称为AP180)是调控最显著的突触蛋白(图二F)。使用针对K885位点乳酸化修饰的定制抗体Kla-SNAP91,结合免疫沉淀(IP),证实其在CRS小鼠中乳酸化修饰减少,以及运动训练后的乳酸化修饰升高(图二G-H)。另外,网格蛋白组装淋巴样髓系白血病蛋白(CALM)是与SNAP91相关的重要分子,在网格蛋白介导的囊泡运输中发挥了至关重要的作用[10]。CALM也遵循了类似的表达模式(图二G-H),表明CALM和SNAP91之间可能存在相互作用。以上数据表明,运动增强了mPFC中突触蛋白的乳酸化作用。
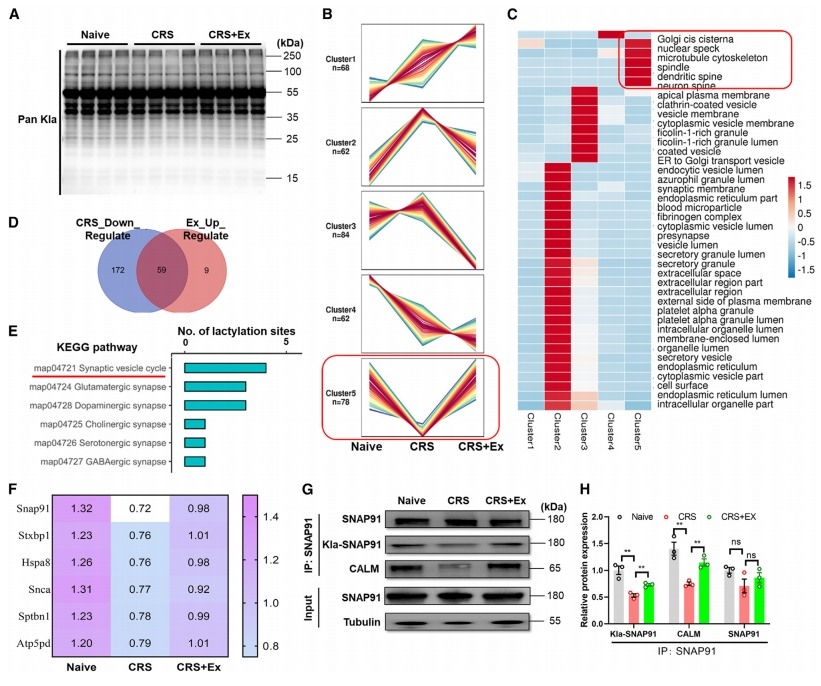
图二 运动增强了mPFC中突触蛋白的乳酸化作用[8]
接下来,研究者探究SNAP91乳酸化修饰的功能。通过免疫荧光染色确认了Kla-SNAP91的相对表达水平后(图三A),量化了微型兴奋性突触后电位(mEPSC),该电流在CRS小鼠中显示振幅降低,而运动训练后增强(图三B-D),表明突触前囊泡释放的增强。研究者还使用透射电镜(TEM)来观察突触位点的形态(图三E)。在突触前区域,突触囊泡的密度表现为在CRS小鼠明显下降,而在运动后升高(图三F)。与增强的突触前传递相一致,运动训练也保持了突触后密度(PSD)区域的结构完整性(图三G-J)。以上数据表明,突触结构和功能的改善与运动训练后SNAP91乳酸化作用的增强有关。
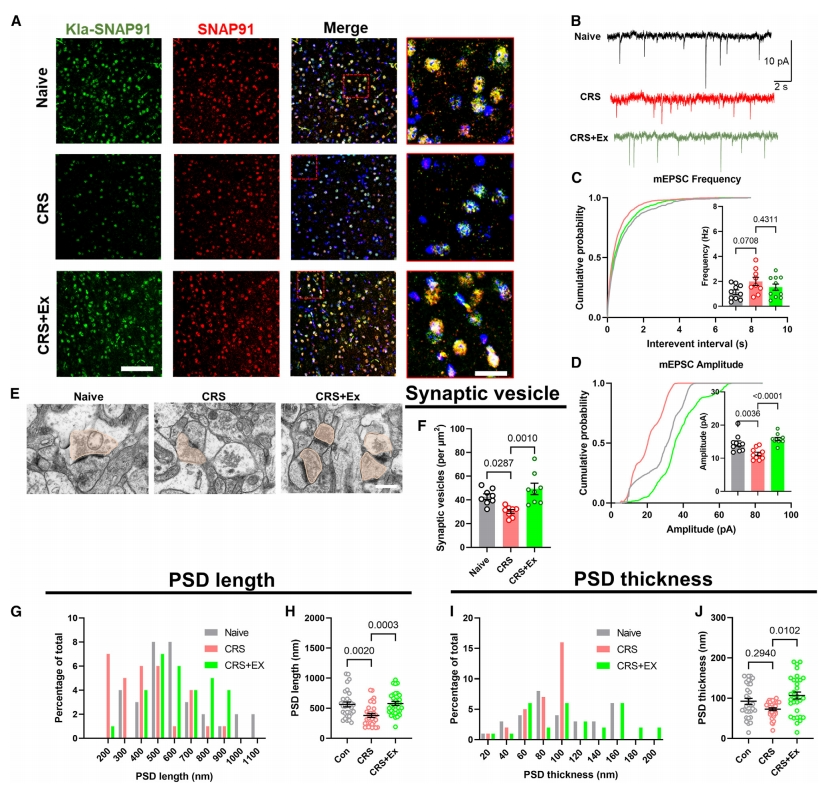
图三 突触结构和功能的改善与运动训练后SNAP91乳酸化作用的增强有关[8]
研究者探究运动后突触蛋白乳酸化修饰升高和神经元功能改善之间的因果关系。通过感染编码人突触素(hSyn)驱动表达突变型SNAP91的腺相关病毒(AAV),构建了K885位点乳酸化能力受损的SNAP91-K885R小鼠模型(图四A)。功能丧失的SNAP91突变体在mPFC中表达,导致SNAP91乳酸化修饰减少(图四B-D)。CALM与SNAP91的结合亲和力也随着乳酸化受损而减少(图四C和D),提示突触小泡结构受到破坏。TEM图像显示,与对照组或表达SNAP91野生型(WT)形式的小鼠相比,K885R突变体显示出较低的突触前囊泡密度(图四E和F)。进一步检测表达SNAP91(K885R)突变体的PrL神经元的体外电生理记录(图四G),发现细胞兴奋性降低(图四H和I)。膜片钳记录也发现mEPSC的频率不变,但振幅减小(图四J-L)。以上数据表明,SNAP91乳酸化缺失会损害突触结构和功能。
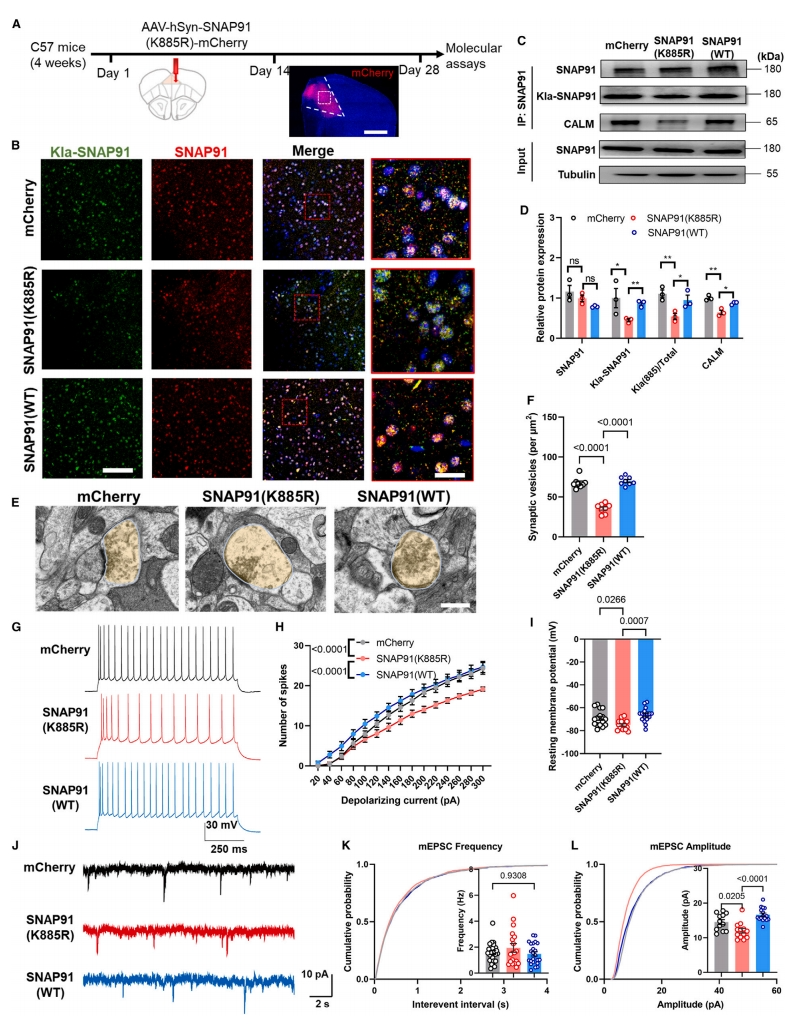
图四 SNAP91乳酸化缺失会损害突触结构和功能[8]
进一步对mPFC神经元进行体内双光子钙成像,在mPFC神经元中共表达hSyn-SNAP91(K885R)和基因编码的钙指示剂GCaMP6s(图五A-B),固定小鼠头部监测清醒时的钙活性(图五C)。定量分析显示,表达SNAP91突变形式后mPFC神经活性降低(图五D-F),表明突触蛋白乳酸化缺失导致神经功能受损。此外,还进行了一系列的行为检测,发现携带K885R突变体的小鼠出现了焦虑样行为(图五G-K)。以上数据表明,乳酸化修饰的SNAP91可维持皮层神经功能和应激韧性。
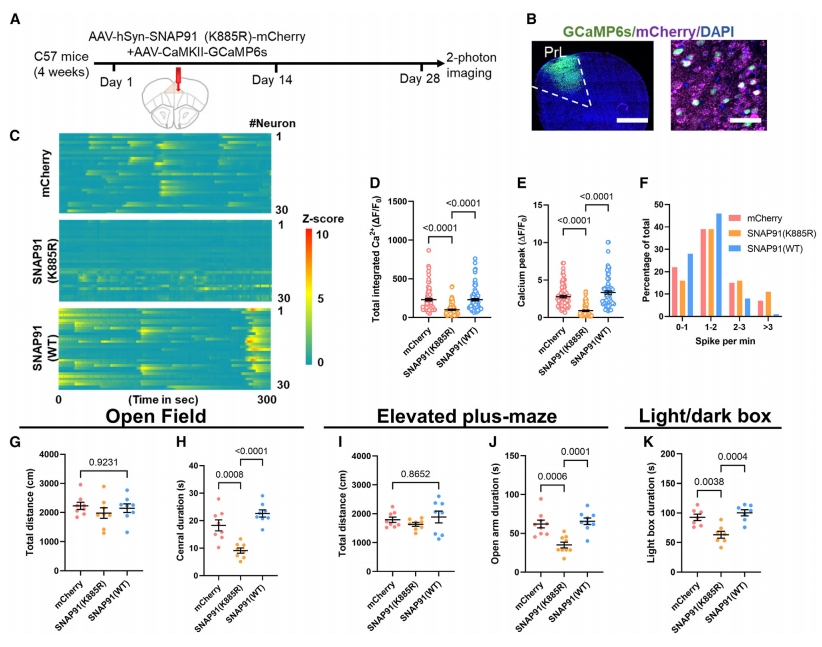
图五 乳酸化修饰的SNAP91可维持皮层神经功能和应激韧性[8]
接下来,研究者使用已建立的K885R突变体测试运动介导的抗焦虑作用(图六A)。量化分析揭示,即使有规律的运动训练,突变体小鼠的SNAP91乳酸化修饰仍然降低(图六B-D),而SNAP91的总表达水平保持不变。对突触超微结构的观察发现,在突变体小鼠中,运动驱动的囊泡形成受损(图六E和F)。并且随着乳酸化能力的剥夺,神经元钙活性降低(图六G-L)。行为学分析一致表明,由于mPFC特异性突触蛋白乳酸化作用受损,运动后没能发挥抗焦虑作用(图六M-Q)。以上数据表明,运动训练通过上调SNAP91乳酸化来增强皮质突触功能。
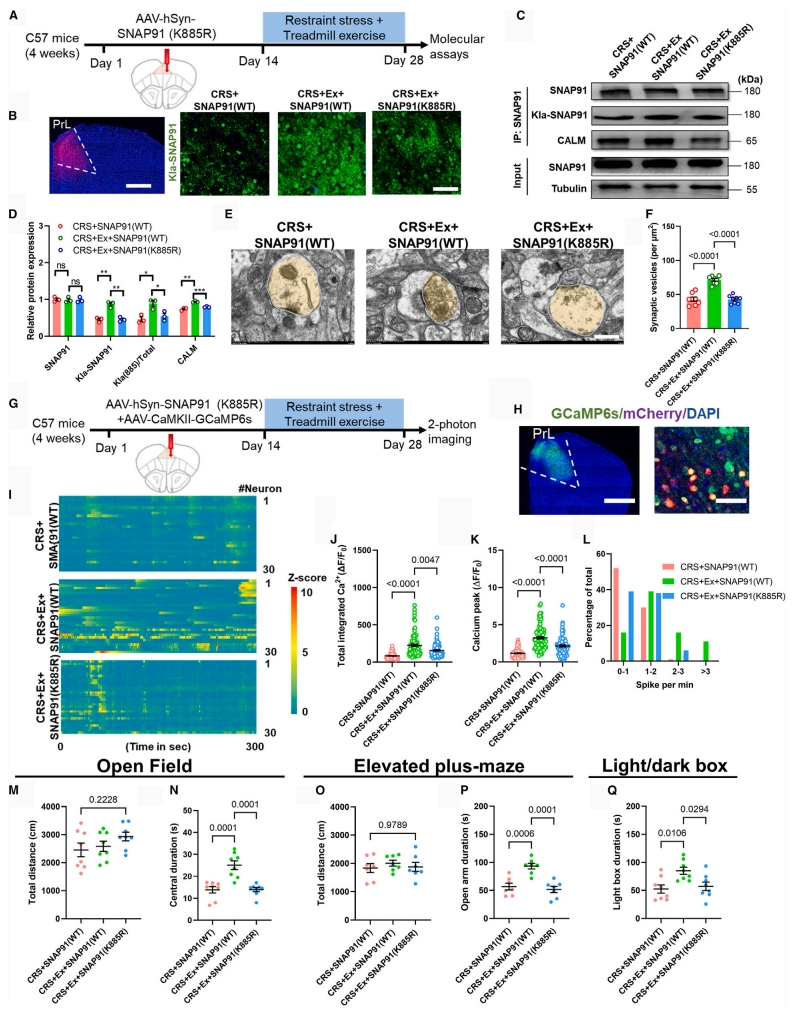
图六 运动训练通过上调SNAP91乳酸化来增强皮质突触功能[8]
最后,为排除突变体SNAP91过表达的干扰因素,研究者利用Cas9介导的SNAP91(K885R)质粒同源重组到mPFC中,建立体内点突变模型(图七A)。这种操作成功地抑制了SNAP91的乳酸化作用,但没有改变内源性SNAP91的总表达水平(图七B-E)。进行体内基因编辑后,透射电子显微镜图像显示突触囊泡的密度降低(图七F-G),行为学检测显示运动介导的抗焦虑作用被消除(图七H-L)。以上数据表明,非组蛋白乳酸化修饰在调节应激韧性方面可能是通过调节突触传递和神经网络活动来发挥作用的。
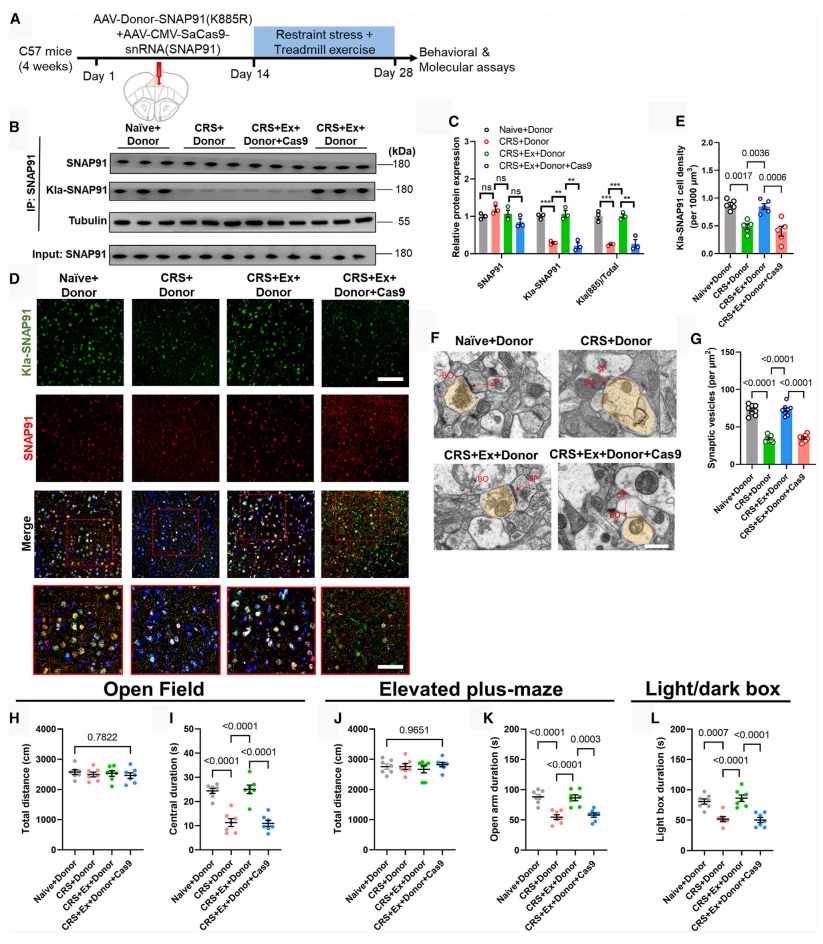
图七 体内基因编辑验证破坏SNAP91乳酸化损害运动的抗焦虑作用[8]
综上所述,该研究发现运动增强了循环和中枢的乳酸水平,这些乳酸分子可以作为细胞内信号,通过乳酸化修饰突触蛋白SNAP91,影响突触传递,增强皮质神经网络的活动,最终赋予了运动小鼠更高的应激韧性,缓解了慢性应激下小鼠的焦虑样行为。该研究揭示了一种解释大脑在运动行为下适应高能量需求的机制,证明了大脑内乳酸介导心理功能的非代谢调节作用。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Luan X, Tian X, Zhang H, Huang R, Li N, Chen P, Wang R: Exercise as a prescription for patients with various diseases. Journal of sport and health science 2019, 8(5):422-441.
2. Cervenka I, Agudelo LZ, Ruas JL: Kynurenines: Tryptophan's metabolites in exercise, inflammation, and mental health. Science 2017, 357(6349).
3. Li VL, He Y, Contrepois K, Liu H, Kim JT, Wiggenhorn AL, Tanzo JT, Tung AS, Lyu X, Zushin PH et al: An exercise-inducible metabolite that suppresses feeding and obesity. Nature 2022, 606(7915):785-790.
4. Sleiman SF, Henry J, Al-Haddad R, El Hayek L, Abou Haidar E, Stringer T, Ulja D, Karuppagounder SS, Holson EB, Ratan RR et al:Exercise promotes the expression of brain derived neurotrophic factor (BDNF) through the action of the ketone body β-hydroxybutyrate. eLife 2016, 5.
5. Karnib N, El-Ghandour R, El Hayek L, Nasrallah P, Khalifeh M, Barmo N, Jabre V, Ibrahim P, Bilen M, Stephan JS et al:Lactate is an antidepressant that mediates resilience to stress by modulating the hippocampal levels and activity of histone deacetylases. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 2019, 44(6):1152-1162.
6. Hagihara H, Shoji H, Otabi H, Toyoda A, Katoh K, Namihira M, Miyakawa T: Protein lactylation induced by neural excitation. Cell Rep 2021, 37(2):109820.
7. Pan RY, He L, Zhang J, Liu X, Liao Y, Gao J, Liao Y, Yan Y, Li Q, Zhou X et al: Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell metabolism 2022, 34(4):634-648.e636.
8. Yan L, Wang Y, Hu H, Yang D, Wang W, Luo Z, Wang Y, Yang F, So KF, Zhang L: Physical exercise mediates cortical synaptic protein lactylation to improve stress resilience. Cell Metab 2024, 36(9):2104-2117.e2104.
9. Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, Liu W, Kim S, Lee S, Perez-Neut M et al: Metabolic regulation of gene expression by histone lactylation. Nature 2019, 574(7779):575-580.
10. Schwartz CM, Cheng A, Mughal MR, Mattson MP, Yao PJ: Clathrin assembly proteins AP180 and CALM in the embryonic rat brain. The Journal of comparative neurology 2010, 518(18):3803-3818.



