技术分享:ERGIC-Rab蛋白双重调控TMED10介导的非经典分泌途径
蛋白分泌是细胞间信息传递的核心机制,其中分泌物的跨膜转运是重要的一环。经典蛋白分泌途径是通过内质网-高尔基体途径,起始于信号识别颗粒和转运体SEC61的连续作用,SEC61可识别分泌蛋白的信号肽并将其转移到内质网中[1, 2]。内质网-高尔基体运输是由外壳蛋白II(COPII)和COPI囊泡所介导,最终将分泌物释放到细胞外[3]。然而越来越多的研究发现,许多缺乏信号肽的蛋白质(称为无导向蛋白)的运输独立于内质网-高尔基体途径,这一过程被称为非经典蛋白质分泌(UcPS)[4]。UcPS涉及几种不同的蛋白质运输方式。其一分泌物可以直接渗透出质膜,称为I型非常规分泌,如成纤维细胞生长因子2[5];其二分泌物通过囊泡运输,涉及膜融合,称为III型非常规分泌[6]。越来越多的证据表明UcPS参与各种生理和病理过程,包括炎症、发育、病毒感染、脂质代谢、神经退行性疾病和癌症[7]。
有研究表明,含Emp24结构域蛋白10(TMED10)介导的UcPS通路(THU)可将多种无导向蛋白转运出膜[8]。THU通路似乎是分泌性自噬和溶酶体介导的UcPS的上游步骤,已被证明可以调节白细胞介素IL-1β的分泌[9]。与经典分泌中SEC61介导的向内质网易位类似,TMED10促进UcPS分泌物进入内质网-高尔基体中间体(ERGIC)。THU利用ERGIC作为易位的关键位点来启动UcPS。之前的证据表明ERGIC在内质网-高尔基体经典分泌中也具有调节作用。然而,ERGIC如何区分其经典与非经典的分泌功能,以及THU在ERGIC上如何受到细胞内分子机器的调控,仍是亟待解决的问题。
2024年7月,Nature Cell Biology期刊报道了一项研究,发现定位于内质网-高尔基体中间体(ERGIC)的Rab 蛋白通过TMED10参与调节非经典蛋白质分泌(UcPS)。具体而言,Rab1A和Rab1B增强TMED10的转运蛋白活性,促进UcPS蛋白转运到ERGIC,而Rab2A在KIF5B的协助下调节ERGIC区室化,建立UcPS特异性区室。该研究揭示了三个定位于ERGIC的Rab蛋白在TMED10介导UcPS中的调控作用及其机制,为理解非经典分泌途径的分子机制提供了新见解,还提出了ERGIC功能区室化的新概念,为ERGIC功能的多样性提供了新的理论依据[10]。
首先,研究者利用之前已经建立的细胞系统,即通过在培养的细胞中表达无导向蛋白来研究UcPS,例如促炎细胞因子IL-1β(mIL-1β)的成熟形式,来模拟囊泡介导的UcPS。在体外HEK293T细胞的mIL-1β分泌测定中,同时过表达各种Rab小GTP酶。结果发现,Rab8A的表达增加了IL-1β的分泌,这与之前的研究一致[9]。Rab5A表达也观察到类似的效果,表明内体参与了UcPS(图一a)。有趣的是,ERGIC定位的Rab1A、Rab1B和Rab2A表达后也对IL-1β的分泌有显著影响(图一a)。在Hela细胞中证实了内源性Rab1A、Rab1B和Rab2A定位在ERGIC(图一b)。蛋白水平也证实Rab1A、Rab1B和Rab2A的促进IL-1β分泌作用(图一c);对它们分别敲降显著减少了IL-1β的分泌,并可通过重新表达Rab1或Rab2A来恢复(图一d-f);同时敲降Rab1A和Rab1B后,IL-1β分泌的抑制作用更明显(图一g)。以上结果表明,ERGIC定位的Rab1和Rab2A可调节成熟IL-1β的释放。
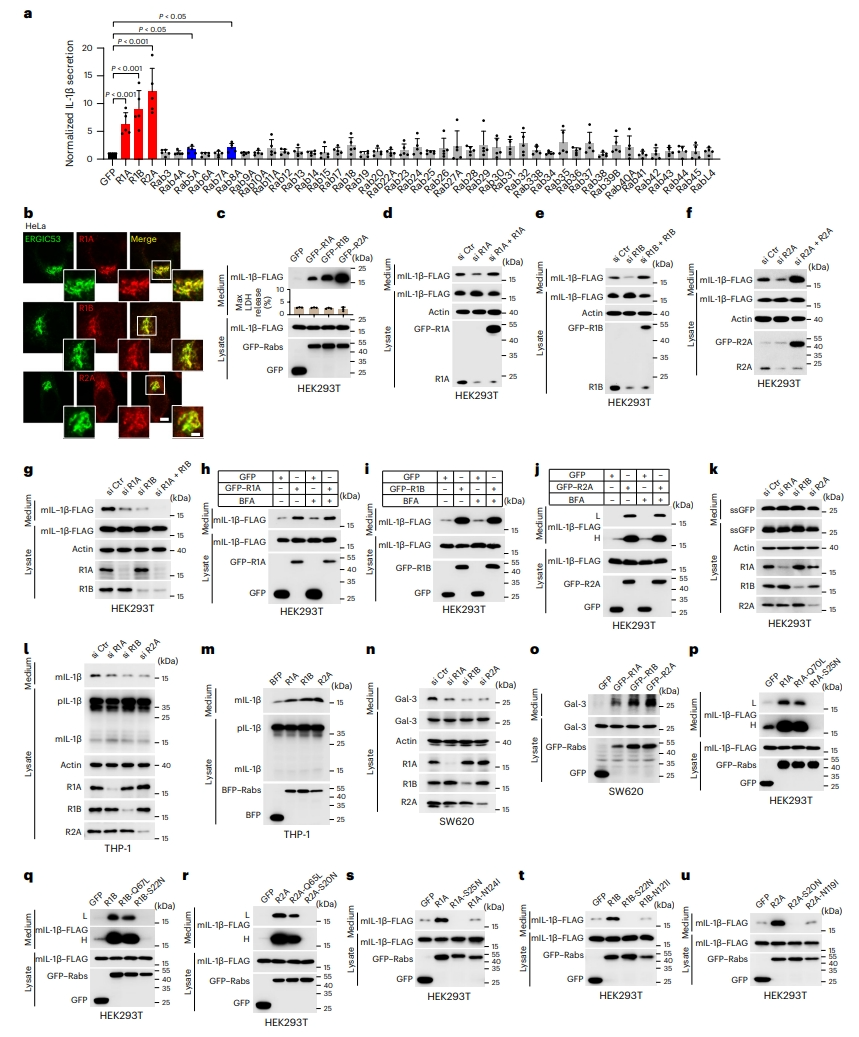
图一 Rab1A、Rab1B和Rab2A调节IL-1β的分泌[10]
Rab1和Rab2可调节内质网和高尔基体之间的双向转运[11]。为了研究它们对UcPS的调节作用,研究者利用布雷非德菌素A(BFA)来阻断内质网-高尔基体的转运,发现Rab1和Rab2A诱导的IL-1β分泌不受BFA处理的影响(图一h-j)。相比之下,传统分泌信号的ssGFP可被BFA阻断,但不受Rab1/Rab2A敲降的影响(图一k)。进一步分析THP-1细胞分化巨噬细胞的mIL-1β生理分泌,发现敲降Rab1/Rab2A会减少内源性mIL-1β分泌(图一l),而过表达则会增加mIL-1β的分泌(图一m)。研究者还分析了SW620细胞的内源性半乳凝素-3(Gal-3)分泌,出现了同样的结果(图一n和o)。研究者构建了不同的Rab点突变,将其锁定在组成型活性GTP结合状态或非活性GDP结合状态。结果显示,野生型(WT)和GTP结合型Rab(Rab1A-Q70L、Rab1B-Q67L和Rab2A-Q65L)会增加IL-1β的分泌,但GDP结合型Rab(Rab1A-S25N、Rab1B-22N和Rab2A-S20N)会显著抑制IL-1β的分泌(图一p-r);而无核苷酸结合能力的突变体(Rab1A-N124I、Rab1B-N121I和Rab2A-N119I)对IL-1β的表达没有显著影响(图一s-u)。以上实验结果表明,Rab1A、Rab1B和Rab2A需要结合GTP来促进UcPS。
Rab1和Rab2A已被证明定位在ERGIC上[12],并且与TMED10共定位,而TMED10是THU途径的关键蛋白[8]。于是,研究者探究Rab1和Rab2A是否通过THU途径来调节非经典分泌。在TMED10敲除(KO)细胞中,Rab1/Rab2A刺激的IL-1β分泌显著减少(图二a-c),表明Rab1/Rab2A调节UcPS需要TMED10。此外,GTP酶激活蛋白TBC1D20的表达,使得Rab1和Rab2A失活,抑制了TMED10刺激的IL-1β分泌(图二d)。Rab1/Rab2A的敲降也减弱了TMED10刺激的IL-1β分泌(图二e-g)。接着,研究者测试具有突变基序的IL-1β(IL-1β-WY/LL),破坏了TMED10结合分泌蛋白质的关键位点(图二h)。发现IL-1β-WY/LL的分泌不受Rab1/Rab2A表达的影响(图二i-k)。在外源表达或内源蛋白的免疫共沉淀实验中,Rab1/Rab2A均与TMED10相结合(图二l和m);与Rab1相比,Rab2A与TMED10的结合较弱(图二l)。与GDP结合型突变体相比,Rab1/Rab2A的GTP结合型突变体更容易结合TMED10(图二n-p)。使用GST下拉测定发现,Rab2A与TMED10的结合比Rab1弱得多(图二q)。TMED10的C末端缺失(TMED10ΔCT)大大降低了与Rab1/Rab2A的结合(图二r-t);TMED10的C末端在下拉分析中能直接与Rab1/Rab2A相结合(图二u-w)。以上实验结果表明,TMED10通过其C末端与Rab1/Rab2A相互作用。

图二 Rab1/Rab2A直接结合TMED10来共同调节IL-1β的分泌[10]
TMED10促进了UcPS分泌蛋白易位到ERGIC内腔中,这是囊泡介导UcPS的重要步骤[8]。研究者使用了一种荧光互补分析技术[8],在HEK293T细胞中共表达mIL-1β-3×GFP11和GFP(1-10)-TMED10,以确定蛋白进入ERGIC(图三a)。FACS结果发现,GFP互补信号随着Rab1的表达而增强,但Rab2A没有(图三b);敲降Rab1而不是Rab2A,GFP互补信号显著减弱(图三c)。Rab1对GFP信号的调节依赖于GTP结合, Rab1的GDP结合型突变体抑制了GFP互补信号(图三d和e)。Rab1的UcPS特异性突变体未能促进GFP互补(图三f)。与FACS分析一致,Rab1显著提高了ERGIC中IL-1β的表达量,IL-1β与TMED10共定位;Rab1敲降后,ERGIC中IL-1β的表达量显著减少,而Rab2A不影响IL-1β进入ERGIC(图三k-n)。随后,研究者对细胞中的膜组分进行分离,测定了膜囊泡的IL-1β表达水平。结果发现,Rab1的表达增加了膜组分中IL-1β的含量,但Rab2A的表达对膜组分中IL-1β的含量没有明显改变(图三g-i)。Rab1的敲降也显著减少了膜组分中IL-1β的含量(图三j)。以上实验结果表明,Rab1,而不是Rab2A,可调节UcPS分泌蛋白进入ERGIC。使用测定蛋白脂质体易位的方法[8]探究Rab1是否直接激活TMED10的易位活性(图三o)。单独存在Rab1,而不是Rab2A,可增加TMED10易位进入蛋白脂质体中IL-1β的量,使得它们受蛋白脂质体的保护,不被蛋白酶K消化所影响。添加GTP可进一步增强脂质体中的IL-1β水平,而添加GDP无效果(图三p-s)。以上实验结果表明,Rab1以GTP依赖的方式激活TMED10的易位活性。
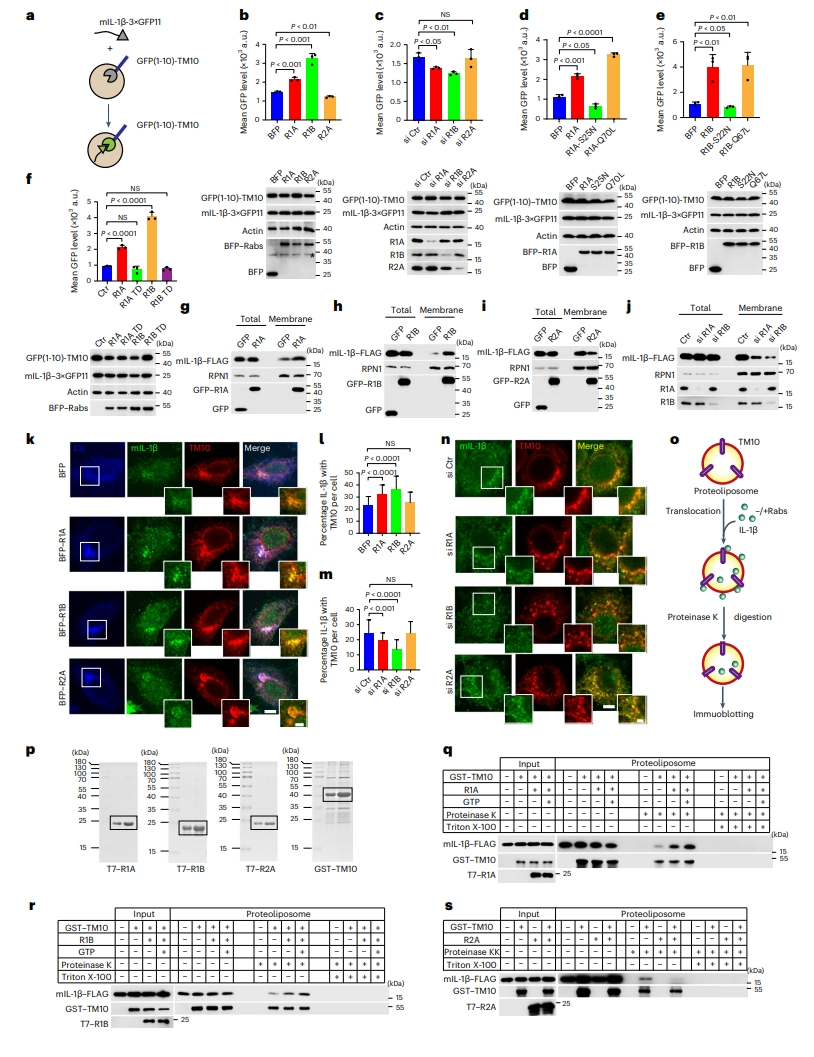
图三 Rab1促进IL-1β进入ERGIC[10]
TMED10的转运能力取决于其寡聚化[8],由此研究者探究Rab1能否调节TMED10寡聚化。交联实验结果显示,表达Rab1显著增加了TMED10的寡聚化,敲降Rab1降低了TMED10的寡聚化;TMED10寡聚化不受Rab2A和其他两种Rab表达的影响(图四a-c)。Rab1的GTP结合型突变进一步增强了TMED10的寡聚化,但GDP结合型突变降低了TMED10的寡聚化(图四d和e),免疫共沉淀实验也同样证实了这一结果(图四f和g)。TMED10的C末端缺失使得TMED10寡聚化对Rab1B表达不敏感(图四h),表明TMED10-Rab1相互作用是TMED10寡聚化增强所必需的。使用体外下拉实验来确定Rab1是否影响IL-1β和TMED10之间的相互作用,发现Rab1以GTP依赖的方式增强了TMED10和IL-1β的直接相互作用(图四i和j)。并且在GTP存在下,IL-1β也能增强TMED10和Rab1之间的相互作用,GDP则不行(图四k和l)。以上结果表明,Rab1、TMED10和IL-1β之间存在三重相互作用,Rab1可增加TMED10寡聚化及其与IL-1β的相互作用。
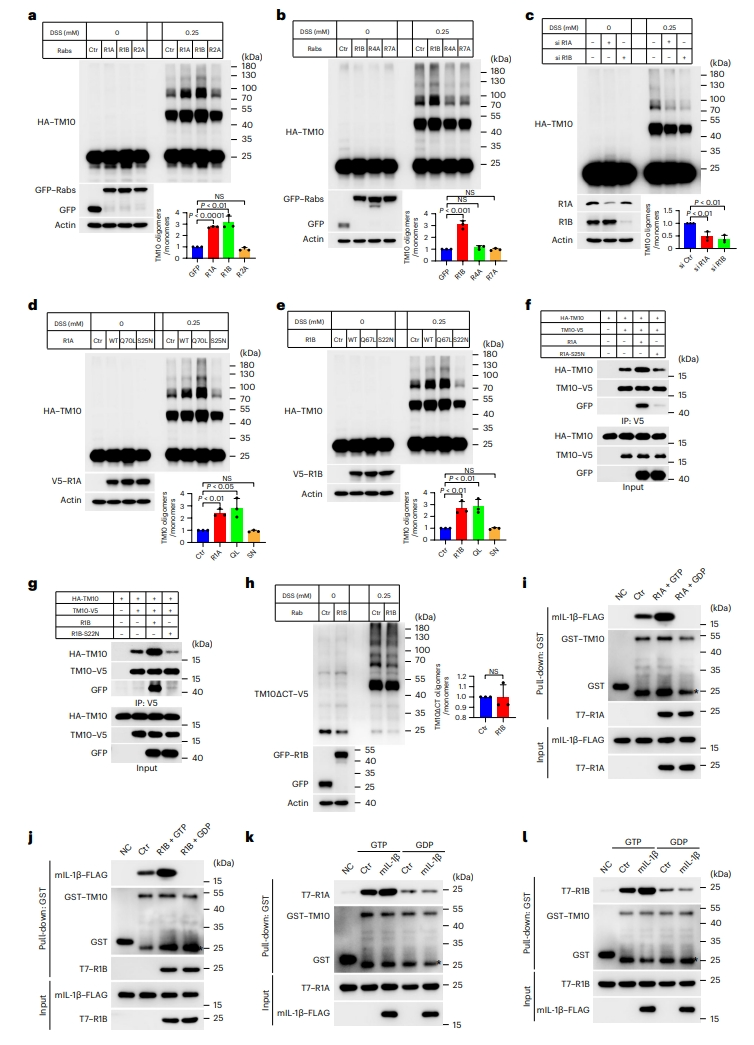
图四 Rab1可增加TMED10寡聚化及其与IL-1β的相互作用[10]
ERGIC的一个主要作用是调节内质网-高尔基体的运输,这对经典分泌来说是至关重要的[13]。于是,研究者进一步探究ERGIC如何在细胞中协调经典分泌和非经典分泌的双重功能。对TMED10和ERGIC53(经典分泌的标志物)染色的细胞进行结构光照明显微镜(SIM)观察,发现TMED10和ERGIC53并不完全共定位,超过50%的TMED10是单独存在的(图五a和b)。为确定TMED10阳性ERGIC的UcPS功能,研究者采用带有GFP(1-10)区域特异性标记的荧光互补分析方法(图五c)。鉴于TMED10本身促进UcPS蛋白运输,研究者构建了一种缺乏易位活性的截短TMED10蛋白(TMED10ΔGOLD)[8],它仍定位于TMED10阳性ERGIC中(图五d)。结果显示,UcPS蛋白IL-1β-GFP11信号主要与GFP(1-10)-TMED10ΔGOLD互补(易位由内源性TMED10介导,图五e),而常规分泌蛋白IL-6-GFP11主要与GFP(1-10)-ERGIC53互补产生强烈的GFP信号(图五g)。ERGIC定位的IL-1β与TMED10的共定位比ERGIC53多些(图五f),而IL-6大多与ERGIC53共定位(图五h)。以上结果表明,ERGIC被划分为至少两个区域,分别标记为ERGIC53和TMED10,用于特异性调节经典和非经典分泌。接下来,研究者采用选择性钩保留(RUSH)系统,其中链霉亲和素结合肽(SBP)标记的TMED10ΔGOLD与链霉亲和素标记的ERGIC53一起表达来人为混合ERGIC区域(图五i和j)。发现当ERGIC53和TMED10两个区域相混合时,UcPS蛋白IL-1β的分泌受到显著抑制;当用生物素处理使得ERGIC分区重新建立后,IL-1β的分泌得到了恢复(图五j和k)。进一步使用光电关联显微技术(CLEM),发现ERGIC存在结构差异的两个不同分区:经典分泌的ERGIC(ERGIC53阳性)与高尔基体紧密偶联;而非经典分泌的ERGIC(TMED10单阳性)周围无高尔基体,表现为管泡状簇结构(图五l),揭示了ERGIC存在功能区室化的现象,不同结构可能具有特定的功能,ERGIC的区室分隔是有效释放UcPS蛋白所必需的。
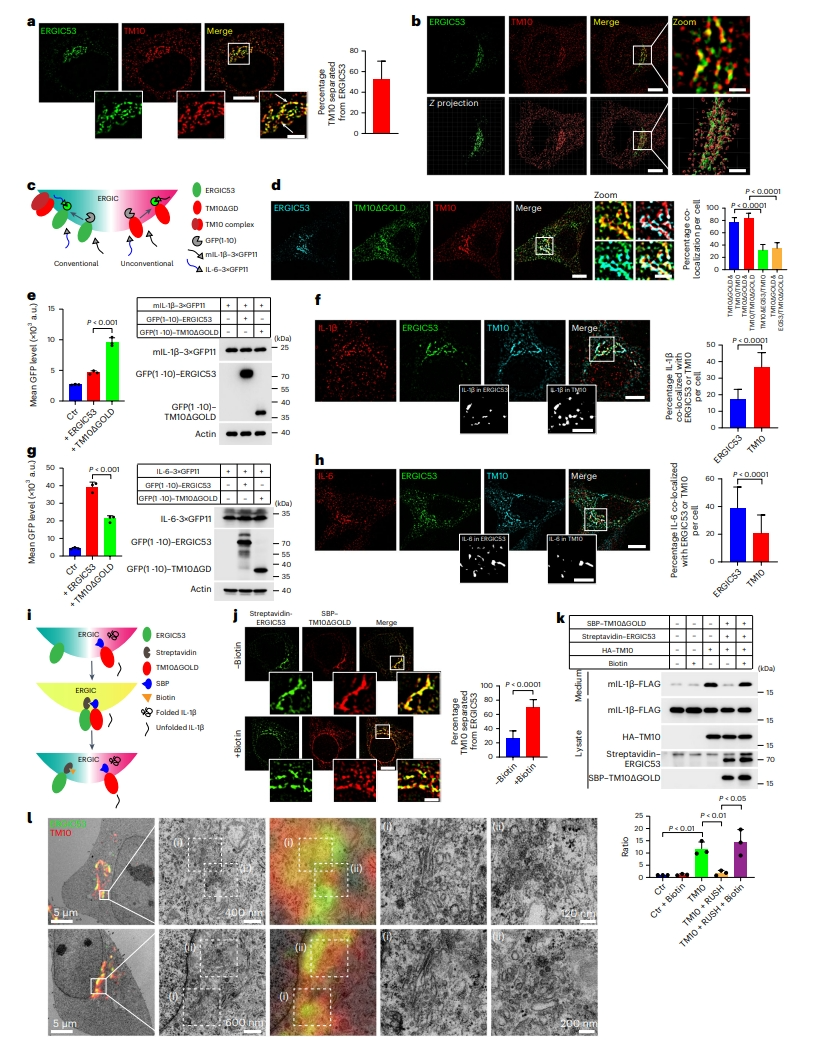
图五 ERGIC存在功能区室化[10]
多项研究表明,Rab1和Rab2A调控内质网-高尔基体系统中的膜转运[14],这促使研究者探究它们是否参与ERGIC的区室化。SIM观察结果显示,Rab2A过表达或敲降后,TMED10和ERGIC53之间的分离显著增加或减少(图六a,b,e和f),且Rab2A诱导的区域分离依赖于活性GTP结合(图六c和g)。为了确认Rab2A对ERGIC区室化的影响,研究者使用随机光学重建显微镜(STORM)量化COS-7细胞中ERGIC区室化,结果也证实ERGIC区室化随着Rab2A的敲降而降低,随着Rab2A过表达而恢复(图六d和h)。以上实验结果表明,Rab2A通过促进ERGIC区室化来促进UcPS。为进一步证实,研究者采用RUSH系统将ERGIC人为锁定在混合状态,结果发现,过表达Rab2A并没有改变ERGIC的混合状态,不能促进ERGIC区室化,UcPS蛋白IL-1β的分泌也没有进一步增加(图六i)。
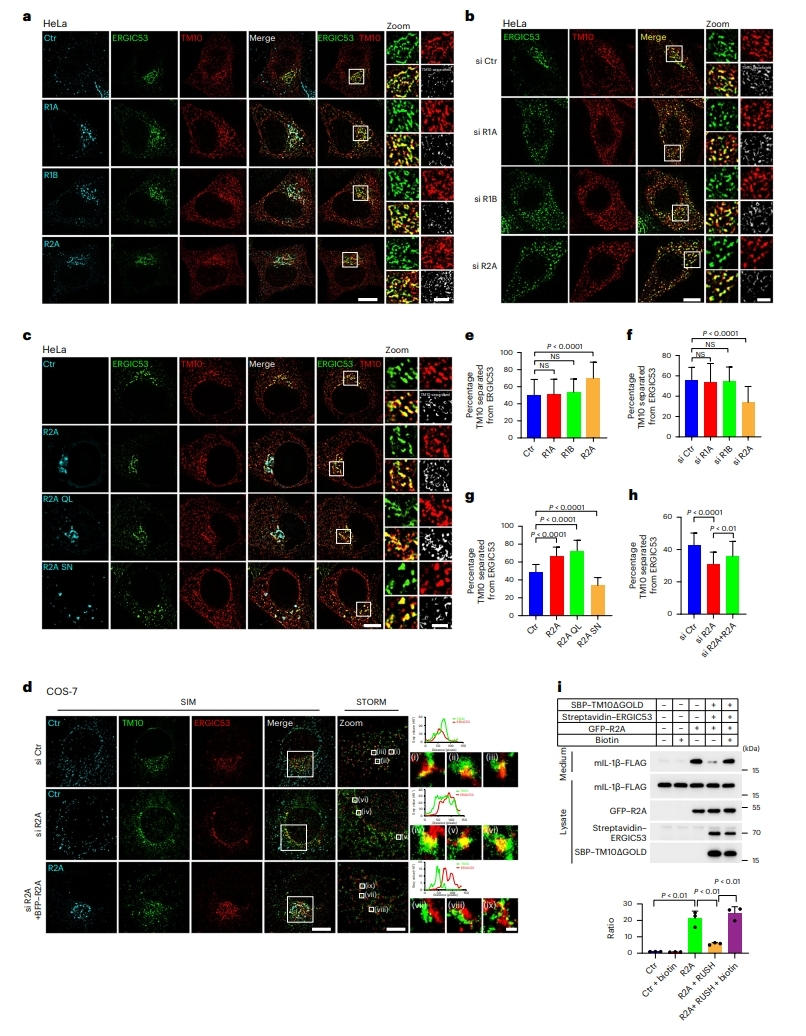
图六 Rab2A调节ERGIC区室化[10]
先前研究表明,Rab2参与招募运动蛋白以促进囊泡运输[15],且囊泡运输依赖于细胞骨架,细胞骨架是运动蛋白的轨道。TMED10介导的易位是囊泡依赖性UcPS的初始步骤,需要囊泡向下游转运以输出蛋白。于是,研究者首先确定细胞骨架在ERGIC区室化中的作用。使用一种微管聚合抑制剂诺考达唑处理后,ERGIC分散,TMED10和ERGIC53之间的分离减少,抵消了Rab2A调节ERGIC区室化的作用(图七a和b)。诺考达唑的处理抑制了IL-1β的分泌(图七c和d),表明ERGIC区室化是依赖于微管的。接下来,研究者寻找与Rab2A相互作用的微管相关运动蛋白。通过shRNA文库筛选,发现敲降四种运动蛋白显著降低了IL-1β的分泌,其中KIF5B最为显著(图七e)。免疫荧光分析结果也证实了Rab2A的表达增加了KIF5B的核周定位(图七f),且表达KIF5B显著增加了IL-1β的分泌(图七g),表明Rab2A调节ERGIC区室化需要KIF5B。KIF5B被鉴定为是Rab2A结合蛋白,对GTP结合形式具有特异性[16]。为确定KIF5B是否与Rab2A一起作用,研究者进行了KIF5B敲降,发现尽管Rab2A表达促进了IL-1β的分泌,但在KIF5B敲降后大大降低了Rab2A的促进作用(图七h),Rab2A促进的ERGIC区室化也被KIF5B敲降所中和(图七i和j)。KIF5B与Rab2A的WT和GTP结合型突变相结合(图七k),表明KIF5B是Rab2A的效应子。KIF5B也与TMED10相结合,通过敲除和过表达验证了Rab2A参与KIF5B-TMED10的结合(图七l)。以上结果表明,Rab2A可能有助于TMED10阳性的ERGIC加载到KIF5B上,推动ERGIC沿微管的分区。
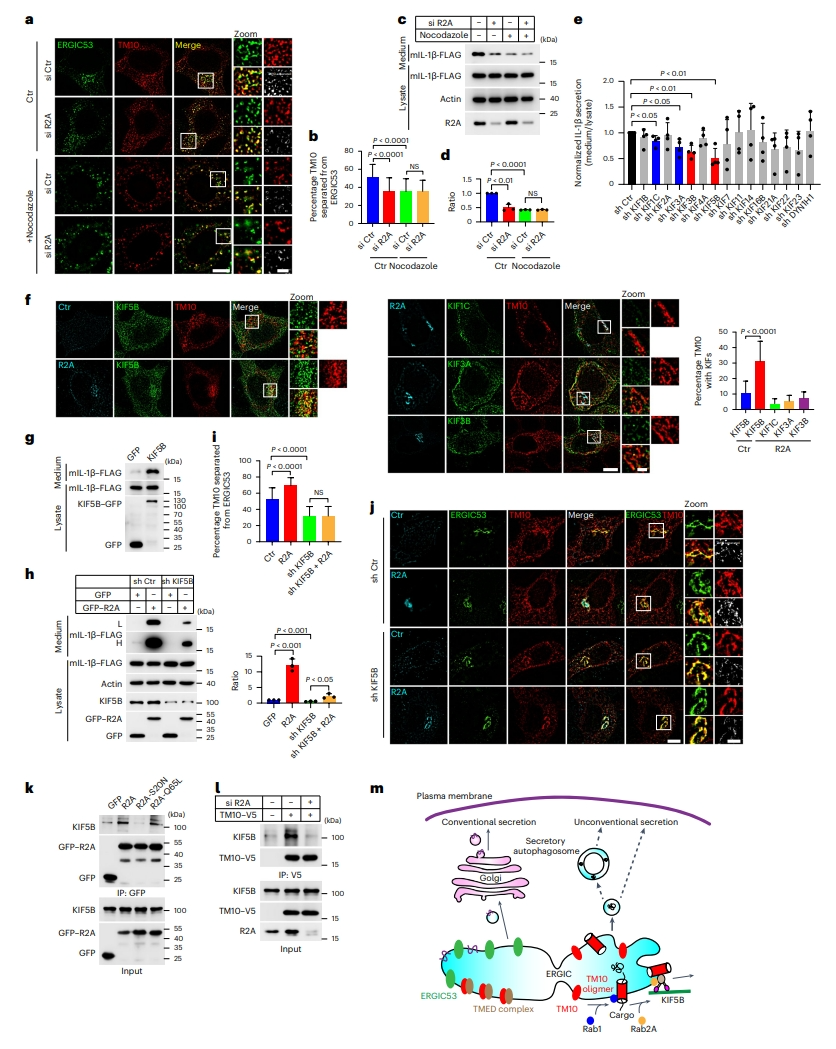
图七 Rab2A调节ERGIC分区需要KIF5B[10]
综上所述,该研究揭示了ERGIC定位的Rab 蛋白Rab1和Rab2A在UcPS蛋白分泌中的双重调节作用。在非经典分泌途径中,Rab1A、Rab1B和Rab2A都定位于ERGIC。Rab1A和Rab1B可促进TMED10的寡聚化,进而促进UcPS分泌蛋白有效进入ERGIC。而Rab2A通过招募KIF5B,促进TMED10介导UcPS的特异性ERGIC隔室形成。UcPS分泌蛋白以膜囊泡的形式从ERGIC中出现,绕过高尔基体直接或通过形成分泌性自噬体运输到胞外(图七m)。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Shan SO, Walter P: Co-translational protein targeting by the signal recognition particle. Febs Lett 2005, 579(4):921-926.
2. Voorhees RM, Hegde RS: Toward a structural understanding of co-translational protein translocation. Curr Opin Cell Biol 2016, 41:91-99.
3. Zanetti G, Pahuja KB, Studer S, Shim S, Schekman R: COPII and the regulation of protein sorting in mammals. Nat Cell Biol 2011, 14(1):20-28.
4. Nickel W, Rabouille C: Mechanisms of regulated unconventional protein secretion. Nature reviews Molecular cell biology 2009, 10(2):148-155.
5. Steringer JP, Nickel W: A direct gateway into the extracellular space: Unconventional secretion of FGF2 through self-sustained plasma membrane pores. Seminars in cell & developmental biology 2018,83:3-7.
6. Malhotra V: Unconventional protein secretion: an evolving mechanism. The EMBO journal 2013, 32(12):1660-1664.
7. Claude-Taupin A, Jia J, Mudd M, Deretic V: Autophagy's secret life: secretion instead of degradation. Essays in biochemistry 2017, 61(6):637-647.
8. Zhang M, Liu L, Lin X, Wang Y, Li Y, Guo Q, Li S, Sun Y, Tao X, Zhang D et al: A Translocation Pathway for Vesicle-Mediated Unconventional Protein Secretion. Cell 2020, 181(3):637-652.e615.
9. Dupont N, Jiang S, Pilli M, Ornatowski W, Bhattacharya D, Deretic V: Autophagy-based unconventional secretory pathway for extracellular delivery of IL-1β. The EMBO journal 2011, 30(23):4701-4711.
10. Sun Y, Tao X, Han Y, Lin X, Tian R, Wang H, Chang P, Sun Q, Ge L, Zhang M: A dual role of ERGIC-localized Rabs in TMED10-mediated unconventional protein secretion. Nat Cell Biol 2024, 26(7):1077-1092.
11. Monetta P, Slavin I, Romero N, Alvarez C: Rab1b interacts with GBF1 and modulates both ARF1 dynamics and COPI association. Molecular biology of the cell 2007, 18(7):2400-2410.
12. Plutner H, Cox AD, Pind S, Khosravi-Far R, Bourne JR, Schwaninger R, Der CJ, Balch WE: Rab1b regulates vesicular transport between the endoplasmic reticulum and successive Golgi compartments. The Journal of cell biology 1991, 115(1):31-43.
13. Appenzeller-Herzog C, Hauri HP: The ER-Golgi intermediate compartment (ERGIC): in search of its identity and function. Journal of cell science 2006, 119(Pt 11):2173-2183.
14. Saraste J: Spatial and Functional Aspects of ER-Golgi Rabs and Tethers. Frontiers in cell and developmental biology 2016, 4:28.
15. Tisdale EJ, Azizi F, Artalejo CR: Rab2 utilizes glyceraldehyde-3-phosphate dehydrogenase and protein kinase C{iota} to associate with microtubules and to recruit dynein. The Journal of biological chemistry 2009, 284(9):5876-5884.
16. Gillingham AK, Sinka R, Torres IL, Lilley KS, Munro S: Toward a comprehensive map of the effectors of rab GTPases. Developmental cell 2014, 31(3):358-373.



