技术分享:焦亡细胞分泌的氧化脂质和代谢物可促进组织修复
焦亡是一种溶解性细胞死亡,是由gasdermin家族蛋白组成大的质膜孔洞所造成的。Gasdermin D(GSDMD)是炎症小体诱导细胞焦亡的主要执行者[1]。一旦质膜孔洞形成,caspase-1进一步介导炎症细胞因子的切割和释放,如白细胞介素IL-18、IL-1β和IL-1α[2]。炎症小体是一类细胞质蛋白复合物,其组装诱导涉及两种信号:信号1通常被Toll样受体(TLR)的配体所激活,促进NF-κB介导的炎症小体成分和促炎细胞因子(如pro-IL-1β)的转录上调;信号2可以由各种各样的因素所触发如ATP、微生物毒素和引起溶酶体损伤的晶体,从而促使炎症小体组装、caspase-1的募集和激活,最终导致细胞溶解[3]。
焦亡在限制感染扩散和清除受损细胞方面发挥着重要的作用,并且在无菌的炎症性病理如自身免疫性疾病、癌症和动脉粥样硬化中也存在,在某些非感染性环境中抑制焦亡也能获得受益。然而,仅仅中和IL-1β和IL-18等细胞因子并不能完全减轻焦亡和GSDMD激活所带来的影响,表明还存在其他作用因素。焦亡还会释放细胞本底及其新诱导产生的蛋白质[4]。此外,炎症小体的激活可以在没有IL-1β或IL-1α释放的情况下发生[5]。因此,在焦亡过程中还可能释放哪些其他小分子和代谢物,及其对邻近组织的影响还有待被探究。
2024年7月,Nature期刊报道了一项研究,利用不释放IL-1β或IL-1α的焦亡模型Pyro-1,发现Pyro-1分泌组具有意想不到的益处。Pyro-1上清液与靶细胞的共孵育,可上调与迁移、细胞增殖和伤口愈合相关的基因特征,促进原代成纤维细胞和巨噬细胞的迁移和体外伤口愈合,并能促进体内的组织修复。脂质组学和代谢组学鉴定出Pyro-1上清液中存在的氧化脂质和代谢物,具有促进伤口愈合的活性。其中氧化脂质前列腺素E2(PGE2)的合成是在caspase-1激活和环氧化酶-2活性下游的焦亡过程中重新诱导的,发生在焦亡后期,其释放取决gasdermin D孔洞,进而促进了巨噬细胞在伤口的聚集从而加速了组织损伤修复。该研究表明焦亡分泌组含有组织修复特性的氧化脂质和代谢物,可以用于伤口治疗[6]。
为了识别独立于IL-1β的焦亡分泌物作用,研究者利用NLRP1B炎症小体在无需TLR触发的信号2条件下可诱导焦亡的能力。C57BL/6小鼠的骨髓源性巨噬细胞(BMDM)对炭疽致死毒素(LeTox)具有抗性。然而,来自Nlrp1b转基因C57BL/6小鼠(Nlrp1b-Tg)的BMDM与LeTox一起孵育时会发生焦亡,且LeTox诱导焦亡发生时没有释放IL-1β或IL-1α[7]。研究者将这种焦亡称为Pyro-1,表示没有信号1触发因素,也没有IL-1β或IL-1α的释放。此外,当Nlrp1b-Tg巨噬细胞缺乏编码caspase-1和caspase-11的基因时(Casp1/11-KO),LeTox则无法触发焦亡,而是诱导凋亡(Apop)[7]。
为了研究Pyro-1分泌物如何与其他细胞进行交流,研究者将LeTox处理的C57BL/6对照组(细胞存活)和Nlrp1b-Tg(Pyro-1)小鼠来源的BMDM上清液加入到C57BL/6小鼠的初始BMDM中孵育4小时,并进行了RNA-seq分析。与对照上清液相比,Pyro-1上清液在M0巨噬细胞中诱导了显著的基因表达变化(图一a),上调基因显著富集在与细胞迁移、增殖和免疫反应(图一b),下调了脂质代谢基因。信号1相关的IL-18也在Pyro-1上清液中被检测到(图一c),为排除IL-18的贡献,研究者进一步敲除 Il18,获得Nlrp1-Tg-Il18 KO小鼠,称为Pyro−1-18。平行比较4组小鼠BMDM,LeTox处理后分别获得对照组(活细胞)、Pyro-1(焦亡)、Pyro−1-18(焦亡)和Apop(凋亡)上清液,用于培养M0巨噬细胞(图一c)。结果显示,Pyro-1和Pyro−1-18上清液显著上调了许多与伤口愈合和组织修复相关的基因,例如凝血酶敏感蛋白1(Thbs1)、血管内皮生长因子(Vegf)、核受体4a1(Nr4a1)和转谷氨酰胺酶2(Tgm2);而Apop上清液则不行(图一c),表明Pyro-1上清液诱导的基因特征在很大程度上与IL-18无关。随后,研究者用蛋白酶K处理4种上清液来降解所含蛋白质,之后进行95℃热灭活(图一d,顶部)。发现蛋白酶K处理后的Pyro-1和Pyro−1-18上清液仍能显著诱导靶细胞的Thbs1、Vegf、Nr4a1和Tgm2表达(图一d)。以上数据表明,Pyro-1分泌组诱导了与细胞增殖和迁移相关基因的表达,及其发挥作用不依赖于所含的蛋白质。
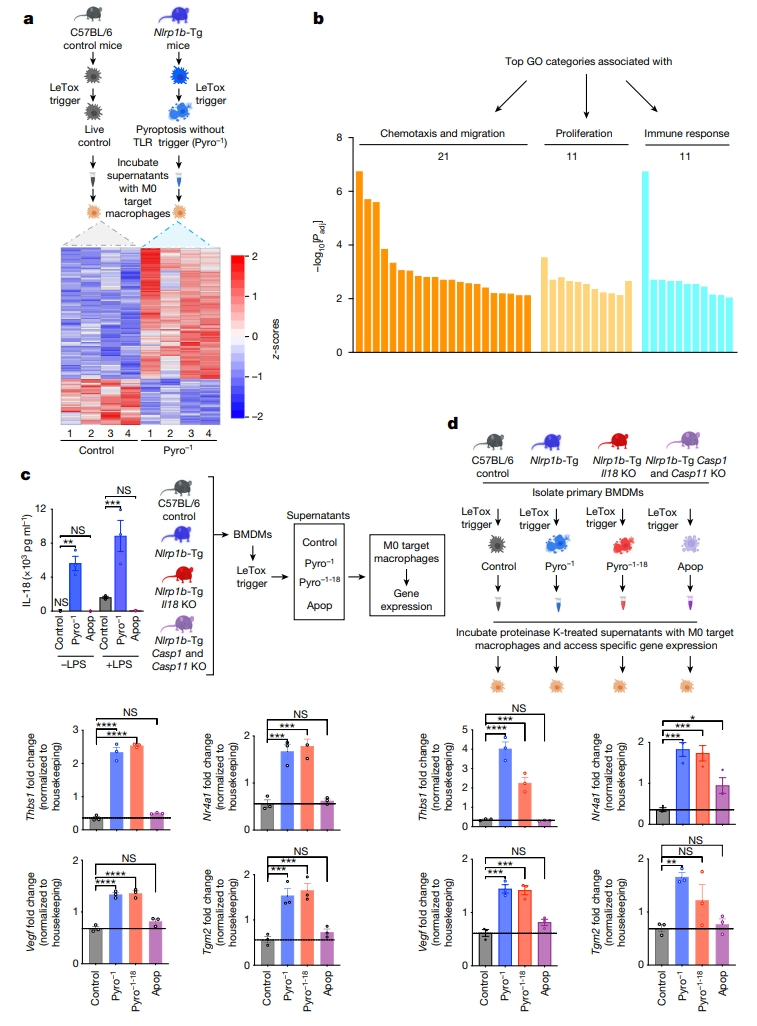
图一 Pyro-1分泌组可诱导细胞增殖和迁移相关基因的表达[6]
接下来,研究者对Pyro-1上清液进行脂质组学研究,发现其富含氧化脂质包括PGE2,而对照和Apop上清液中没有(图二a)。比对一个公开RNA-seq数据集,其中PGE2直接添加到小鼠M0 BMDM,分析发现诱导变化基因与Pyro-1上清液诱导的一半基因相重叠,包括许多高度上调的基因(图二b),表明PGE2可能是Pyro-1上清液的主要作用成分。PGE2与伤口愈合有关,于是研究者进行体外伤口愈合试验。与对照组相比,Pyro-1和Pyro−1-18上清液显著增加了小鼠原代成纤维细胞单层划痕实验的伤口愈合(图二c),表明IL-18在这种情况下是不必要的。进一步测试Transwell迁移试验,发现Pyro-1上清液可诱导原代小鼠成纤维细胞和巨噬细胞的更多迁移,且这种作用同样独立于IL-18(图二d)。随后,研究者测试这种效应是否也能发生在人类髓系细胞上。用NLRC4炎症小体激动剂NeedleTox触发人CD14+血单核细胞的焦亡。这些焦亡上清液也能诱导成纤维细胞伤口愈合急剧增加,并且也检测到PGE2(图二e)。
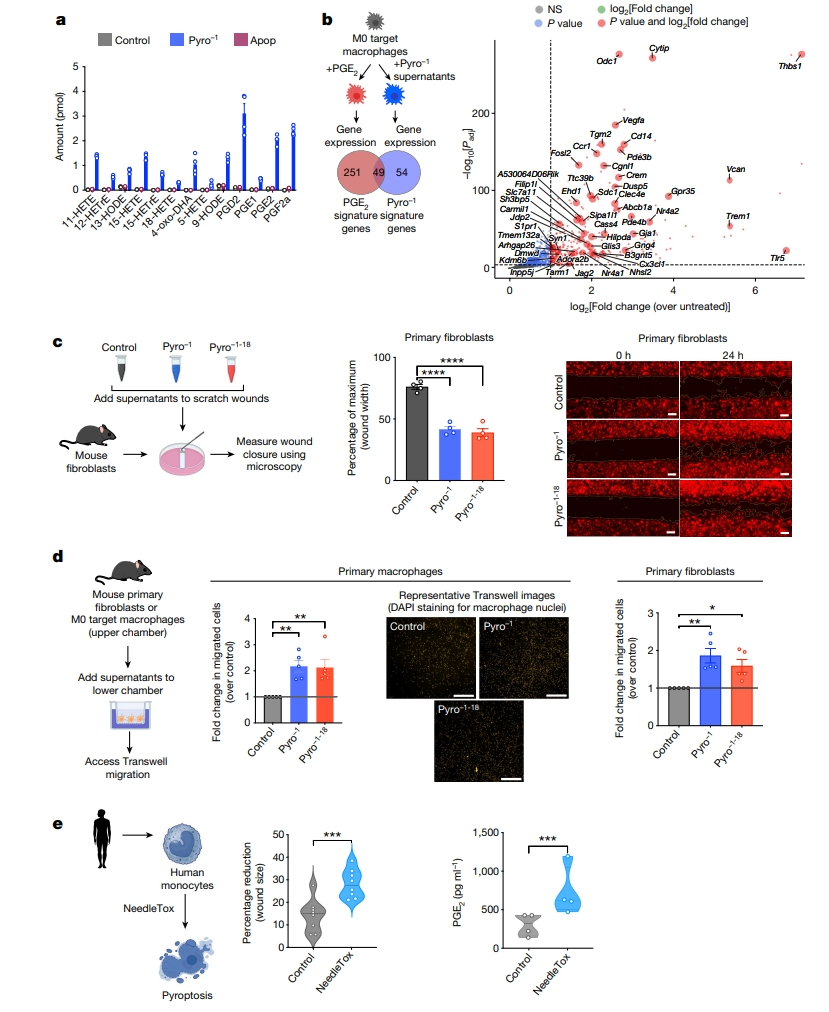
图二 Pyro-1上清液中活性代谢物的鉴定[6]
接下来,研究者试图了解PGE2释放的动力学、来源和可能的释放模式。之前研究表明,从焦亡细胞中释放乳酸脱氢酶和IL-1β等蛋白质是一个动态调节的过程,其中膜通透性由GSDMD和NINJ1等控制,修复过程由ESCRT复合体介导[8]。在产生Pyro-1上清液的方法中,细胞在LeTox触发后90分钟内可渗透进7-氨基放线菌素D(7-AAD;质量为1270 Da)(图三a),而膜孔开放标志物LDH(依赖于NINJ1)在120分钟左右检测最高(图三b)。相比之下,对照组在相同的LeTox触发后的任何时间点都没有表现出膜渗透性或LDH释放,Apop组也无LDH释放(图三a和b)。LeTox触发后90分钟,可在Pyro-1上清液中检测到PGE2,并且在120分钟时水平显著更高(图三c)。进而探究释放的PGE2是来源于焦亡触发之前就已经存在于细胞中的,还是焦亡过程中新产生的。前列腺素由花生四烯酸通过环氧化酶-1(COX1)和COX2的活性合成。COX1和COX2的酶活性可以使用非甾体抗炎药来抑制,包括阿司匹林、布洛芬和吲哚美辛可抑制COX1和COX2,以及NS-398抑制COX2。此外,阿司匹林的抑制作用是不可逆的,但其他三种药物的抑制是可逆的。将Nlrp1b-Tg巨噬细胞预先用阿司匹林、布洛芬、NS-398或吲哚美辛处理过夜,在去除药物并诱导焦亡后,发现用可逆抑制剂布洛芬、NS-398或吲哚美辛处理的细胞上清液中PGE2水平恢复到未经药物处理的Pyro-1水平,而不可逆抑制剂阿司匹林阻断了PGE2的释放(图三d),表明在焦亡过程中诱导了COX1和COX2活性,这可能导致PGE2的从头合成和释放。在诱导焦亡后,测试不同时间点添加阿司匹林的情况,发现即使在LeTox触发后60分钟添加阿司匹林也都会显著降低PGE2水平(图三d),表明PGE2的产生和释放发生在焦亡的后期。
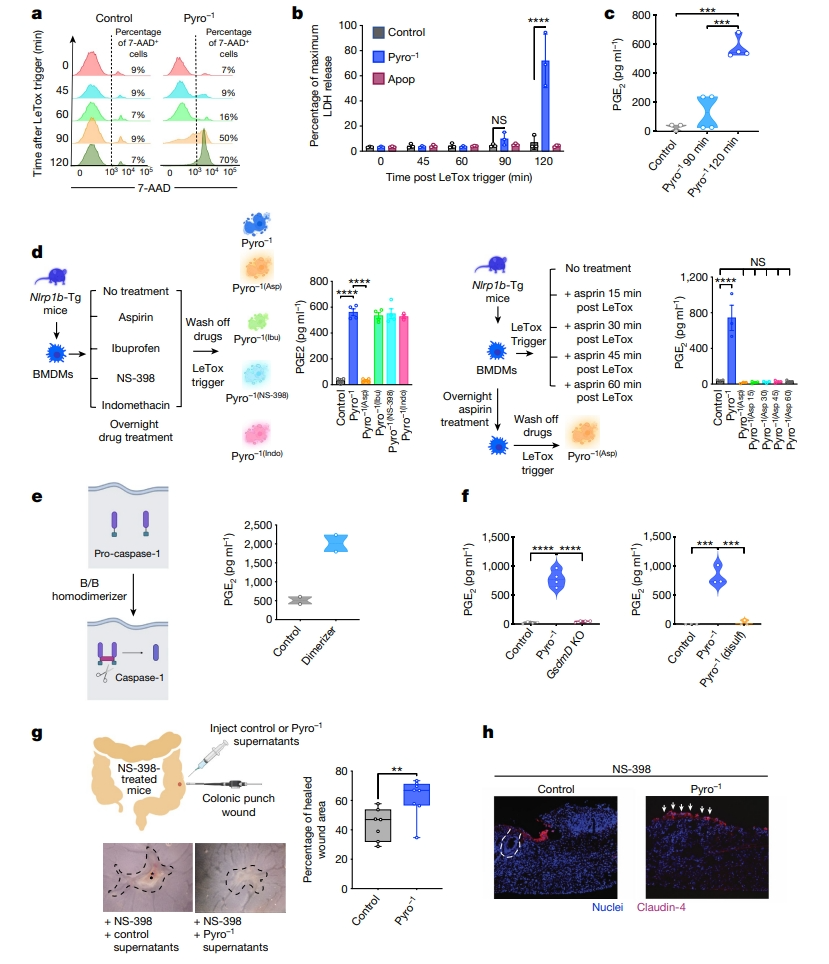
图三 焦亡过程中PGE2的从头合成可以促进体内伤口愈合[6]
触发焦亡后,炎症小体激活Caspase-1活性,这对诱导焦亡至关重要。为了测试Caspase-1活性是否有助于PGE2的释放,研究者构建了可诱导表达Caspase-1的人THP-1单核细胞。通过直接激活Caspase-1,也能显著诱导PGE2的释放(图三e)。进一步测试Caspase-1激活下游的GSDMD打孔是否有助于PGE2的释放。使用Nlrp1b-Tg Gsdmd KO小鼠祖细胞产生的HoxB8巨噬细胞诱导焦亡,Gsdmd KO后不会导致上清液中PGE2的释放;相比之下,对照组HoxB8巨噬细胞分泌了大量的PGE2;用GSDMD打孔抑制剂双硫仑处理后,完全抑制了PGE2的释放(图三f),表明焦亡细胞释放PGE2需要形成GSDMD孔。为了测试释放到Pyro-1上清液中的PGE2是否具有体内功能,研究者使用一种检测伤口愈合的结肠穿刺活检模型,在小鼠远端结肠的不同部位手术引入多个伤口,该模型的组织修复完全依赖于生物活性PGE2的局部存在。当小鼠全身施用COX2抑制剂NS-398时,大大延迟了结肠损伤的伤口愈合,导致受伤部位出现纤维蛋白凝块。通过灌肠局部施用对照或Pyro-1上清液后,第4天评估损伤部位的伤口愈合面积,发现Pyro-1上清液显著促进了结肠伤口的修复(图三g)。伤口相关上皮细胞在肠屏障重建中起着关键作用,Claudin-4是PGE2在伤口相关上皮细胞中诱导的特异标志物[9]。与此相一致,数据显示Claudin-4阳性上皮细胞在Pyro-1组伤口上延伸(图三h)。以上数据表明,PGE2是Pyro-1上清液中的生物活性物质。
最后,研究者在小鼠全层皮肤损伤模型中测试Pyro-1上清液(图四a),该模型仅部分依赖于PGE2进行组织恢复。当在受伤后第0、1和2天皮内注射上清液时,Pyro-1组对伤口愈合有着积极的影响(图四a)。阿司匹林处理的Pyro-1(Asp)上清液显示出部分的促伤口愈合作用(图四b),提示Pyro-1上清液中除氧化脂质以外的成分可能有助于改善组织修复。尽管凋亡上清液不含氧化脂质(图四c),但是在伤口闭合方面仍有显著的较小改善(图四d)。这促使研究者检查Pyro-1上清液中其他活性代谢物。在LeTox触发焦亡后90分钟和120分钟,对Pyro-1上清液进行非靶向代谢组学研究,发现Pyro-1分泌组包含许多“独特”代谢物,以及凋亡细胞分泌组中也存在的“共享”代谢物(图四e)。
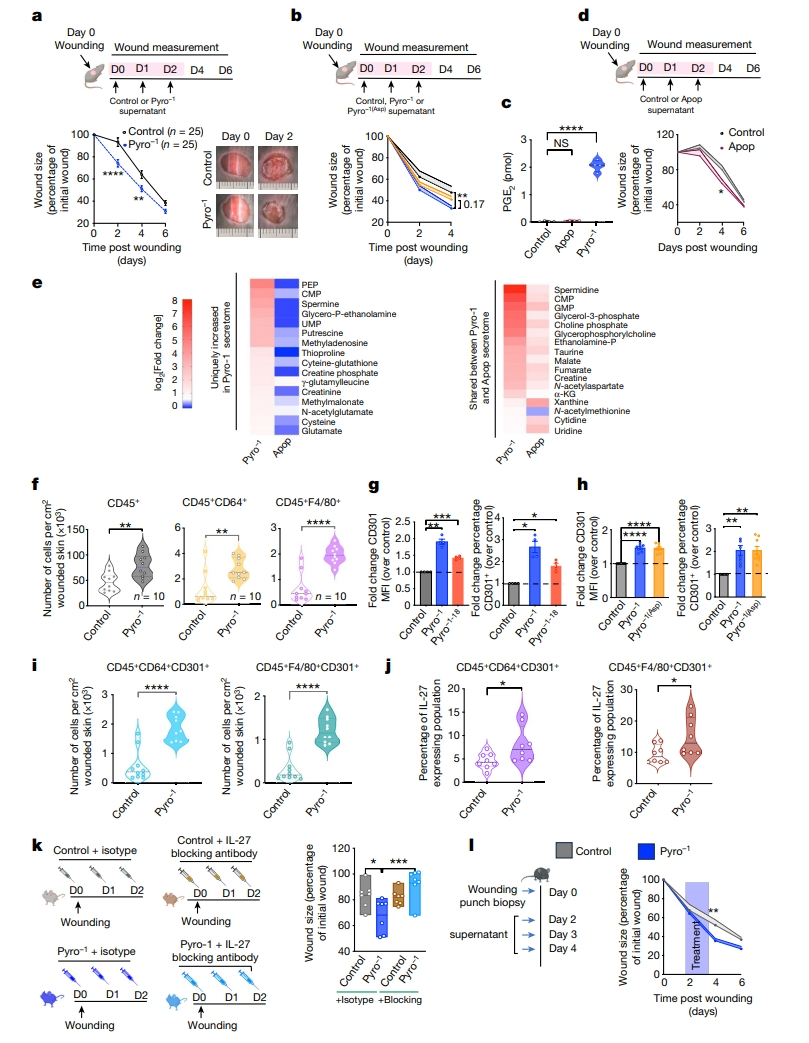
图四 Pyro-1上清液中的代谢物和氧化脂质促进伤口愈合[6]
伤口修复的早期阶段,通常称为炎症阶段,伴随着巨噬细胞和中性粒细胞快速浸润到损伤部位,这有助于预防感染,同时促进伤口修复。为了更好地理解Pyro-1上清液中代谢物对体内伤口部位免疫细胞迁移和/或极化的调节作用,收集第3天全层皮肤伤口,分析免疫细胞浸润情况。经Pyro-1上清液处理的伤口显示出CD45+细胞和CD45-细胞数量增加,以及F4/80+和CD64+巨噬细胞的显著增加(图四f)。先前的工作已经确定,皮肤单核吞噬细胞是皮肤间质细胞群的主要组成部分,其中促进修复伤口部位的巨噬细胞表达凝集素CD301,它是一种极化标志物[11]。此外,伤口部位巨噬细胞的CD301+CD206+群体倾向于表达更多的IL-10和TGFβ,促进了再上皮化和成纤维细胞募集,进而促进伤口愈合。用上清液孵育M0巨噬细胞,发现Pyro-1上清液孵育24小时后,CD301+细胞的百分比明显增加,每个细胞表面CD301表达水平也增加,IL-18在很大程度上不起作用(图四g)。值得注意的是,Pyro-1上清液在诱导巨噬细胞CD301极化方面的作用与PGE2无关,因为阿司匹林处理的Pyro-1(Asp)上清液在诱导CD301+细胞方面同样有效(图四h),表明PGE2以外的成分介导了这种作用。测试Pyro-1上清液是否调节体内CD301的表达,收集第3天皮肤伤口分析CD45+CD64+和CD45+F4/80+细胞中CD301的表达,发现每单位伤口面积的CD301+细胞显著增加(图四i);表达CD301+巨噬细胞分泌细胞因子IL-27的细胞也更多(图四j)。进一步在小鼠造模中施用一种IL-27阻断抗体,显著减少了Pyro-1上清液的伤口愈合作用(图四k),表明Pyro-1上清液显著诱导了分泌IL-27的CD301+巨噬细胞,进而增强伤口愈合。IL-1β会延缓伤口愈合[10]。在炎症期高峰期(IL-1β最高值),即从第2天至第4天在伤口部位施用上清液,Pyro-1上清液仍能促进伤口愈合(图四l),表明Pyro-1上清液仍然可以在伤口愈合的炎症阶段获得受益。
综上所述, 研究者证明缺乏IL-1β的焦亡细胞分泌组可以成为组织修复的有力促进因子。首先,Pyro-1分泌组含有氧脂质和代谢物,在体内协同促进伤口闭合。其次,PGE2等氧化脂质的产生是在caspase-1激活的下游从头合成的,PGE2的释放依赖于GASDMD孔。第三,根据生物信息学分析,PGE2贡献了Pyro-1上清液诱导的约50%的基因特征,与此相一致,氧化脂质对全层伤口模型的愈合提供了部分益处,其余的作用归因于Pyro-1上清液中的其他代谢物。第四,Pyro-1上清液促进了伤口部位与伤口愈合有关的巨噬细胞亚群的富集。该研究为治疗伤口修复提供了新的线索,有望用于相关疾病的组织修复治疗。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Kesavardhana S, Malireddi RKS, Kanneganti TD: Caspases in Cell Death, Inflammation, and Pyroptosis. Annual review of immunology 2020, 38:567-595.
2. Mariathasan S, Newton K, Monack DM, Vucic D, French DM, Lee WP, Roose-Girma M, Erickson S, Dixit VM: Differential activation of the inflammasome by caspase-1 adaptors ASC and Ipaf. Nature 2004, 430(6996):213-218.
3. Broz P, Dixit VM: Inflammasomes: mechanism of assembly, regulation and signalling. Nature reviews Immunology 2016, 16(7):407-420.
4. Phulphagar K, Kühn LI, Ebner S, Frauenstein A, Swietlik JJ, Rieckmann J, Meissner F: Proteomics reveals distinct mechanisms regulating the release of cytokines and alarmins during pyroptosis. Cell Rep 2021, 34(10):108826.
5. Linder A, Bauernfried S, Cheng Y, Albanese M, Jung C, Keppler OT, Hornung V: CARD8 inflammasome activation triggers pyroptosis in human T cells. The EMBO journal 2020, 39(19):e105071.
6. Mehrotra P, Maschalidi S, Boeckaerts L, Maueröder C, Tixeira R, Pinney J, Burgoa Cardás J, Sukhov V, Incik Y, Anderson CJ et al: Oxylipins and metabolites from pyroptotic cells act as promoters of tissue repair. Nature 2024, 631(8019):207-215.
7. de Vasconcelos NM, Van Opdenbosch N, Van Gorp H, Parthoens E, Lamkanfi M: Single-cell analysis of pyroptosis dynamics reveals conserved GSDMD-mediated subcellular events that precede plasma membrane rupture. Cell death and differentiation 2019, 26(1):146-161.
8. Rühl S, Shkarina K, Demarco B, Heilig R, Santos JC, Broz P: ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science 2018, 362(6417):956-960.
9. Seno H, Miyoshi H, Brown SL, Geske MJ, Colonna M, Stappenbeck TS: Efficient colonic mucosal wound repair requires Trem2 signaling. Proceedings of the National Academy of Sciences of the United States of America 2009, 106(1):256-261.
10. Mirza RE, Fang MM, Ennis WJ, Koh TJ: Blocking interleukin-1β induces a healing-associated wound macrophage phenotype and improves healing in type 2 diabetes. Diabetes 2013, 62(7):2579-2587.



