技术分享:脂质介导翻译组重塑及其在肿瘤治疗中的作用
几千年来,禁食一直被认为有益健康,可将身体的能量来源从葡萄糖转换为酮体,通过代谢重塑来建立这些健康益处[1]。间歇性禁食和生酮饮食可带来广泛的健康益处,包括减肥、减少炎症、增强大脑功能和预防癌症。由禁食、低碳水高脂肪饮食以及运动诱导的生酮作用已被证明可以激活多种细胞信号通路[2]。然而,禁食信号如何引起基因表达乃至蛋白质组的变化,进而建立生酮代谢程序,仍然没有得到充分的研究。
肝脏是禁食期间协调代谢重编程的主要器官。禁食时,肝脏中的全局翻译及其主调节因子mTOR通路被下调[3]。mTOR通路主要通过磷酸化RPS6K1和eIF4E结合蛋白1(4EBP1)来调节蛋白质合成,4EBP1的低磷酸化会抑制真核翻译起始因子eIF4E的活性[4]。一个悬而未决的问题是,禁食时全局蛋白质合成下降,那么特定代谢途径的mRNA又是如何被翻译的?
2024年8月,Nature期刊在线报道了一项研究,揭示了禁食诱导代谢转变过程中一种新的翻译调控机制,即增加真核翻译起始因子4E的磷酸化(P-eIF4E)。P-eIF4E负责调控参与脂质分解代谢和酮体生成的基因翻译,通过这些靶基因5′UTR上的一个特定翻译调控元件来调控靶基因mRNA的翻译。在禁食或生酮饮食期间,长链脂肪酸可以作为信号分子,结合并诱导AMP活化蛋白激酶(AMPK)的活性,进而增强MNK磷酸化,最终增加P-eIF4E。进一步利用这一特性来治疗以酮体为能量来源的特定肿瘤,发现在生酮饮食中,P-eIF4E抑制剂eFT508的联合治疗可以抑制胰腺肿瘤的生长,提供了一种个性化的饮食干预联合治疗癌症的新方法[5]。
首先,研究者对随意进食、禁食、禁食后再喂食的小鼠肝脏进行蛋白质免疫印迹分析,发现活性形式eIF4E的209位丝氨酸磷酸化(P-eIF4E)在禁食24小时后显著增加,而4EBP1表现为低磷酸化(图一a),且P-eIF4E随着再喂食而降低(图一b),表明eIF4E活性在进食-禁食过渡期间受到动态调节。已知唯一的eIF4E激酶MNK,空腹时活性也增加(图一a)。于是,研究者探究禁食时肝脏是否发生翻译组学重编程来协调代谢重塑。使用一种金标准技术,无偏见的全基因组翻译分析方法结合RNA测序(PolyRibo-seq)[6],发现小鼠禁食后与mRNA结合的重多聚核糖体总面积减少,即翻译减少(图一c)。计算禁食时肝脏中每种mRNA的相对翻译效率(TE),鉴定出983个转录本在禁食时的相对翻译效率显著下调,包括mTOR翻译靶点;另有615个转录本显著上调(图一d)。通路富集分析显示,禁食诱导的上调翻译基因主要参与酮体生成和脂质代谢(图一e)。对分离组分进行定量PCR(qPCR)分析发现,生酮限速酶Hmgcs2和肝脏脂质代谢及生酮反应的主调节因子Ppara的mRNA在禁食后转变为高度翻译的多聚核糖体结合形式(图一f)。以上数据表明,禁食诱导了eIF4E磷酸化,改变了肝脏的翻译组学,特别是增加了与脂质代谢和生酮作用有关基因的翻译。
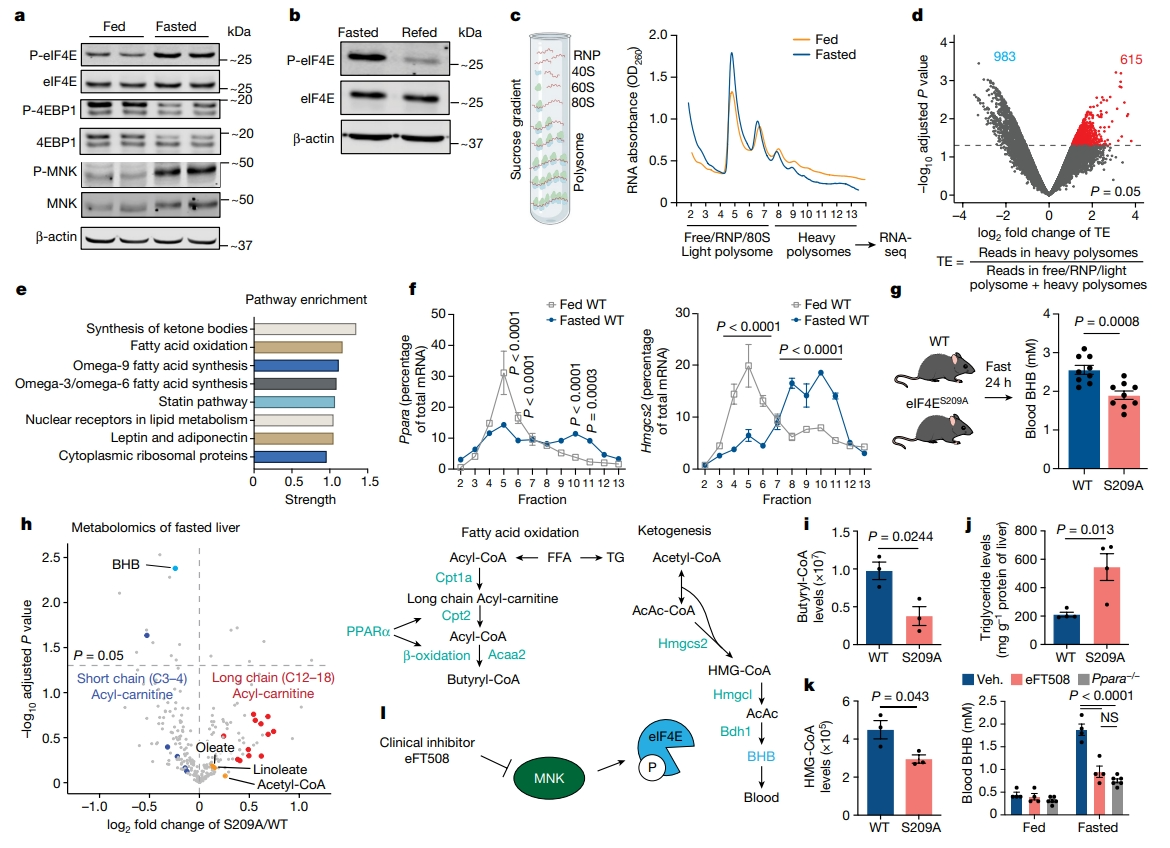
图一 禁食期间通过增加P-eIF4E在翻译水平上控制生酮作用[5]
接着,研究者探索禁食诱导的P-eIF4E在生酮过程中的作用。使用eIF4ES209A小鼠模型,突变了MNK磷酸化位点Ser209。禁食24小时后,与WT小鼠相比,eIF4ES209A小鼠产生的血液β-羟基丁酸(BHB)减少(图一g),BHB是血液中最丰富的酮体。小鼠体重、血液脂肪酸或甘油浓度没有变化,表明eIF4ES209A小鼠的脂肪组织脂解正常。代谢组学分析发现,在禁食的eIF4ES209A肝脏中,BHB是第二显著下调的代谢物(图一h)。β-氧化的中间体长链酰基肉碱,在eIF4ES209A肝脏中积累,而短链酰基肉碱被耗尽(图一h),提示β-氧化存在缺陷。还观察到eIF4ES209A肝脏中β-氧化产物丁酰辅酶A下调(图一i),甘油三酯增加了两倍(图一j)。CoA种类分析显示,Hmgcs2产物HMG-CoA减少(图一h和k)。使用MNK抑制剂eFT508[7]在小鼠中短暂抑制P-eIF4E,导致生酮作用减少50%以上,与Ppara敲除小鼠[8]相似(图一l)。以上数据表明,抑制P-eIF4E会破坏禁食期间肝脏的β氧化和生酮作用。
进一步,研究者使用PolyRibo-seq检测eIF4ES209A禁食肝脏的翻译组学。在WT禁食小鼠中翻译上调的615个基因中,有445个基因在禁食的eIF4ES209A肝脏中下调,包括Ppara和Hmgcs2,以及其他参与β氧化和生酮的基因Cpt1a、Hmgcl和Bdh1(图二a-b)。与WT相比,eIF4ES209A禁食肝脏中Ppara和Hmgcs2的翻译水平显著降低(图二c)。活性测定和免疫组化(IHC)染色也证实了PPARα和Hmgcs2蛋白浓度的下调(图二d)。有报道提出,mRNA的5′UTR可能包含不同基序,介导eIF4E的翻译调控[9]。因此,研究者探究靶基因的5′UTR对禁食的翻译敏感性。通过水动力尾静脉注射和体内生物荧光成像,将含有Ppara 5′UTR驱动的荧光素酶的质粒导入肝脏,24小时禁食增加了WT小鼠中荧光素酶表达(图二e),但eIF4ES209A小鼠中没有增加(图二f)。已知富含胞嘧啶的翻译调节因子(CERT)和富含嘧啶的翻译元件(PRTE)为eIF4E调节mRNA翻译的两种基序(图二g)。在P-eIF4E依赖性禁食上调的445个基因中(图二b),超过70%的基因含有至少一个CERT或PRTE基序,而Ppara同时含有这两个基序(图二h)。研究者在Ppara 5′UTR的PRTE或CERT基序中引入C到G的颠换,发现突变PRTE会损害禁食升高的萤光素酶表达,而突变CERT影响不大(图二i)。突变PRTE阻断了Ppara 5′UTR对P-eIF4E的翻译敏感性(图二j),表明PRTE基序是一种顺式调控元件。这种翻译特异性可以在使用禁食模拟培养基(FFM)培养小鼠肝细胞系AML12中体外重现,该培养基促进了含有Ppara 5′UTR的萤光素酶报告基因的翻译,突变PRTE则无作用(图二k)。以上数据表明,P-eIF4E与靶基因携带的PRTE基序相结合,调节禁食期间的选择性翻译。
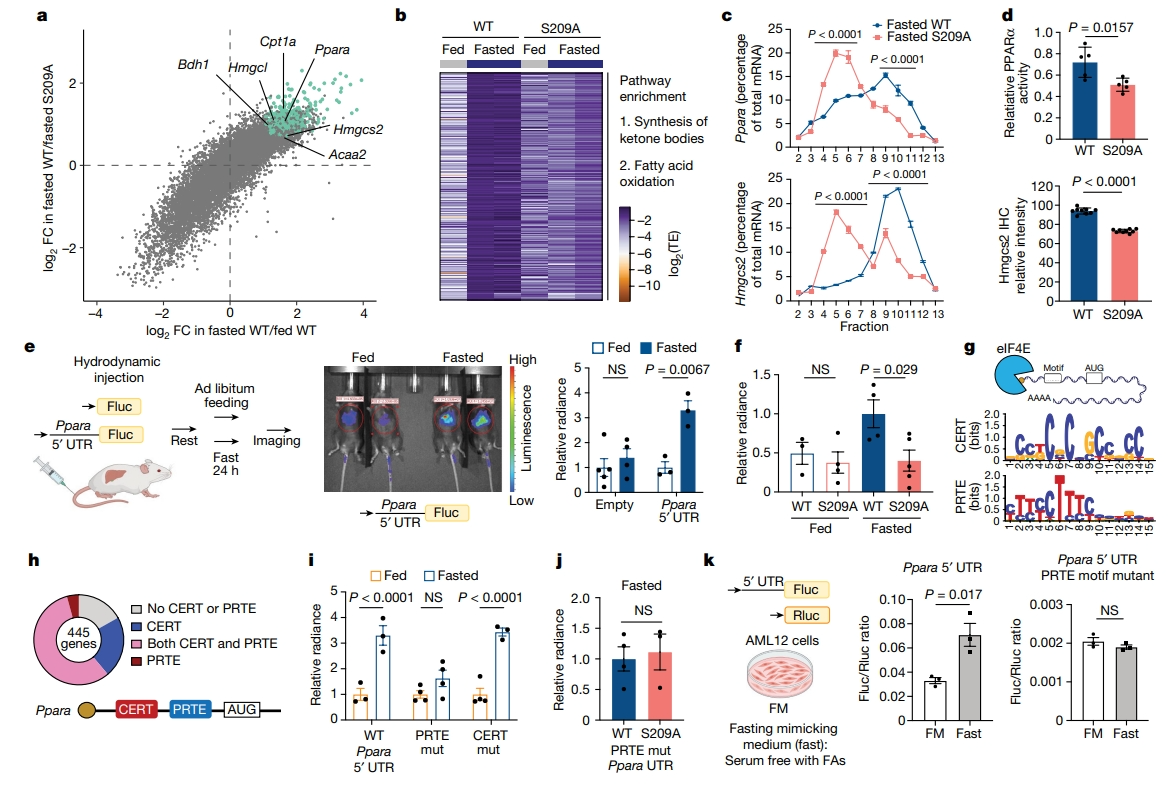
图二 P-eIF4E通过靶基因5'UTR上的PRTE基序实现禁食诱导的选择性翻译[5]
接下来,研究者探究禁食如何触发MNK-P-eIF4E依赖的翻译控制。血浆中游离脂肪酸的增加是禁食的关键特征之一,已被证明可以作为信号分子[10]。研究者推测脂肪酸可能在禁食期间触发MNK-P-eIF4E轴。为验证这一假设,将AML12细胞和原代小鼠肝细胞培养在无血清和无激素的培养基中,额外添加禁食期间血液最常见的上调脂肪酸棕榈酸(PA)、油酸(OA)和亚油酸(LA)进行短时间刺激。结果显示,所有这些脂肪酸都能诱导MNK-P-eIF4E轴,特别是多不饱和脂肪酸亚油酸(LA)(图三a),表明脂肪细胞脂肪分解产生的脂肪酸可以发出信号,在禁食期间激活肝脏的MNK-P-eIF4E轴及其对下游生酮转录本的翻译调控。研究者接着对上游调节因子进行药理学筛选,发现只有AMPK抑制剂显著下调了AML12细胞中的P-eIF4E(图三b)。抑制AMPK活性阻断了脂肪酸诱导的PPARα和Hmgcs2的翻译(图三c)。体内抑制AMPK活性显著降低了禁食WT小鼠的BHB(图三d),但在eIF4ES209A小鼠没有变化。使用重组蛋白和体外活性测定,发现AMPK以剂量依赖的方式磷酸化MNK(图三e)。通过质谱分析,观察到三个显著增加的MNK磷酸化位点:P-Ser39、P-Ser168和P-Ser394。将每种丝氨酸突变为丙氨酸会降低AMPK介导的P-MNK,而将它们全部突变会完全抑制这种作用(图三f)。此外,S394所在的MNK的C末端需要结合MAP激酶,如ERK1/2(图三f)。MNK与AMPK预孵育显著增加了ERK1依赖的MNK在Thr250和Thr255的磷酸化(图三g),这对MNK活性至关重要。将Ser394单独突变为磷酸失活的丙氨酸,可抑制AMPK预孵育诱导的ERK1对MNK Thr250/255磷酸化(图三g),表明AMPK具有新的功能,可以通过MNK-P-eIF4E轴激活mRNA的特异性翻译。
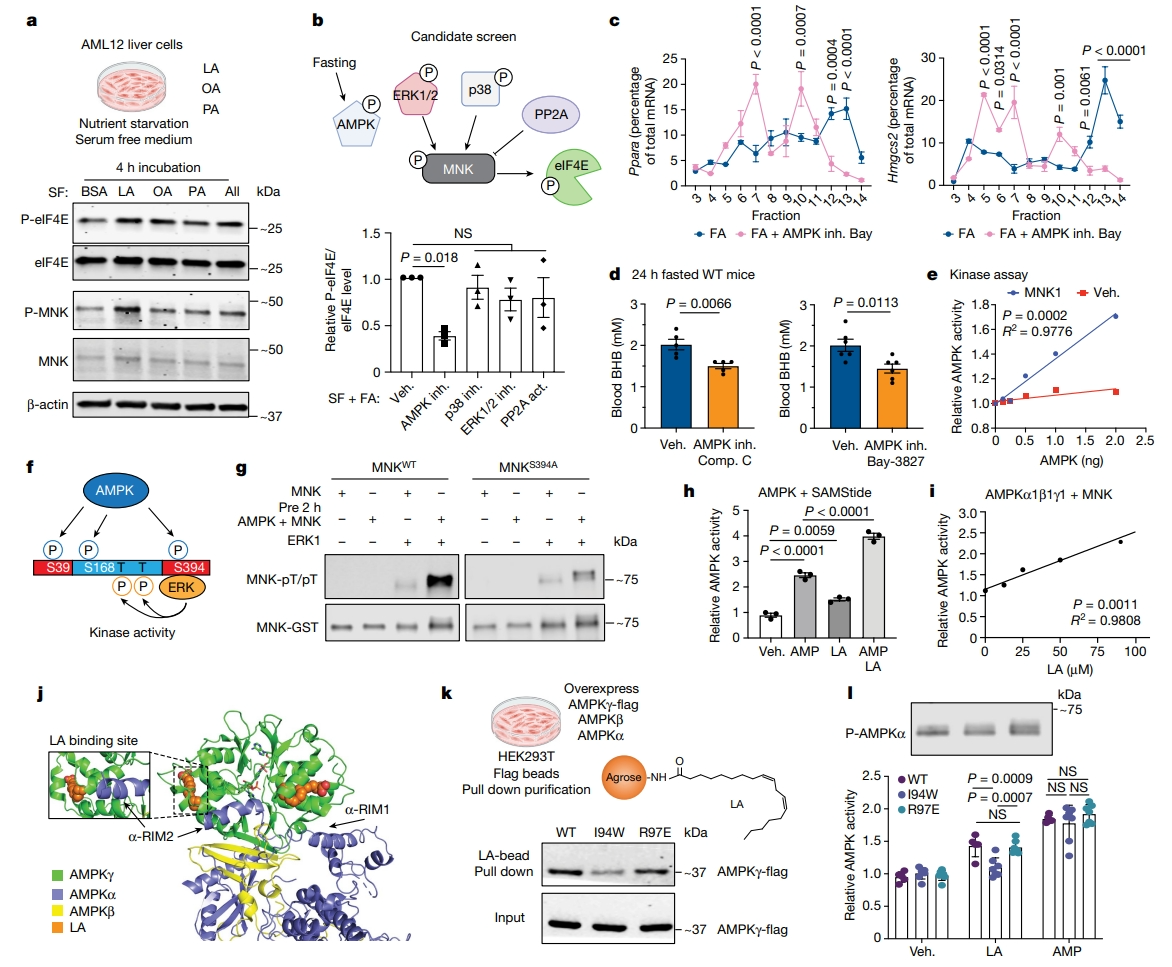
图三 脂肪酸增强AMPK活性,诱导MNK-P-eIF4E轴[5]
研究者进一步测试脂肪酸能否直接调节AMPK活性。利用纯化的人AMPKα1β1γ1及其底物SAMS肽进行体外活性试验,发现即使没有AMP,亚油酸也能剂量依赖性地增强AMPK的活性(图三h和i)。研究者对AMPK活性结构和亚油酸进行了分子动力学模拟,发现有两个主要的相互作用位点,亚油酸进入埋藏的疏水口袋并保持稳定结合(图三j)。每个结合口袋都包含一个γ-螺旋,激酶亚基-α的调节相互作用基序(α-RIM)与其结合并激活AMPK(图三j)。突变结合位点氨基酸削弱了与亚油酸的结合,以及亚油酸诱导的AMPK激活,而突变非结合位点则无影响(图三k和l)。以上数据表明,脂肪酸充当AMPKγ的生理配体,直接激活AMPK活性以调节下游代谢途径,并促进MNK-P-eIF4E轴。
研究者接着在生酮饮食系统中检测上述调控通路。在生酮饮食后,观察到WT小鼠肝脏中AMPK磷酸化和活性增加(图四a),P-eIF4E显著增加和P-4EBP1下调(图四b),药理抑制AMPK活性降低了生酮饮食诱导的P-MNK和P-eIF4E(图四c)。和WT小鼠相比,eIF4ES209A小鼠在1天生酮饮食后就出现了BHB血浓度下降,2个月长期生酮饮食后BHB血浓度下降了50%以上(图四d)。使用PolyRibo-seq检测生酮饮食肝脏,发现生酮饮食和禁食之间存在类似的翻译组重编程,包括211个重叠的显著上调翻译基因(图四e和f)。qPCR进一步证实在生酮饮食下,eIF4ES209A肝脏中PPARα和Hmgcs2的翻译水平降低(图四g),甘油三酯含量积累(图四h),乙酰辅酶A和其他短链酰基辅酶A含量下降(图四i),提示β氧化缺陷。由于Hmgcs2的底物乙酰辅酶A被耗尽,尾静脉注射Hmgcs2 cDNA部分挽救了eIF4ES209A的BHB浓度(图四j)。值得注意的是,Ppara cDNA注射完全恢复了eIF4ES209A小鼠的BHB浓度及其转录靶标(图四k)。以上数据表明,P-eIF4E同样调控生酮饮食诱导的酮体产生,Ppara的翻译控制在这一过程中具有核心作用。
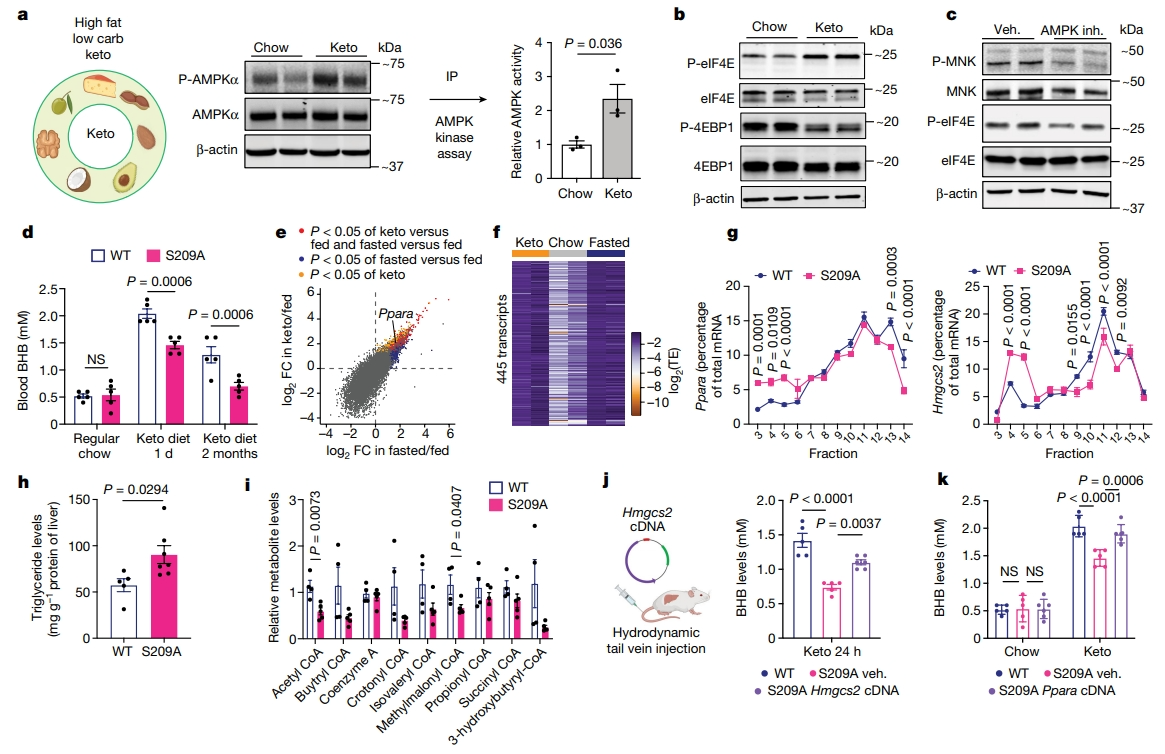
图四 生酮饮食激活P-eIF4E依赖性翻译以调节生酮反应[5]
某些癌症可以利用酮体作为一种替代能源来维持癌症生长所需,如胰腺肿瘤[11]。研究者推测在生酮饮食下的胰腺肿瘤生长,可能也依赖于P-eIF4E,而P-eIF4E可以被MNK的临床试验抑制剂eFT508(也称为托米伏塞替)所阻断。通过构建人胰腺癌细胞系T3M4和AsPC1的异种移植模型来验证这一假设。生酮饮食和eFT508联合使用抑制了胰腺肿瘤的生长,而单一治疗没有效果(图五a和b)。与禁食类似,eFT508处理下调了肝脏中Ppara和Hmgcs2转录本的翻译(图五c),并降低了生酮饮食中的BHB血浓度(图五d)。为更好地理解P-eIF4E在肿瘤形成中的作用,研究者测试补充BHB是否可以绕过eFT508的作用。当小鼠接受eFT508和生酮饮食处理时,在饮水中添加BHB可恢复小鼠体内BHB的浓度(图五e),进而有效地阻断了联合治疗的肿瘤抑制作用(图五f),还观察到亚油酸也激活了胰腺癌细胞中的MNK-P-eIF4E轴(图五g)。生酮饮食也重塑了肿瘤的翻译组,而这种重塑可被eFT508所抑制(图五h)。其中,Ppara是受影响最大的基因,在生酮饮食中翻译上调,在eFT508处理后翻译下调(图五h)。研究者还构建了不含5′UTR的过表达Ppara的T3M4细胞进行异种移植,此时Ppara过表达的肿瘤对生酮饮食和eFT508的组合变得不敏感(图五i)。以上数据表明,为了适应高脂肪低碳水饮食环境,胰腺肿瘤重编程翻译组,上调了β-氧化和生酮反应;eFT508处理会破坏这些营养途径,抑制肿瘤生长(图五j)。一旦恢复循环BHB或过表达β-氧化的Ppara来增强营养来源,就能维持肿瘤生长(图五j)。这一模型也在FFM培养的T3M4细胞中得到验证,在添加BHB或过表达不含5′UTR的Ppara都会促进T3M4细胞的生长(图五k)。以上数据表明,生酮饮食和eFT508的组合处理限制了胰腺肿瘤细胞中酮的可用性,提供了一种治疗胰腺癌症的临床新策略。
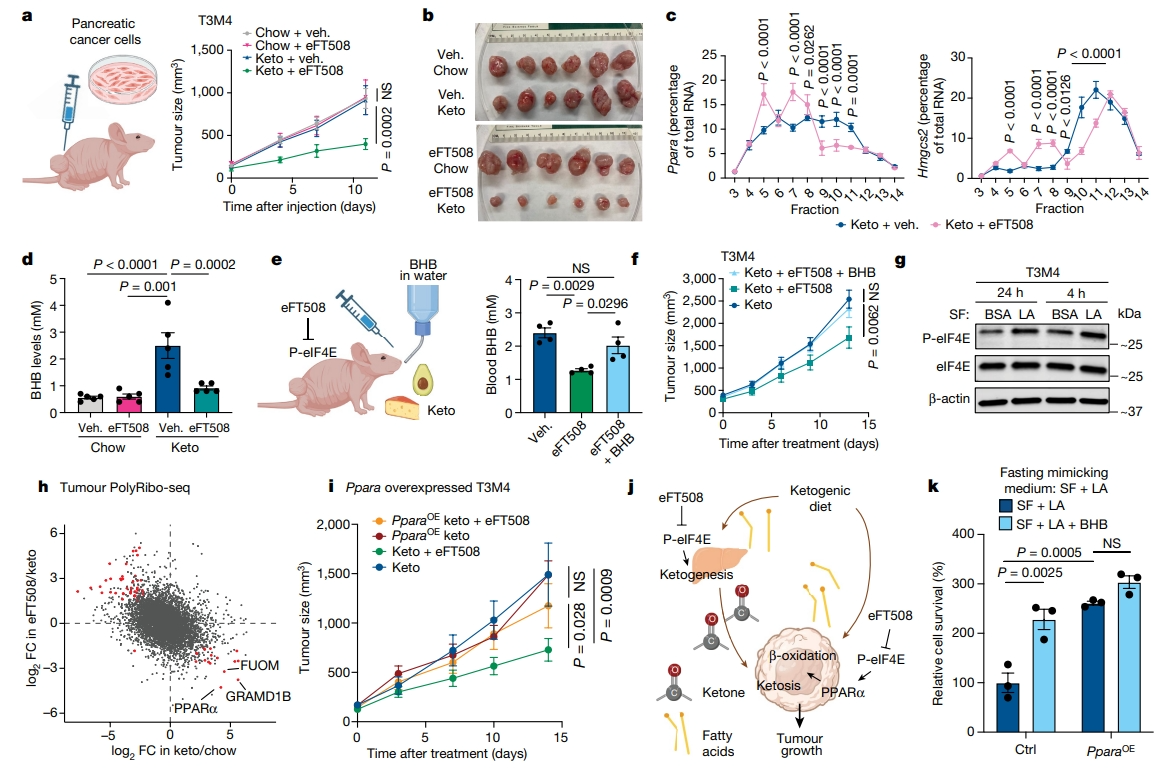
图五 药理学靶向P-eIF4E联合生酮饮食限制了胰腺肿瘤生长[5]
综上所述,该研究发现在禁食或生酮饮食中,上调的P-eIF4E作为一种选择性翻译因子,充当着协调生酮反应翻译特异性的中心枢纽,促进代谢重塑。机制上,长链脂肪酸可以作为信号分子,激活营养传感器AMPK,分级激活MNK,最终上调P-eIF4E。该研究揭示了AMPK-MNK-eIF4E轴可调控生酮作用,提出了一种新的脂肪酸介导的激酶信号通路将生酮作用与翻译调控联系起来。利用这一机理,通过靶向P-eIF4E的临床抑制剂和生酮饮食相结合,能够阻断胰腺癌小鼠模型中胰腺癌细胞的唯一能量来源(脂肪代谢),进而强烈抑制肿瘤生长。该研究提出了联合治疗的潜在靶点,提供了一种个性化的饮食干预联合治疗癌症的新方法。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Effects of Intermittent Fasting on Health, Aging, and Disease. N Engl J Med 2020, 382(10):978.
2. Dowis K, Banga S: The Potential Health Benefits of the Ketogenic Diet: A Narrative Review. Nutrients 2021, 13(5).
3. Sengupta S, Peterson TR, Laplante M, Oh S, Sabatini DM: mTORC1 controls fasting-induced ketogenesis and its modulation by ageing. Nature 2010, 468(7327):1100-1104.
4. Dowling RJ, Topisirovic I, Alain T, Bidinosti M, Fonseca BD, Petroulakis E, Wang X, Larsson O, Selvaraj A, Liu Y et al: mTORC1-mediated cell proliferation, but not cell growth, controlled by the 4E-BPs. Science 2010, 328(5982):1172-1176.
5. Yang H, Zingaro VA, Lincoff J, Tom H, Oikawa S, Oses-Prieto JA, Edmondson Q, Seiple I, Shah H, Kajimura S et al: Remodelling of the translatome controls diet and its impact on tumorigenesis. Nature 2024.
6. Zhulyn O, Rosenblatt HD, Shokat L, Dai S, Kuzuoglu-Öztürk D, Zhang Z, Ruggero D, Shokat KM, Barna M: Evolutionarily divergent mTOR remodels translatome for tissue regeneration. Nature 2023, 620(7972):163-171.
7. Reich SH, Sprengeler PA, Chiang GG, Appleman JR, Chen J, Clarine J, Eam B, Ernst JT, Han Q, Goel VK et al: Structure-based Design of Pyridone-Aminal eFT508 Targeting Dysregulated Translation by Selective Mitogen-activated Protein Kinase Interacting Kinases 1 and 2 (MNK1/2) Inhibition. Journal of medicinal chemistry 2018, 61(8):3516-3540.
8. Montagner A, Polizzi A, Fouché E, Ducheix S, Lippi Y, Lasserre F, Barquissau V, Régnier M, Lukowicz C, Benhamed F et al: Liver PPARα is crucial for whole-body fatty acid homeostasis and is protective against NAFLD. Gut 2016, 65(7):1202-1214.
9. Truitt ML, Conn CS, Shi Z, Pang X, Tokuyasu T, Coady AM, Seo Y, Barna M, Ruggero D: Differential Requirements for eIF4E Dose in Normal Development and Cancer. Cell 2015, 162(1):59-71.
10. DiMarco NM, Beitz DC, Whitehurst GB: Effect of fasting on free fatty acid, glycerol and cholesterol concentrations in blood plasma and lipoprotein lipase activity in adipose tissue of cattle. Journal of animal science 1981, 52(1):75-82.
11. Gouirand V, Gicquel T, Lien EC, Jaune-Pons E, Da Costa Q, Finetti P, Metay E, Duluc C, Mayers JR, Audebert S et al: Ketogenic HMG-CoA lyase and its product β-hydroxybutyrate promote pancreatic cancer progression. The EMBO journal 2022, 41(9):e110466.



