技术分享:禁食后的再进食可通过多胺增强肠道干性
禁食包括短期禁食、间歇性禁食和热量限制,可改善人类以及各种生物体的健康、寿命和组织再生[1, 2]。成体干细胞在组织再生和肿瘤发生中具有重要作用。研究表明,禁食干预通过调节成体干细胞来增强损伤组织的再生与修复[3],也被认为对肿瘤生长有抑制作用。尽管如此,成体干细胞是如何使得机体受益,以及究竟是禁食本身,还是禁食后的重新进食促进了组织再生或癌症发生发展,目前尚未完全确定。
快速更新的哺乳动物肠上皮细胞可响应饮食诱导的生理信号,动态地改变肠道组成[4]。在这个过程中,主要贡献者是位于隐窝基部活性循环的Lgr5+ 肠道干细胞(ISC)。这些ISC由上皮、基质和免疫细胞微环境所支持[5],以及由微环境衍生的生长因子和发育信号通路所维持,如WNT、NOTCH、BMP抑制剂和EGF[6],也能响应环境因素的调节,如微生物组和饮食[1]。宿主饮食和营养物质可通过直接或间接控制ISC的方式来影响肠道组成。已报道, 24小时的急性禁食可通过激活脂肪酸氧化代谢直接改善ISC的功能[7];而长期热量限制(热量摄入减少40%)则是通过抑制潘氏细胞生态位的mTORC1信号来间接增加ISC[8]。因此,ISC及其微环境共同整合不同信号来实现肠道适应,但是营养或代谢信号是如何协调ISC功能和肿瘤发生需要进一步深入研究。
2024年8月,Nature期刊在线报道了一项研究,证明了是禁食后的再进食增加了肠道干细胞(ISC)增殖和肿瘤形成。具体而言,小鼠禁食后再喂食增强了Lgr5+ ISC的再生能力,期间小肠内和结肠中肿瘤抑制基因Apc的缺失导致肠癌发病率高于禁食或随意喂食状态,表明禁食后再喂食是一种独特的状态。机制上,禁食后再喂食小鼠的ISC显著激活了mTORC1信号通路,进而通过多胺代谢增加了蛋白质合成,从而推动了这些变化。抑制mTORC1、多胺代谢物产生或蛋白质合成可消除禁食后再喂食的再生或致瘤效应[9]。
首先,研究者探究禁食后再喂食对肠道的影响。将小鼠分为四种不同饮食条件:可以自由获取食物的随意进食组,剥夺食物24小时的禁食组,禁食24小时后再喂食1天组(Refed 1 d)和再喂食3天组(Refed 3 d)。通过量化干细胞和祖细胞所在的肠隐窝内S期和M期细胞的数量,发现24小时的禁食显著降低了肠隐窝的细胞增殖,再喂食后细胞增殖显著增加(图一a)。分析每种饮食条件下肠隐窝和ISC(使用Lgr5-eGFP-IRES-CreERT2报告小鼠)形成离体肠道类器官的能力,发现禁食和再喂食1天增强了肠隐窝和ISC的类器官形成能力,再喂食3天组恢复到随意进食组的基线水平(图一b)。随后,研究者使用Lgr5+ ISC谱系追踪模型Lgr5-IRES-CreERT2;Rosa26 loxp-stop-loxp(LSL)-tdTomato来了解禁食和再喂食对体内ISC活性的影响。在禁食和再喂食方案下注射他莫昔芬2天后,量化tdTomato阳性的隐窝-绒毛轴长度(图一c)。与随意进食对照组相比,再喂食1天组的小肠tdTomato阳性长度增加了60%(图一d),结肠增加了35%,表明禁食再喂食的ISC具有增强的细胞增殖能力。进一步评估放射性损伤后ISC驱动的修复能力,在辐射暴露前24小时用tdTomato标记ISC(图一e),发现再喂食1天组对辐射诱导损伤后的ISC介导修复效果最佳(图一f)。以上数据表明,禁食的许多肠道受益是发生在重新喂食期间,可在稳态和损伤条件下刺激ISC产生更多的后代。
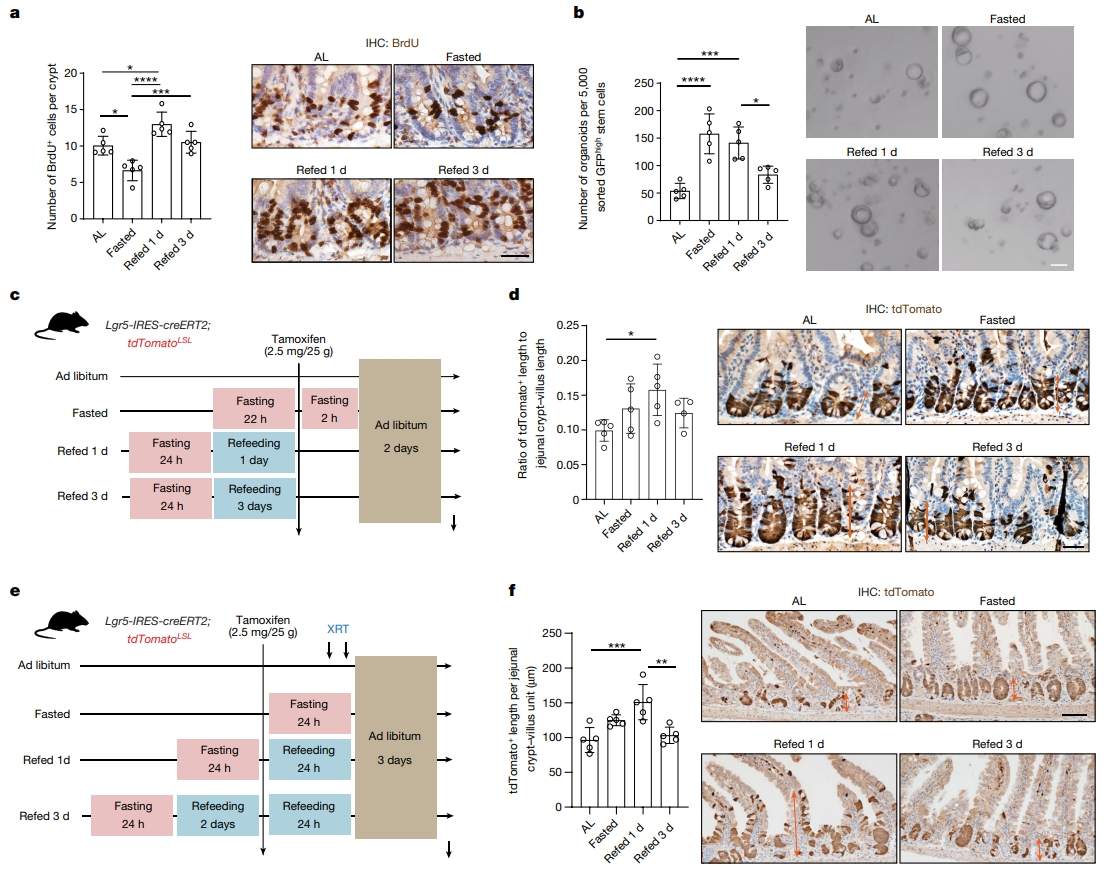
图一 禁食后再喂食可增强ISC功能[9]
接下来,研究者评估禁食和再喂食如何影响胰岛素-PI3K和mTORC1营养感应途径[10]。在肠隐窝中,再喂食1小时即可观察到更高水平的磷酸化AKT(S473)蛋白、磷酸化40S核糖体蛋白S6(pS6)和磷酸化真核翻译起始因子4E结合蛋白(p4EBP1),且再喂食1天组的mTORC1活性也大于对照组(图二a),表明再喂食诱导了胰岛素-PI3K-AKT-mTORC1信号传导。这些变化也出现在隐窝基部,包括Lgr5+ ISC及其早期子代祖细胞(图二b和c)。为了确定再喂食状态下mTORC1的必要性,再喂食前不久和期间给药mTORC1抑制剂雷帕霉素。尽管雷帕霉素处理不能阻止再喂食介导的隐窝细胞过度增殖,但它确实在稳态(图二d和e)和损伤后(图二f和g)抑制了再喂食的Lgr5+ ISC增殖。研究者进一步构建了Tsc1loxp/loxp;Villin-CreERT2和Raptorloxp/loxp;Villin-CreERT2小鼠模型,通过他莫昔芬给药可分别在肠道中组成型激活或失活mTORC1。与随意进食对照组相比,Tsc1缺失后mTORC1的激活增加了隐窝类器官形成能力(图二h),而Raptor缺失后mTORC1的失活抑制了再喂食后隐窝类器官的形成能力(图二i)。以上数据表明,禁食后再喂食增加了Lgr5+ ISC中胰岛素-PI3K-mTORC1信号传导,进而增强它们在稳态和损伤中的活性。
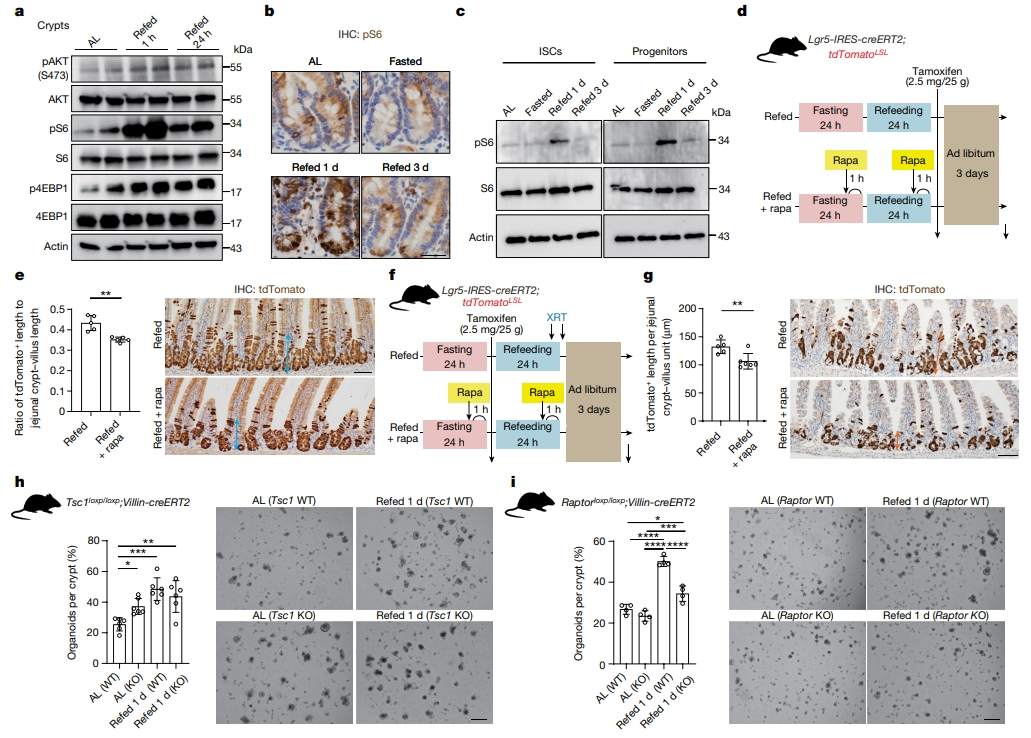
图二 禁食后再喂食激活mTORC1信号[9]
研究者进一步探究再喂食激活的mTORC1信号如何增强干性。从不同饮食条件的Lgr5-eGFP-IRES-CreERT2小鼠中分选出ISC及其祖细胞(GFP+),进行单细胞RNA测序分析(图三a)。进行统一流形近似和投影(UMAP)分析,根据已建立的标记物基因将GFP+细胞划分为17个簇(图三b)。并根据Lgr5表达水平确定了三个ISC簇(簇5、2和10)(图三c),这些簇与之前确定的称为Biton ISC-I、ISC-II和ISC-III的簇相匹配[11]。簇5具有最多的干性和低循环特征,与Biton-I相似。相比之下,簇10具有较少的原始和增殖特征,模拟了Biton III,簇2具有中间特征(图三d)。对ISC亚群进行差异基因表达分析,重点关注以mTORC1依赖的方式调节的基因特征。与随意喂食组相比,鸟氨酸氨基转移酶(Oat)的表达是再喂食ISC中上调最多的基因之一,这种诱导作用可被雷帕霉素处理所阻断(图三e),尤其是在ISC簇5和2中。蛋白质免疫印迹表明,在重新喂食的24小时内,OAT水平逐渐升高(图三f)。OAT是一种线粒体酶,主要在肝脏、肠道、大脑和肾脏中表达。在肠道中,OAT从吡咯啉-5-羧酸盐(P5C)中产生鸟氨酸,P5C由脯氨酸和谷氨酸产生。鸟氨酸是一种非蛋白原性氨基酸,用于瓜氨酸或多胺合成(图三g)。为更好地了解再喂食如何改变鸟氨酸代谢,研究者测量了随意进食、禁食、再喂食4小时和再喂食24小时的小鼠肠道组织中脯氨酸、谷氨酸和鸟氨酸的水平。值得注意的是,禁食降低了肠道中脯氨酸、谷氨酸和鸟氨酸的水平,而从再喂食4小时开始,禁食后重新喂食显著提高了它们的水平(图三h)。采用OAT抑制剂5-氟甲基鸟氨酸(5-FMO)处理,发现降低了再喂食辐照小鼠隐窝的tdTomato阳性长度,即消除了再喂食对ISC的影响,且对随意喂食组没有影响(图三i)。以上数据表明,禁食后重新喂食会刺激mTORC1依赖的OAT-鸟氨酸轴,从而促进损伤后ISC介导的修复。
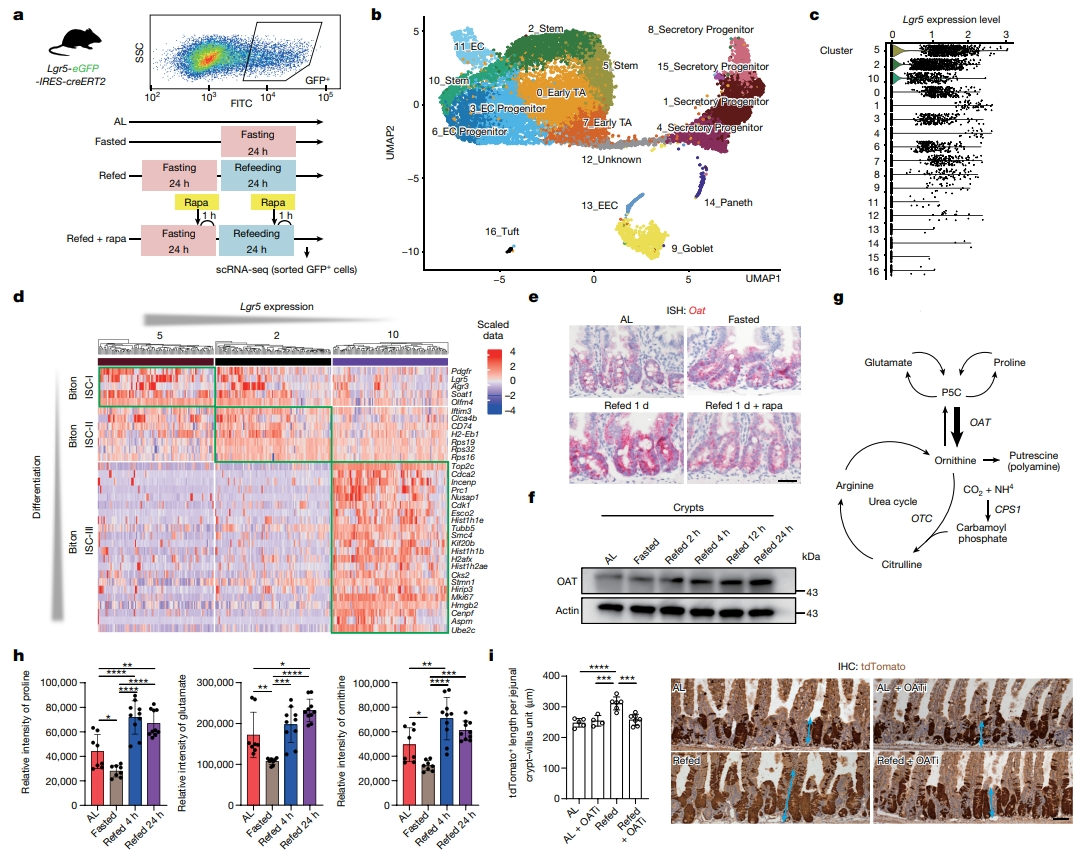
图三 再喂食可以增强ISC中OAT表达[9]
参与尿素循环和多胺合成是两种鸟氨酸下游代谢通路(图三g)。在尿素循环中,氨基甲酰磷酸合成酶1(CPS1)和鸟氨酸转氨酰酶(OTC)是催化氨甲酰磷酸酯和鸟氨酸形成瓜氨酸的酶(图三g)。此外,鸟氨酸有助于ISC和祖细胞中的多胺(腐胺、亚精胺和精胺)生物合成。鸟氨酸脱羧酶1(ODC1)是多胺生产的限速酶,催化鸟氨酸转化为腐胺。腺苷甲硫氨酸脱羧酶1(AMD1)是第二种限速酶,它从S-腺苷甲硫嘌呤中提取氨基丙基用于多胺合成(图四a)。于是,研究者首先检测小鼠ISC中多胺合成相关基因的表达水平。与随意进食相比,观察到再喂食2小时小鼠的ISC中Odc1和Amd1以及亚精胺合酶(Srm)mRNA水平以mTORC1依赖的方式显著上调(图四b和c)。测量肠隐窝中的多胺水平,发现禁食后亚精胺和精胺水平降低,再喂食隐窝中亚精胺水平升高至随意进食组水平(图四d)。真核翻译起始因子5A(eIF5A)在翻译后可被亚精胺修饰产生hypusine修饰的eIF5A,后者可作为亚精胺水平的指标[12]。在再喂食4小时和24小时的隐窝中,hypusined eIF5A表达量均大于随意进食(图四e)。由于多胺和mTORC1信号调节全局转运速率,研究者使用嘌呤霉素测量禁食和再喂食状态下的蛋白质合成速率。嘌呤霉素是一种酪氨酰tRNA模拟物,可以掺入新生多肽链中,从而能够对蛋白质合成进行蛋白质测量(图四f)。与其他组相比,再喂食组的隐窝细胞、ISC和祖细胞以mTORC1依赖或ODC1依赖的方式显示出更高的蛋白质合成率,并且与昼夜节律周期无关(图四g-i)。利用 Odc1loxp/loxp;Villin-CreERT2小鼠在肠上皮中敲除编码多胺合成限速酶的Odc1,发现Odc1缺失显著降低了再喂食隐窝中的腐胺和精胺水平,并以亚精胺依赖的方式消除了再喂食隐窝类器官的形成(图四j和k)。同样地,ODC抑制剂DFMO处理阻断了辐射诱导损伤后再喂食ISC介导的增强修复(图四l和m)。在tdTomato谱系追踪模型中,体内添加亚精胺和精胺可逆转雷帕霉素的阻断作用,并伴随着更高的蛋白质合成(图四n)。以上数据表明,禁食后再喂食以mTORC1-多胺依赖的方式,通过hypusine修饰的eIF5A,促进全局蛋白质翻译,来增强ISC功能。
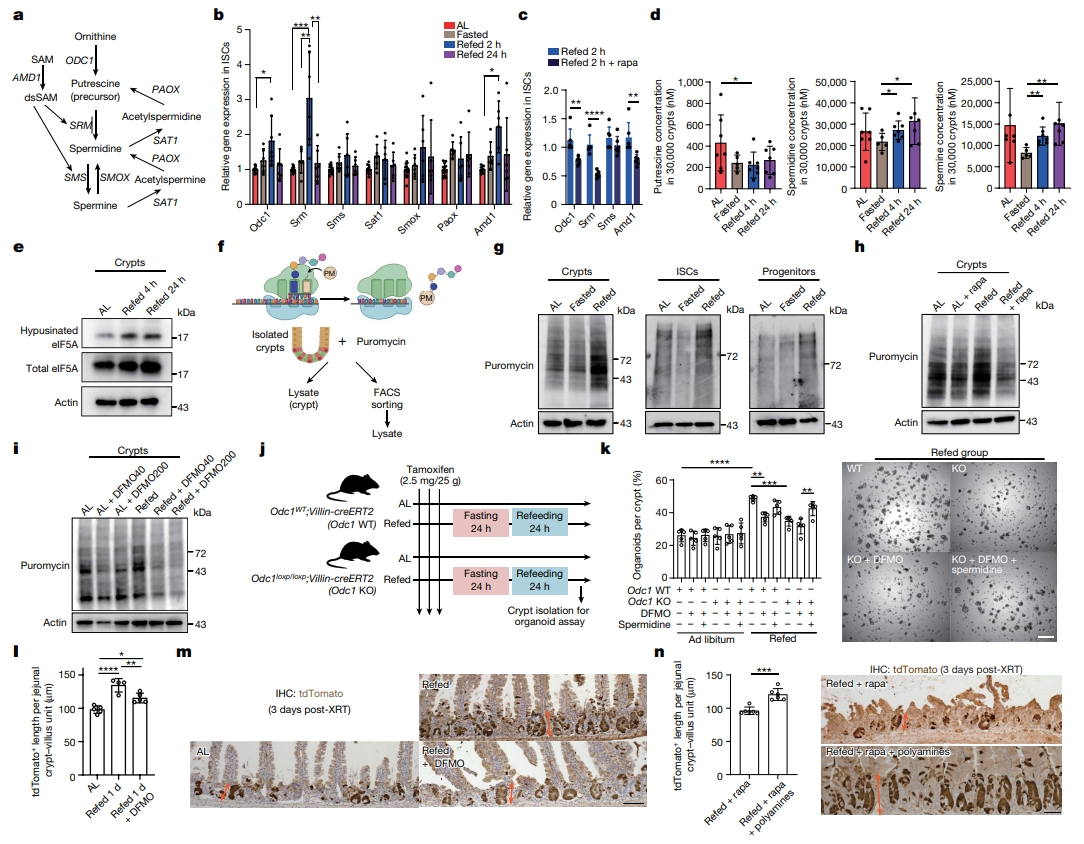
图四 禁食后再喂食可增强蛋白质合成[9]
最近的研究表明,禁食干预可以减少肠道肿瘤的发生,但目前尚不清楚在禁食和重新喂食周期里发生的突变会如何影响肿瘤发生。考虑到蛋白质合成在控制干细胞再生和肿瘤发生方面的作用,以及再喂食驱动ISC中mTORC1-多胺依赖性的蛋白质翻译,研究者认为禁食再喂食可能会增加这一时期发生的肠道肿瘤的形成,因此利用一种肿瘤发生的Apc模型Apcloxp/loxp;Lgr5-eGFP-IRES-CreERT2进行研究(图五a)。结果显示,再喂食1天诱导癌性突变组出现的小肠和结肠肿瘤数量更多,然而,再喂食3天诱导癌性突变组的表型与禁食组相似(图五b和c)。在类器官系统中,检测再喂食是否会增强Lgr5+ ISC细胞的致瘤潜力。在他莫昔芬给药后5天,从随意进食、禁食和再喂食小鼠中分离出相同数量的Apc-null Lgr5+ ISC,评估它们产生Apc-null腺瘤样类器官的能力(图五d)。与其他组相比,再喂食促使ISC衍生的Apc-null类器官数量增加了两倍(图五e)。使用Apcloxp/loxp;Villin-eGFP-IRES-CreERT2小鼠诱导肿瘤,在他莫昔芬处理后所有肠上皮细胞(包括ISC)中缺失Apc(图五f)。一致地,再喂食1天诱导癌性突变组显著增强了小肠和结肠肿瘤形成(图五g)。最后,在Apcloxp/loxp;Lgr5-eGFP-IRES-CreERT2小鼠的间歇性禁食后再喂食1天诱导癌性突变组同样导致了更多的肠道肿瘤(图五h和i)。以上数据表明,禁食后再喂食期间出现的癌性突变会显著增强ISC的致瘤性。
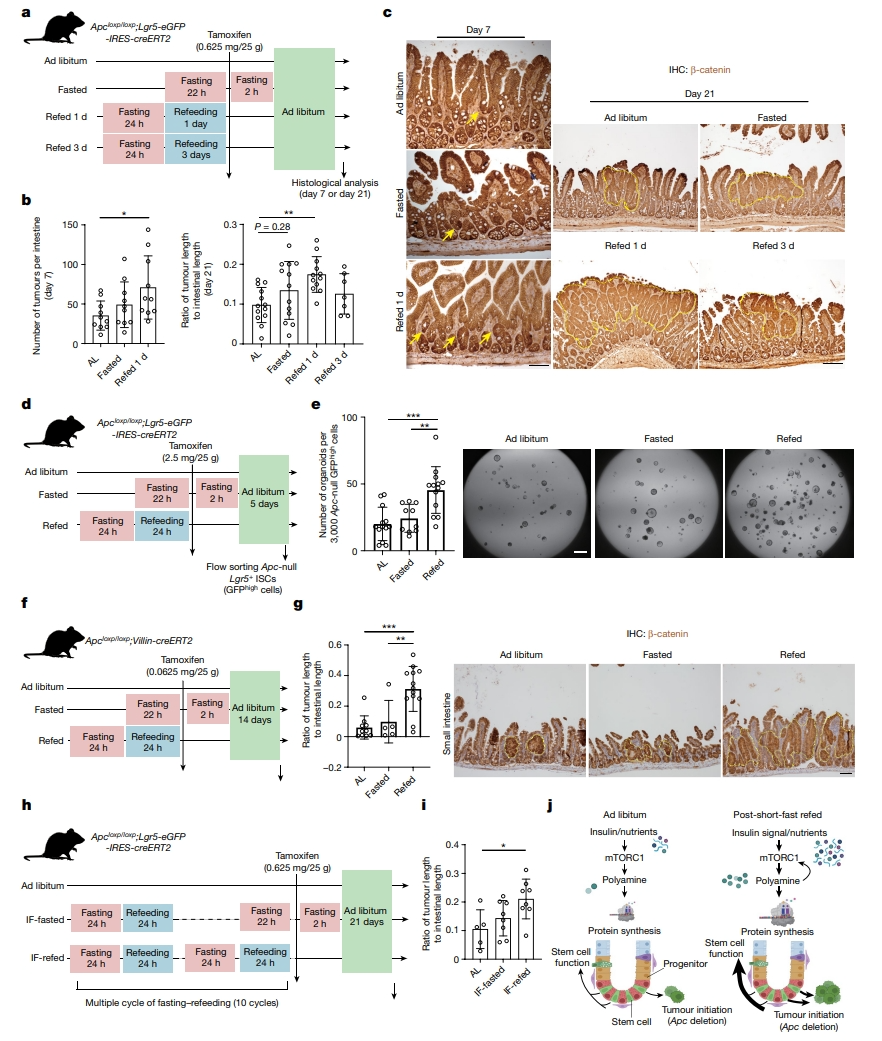
图五 禁食后再喂食增强了ISC致瘤性[9]
综上所述,该研究证明了禁食后再进食期间通过调节一种mTORC1-多胺代谢物-蛋白质翻译轴来增强ISC介导的损伤后再生和致瘤性(图五j)。尽管禁食后再进食会导致干细胞驱动的再生能力增加,但此时如果这些干细胞暴露于基因突变的环境中则会具有更高的致癌风险。该研究提示了禁食有益身体健康,在规划基于饮食的再生策略中,应仔细考虑禁食-重新进食周期,以免增加不必要的癌症风险。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Cheng CW, Yilmaz Ö H: 100 Years of Exploiting Diet and Nutrition for Tissue Regeneration. Cell stem cell 2021, 28(3):370-373.
2. Nencioni A, Caffa I, Cortellino S, Longo VD: Fasting and cancer: molecular mechanisms and clinical application. Nat Rev Cancer 2018, 18(11):707-719.
3. Cheng CW, Adams GB, Perin L, Wei M, Zhou X, Lam BS, Da Sacco S, Mirisola M, Quinn DI, Dorff TB et al: Prolonged fasting reduces IGF-1/PKA to promote hematopoietic-stem-cell-based regeneration and reverse immunosuppression. Cell stem cell 2014, 14(6):810-823.
4. Alonso S, Yilmaz Ö H: Nutritional Regulation of Intestinal Stem Cells. Annual review of nutrition 2018, 38:273-301.
5. Beumer J, Clevers H: Cell fate specification and differentiation in the adult mammalian intestine. Nature reviews Molecular cell biology 2021, 22(1):39-53.
6. Gehart H, Clevers H: Tales from the crypt: new insights into intestinal stem cells. Nature reviews Gastroenterology & hepatology 2019, 16(1):19-34.
7. Mihaylova MM, Cheng CW, Cao AQ, Tripathi S, Mana MD, Bauer-Rowe KE, Abu-Remaileh M, Clavain L, Erdemir A, Lewis CA et al: Fasting Activates Fatty Acid Oxidation to Enhance Intestinal Stem Cell Function during Homeostasis and Aging. Cell stem cell 2018, 22(5):769-778.e764.
8. Igarashi M, Guarente L: mTORC1 and SIRT1 Cooperate to Foster Expansion of Gut Adult Stem Cells during Calorie Restriction. Cell 2016, 166(2):436-450.
9. Imada S, Khawaled S, Shin H, Meckelmann SW, Whittaker CA, Corrêa RO, Alquati C, Lu Y, Tie G, Pradhan D et al: Short-term post-fast refeeding enhances intestinal stemness via polyamines. Nature 2024.
10. Liu GY, Sabatini DM: mTOR at the nexus of nutrition, growth, ageing and disease. Nature reviews Molecular cell biology 2020, 21(4):183-203.
11. Biton M, Haber AL, Rogel N, Burgin G, Beyaz S, Schnell A, Ashenberg O, Su CW, Smillie C, Shekhar K et al: T Helper Cell Cytokines Modulate Intestinal Stem Cell Renewal and Differentiation. Cell 2018, 175(5):1307-1320.e1322.
12. Park MH, Wolff EC: Hypusine, a polyamine-derived amino acid critical for eukaryotic translation. The Journal of biological chemistry 2018, 293(48):18710-18718.



