技术分享:N-乙酰牛磺酸水解酶PTER缺失可减少饮食摄入和肥胖
牛磺酸是一种半必需微量营养素,也是一种含量丰富的氨基磺酸,广泛存在于哺乳动物组织如心脏、眼睛、大脑和肌肉,以及许多食物中[1]。牛磺酸在细胞和生理功能方面具有多效性,牛磺酸水平的遗传性降低会导致肌肉萎缩、运动能力下降和多种组织中的线粒体功能障碍[2]。相反,补充牛磺酸可以减少线粒体氧化还原应激,提高运动表现,以及控制体重[3]。
牛磺酸代谢的生物化学和酶学已经引起了广泛的研究兴趣。在内源性牛磺酸代谢途径中,多种代谢酶参与从半胱氨酸合成牛磺酸和次级牛磺酸代谢物的下游代谢[4]。牛磺酸本身的下游是一些次级牛磺酸代谢物,包括牛磺胆酸盐、牛磺胞胺和N-乙酰牛磺酸。其中,N-乙酰牛磺酸在生物体液中的水平受到各种生理扰动的动态调节,如耐力运动、膳食补充牛磺酸和饮酒的扰动会增加牛磺酸和/或醋酸盐的通量[5]。此外,N-乙酰牛磺酸与某些信号分子如神经递质乙酰胆碱在化学结构上具有相似性,表明它也可能作为一种信号代谢产物发挥作用。然而,N-乙酰牛磺酸的生物合成、代谢和潜在功能仍然未知。
2024年8月,Nature期刊在线报道了一种生理性N-乙酰牛磺酸水解酶,孤儿酶磷酸三酯酶相关蛋白(PTER)。PTER可在体外催化N-乙酰牛磺酸水解为牛磺酸和醋酸盐,并在小鼠肾脏、肝脏和脑干中表达。小鼠Pter基因敲除造成组织的N-乙酰牛磺酸水解活性完全丧失,导致N-乙酰牛磺酸水平的系统性升高。在增加牛磺酸刺激后,Pter基因敲除小鼠表现出食物摄入量减少,以及对饮食诱导的肥胖具有抵抗力,葡萄糖稳态得到改善。给肥胖野生型小鼠注射N-乙酰牛磺酸也能以GFRAL依赖的方式减少食物摄入量和体重。该研究首次将PTER置于次级牛磺酸代谢的核心酶节点位置,揭示其与N-乙酰牛磺酸在体重控制和能量平衡中的作用[6]。
首先,研究者鉴定调节N-乙酰牛磺酸的酶,使用体外酶活测定的方法检测小鼠组织中的水解活性产物(图一a)。将小鼠总组织匀浆与100 µM N-乙酰牛磺酸37°C孵育1小时后,采用液相色谱-质谱(LC-MS)检测反应产物。发现在肾脏中观察到很强的组织水解活性,肝脏次之,其他组织中则很少(图一b)。将肾组织离心发现,这种水解活性在细胞质中富集(图一c)。接着,用阴离子交换色谱法对总肾细胞质组分进行分级,结果显示酶活性在组分15-20中达到峰值(图一d);收集活性峰值的部分(包括17-19)进行尺寸排除色谱,同样观察到一个单一的活性峰,集中在组分20附近(图一e)。进一步采用鸟枪法分析组分20,排名靠前的酶有酯酶EST2C、肽酶/合成酶CNDP2和磷酸三酯酶相关蛋白PTER(图一f)。其中,PTER推测是一种金属依赖性水解酶,其酶活性或功能未知。于是,研究者将编码这三种酶的cDNA转染到HEK293T细胞中,发现仅有转染PTER的细胞裂解物显示出较强的N-乙酰牛磺酸水解活性(图一g)。并且,PTER敲除的HEK293T细胞裂解物的水解活性完全丧失(图一h)。以上数据表明,PTER是HEK293T细胞内源性N-乙酰牛磺酸水解活性所必需的,在牛磺酸代谢的内源性生化通路中新增了PTER这一N-乙酰牛磺酸水解酶(图一i)。
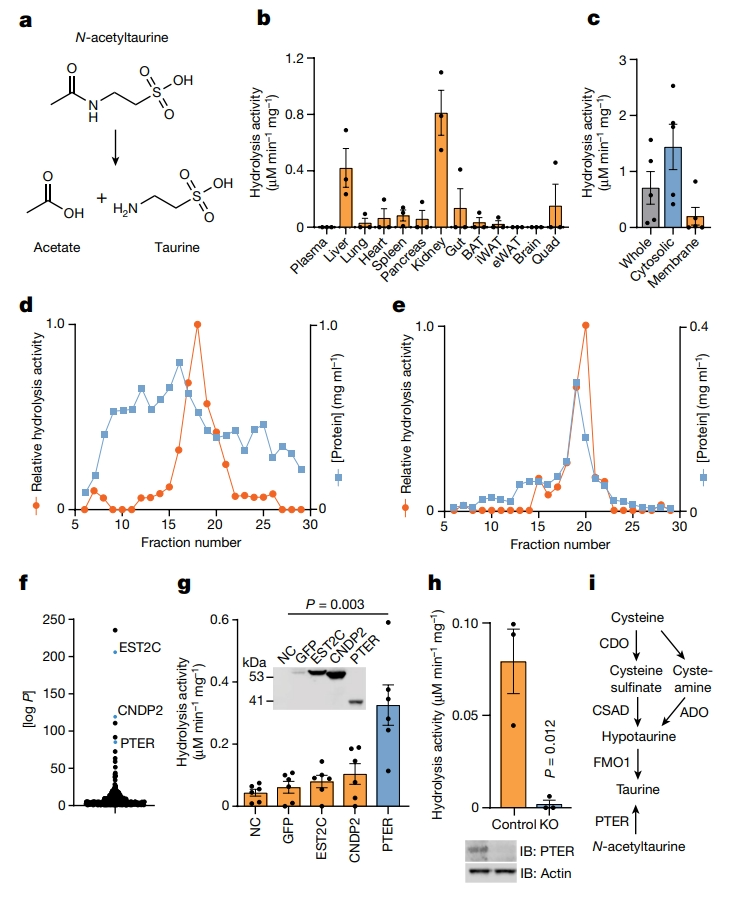
图一 新鉴定出PTER为N-乙酰牛磺酸水解酶[6]
接着,研究者体外检测PTER的酶学。在细菌中异源表达纯化小鼠PTER蛋白,并使用N-乙酰牛磺酸作为底物测定酶活。重组PTER表现出以下特性:Kcat=2600 s-1,Km=430 µM和Vmax=3.7 nM min-1 mg-1(图二a)。重组PTER与潜在底物孵育,当使用N-乙酰牛磺酸时,PTER最为活跃(图二b)。为确定PTER酶的活性位点残基,将N-乙酰牛磺酸对接到AlphaFold模型化PTER中,模拟出与N-乙酰牛磺酸具有潜在相互作用的残基(如H300、R233和R204),以及与金属阳离子(如H26、H28和E169)和邻近底物的其他活性位点残基(如Y263、Y65和T258)(图二c)。进一步制备15种单点突变的PTER蛋白,发现除R233A外,这些点突变体的表达与野生型(WT)PTER的表达相当,然而多数单点突变完全消除了PTER的酶活性(图二d)。以上数据体外证明了PTER是一种N-乙酰牛磺酸特异性水解酶。
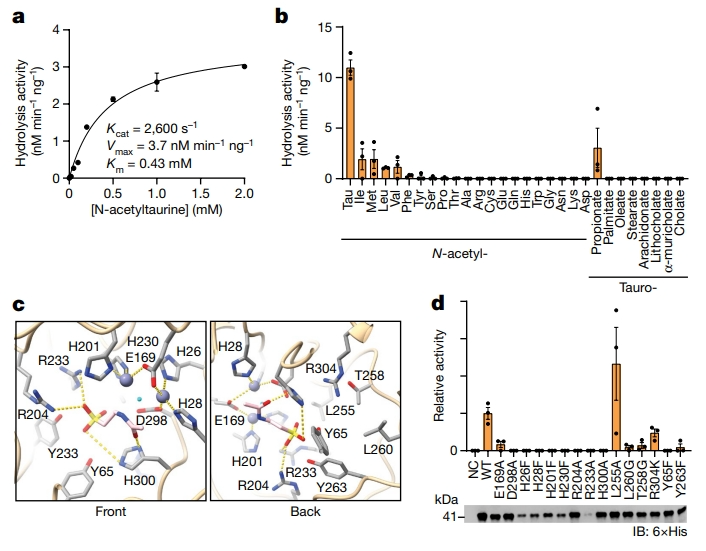
图二 小鼠PTER重组蛋白的体外酶学鉴定[6]
下一步,研究者探索PTER的体内潜在生理作用。构建了Pter敲除(KO)小鼠,发现Pter KO小鼠的出生符合孟德尔比率,且在笼中的行为表现正常。使用PTER抗体,在WT小鼠的肾脏和肝脏组织中检测到最高的PTER蛋白表达水平(图三a),这与最初在相同组织中检测到的N-乙酰牛磺酸水解活性相对应(图一b)。且在Pter KO小鼠中观察到PTER蛋白的完全缺失和N-乙酰牛磺酸水解活性的丧失(图三a和b)。为确定遗传性Pter缺失是否改变内源性N-乙酰牛磺酸水平,研究者开发了一种针对这种代谢物的靶向LC-MS方法。观察到Pter KO小鼠组织的N-乙酰牛磺酸水平升高,变化幅度从两倍(脾脏)到十倍(血液)不等(图三c)。使用靶向LC-MS检测WT小鼠和Pter KO小鼠组织中牛磺酸和几种牛磺酸途径代谢物的组织水平。在所检查的任何组织中,牛磺酸本身的水平没有表现出任何显著的基因型依赖性变化(图三d)。在Pter KO小鼠的附睾白色脂肪组织中,亚牛磺酸增加,但在任何其他组织中都没有增加。相反,半胱氨酸亚磺酸在心脏和棕色脂肪中减少,但在其他组织中没有(图三d)。由于PTER在体外对另外四种N-乙酰氨基酸(N-乙酰亮氨酸、异亮氨酸、蛋氨酸和缬氨酸)也表现出适度的水解活性,研究者使用靶向代谢组学来测量WT小鼠和Pter KO小鼠中这些N-乙酰化氨基酸的水平。结果发现,除了脾脏中N-乙酰蛋氨酸的少量减少外,Pter KO小鼠组织中其他N-乙酰化氨基酸水平没有明显变化(图三d)。以上数据表明,PTER是一种体内生理性N-乙酰牛磺酸水解酶,遗传性Pter缺失导致所有组织中N-乙酰牛磺酸水平的广泛变化。
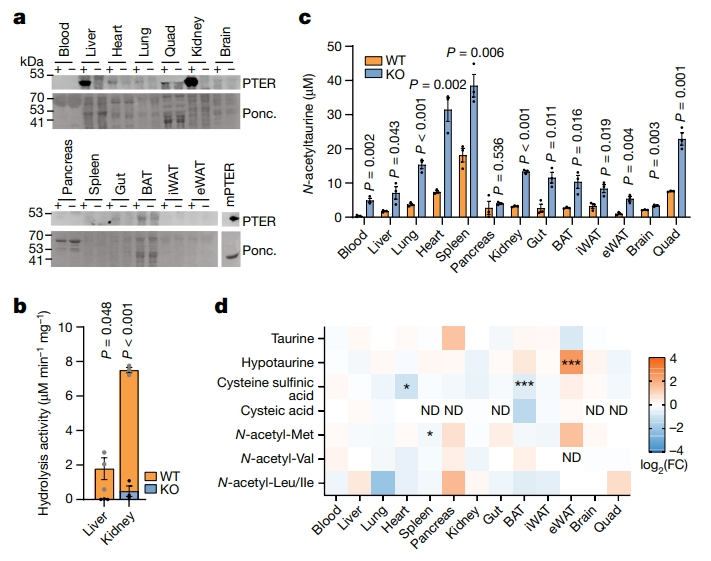
图三 Pter KO小鼠的生化表征[6]
接下来,研究者探究PTER作为N-乙酰牛磺酸水解酶这一生化途径的潜在功能。先前的研究发现人类PTER基因附近的多态性与欧洲个体的成人肥胖有关[7],提示PTER通路可能参与体重调节。为了验证这一推测,研究者首先将一组雄性Pter KO和WT同窝小鼠进行高脂饮食,8周后,Pter KO小鼠的食物摄入量减少了约7%,但体重没有差异。因为牛磺酸是PTER催化反应的产物,研究者推断,在牛磺酸通量增加的条件下,Pter KO小鼠的表型可能更加明显。于是,将另一组WT小鼠和Pter KO小鼠喂食高脂饮食,并在饮用水中补充牛磺酸(2.5% w/v)。8周后,与WT同窝小鼠相比,Pter KO小鼠的体重降低,体重增加减少,累积食物摄入量减少(图四a-c),且两组小鼠摄水量相等(图四d)。Pter KO小鼠表现出更好的糖耐量和胰岛素敏感性(图四e和f)。组织切片显示,体重差异完全是由Pter KO小鼠的脂肪量减少造成的(图四g和h)。MS分析证实,牛磺酸补充方案在WT小鼠和Pter KO小鼠中均同等提高了循环牛磺酸水平(图四i),饮用水中补充牛磺酸导致Pter KO小鼠血浆N-乙酰牛磺酸过度累积(图四j)。使用代谢笼测量了一组新的Pter KO和WT小鼠的全身能量摄入和消耗参数,这些小鼠在体重出现差异之前的4周这个时间点喂食补充牛磺酸的水。结果发现,Pter KO小鼠的食物摄入量减少,但没有观察到任何其他测量参数的变化,包括VO2、VCO2、呼吸交换比或动态运动(图四k)。以上数据表明,在同时进行的高脂饮食和补充牛磺酸的条件下,Pter KO小鼠以刺激依赖的方式减少了肥胖、体重和食物摄入量。
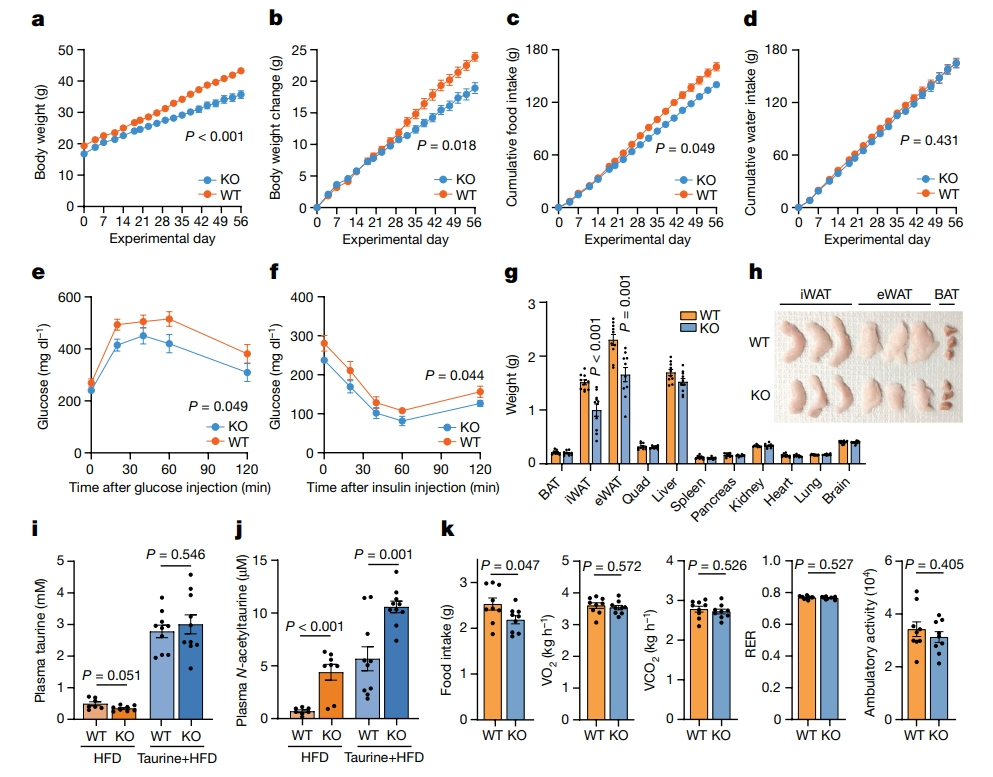
图四 Pter KO小鼠的代谢表型[6]
由于N-乙酰牛磺酸的积累是WT小鼠和Pter KO小鼠之间的主要代谢产物差异,研究者试图确定单独补充N-乙酰牛磺酸能否再现Pter KO小鼠的代谢表型。给饮食诱导的肥胖(DIO)小鼠腹腔注射(i.p.)N-乙酰牛磺酸(每天1-50 mg/kg),发现其体重和食物摄入量均表现出剂量依赖性的降低(图五a和b)。为确定N-乙酰牛磺酸的作用是否需要完整的酰胺化结合物,研究者与单独的醋酸盐或牛磺酸相同剂量(每天15 mg/kg)进行了直接比较。N-乙酰牛磺酸处理的小鼠表现出食物摄入量和体重减少,而单独用醋酸盐或单独用牛磺酸处理的小鼠与对照处理的小鼠没有区别(图五c和d)。研究者还使用PTER抗体检测不同脑区PTER的表达。发现可在脑干中检测到PTER,但在下丘脑或大脑皮层中未检测到(图五e)。另外,也检测到脑干中PTER依赖性水解活性和N-乙酰牛磺酸的积累(图五f和g)。尽管N-乙酰牛磺酸在所有检测的大脑区域都有所增加,但在脑干中观察到最大的倍数变化(图五g)。由于脑干限制性GDF15-GFRAL信号通路对饮食控制的作用,研究者测试N-乙酰牛磺酸的厌食性和抗肥胖作用是否需要一个完整的GFRAL受体。研究者获得了一个GFRAL中和抗体(IgG克隆8A2)和IgG对照抗体,发现GFRAL中和抗体可消除重组GDF15的厌食作用(图五h)。当N-乙酰牛磺酸与IgG对照抗体联合使用时,N-乙酰牛磺酸降低了体重和食物摄入量,相比之下,联合使用GFRAL中和抗体的情况下,N-乙酰牛磺酸并没有显著降低体重或食物摄入量(图五i和j)。以上数据表明,PTER在脑干中表达,且N-乙酰牛磺酸介导的饮食控制和抗肥胖作用需要功能性的GFRAL受体。
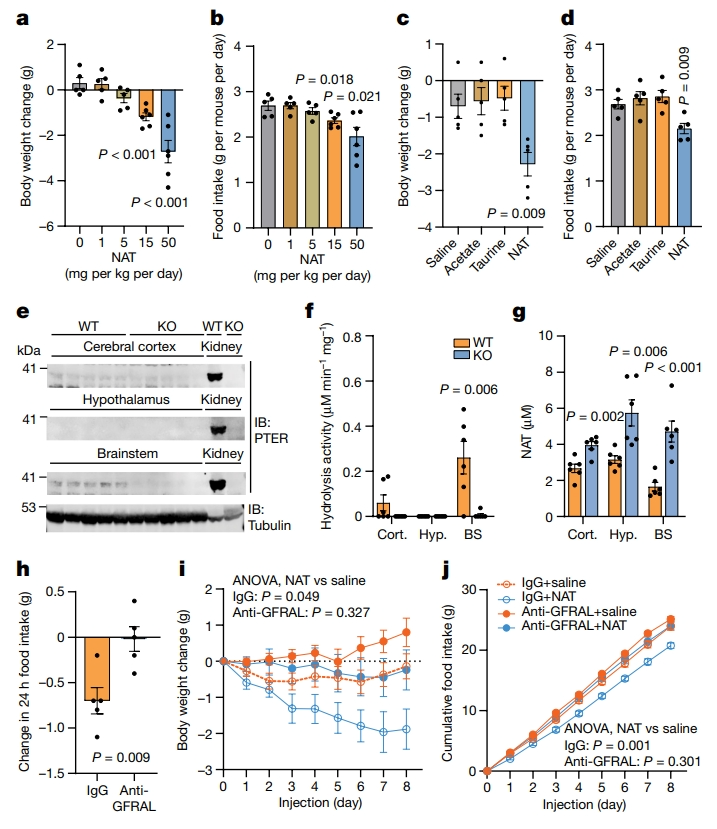
图五 N-乙酰牛磺酸给药对小鼠的影响[6]
综上所述,该研究鉴定出一种先前功能未知的孤儿酶PTER,它是哺乳动物主要的N-乙酰牛磺酸水解酶。PTER可催化N-乙酰牛磺酸水解为牛磺酸和醋酸盐,这一反应将PTER置于次级牛磺酸代谢中的核心酶节点。利用人类PTER位点与体重指数(BMI)相关的遗传线索,证实了在牛磺酸刺激的高脂饮食条件下,Pter遗传性缺失或N-乙酰牛磺酸的药理学给药会导致小鼠食物摄入量减少、脂肪减少和体重下降,并且N-乙酰牛磺酸的食量控制和抗肥胖作用需要功能性的GFRAL受体。该研究新定义了与能量平衡相关的牛磺酸代谢的PTER依赖途径,提示PTER是个潜在新靶点,未来PTER抑制剂的开发可能有望用于治疗肥胖。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Ripps H, Shen W: Review: taurine: a "very essential" amino acid. Molecular vision 2012, 18:2673-2686.
2. Ito T, Kimura Y, Uozumi Y, Takai M, Muraoka S, Matsuda T, Ueki K, Yoshiyama M, Ikawa M, Okabe M et al: Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy. J Mol Cell Cardiol 2008, 44(5):927-937.
3. Waldron M, Patterson SD, Tallent J, Jeffries O: The Effects of an Oral Taurine Dose and Supplementation Period on Endurance Exercise Performance in Humans: A Meta-Analysis. Sports medicine (Auckland, NZ) 2018, 48(5):1247-1253.
4. Jacobsen JG, Smith LH: Biochemistry and physiology of taurine and taurine derivatives. Physiol Rev 1968, 48(2):424-511.
5. Shi X, Yao D, Chen C: Identification of N-acetyltaurine as a novel metabolite of ethanol through metabolomics-guided biochemical analysis. J Biol Chem 2012, 287(9):6336-6349.
6. Wei W, Lyu X, Markhard AL, Fu S, Mardjuki RE, Cavanagh PE, Zeng X, Rajniak J, Lu N, Xiao S et al: PTER is a N-acetyltaurine hydrolase that regulates feeding and obesity. Nature 2024.
7. Meyre D, Delplanque J, Chèvre JC, Lecoeur C, Lobbens S, Gallina S, Durand E, Vatin V, Degraeve F, Proença C et al: Genome-wide association study for early-onset and morbid adult obesity identifies three new risk loci in European populations. Nat Genet 2009, 41(2):157-159.



