技术分享:断裂型内含肽介导的大型抗肌萎缩蛋白表达
杜氏肌营养不良症(DMD)是由编码抗肌萎缩蛋白基因DMD的功能缺失突变引起的,是最常见的人类遗传性疾病之一,呈X连锁隐性遗传[1]。在肌肉中,抗肌萎缩蛋白在保护细胞免受机械应力方面发挥关键作用,还为各种蛋白质提供支架来调节多种细胞内信号通路[2]。DMD还没有治愈的方法,现有的治疗方法和药物只能减缓病情。尽管已经开发了利用腺相关病毒(AAV)载体递送“微型抗肌萎缩蛋白”(µDys)的DMD基因治疗方法,但这些微型蛋白仅占全长抗肌萎缩蛋白的33%,且缺乏关键功能域,在动物模型和疾病患者中表现出不完全的表型挽救[3]。也有科学家测试了通过同时递送两种或三种AAV来产生更大的抗肌萎缩蛋白[4],如利用同源重组或DNA反式剪接,将单个AAV携带的部分抗肌萎缩蛋白序列在肌肉内重新组装,以编码更大的蛋白质。然而,这些基于DNA的方法显示出效率降低,并且依赖于载体基因组在特定方向上的连接。此外,还可能形成载体连环化产生不需要的产物,使得临床上的使用复杂化。另有一种可选择的方法是依赖内含肽,其可催化蛋白质剪接,通过自我剪切的方式从前体蛋白中释放出来,与此同时将两端的外显肽以肽键的方式相连。内含肽通常以连续的形式存在,但某些内含肽以断裂的形式存在。断裂型内含肽的中间区域在特定位点断开, 形成N端片段和C端片段,分别位于基因组上相距较远的2个基因上。在前体蛋白翻译成熟过程中, 这2个片段相互识别并恢复核酸内切酶活性, 介导蛋白质反式剪接(PTS),其中侧翼的N和C末端外显肽自发连接成一种功能蛋白,同时去除重组的内含肽[5]。这种遗传元件已成功应用于许多生物应用场景中,包括蛋白质纯化,以及最近在涉及大基因的视网膜或肝脏疾病中的基因置换[6, 7]。
2024年7月,Nature在线发表了一篇文章,利用断裂型内含肽(split intein)介导的蛋白反式剪接机制(PTS)成功表达了大型抗肌萎缩蛋白(dystrophin),实现了更优的临床前DMD基因治疗效果[8]。研究者测试了多个断裂型内含肽对,可以有效地连接抗肌萎缩蛋白的两个或三个片段,从而表达中等大小的功能性抗肌萎缩蛋白(midi-dys)或全长抗肌萎缩蛋白(full-Dys)。利用AAV进行递送,可强健表达midi-dys和full-Dys,并显著性改善mdx小鼠的疾病表型。此外,使用低剂量的强效嗜肌性AAVMYO4载体进行递送,足以在全身横纹肌中表达大型抗肌萎缩蛋白,并在mdx小鼠中显著逆转生理缺陷,相比“微型抗肌萎缩蛋白”(µDys)具有明显的功能优势。该疗法可能在未来使得许多DMD患者受益,还能拓展到由大基因突变导致的其他疾病的治疗[8]。
首先,研究者比较了不同断裂型内含肽的功效。构建了一个包含23个短且剪接速度超快的断裂型内含肽库,同时开发一种分割绿色荧光蛋白(GFP)系统来进行筛选。经过三轮筛选,最终选定三种断裂型内含肽gp41.1、IMPDH和Nrdj1,它们长度短且具有高 PTS活性,且在连接的蛋白质中留下最少的肽键。研究者先利用两个AAV载体测试断裂型内含肽gp41.1的效果。其中一个AAV载体携带抗肌萎缩蛋白Isoform Dp427的 5′端,编码从N末端结构域到类血影蛋白重复序列(SR)19末端的序列,但缺少SR 5-15。另一个AAV携带Dp427的 3′端,编码从铰链3到C末端结构域的序列。这两个片段可通过gp41.1介导的PTS融合,产生一个中等大小的midi-Dys(∆SR5-15),含有68%的全长蛋白序列(图一a)。对肽序列分析表明,SR19和铰链3之间存在四个分裂位点,GpS1、GpS2、GpS3和GpS4。为了测试这些选择,用表达整个midi-Dys(∆SR5-15)的对照质粒或编码N或C末端的双质粒转染HEK293细胞。蛋白质印迹(WB)分析显示,对应于重组的midi-Dys,在291 kDa左右出现了一条强带,并且使用分裂位点GpS2和GpS4时检测到更高的表达(图一b),对应的蛋白分别称为midi-Dys1和midi-Dys2,表明gp41.1可以有效地连接midi-Dys(∆SR5-15)的两个片段。随后,研究者测试使用两个断裂型内含肽连接三个片段来表达全长抗肌萎缩蛋白的可能性(图一c)。将全长抗肌萎缩蛋白分成N末端、中间片段和C末端片段。由于gp41.1显示出SR19与铰链3的有效连接,因此将其保持在该位置以连接中间片段到C末端片段,进而测试连接N末端到中间片段的IMPDH(Full-Dys1)和Nrdj1(Full-Dys2)效果。WB分析表明这两种组合都能诱导出约427 kDa全长蛋白的高表达,比对照全长质粒高出2-4倍(图一c)。这些数据表明,通过两个高效断裂型内含肽介导的PTS可以从三个质粒中稳健重组出全长的抗肌萎缩蛋白。
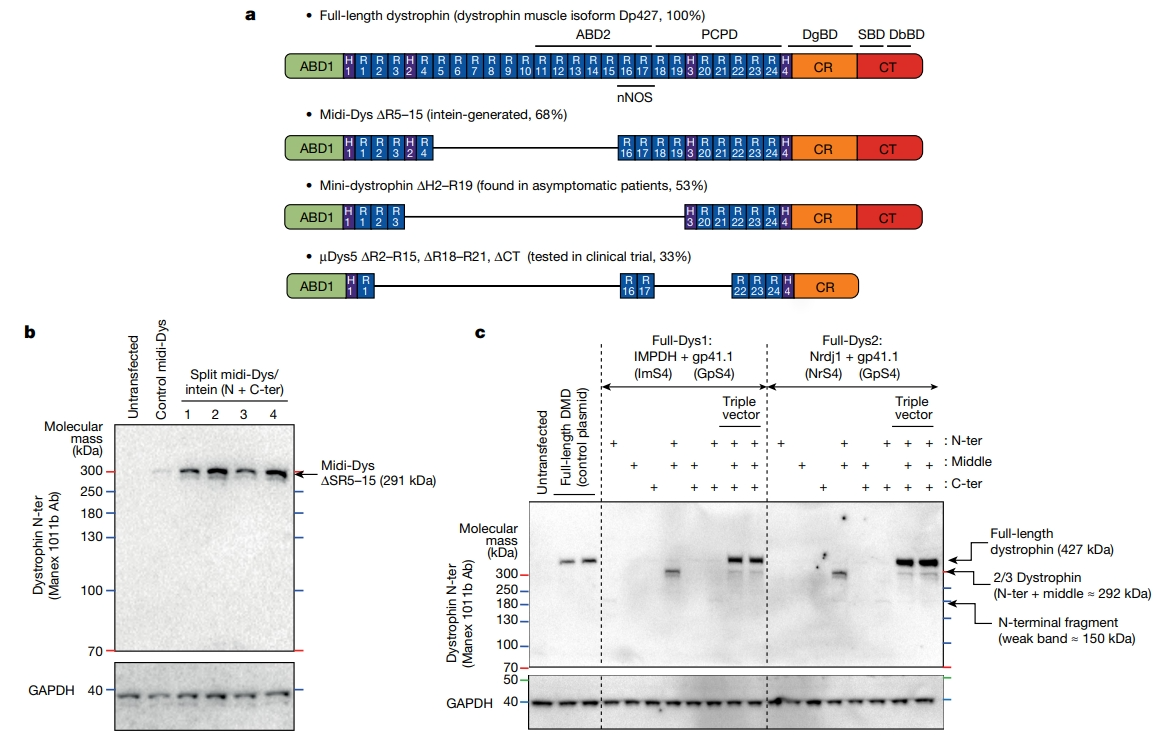
图一 体外表达抗肌萎缩蛋白的断裂型内含肽测试[8]
接下来,研究者在体内验证双载体系统的midi-Dys表达。将两种组合的抗肌萎缩蛋白/内含肽分别克隆到肌肉特异性增强子/启动子CK8e的下游,并包装到AAV6 [9],注射到3周龄抗肌萎缩蛋白缺失mdx4cv雄鼠的胫骨前肌(TA)中,注射后5周取肌肉进行分析。C端抗体的WB结果显示,双AAV注射后均检测到midi-Dys1和midi-Dys2的291 kDa条带(图二a和b)。150 kDa条带指示了未剪接的C末端片段,占检测到产物的50-70%(图二a和c)。midi-Dys2的表达量显著高于midi-Dys1(图二b),表明当gp41.1插入在分裂位点GpS4时,蛋白质片段的稳定性更高。分别使用N端或C端抗体对肌肉切片进行免疫标记,显示出midi-Dys在肌膜上的共定位(图二d)。进而测试三载体系统,发现注射Full-Dys2的三个AAV组合显示出全长抗肌萎缩蛋白的高表达,水平约为WT内源性抗肌萎缩蛋白的九倍(图二e和f)。另外,均检测到150 kDa左右的条带,表明Full-Dys1和Full-Dys2分别有67%和33%的未融合的C末端片段,还有约260 kDa和280 kDa的两条中等大小的条带(图二e和g)。使用N端、中间或C端抗体对肌肉切片进行免疫标记,结果显示这三部分蛋白片段在肌纤维外周的共定位(图二h)。肌肉形态的分析显示,注射双载体/三载体抗肌萎缩蛋白片段,显著改善了其形态计量学,中心有核肌纤维显著减少(图二h)。以上数据表明,优化的断裂型内含肽通过连接两个或三个由AAV递送的片段,可以在体内高表达功能性midi-Dys(∆SR5-15)或全长抗肌萎缩蛋白。
使用上述方法需要在不影响安全性的条件下考虑注射AAV剂量,肌肉骨骼疾病临床试验中注射最大剂量约为2-3×1014 vg/kg(AAV血清型9或rh74)[10]。为了测试使用全身递送断裂型内含肽方法的可行性,研究者使用静脉注射的方法,将总剂量为2×1014 vg/kg的AAV6双载体或三载体注射到8周龄mdx4cv雄鼠体内,另外注射表达µDys5的AAV单载体作为对照组。注射后3个月,发现TA中midi-Dys2的抗肌萎缩蛋白表达为WT水平的75%,Full-Dys2约为31%,而µDys5约为8%(图二i)。这些蛋白质在心肌中更为丰富,Full-Dys2约为62%,midi-Dys2约178%,µDys5约66%(图二j)。TA和心肌切片的免疫标记也证实了抗肌萎缩蛋白的表达增加(图二k)。但相比较来说,在Full-Dys2或midi-Dys2组中,约40%的TA肌纤维对抗肌萎缩蛋白染色呈阳性,而µDys5组只有约5%呈阳性。以上数据表明,全身递送两个或三个AAV载体可以通过断裂型内含肽来介导大型抗肌萎缩蛋白的强表达。
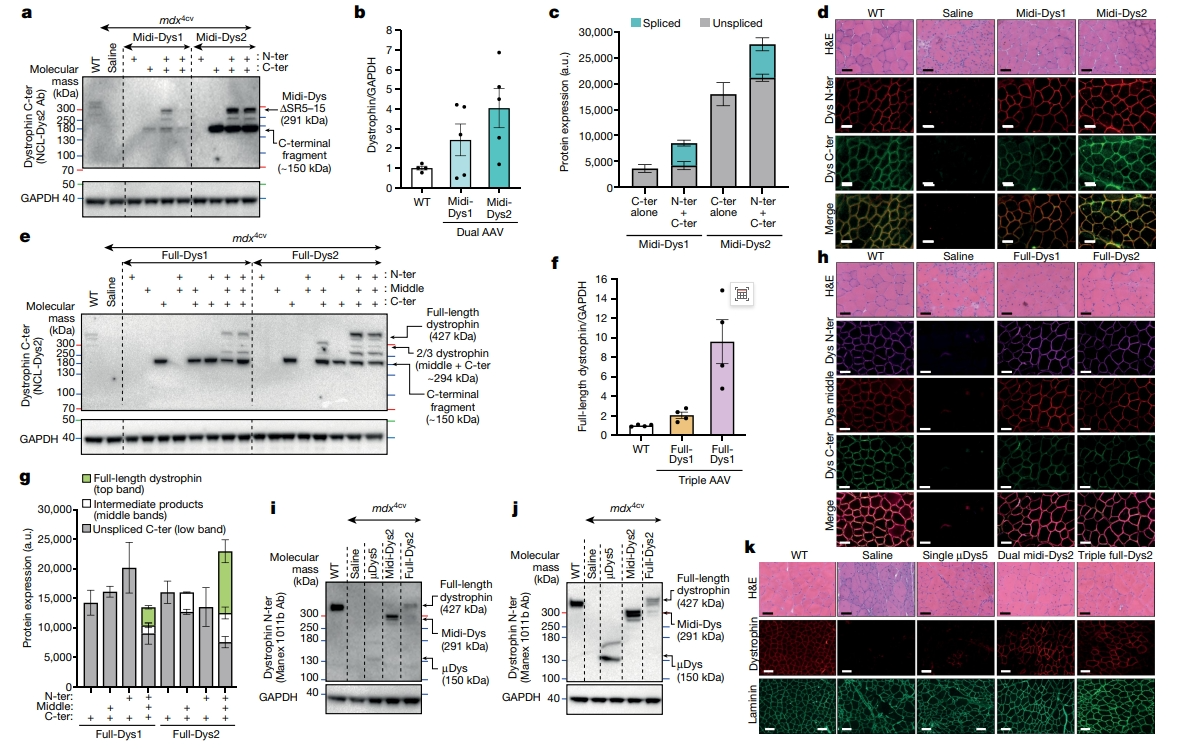
图二 断裂型内含肽介导的抗肌萎缩蛋白体内表达验证[8]
在成年小鼠TA横截面中,抗肌萎缩蛋白是镶嵌表达的[9],以2×1014 vg/kg的注射剂量全身递送AAV6可能不足以确保成年小鼠中抗肌萎缩蛋白的表达达到治疗水平。于是,研究者测试使用了一种新的表达载体嗜肌AAVMYO [9]。以AAV9-µDys5表达载体(低剂量2×1013 vg/kg)作为对照组,AAVMYO-µDys5和AAVMYO-Midi-Dys2作为实验组,并设置低剂量组(2×1013 vg/kg)和高剂量组(2×1014 vg/kg)。通过尾静脉注射到8周龄mdx4cv雄鼠体内,注射3个月后,对TA肌肉力量进行分析。结果显示,低剂量AAV9-µDys5对照组并没有起到显著的治疗效果(图三a)。与生理盐水注射组相比,低剂量AAVMYO-µDys5治疗组TA肌肉力量显著增加(图三a),但在拉长肌纤维长度后肌肉的收缩力量并没有显著改善,表明µDys5治疗组对肌纤维收缩诱导的肌肉损伤均未显示出良好的保护作用(图三b)。低剂量AAVMYO-Midi-Dys2治疗组的TA肌肉力量已然恢复至接近WT水平(图三a),并且对肌纤维收缩诱导的肌肉损伤显示出良好的保护作用(图三b)。高剂量AAVMYO-µDys5和高剂量AAVMYO-Midi-Dys2治疗组的TA肌肉力量也都恢复至接近WT水平(图三a)。此外,血清肌酸激酶(CK)水平分析显示,与生理盐水组相比,低剂量治疗组均未表现出显著的治疗效果,而高剂量AAVMYO治疗组都显著降低了CK水平(图三c)。以上表型实验结果均与µDys5和midi-Dys2表达水平相关,低剂量AAV9-µDys5治疗组中未检测到抗肌萎缩蛋白的表达,AAVMYO治疗组显示µDys5和midi-Dys2的强表达,而高剂量AAVMYO组的抗肌萎缩蛋白的表达显著升高(图三d)。以上实验结果表明,AAVMYO表达载体在递送µDys5或midi-Dys2方面具有显著的优越性。
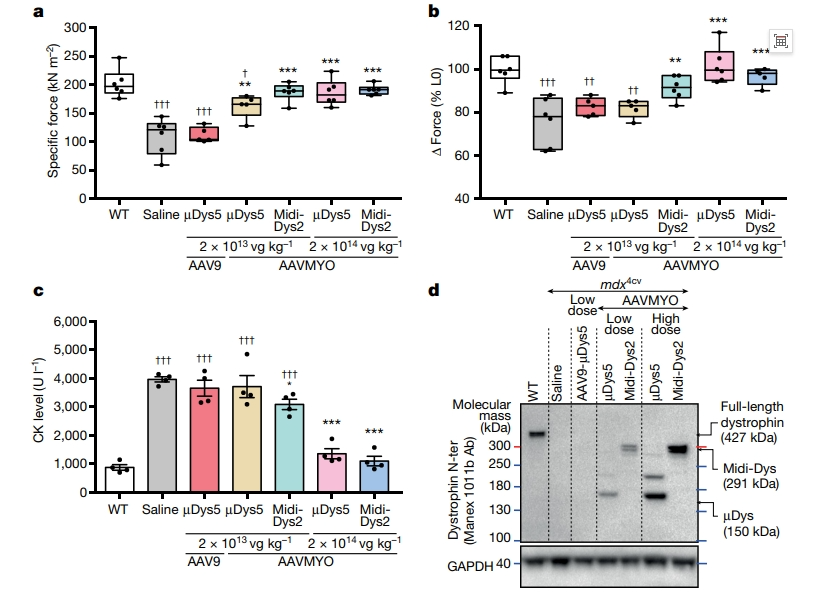
图三 AAVMYO载体的体内递送表达验证[8]
mdx小鼠在年轻时仅会出现轻度的肌萎缩表型[11],然而,随着年龄的增长,表型逐渐恶化,会导致严重的膈肌功能障碍、心肌病和更大的骨骼肌损伤,并伴有明显的纤维化表型[12, 13]。为了验证断裂型内含肽连接蛋白的方法是否可以保护以及逆转这些缺陷,研究者使用AAV9或AAVMYO递送表达µDys5或midi-Dys2(低剂量2×1013 vg/kg)对17月龄的mdx4cv雄鼠进行7个月的治疗。结果发现,AAVMYO-µDys5和AAVMYO-Midi-Dys2治疗组的TA、腓肠肌和比目鱼肌中抗肌萎缩蛋白高表达,观察到约60%的抗肌萎缩蛋白阳性肌纤维,相比之下,AAV9-µDys5治疗组表达较弱(图四a和b)。肌肉组织学分析显示,AAV9-µDys治疗组依旧显示出高度纤维化和浸润,而AAVMYO-µDys5治疗组的肌肉形态有显著改善,AAVMYO-Midi-Dys2治疗组的肌肉形态改善效果更加显著(图四a和c)。AAVMYO表达载体治疗组对肌肉损伤显示出良好的保护作用,TA肌肉力量也都恢复至接近WT水平(图四d和e)。以上实验结果表明,AAVMYO-Midi-Dys2对老年mdx4cv雄鼠有显著的治疗效果。
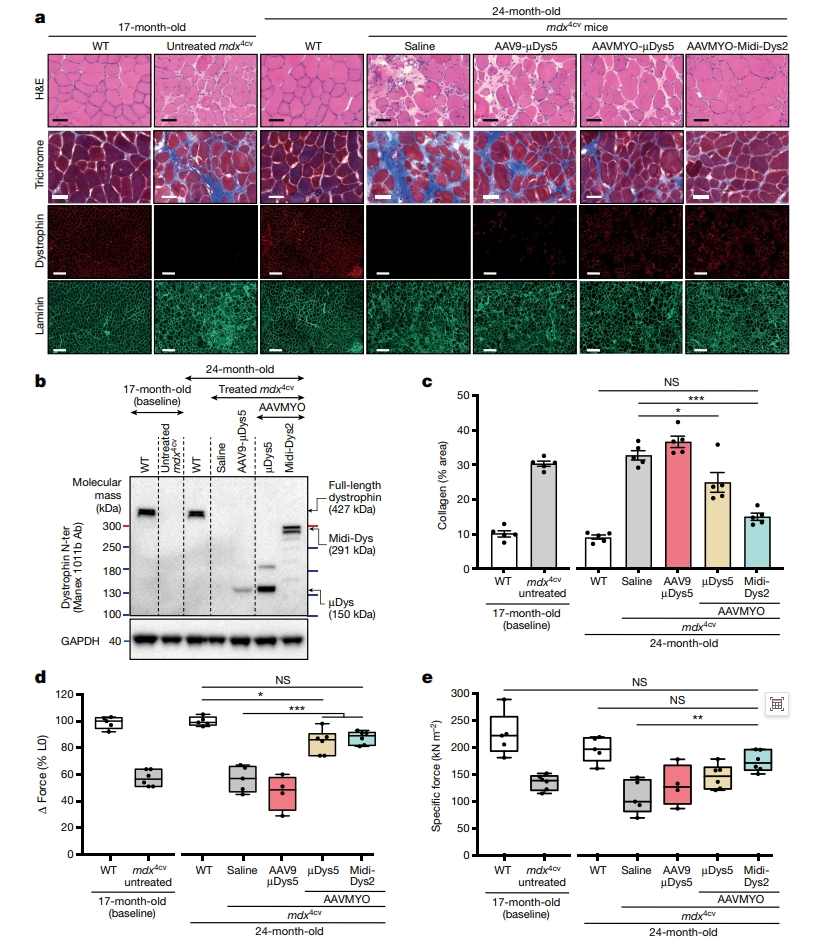
图四 Midi-Dys2在老年mdx4cv雄鼠中长期表达逆转骨骼肌缺陷[8]
最后,研究者分离心脏进行评估。发现AAVMYO-Midi-Dys2治疗的mdx4cv雄鼠心脏对过高浓度钙诱导左心室高负荷有反应,与WT心脏没有区别(图五a和b)。在AAV9和AAVMYO递送的mdx4cv心脏之间没有发现µDys5蛋白表达的差异,但观察到midi-Dys2的高表达(图五c)。这可能表明大型Dys的半衰期更长或稳定性增强。这些观察结果与使用隔膜样本的WB一致,显示midi-Dys2表达强烈,µDys5表达量略低(图五d)。取小鼠膈肌体外测试膈肌受力能力的变化,结果显示AAVMYO-Midi-Dys2治疗组膈肌受力能力显著提高(图五e)。因此,中等大小的midi-Dys表达对老年肌营养不良心脏具有明显的保护作用,随着时间的推移,治疗效果有所改善,膈肌也得到了明显的保护。事实上,mdx4cv小鼠在17个月龄和24个月龄组之间表现出明显的肌肉质量损失,肌纤维间浸润和胶原沉积明显,纤维较小(图五f),如先前研究所述[12]。相比之下,AAVMYO递送可增加抗肌萎缩蛋白表达,防止肌肉萎缩,使纤维大小和直径均匀,从而增加肌肉力量。
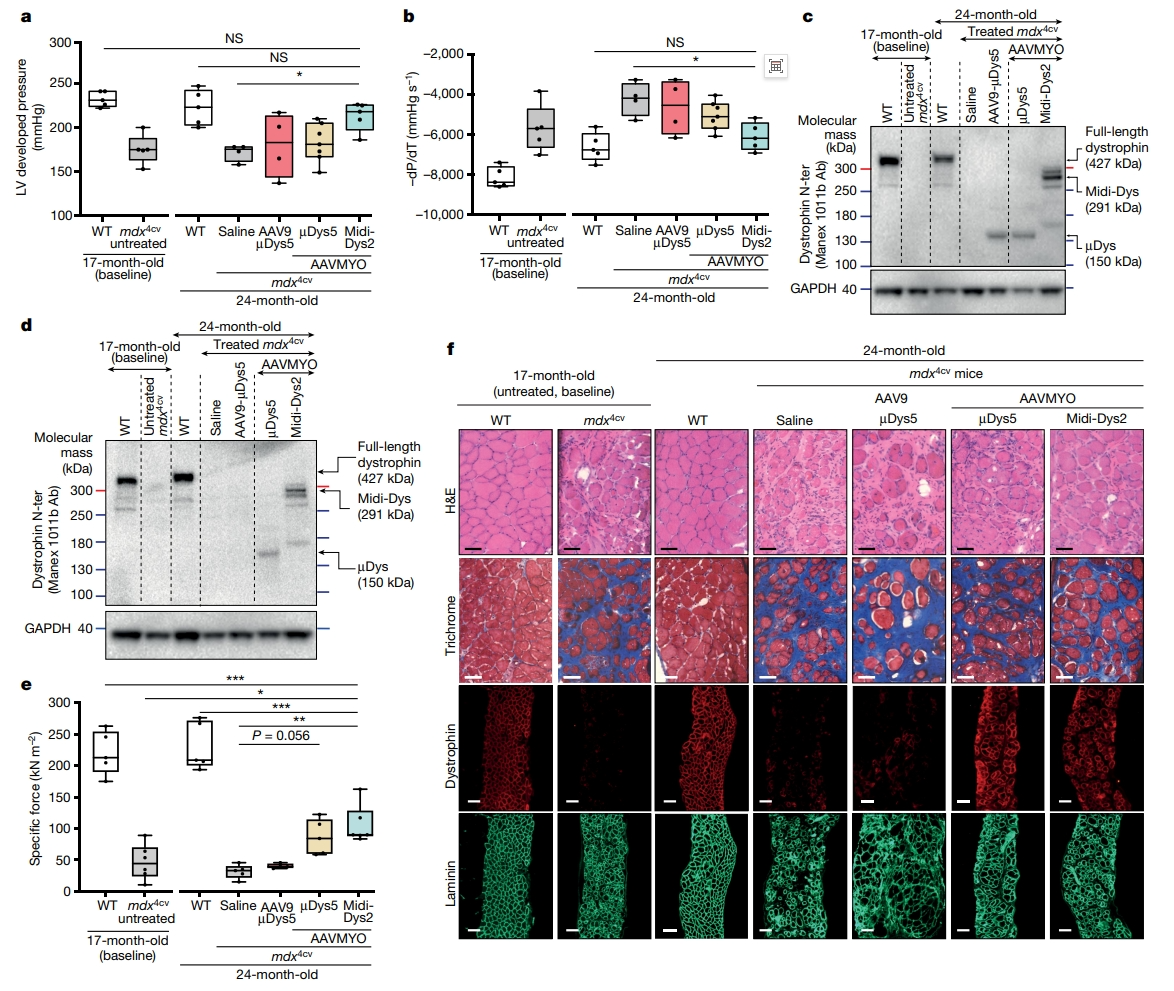
图五 AAVMYO-Midi-Dys2对老年mdx4cv雄鼠的心脏和膈肌的保护作用[8]
综上所述,研究者开发了几种高效的断裂型内含肽,可以在递送两种或三种AAV载体后重建高功能性的midi-Dys(∆SR5-15)或全长抗肌萎缩蛋白(Dp427)。使用最近发表的嗜肌性AAVMYO载体,可在肌肉中高效产生大型抗肌萎缩蛋白,其有效剂量明显低于目前临床测试的剂量,且对于年轻和年老mdx小鼠横纹肌功能缺陷的治疗效果优于当前µDys疗法。这种断裂型内含肽和嗜肌性AAVMYO载体的联合使用,有可能大大增加基因治疗对DMD以及由大基因突变引起的其他疾病的治疗效果,具有广阔的应用前景。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Monaco AP, Bertelson CJ, Middlesworth W, Colletti CA, Aldridge J, Fischbeck KH, Bartlett R, Pericak-Vance MA, Roses AD, Kunkel LM: Detection of deletions spanning the Duchenne muscular dystrophy locus using a tightly linked DNA segment. Nature 1985, 316(6031):842-845.
2. Danialou G, Comtois AS, Dudley R, Karpati G, Vincent G, Des Rosiers C, Petrof BJ: Dystrophin-deficient cardiomyocytes are abnormally vulnerable to mechanical stress-induced contractile failure and injury. Faseb J 2001, 15(9):1655-1657.
3. Bostick B, Shin JH, Yue Y, Wasala NB, Lai Y, Duan D: AAV micro-dystrophin gene therapy alleviates stress-induced cardiac death but not myocardial fibrosis in >21-m-old mdx mice, an end-stage model of Duchenne muscular dystrophy cardiomyopathy. J Mol Cell Cardiol 2012, 53(2):217-222.
4. Koo T, Popplewell L, Athanasopoulos T, Dickson G: Triple trans-splicing adeno-associated virus vectors capable of transferring the coding sequence for full-length dystrophin protein into dystrophic mice. Hum Gene Ther 2014, 25(2):98-108.
5. Shah NH, Muir TW: Inteins: Nature's Gift to Protein Chemists. Chemical science 2014, 5(1):446-461.
6. Esposito F, Lyubenova H, Tornabene P, Auricchio S, Iuliano A, Nusco E, Merlin S, Olgasi C, Manni G, Gargaro M et al: Liver gene therapy with intein-mediated F8 trans-splicing corrects mouse haemophilia A. EMBO molecular medicine 2022, 14(6):e15199.
7. Li Y: Split-inteins and their bioapplications. Biotechnol Lett 2015, 37(11):2121-2137.
8. Tasfaout H, Halbert CL, McMillen TS, Allen JM, Reyes TR, Flint GV, Grimm D, Hauschka SD, Regnier M, Chamberlain JS: Split intein-mediated protein trans-splicing to express large dystrophins. Nature 2024, 632(8023):192-200.
9. Ramos JN, Hollinger K, Bengtsson NE, Allen JM, Hauschka SD, Chamberlain JS: Development of Novel Micro-dystrophins with Enhanced Functionality. Molecular therapy : the journal of the American Society of Gene Therapy 2019, 27(3):623-635.
10. Crudele JM, Chamberlain JS: AAV-based gene therapies for the muscular dystrophies. Human molecular genetics 2019, 28(R1):R102-R107.
11. Lynch GS, Hinkle RT, Chamberlain JS, Brooks SV, Faulkner JA: Force and power output of fast and slow skeletal muscles from mdx mice 6-28 months old. The Journal of physiology 2001, 535(Pt 2):591-600.
12. Stedman HH, Sweeney HL, Shrager JB, Maguire HC, Panettieri RA, Petrof B, Narusawa M, Leferovich JM, Sladky JT, Kelly AM: The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature 1991, 352(6335):536-539.
13. Lefaucheur JP, Pastoret C, Sebille A: Phenotype of dystrophinopathy in old mdx mice. The Anatomical record 1995, 242(1):70-76.



