技术分享:TRPC5缺失导致肥胖和产后抑郁
先天或本能的行为如寻找食物、照顾后代、自我保护和社交合作,都是由基因编码的反应,对于生存和繁殖成功至关重要[1]。下丘脑不同核团内的神经元调节着行为的启动与维持,包括进食、睡眠、攻击和母性护理[2]。这些神经元回路可感知内部状态和外部条件的变化,然后选择最具适应性的行为反应,例如逃跑或战斗[3],从而实现固有先天行为的可变性或可塑性。迄今为止,人们对于如何整合内部和外部感知线索以协调先天行为的机制仍然理解有限。
瞬时受体电位(TRP)蛋白是一种表达在膜上的钙渗透性阳离子通道,能将感觉刺激转化为可被大脑解读的电信号[4]。TRP通道可以被生物物理(如电压、温度和压力)以及生物化学刺激(如通过G蛋白偶联受体(GPCR)、受体酪氨酸激酶和细胞内钙库的耗竭)所激活。这些多模式属性使其能够检测并整合来自环境以及内源性的感知线索。例如 TRPV1能感知热和辣椒素,而TRPM8能感知冷和薄荷醇。TRPC5在下丘脑的阿黑皮素原(Pomc)神经元上表达,该神经元可响应瘦素、胰岛素和血清素来调节能量稳态[5]。据报道,靶向破坏大脑和Pomc神经元中的TRPC5会导致小鼠肥胖,表现为食物摄入增加和能量消耗减少 [6]。然而,TRPC5在人类大脑中的生理和病理作用及其机制尚不清楚。
2024年7月,Cell期刊在线报道了一项研究,发现人类染色体Xq23的微缺失破坏了大脑表达的TRPC5。TRPC5缺失的男性携带者表现出摄食增加、肥胖、焦虑和自闭症,并且这些表型可在携带人类功能丧失TRPC5突变雄鼠中重现。携带TRPC5缺失的女性患有严重的产后抑郁症,Trpc5缺失杂合雌鼠也表现出快感缺失和母子互动受损的抑郁样行为。在下丘脑室旁核(PVH)的催产素(OXT)神经元中缺失Trpc5可造成两性肥胖和雌性产后抑郁行为,而Trpc5过表达可以逆转这些表型。该研究证明,TRPC5在介导人类生存基础的先天行为包括寻觅食物和母性护理中起着关键作用[7]。
首先,研究者使用比较基因组杂交,在来自欧洲不同家庭的两名严重肥胖男孩中发现了染色体Xq23的微缺失,破坏了TRPC5(图一A)。两名患者的兄弟也都患有严重肥胖,都携带了TRPC5缺失,这些缺失分别来自同样患有肥胖的母亲(TRPC5缺失杂合子,图一B),而两位父亲都没有肥胖或行为困难。这些观察结果表明TRPC5缺陷是一种X连锁显性肥胖综合征。与其他单基因肥胖综合征儿童表现出的寻觅食物并快速食用不同,这两名患者儿童时期表现出极端的寻觅和囤积食物的行为,隐藏食物以备日后食用。此外,两名患者都有自闭症特征,在自闭症特征、思维障碍、注意力障碍、焦虑和/或抑郁方面得分很高,且有睡眠障碍。两名患者母亲都有较早的初潮(9-10岁),月经周期正常,血清促性腺激素和泌乳素水平正常,都能顺利受孕,但在分娩后前四周内都经历了严重的产后抑郁。为了研究TRPC5的罕见变异是否出现在其他严重肥胖者中,研究者审查了984名儿童期严重肥胖者的外显子组测序数据[8],没有发现任何与TRPC5重叠的微缺失,但鉴定出7种罕见变体,突变在高度保守的残基上(图一C)。于是,研究者在HEK293细胞中瞬转野生型(WT)和突变型TRPC5,发现与WT相比,K34del和S884F TRPC5的表达导致其蛋白质水平降低(图一D),其降解速度显著加快(图一E),表明蛋白质稳定性受损。K34del的细胞膜表达水平降低,而其他突变体的细胞膜表达水平正常(图一F)。电生理学实验表明表达WT TRPC5的HEK293细胞显示出强大的内向电流,并可被选择性TRPC5拮抗剂的处理所消除(图一G)。表达7个TRPC5突变体导致电流显著减少(图一G)。以上数据表明,TRPC5缺陷患者表现出肥胖、焦虑和适应不良等行为。
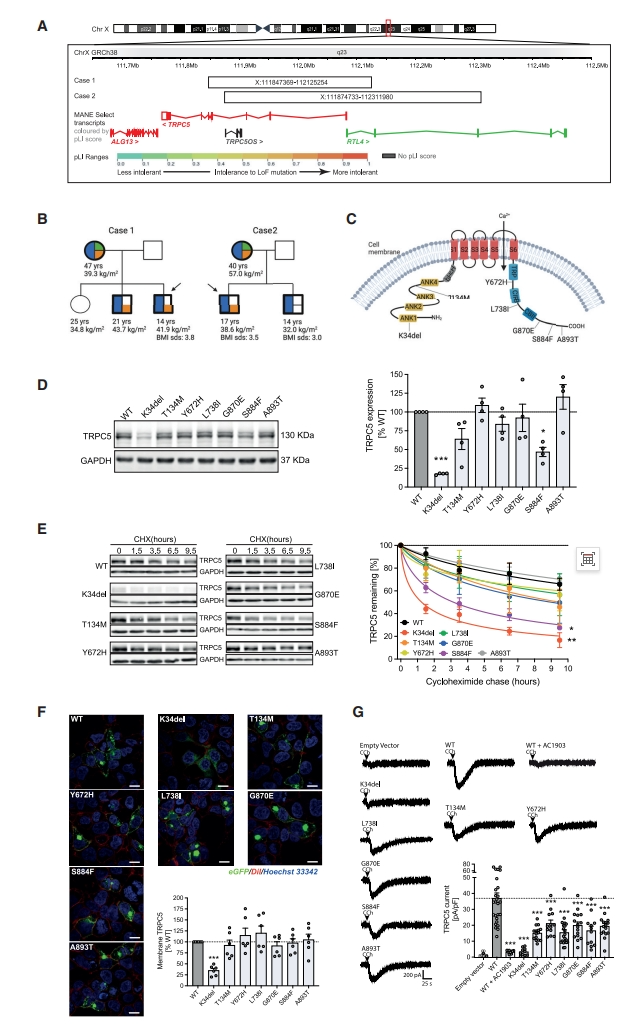
图一 在严重肥胖患者中发现TRPC5变异[7]
为研究TRPC5的突变是否导致肥胖和上述观察到的行为表型,研究者构建一个人类严重功能丧失(LoF)突变的Trpc5K34del小鼠。喂食高脂饮食(HFD)后,Trpc5K34del/Y雄鼠表现出显著的体重、脂肪量和食物摄入的增加(图二A–C);体力活动没有变化,但能量消耗减少(图二D和E);在28℃的环境温度下饲养时,食物囤积行为增加(图二F和G)。在开放场地测试中,突变雄鼠表现出焦虑行为,行动距离、进入中心的次数以及停留时间都减少了(图二H)。使用家庭笼式扫描系统,观察到突变雄鼠的清醒时间增加,特别是在禁食期间(图二I)。在社交互动测试中,与WT雄鼠相比,突变雄鼠与另一只小鼠的互动减少(图二J和K)。在入侵测试中(图二L),突变雄鼠对入侵者的攻击增加,表现为攻击延迟降低,攻击次数和持续时间增加(图二M-N)。以上数据表明,携带人类LoF TRPC5 突变的Trpc5K34del/Y雄性小鼠表现出肥胖、焦虑和社交能力下降,以及攻击行为增加。
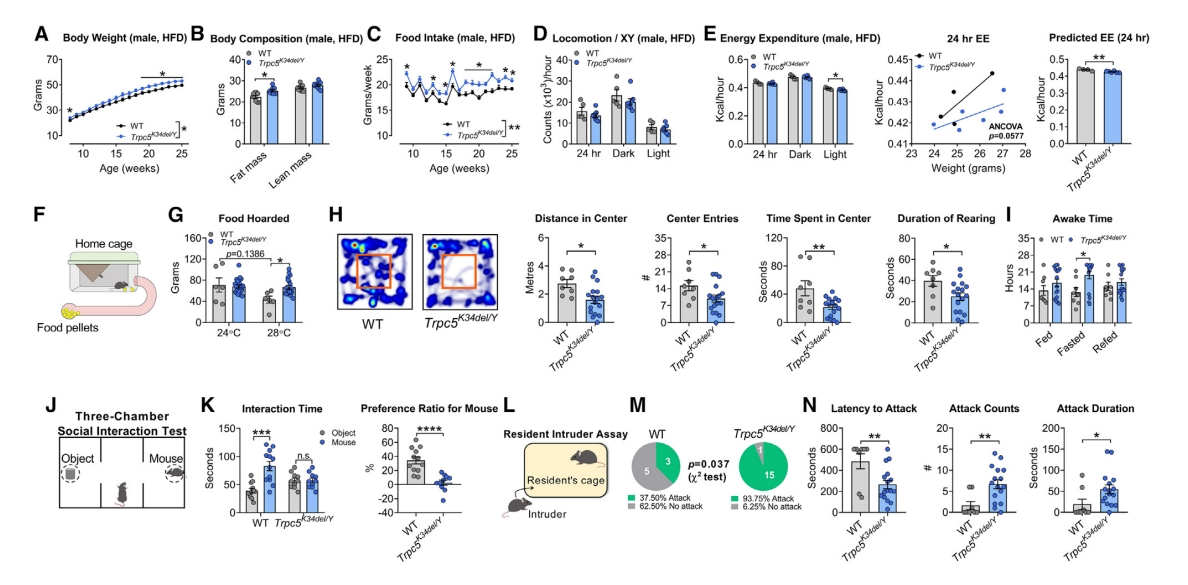
图二 Trpc5K34del/Y雄鼠的代谢和行为表型[7]
下一步,研究者检测雌鼠Trpc5缺失的代谢表型。结果发现,Trpc5K34del/+杂合雌鼠的体重和脂肪量增加,与HFD的食物摄入量增加有关(图三A–C);28℃饲养时也表现出食物囤积的增加(图三D和E)。检测小鼠对环境温度变化的反应,当饲养温度从24℃增加到28℃时,WT和杂合突变雌鼠的能量消耗减少(图三F);WT的运动活动降低,而无论环境温度如何,杂合突变雌鼠的运动活动都降低(图三G)。WT小鼠的呼吸交换率(RER)显著增加,但杂合突变雌鼠在切换到28℃时RER没有增加,导致与WT小鼠相比,RER显著降低(图三H)。以上数据表明,Trpc5K34del突变削弱了雌鼠对环境温度变化的适应性反应。接着,探索Trpc5K34del/+雌鼠的产后行为。与WT雄鼠交配后,WT雌鼠或杂合突变雌鼠都能成功怀孕,幼崽产量、存活率和平均体重相当(图三I)。在产后第1天(PPD1),与WT母鼠相比,杂合突变母鼠表现出明显的遗弃幼崽行为(图三J)。在家笼的母性行为实验中,杂合突变母鼠的幼崽取回潜伏期增加,幼崽取回次数减少(图三K和L);蹲在幼崽上方的时间、幼崽梳理和筑巢行为均显著减少(图三M)。杂合突变母鼠照顾的幼崽在巢中的比例显著降低,幼崽离巢距离显著增加(图三N和O)。在更大露天场地的幼崽取回行为测试中,杂合突变母鼠同样出现取回受损,表现为取回延迟增加,次数减少(图三P-Q)。在PPD 12,检测到杂合突变母鼠哺乳诱导的泌乳素分泌严重减少,尽管它们的哺乳前基线泌乳素水平与WT母鼠相当(图三R)。断奶后,杂合突变母鼠出现游泳不动的时间增加,对蔗糖的偏好性降低,这与抑郁样行为和快感缺失一致(图三S-T)。以上数据表明,Trpc5缺陷导致杂合突变雌性小鼠的囤食增加、产后抑郁和母性行为受损。
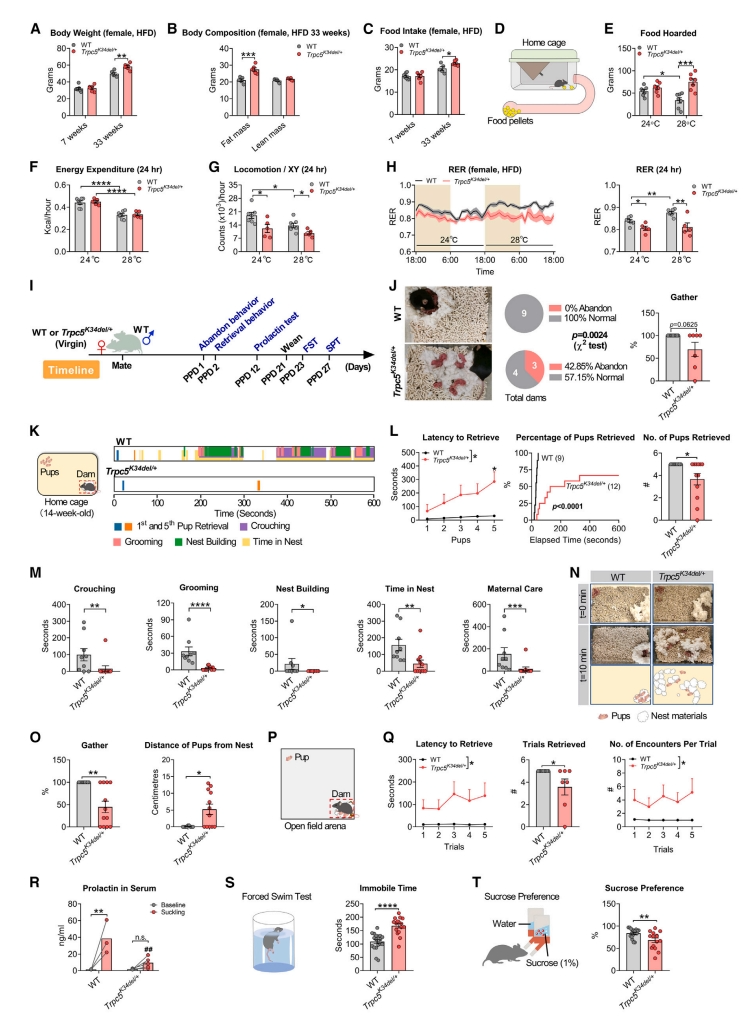
图三 Trpc5K34del/+杂合雌鼠的代谢和行为表型[7]
先前研究表明Trpc5使Pomc神经元去极化,在这些神经元中靶向缺失Trpc5会导致自噬和肥胖[6]。研究者染色发现,在WT雄鼠的下丘脑弓状核(ARH)内,约有91%的Pomc神经元共表达Trpc5(图四A)。给予Trpc5激活剂苯并噻二唑衍生物(BTD),WT小鼠的正常食物和HFD摄入量都显著减少(图四B和C),ARH-Pomc神经元中的c-Fos免疫反应性增加(图四D)。并且,氯氮平N-氧化物(CNO)可阻断BTD诱导的厌食症(图四E和F)。然而,这些作用在Trpc5K34del/Y雄鼠中减少(图四G和H)。注射BTD也降低了HFD喂养的WT雌鼠的体重和食物摄入量,而这些效应在Trpc5K34del/K34del纯合雌鼠中也被减弱(图四I-K)。以上数据表明,Trpc5的缺失削弱了下丘脑Pomc神经元介导的厌食作用。
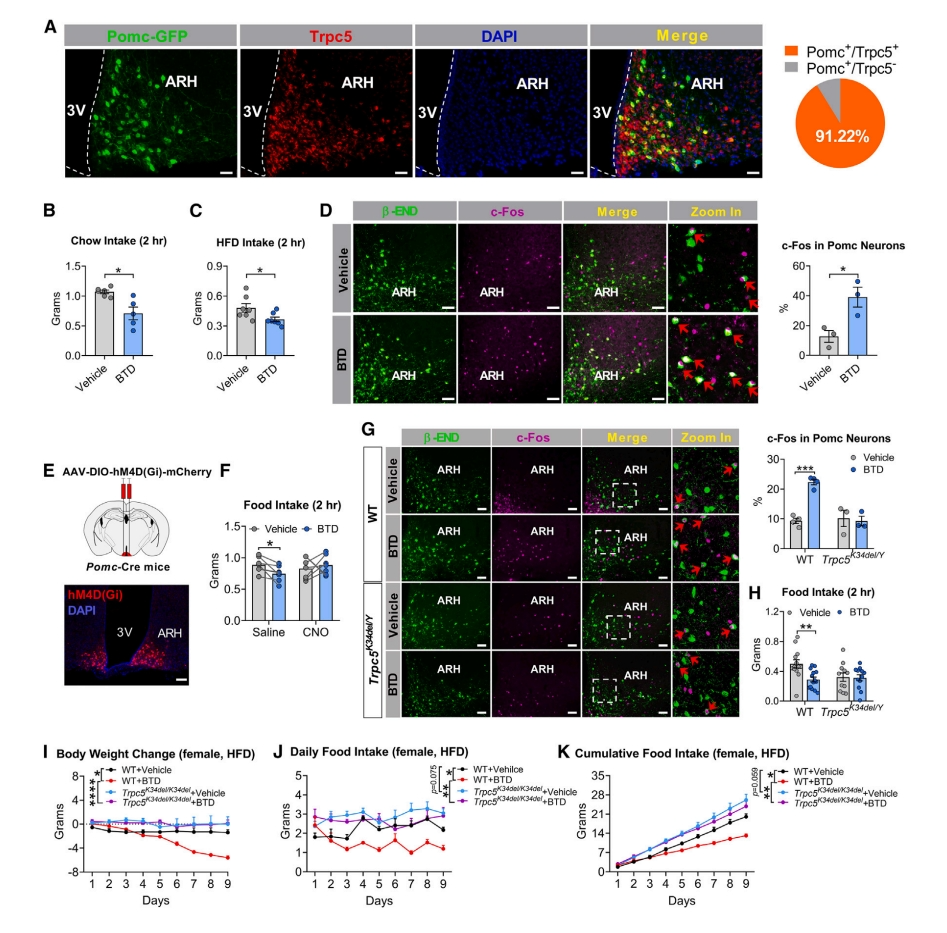
图四 Trpc5缺失可损害Pomc神经元介导的厌食作用[7]
研究者在室旁核(PVH)中检测到丰富的Trpc5表达,且与34%的催产素(OXT)神经元共定位(图五A)。为研究OXT神经元里的Trpc5对上述观察到的表型的贡献,使用Cre-loxP方法特异性敲除OXT神经元中的Trpc5,构建Trpc5f/Y/OXT-Cre小鼠。OXT神经元中Trpc5缺失明显增加了雄鼠的饮食摄入、体重和肥胖(图五B–D)。TSE PhenoMaster代谢笼的实验证实,缺失雄鼠食物摄入量增加,运动活动减少,但能量消耗没有变化(图五E和F),表明OXT神经元缺乏Trpc5导致肥胖的主要驱动因素是过度进食。给Trpc5f/Y/OXT-Cre雄鼠补充OXT可降低食物摄入量和体重,与WT小鼠降低水平相当(图五G),提示OXT类似物/受体激动剂能有效治疗TRPC5缺乏引起的人类肥胖。以上数据表明,除了Pomc神经元,Trpc5还作用于OXT神经元,以调节食物摄入和体重。
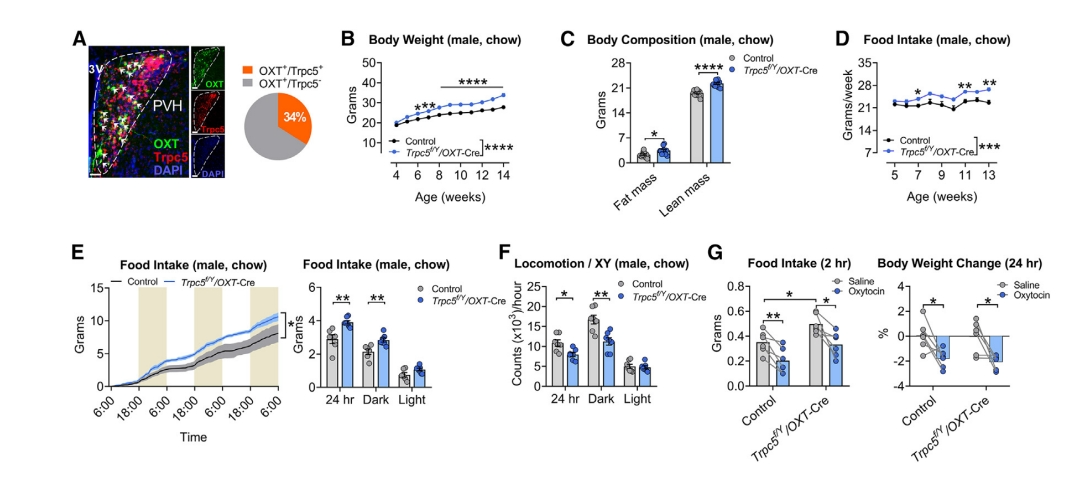
图五 OXT神经元中Trpc5缺失的代谢影响[7]
进一步,研究者在Trpc5f/Y/OXT-Cre雄鼠和Trpc5f/+/OXT-Cre雌鼠中进行一系列行为测试。发现OXT神经元Trpc5缺失的雄鼠焦虑样行为增加(图六A和B),社交能力降低(图六C)。Trpc5f/+/OXT-Cre雌鼠与WT雄鼠交配,可成功怀孕,幼崽产量和平均体重相当。在哺乳期,Trpc5f/+/OXT-Cre母鼠的幼崽取回行为也显著减少,母性行为受损(图六D-H);断奶后也表现出增加的抑郁样行为和快感缺失(图六I和J)。以上数据表明,OXT神经元的Trpc5缺失也会导致小鼠行为缺陷,包括焦虑样行为、社交能力下降、母性行为受损和产后抑郁样行为。
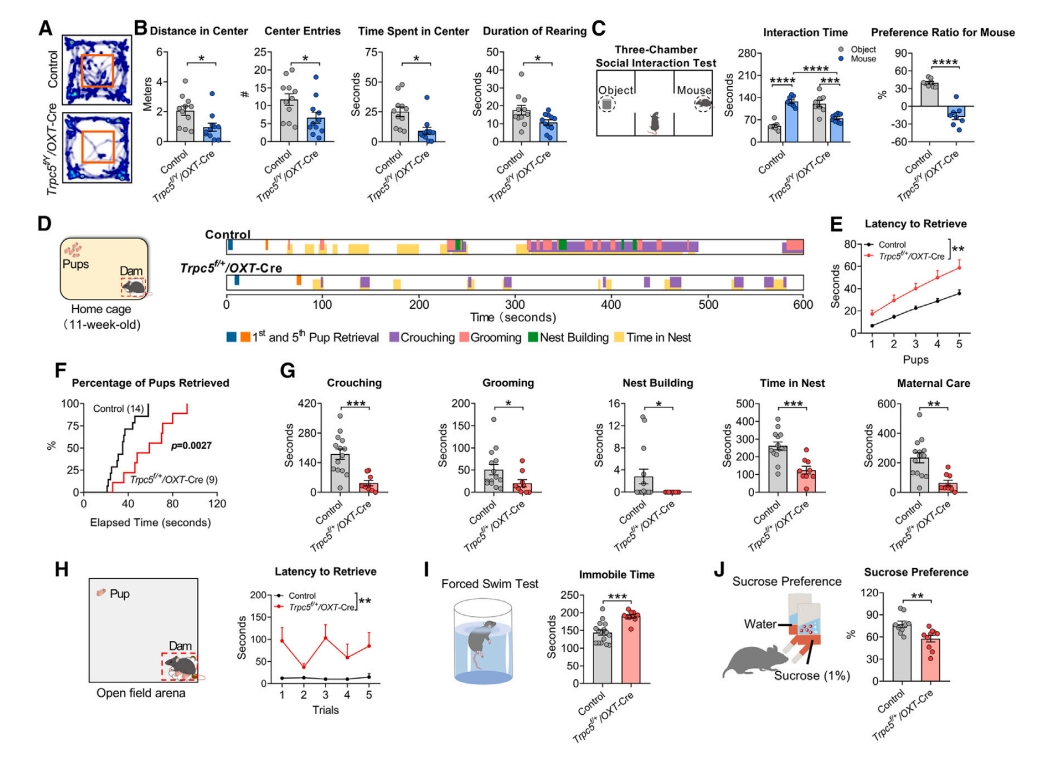
图六 OXT神经元中Trpc5缺失的行为效应[7]
最后,研究者探索Trpc5在PVH OXT神经元中的作用。构建了Cre依赖性过表达WT Trpc5的AAV载体(AAV-DIO-Trpc5),注射到Trpc5K34del/OXT-Cre雄鼠或雌鼠的PVH中,实现在PVH OXT神经元中选择性过表达Trpc5(图七A)。结果发现,Trpc5仅在Trpc5K34del/Y雄鼠的PVH OXT神经元中过表达,显著减少了食物摄入和能量消耗,导致体重和脂肪量显著减少(图七B-E),也改善了焦虑和社交行为(图七F-I)。此外,研究者在Trpc5K34del/+/OXT-Cre雌鼠的PVH OXT神经元中过表达Trpc5,与WT雄鼠交配后成功怀孕且幼崽产量和平均体重相当(图七J)。Trpc5的过表达改善了杂合突变母鼠的幼崽取回行为和母性行为(图七K-O),以及改善了断奶后母鼠抑郁行为和快感缺失(图七P和Q)。以上数据表明,在PVH OXT神经元过表达Trpc5,可降低Trpc5K34del小鼠的体重、焦虑和产后抑郁行为。
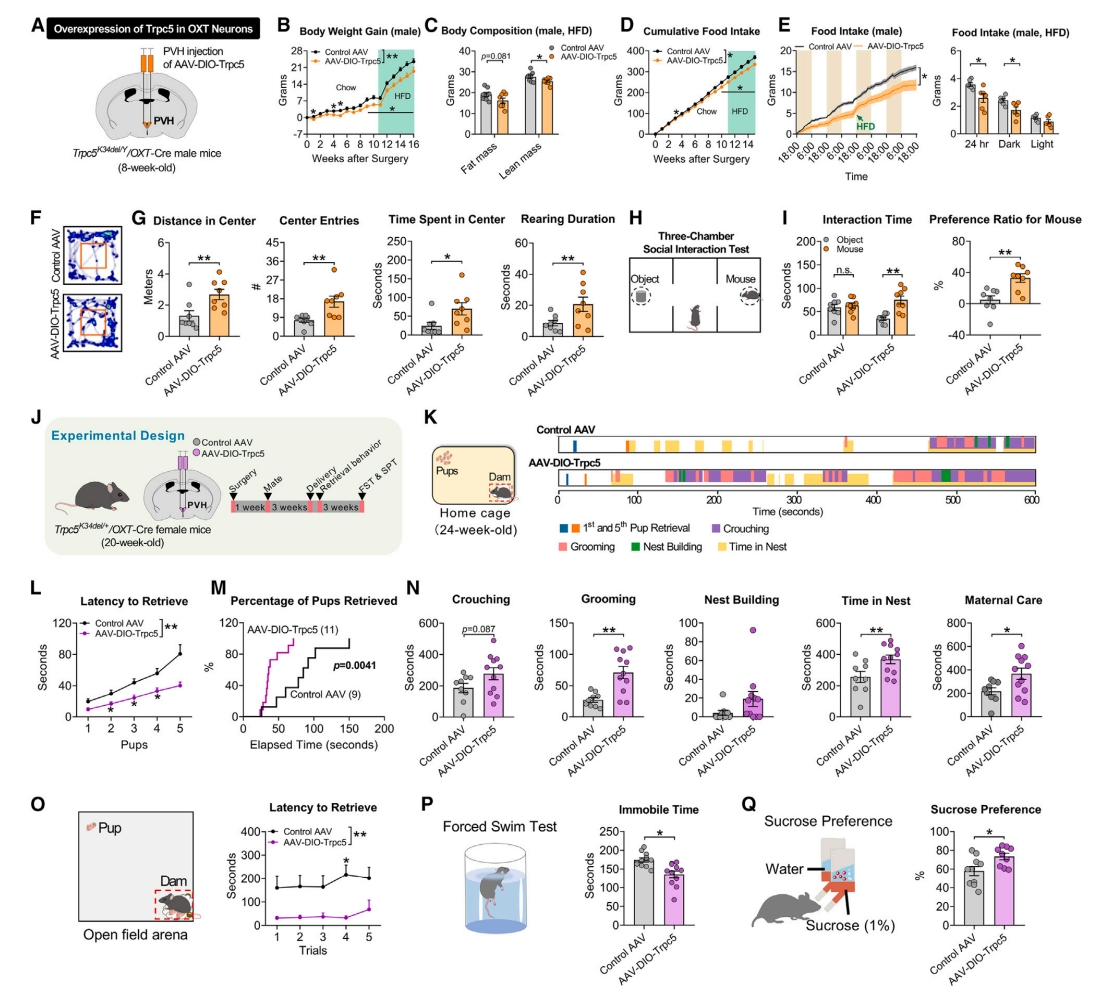
图七 PVH OXT神经元过表达Trpc5可逆转Trpc5缺乏导致的行为特征[7]
综上所述,该研究发现人类TRPC5的缺失会导致肥胖、焦虑、自闭症和产后抑郁症,这些表型可以在携带人类TRPC5突变的小鼠中重现。TRPC5作用于下丘脑Pomc和催产素神经元调节着先天行为,如生存基础的进食、觉醒、社会互动和母性行为。该研究证明了大脑表达的TRPC5在哺乳动物物种进化保守的一系列先天行为中起着关键作用,提示TRPC5可能成为一个有潜力的治疗肥胖及产后抑郁的新靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Tinbergen N: Derived activities; their causation, biological significance, origin, and emancipation during evolution. The Quarterly review of biology 1952, 27(1):1-32.
2. Saper CB, Scammell TE, Lu J: Hypothalamic regulation of sleep and circadian rhythms. Nature 2005, 437(7063):1257-1263.
3. Heisenberg M: The beauty of the network in the brain and the origin of the mind in the control of behavior. Journal of neurogenetics 2014, 28(3-4):389-399.
4. Clapham DE: TRP channels as cellular sensors. Nature 2003, 426(6966):517-524.
5. Qiu J, Fang Y, Rønnekleiv OK, Kelly MJ: Leptin excites proopiomelanocortin neurons via activation of TRPC channels. J Neurosci 2010, 30(4):1560-1565.
6. Gao Y, Yao T, Deng Z, Sohn JW, Sun J, Huang Y, Kong X, Yu KJ, Wang RT, Chen H et al: TrpC5 Mediates Acute Leptin and Serotonin Effects via Pomc Neurons. Cell Rep 2017, 18(3):583-592.
7. Li Y, Cacciottolo TM, Yin N, He Y, Liu H, Liu H, Yang Y, Henning E, Keogh JM, Lawler K et al: Loss of transient receptor potential channel 5 causes obesity and postpartum depression. Cell 2024.
8. Hendricks AE, Bochukova EG, Marenne G, Keogh JM, Atanassova N, Bounds R, Wheeler E, Mistry V, Henning E, Körner A et al: Rare Variant Analysis of Human and Rodent Obesity Genes in Individuals with Severe Childhood Obesity. Sci Rep 2017, 7(1):4394.



