技术分享:单细胞图谱解析雄激素调控性别差异的分子细胞基础
性别差异与诸多疾病的发病率息息相关,且相关疾病的症状表现以及对药物的疗效反应也是迥然不同。表型性别差异是由内源性因素和外源性环境暴露的综合作用形成的。激素,尤其是雄激素和雌激素,对性别偏向性相关表型的影响很大。雄激素过量的女性和雄激素缺乏的男性具有一些相似的代谢表型,如肥胖等。部分疾病的药物治疗临床反应也具有性别偏向性,可能是由雄激素途径驱动的[1, 2]。雄激素的作用是通过与雄激素受体(AR)结合介导的,AR是一种配体依赖性核转录因子[3]。靶向AR和雄激素合成的抑制雄激素途径药物,如恩扎鲁胺和阿比特龙,为前列腺癌患者带来了巨大受益[4, 5]。然而,雄激素是如何调节性别差异,又是如何在性别偏向性相关疾病的治疗中发挥内在潜力,目前仍是了解甚少,亟需构建一个完整的调控网络体系来阐明雄激素的性别依赖性功能。
2024年4月,Nature期刊报道了一项研究,利用四种小鼠17个组织的230多万个细胞构建了一个高维度单细胞转录组图谱,探索了性别和雄激素对分子程序和细胞类群的影响。同时,与英国生物银行数据集的整合揭示了性别偏向性疾病抗原呈递中的潜在细胞靶点和风险基因。这项研究为理解雄激素引起的性别差异奠定了基础,并为靶向雄激素途径作为性别偏向性疾病的广泛治疗策略提供了重要证据[6]。
首先,研究者系统地描述性别差异以及雄激素效应。基于AR阳性细胞在雄性和雌性小鼠的组织中普遍存在,设置了4组小鼠:对10周龄C57BL/6雄鼠进行雄激素剥夺(MC),设置雄鼠的假手术组为对照组(MS);在C57BL/6雌鼠中补充雄激素二氢睾酮(DHT)(FD),设置雌鼠的假手术组为对照组(FS)(图一a)。4周后对MS、MC、FS和FD小鼠的17个组织进行单细胞转录组分析(图一a–c),质量控制后,共计获得1294831个细胞数据,在17个组织中平均检测到2070个基因(图一d),并开发网络工具(https://casadbtools.com/)以提供数据集的定制可视化和分析。比较MS和FS小鼠(性别差异)、MC和MS小鼠(雄激素剥夺的影响)以及FD和FS小鼠(雄激素补充的影响)之间的细胞比例(图一c和e),选择每个组织中比例变化最大的前三种细胞类型进行绘图(图一e)。结果显示,性别比例差异最大的前三种细胞类型往往因组织而异,例如,在肝脏中,雄鼠的T细胞和B细胞的比例明显低于雌鼠;在脂肪中,淋巴管内皮细胞在雄性小鼠中表现出更高的比例(图一e)。此外,研究者还发现细胞比例的性别差异与雄激素补充的效果显著正相关,但与雄激素剥夺的效果显著负相关。以上实验结果表明,雄激素可能是组织细胞组成性别差异的主要原因之一。

图一 性别差异和雄激素效应的单细胞转录组图谱[6]
接下来,研究者表征性别差异和雄激素效应的分子特征。首先在MS和FS小鼠之间的17个组织的每种细胞类型中鉴定差异表达基因(DEG)。根据DEG的数量对细胞类型进行排序,确定了每个组织的前三种性别差异最显著的细胞类型(图二a)。例如,在骨骼肌的肌肉干细胞中,Xist和Ddx3y这两个性染色体基因的表达具有显著的性别偏向性(图二b)。比较MC和MS小鼠之间雄激素剥夺或FD和FS小鼠之间雄激素补充诱导的DEG。雄激素剥夺后,肾脏近端直小管(PST1)细胞中Kap的表达显著下调(图二c)。确定每个组织中哪些细胞类型对雄激素敏感,观察到在肾脏中,PST1细胞不仅表现出最多的性别偏向性DEG,而且对雄激素剥夺和补充都表现出最强的反应(图二a)。雄激素剥夺诱导的DEG之间表达差异的大小与这些基因表达的性别差异的大小呈显著负相关(图二d)。同样的,雄激素补充诱导的DEG之间的表达差异程度与这些基因表达的性别差异程度呈显著正相关(图二e)。
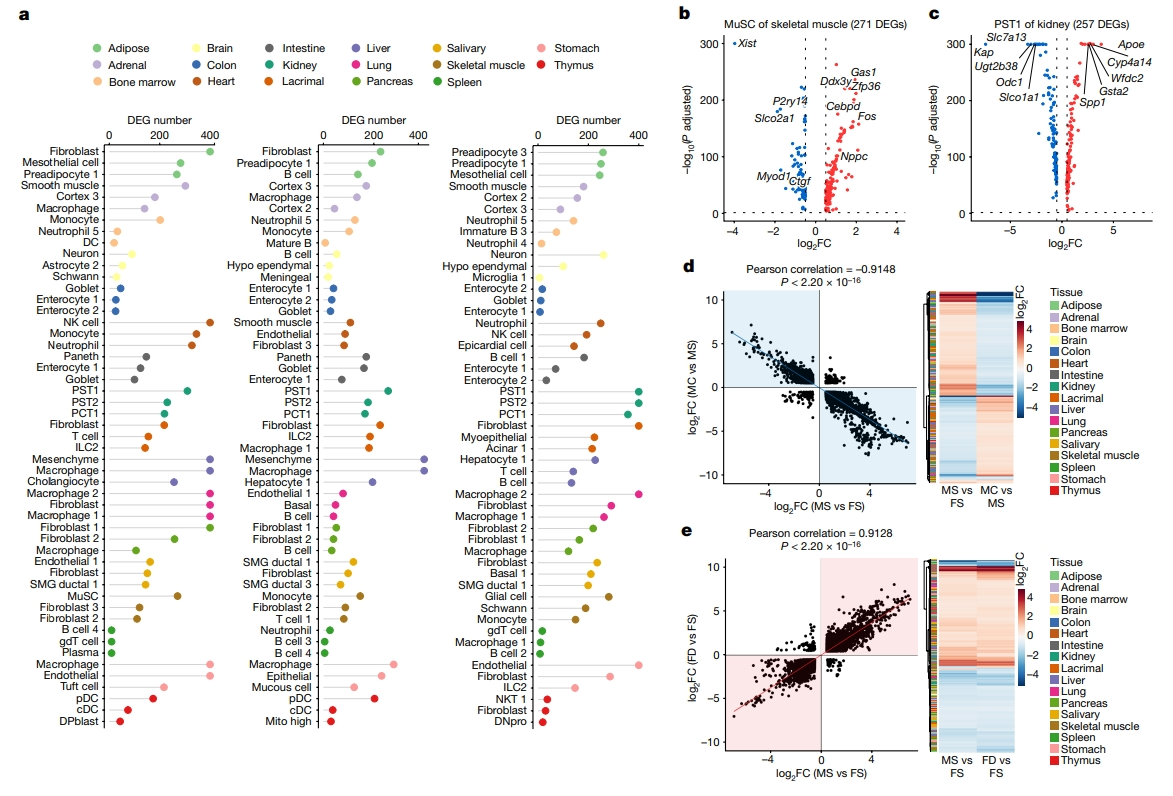
图二 性别差异和雄激素效应的分子特征[6]
研究已证实抑制雄激素通路可以诱导免疫治疗和靶向治疗的效果增强[1],提示雄激素调节的性别偏向性DEG可能代表抑制雄激素通路治疗性别偏向性疾病的潜在生物标志物和治疗靶点。为此,研究者为17个组织中的每种细胞类型定义了雄激素相关的性别偏向性DEG(AASB-DEG),其中阳性AASB-DEG表达水平表现为雄性偏向性并受雄激素正调控,和阴性AASB-DEG为雌性偏向性且受雄激素负调控(图三a)。例如,在脂肪细胞中,有15个阴性AASB-DEG和6个阳性AASB-DEG(图三b)。其中Fasn是阴性AASB-DEG,在雄激素剥夺的雄性小鼠中(MC)显著上调,在雄性激素补充的雌性小鼠中(FD)显著下调(图三b和c),这与先前的研究相一致[7]。AASB-DEG的数量因组织细胞类型而异,其中肾脏PST1细胞不仅表现出最多的AASB-DEG(182),而且在性别偏见的DEG中表现出相对较高的AASB-DEG百分比(58.7%)(图三d)。尽管如此,仍发现至少有两个组织共享93个阳性AASB-DEG和81个阴性AASB-DEG(图三e和f)。这些AASB-DEG包括细胞生长和分化因子,如Egfr、Fos和Fosb等,以及一些免疫调节因子,如Ccl3、Il33和Ccl4等(图三e和f)。还观察到一些预期的AASB-DEG,如Ace和Hsd11b1(图三e),与先前的研究一致[8]。以上数据表明雄激素敏感调节这些细胞类型的性别差异。对每种细胞类型中的AASB-DEG进行通路富集分析,发现有50个阳性AASB-DEG和145个阴性AASB-DEG富集的生物学通路。50个阳性富集通路包括“药物分解代谢过程”、“激素分解代谢过程和”肽酶活性负调控“途径,145个阴性富集通路包括“脂肪酸代谢过程”、“嘌呤核苷酸代谢过程” 和“酰基辅酶A代谢过程”。以上研究表明,这些AASB-DEG可能是靶向雄激素通路的精准医学的关键生物标志物和有吸引力的治疗靶点。
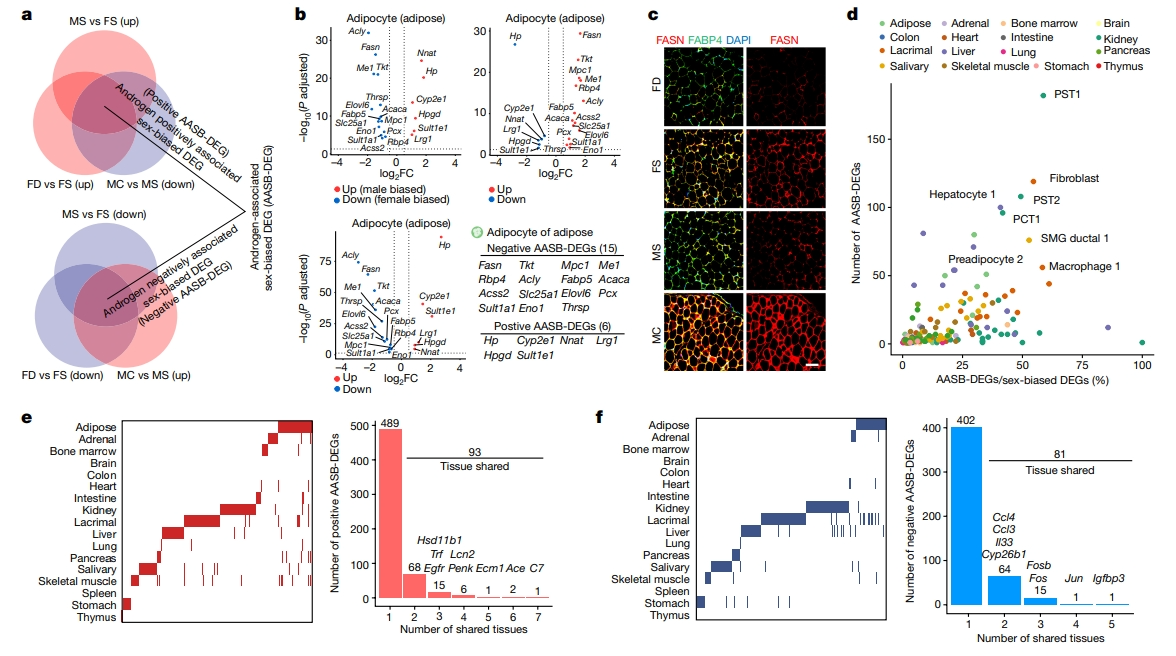
图三 雄激素通路相关的性别偏向性差异基因的表达和鉴定[6]
为验证性别和雄激素对免疫细胞组成的影响,研究者筛选出17个组织中的所有免疫细胞,通过重建免疫区室,最终产生了九种主要的免疫细胞类型(图四a和b)。结果发现,免疫细胞群体中的性别差异与雄激素补充诱导的变化显著正相关,但与雄激素缺乏诱导的变化呈显著负相关(图四c)。接下来,研究者确定了多种对雄激素剥夺和补充表现出协调反应的性别偏向性免疫细胞类型,即AASB免疫细胞类型。发现了9种阳性AASB免疫细胞型,其细胞类型的比例与雄激素呈正相关,和13种阴性AASB免疫细胞型(图四d)。在这9种阳性AASB免疫细胞型中,有7种属于髓系细胞,包括肾脏、泪腺和肝脏中的中性粒细胞;13种阴性AASB免疫细胞型均是淋巴细胞(图四d)。在以上各类AASB免疫细胞中,高表达Gata3、Areg、Rora的先天性淋巴细胞ILC2[9-12]是七个组织共有的阴性AASB免疫细胞型(图四e),存在于心脏、泪腺、肝脏、胰腺、唾液腺、脾脏和胃中(图四f和g)。在九种主要免疫细胞类型中,ILC2具有最高的Ar表达水平(图四e),部分解释了ILC2对雄激素扰动的敏感性反应。以上结果表明,雄激素对免疫细胞有显著的调节作用。
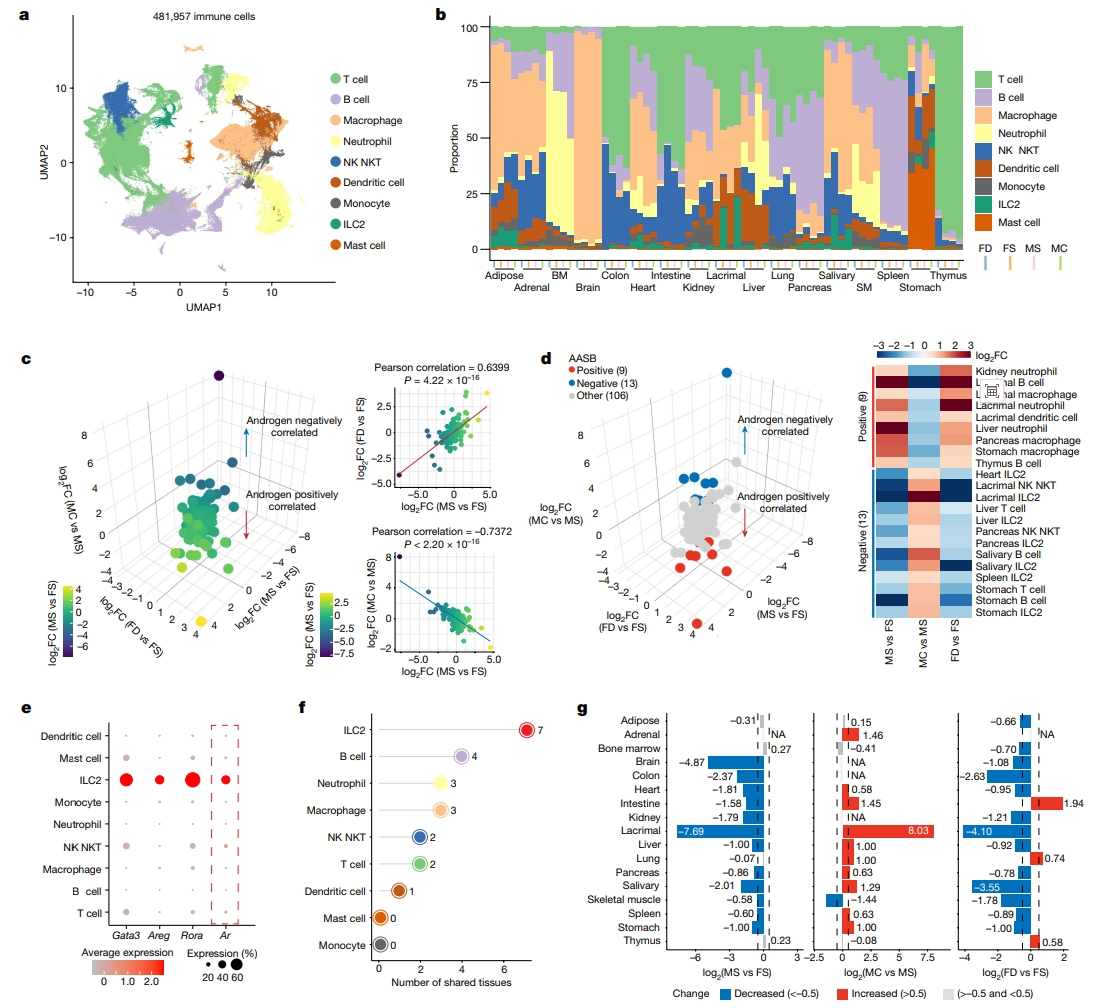
图四 雄激素调节性别差异相关免疫反应[6]
最后,研究者从英国生物库目录中提取了与图谱中17种组织相关的214种主要ICD10疾病表型[13],用于下游分析(图五a)。根据英国生物库的信息,比较这214种疾病在男性和女性之间的发病率,定义了119种具有性别偏向性疾病和95种性别可比性疾病(图五b)。在这119种性别偏向性疾病中,胃(C16)、肾(C64)和肺(C34)部相关的恶性肿瘤是男性偏向性的,而哮喘(J45)是女性偏向性的(图五b)[14, 15]。多种性别偏向性疾病相关的风险基因可能是驱动该疾病发病机制的重要组成部分,由此,研究者确定患者和对照组之间存在显著差异的风险基因单核苷酸多态性(SNP),然后将这些风险SNP与相关风险基因联系起来。对于以上119种性别偏向性疾病,有63.79%比例的风险基因是疾病特异性的,但有8.91%的风险基因共存于三种以上疾病,属于疾病共有风险基因(图五c)。对于95种性别可比性疾病,共有风险基因占比仅为2.34%(图五c)。性别偏向性疾病的共有风险基因主要与组织相容性复合体(MHC)相关,例如HLA-DQA1是一种MHC II类α链旁系同源物,是17种性别偏向性疾病的共有风险基因(图五d)。
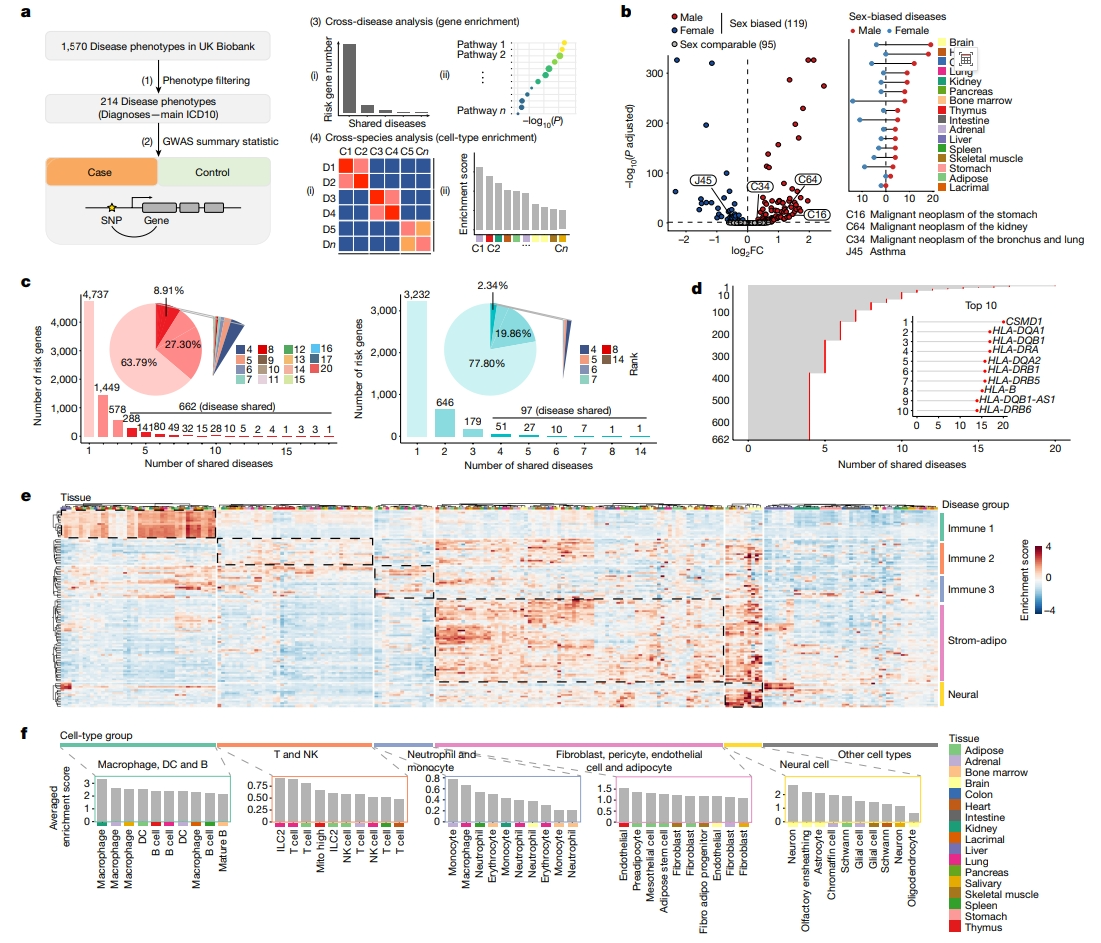
图五 性别偏向性疾病相关的富集风险基因[6]
结合17种组织的scRNA-seq数据,研究者进行了跨物种分析,通过确定疾病富集分数来建立细胞类型与性别偏向性疾病之间的关联。基于这些数据,研究者将性别偏向性疾病分为五大类,对应于跨组织的五个主要细胞谱系:免疫1(巨噬细胞、树突状细胞和B细胞)、免疫2(T细胞和NK细胞)、免疫3(中性粒细胞和单核细胞)、脂肪基质(间充质细胞、内皮细胞和脂肪细胞)和神经细胞(图五e)。还确定了与疾病关联的新细胞类型,例如,巨噬细胞与非胰岛素依赖型糖尿病(E11)相关,免疫1与多个组织中的巨噬细胞和树突状细胞密切相关等(图五f)。以上研究所筛选出的这些细胞类型均可能成为性别偏向性疾病的潜在细胞靶点。
综上所述,该研究对四种小鼠的17个器官分别进行了单细胞转录组测序,绘制了首张用于系统性研究雄激素功能和性别差异的小鼠多器官单细胞图谱(https://casadbtools.com)。系统性证明了雄激素在性别差异中扮演着重要角色,并深入解析了雄激素调控性别差异的分子和细胞基础,鉴定了雄激素对于免疫分子和免疫细胞的重要调控作用,为理解性别差异性疾病的发生发展机制和靶向雄激素信号通路的潜在临床应用提供了重要理论基础。 GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。
GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Vellano CP, White MG, Andrews MC, Chelvanambi M, Witt RG, Daniele JR, Titus M, McQuade JL, Conforti F, Burton EM et al: Androgen receptor blockade promotes response to BRAF/MEK-targeted therapy. Nature 2022, 606(7915):797-803.
2. Yang C, Jin J, Yang Y, Sun H, Wu L, Shen M, Hong X, Li W, Lu L, Cao D et al: Androgen receptor-mediated CD8(+) T cell stemness programs drive sex differences in antitumor immunity. Immunity 2022, 55(7):1268-1283 e1269.
3. Watson PA, Arora VK, Sawyers CL: Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer. Nature reviews Cancer 2015, 15(12):701-711.
4. Beer TM, Tombal B: Enzalutamide in metastatic prostate cancer before chemotherapy. The New England journal of medicine 2014, 371(18):1755-1756.
5. Schmidt KT, Huitema ADR, Chau CH, Figg WD: Resistance to second-generation androgen receptor antagonists in prostate cancer. Nature reviews Urology 2021, 18(4):209-226.
6. Li F, Xing X, Jin Q, Wang XM, Dai P, Han M, Shi H, Zhang Z, Shao X, Peng Y et al: Sex differences orchestrated by androgens at single-cell resolution. Nature 2024, 629(8010):193-200.
7. Hartig SM, He B, Newberg JY, Ochsner SA, Loose DS, Lanz RB, McKenna NJ, Buehrer BM, McGuire SE, Marcelli M et al: Feed-forward inhibition of androgen receptor activity by glucocorticoid action in human adipocytes. Chemistry & biology 2012, 19(9):1126-1141.
8. Oliva M, Muñoz-Aguirre M, Kim-Hellmuth S, Wucher V, Gewirtz ADH, Cotter DJ, Parsana P, Kasela S, Balliu B, Viñuela A et al: The impact of sex on gene expression across human tissues. Science 2020, 369(6509).
9. Spits H, Mjosberg J: Heterogeneity of type 2 innate lymphoid cells. Nature reviews Immunology 2022, 22(11):701-712.
10. Jacquelot N, Seillet C, Vivier E, Belz GT: Innate lymphoid cells and cancer. Nat Immunol 2022, 23(3):371-379.
11. Ebbo M, Crinier A, Vely F, Vivier E: Innate lymphoid cells: major players in inflammatory diseases. Nature reviews Immunology 2017, 17(11):665-678.
12. Bal SM, Golebski K, Spits H: Plasticity of innate lymphoid cell subsets. Nature reviews Immunology 2020, 20(9):552-565.
13. Backman JD, Li AH, Marcketta A, Sun D, Mbatchou J, Kessler MD, Benner C, Liu D, Locke AE, Balasubramanian S et al: Exome sequencing and analysis of 454,787 UK Biobank participants. Nature 2021, 599(7886):628-634.
14. Costa AR, Lanca de Oliveira M, Cruz I, Goncalves I, Cascalheira JF, Santos CRA: The Sex Bias of Cancer. Trends in endocrinology and metabolism: TEM 2020, 31(10):785-799.
15. Mauvais-Jarvis F, Bairey Merz N, Barnes PJ, Brinton RD, Carrero JJ, DeMeo DL, De Vries GJ, Epperson CN, Govindan R, Klein SL et al: Sex and gender: modifiers of health, disease, and medicine. Lancet 2020, 396(10250):565-582.



