技术分享:TM7SF3通过调控TEAD1剪接抑制MASH诱导的肝纤维化
非酒精性脂肪肝病(NAFLD),现已更名为代谢功能障碍相关脂肪变性肝病(MASLD),其特征是肝脏出现脂肪的过度积累,伴随着轻度或无炎症[1]。预计约25%的MASLD患者会发展为代谢功能障碍相关脂肪性肝炎(MASH;之前称为NASH),后者的特征是脂肪变性、肝脏炎症、肝细胞气球样变性和纤维化[2]。肝纤维化是MASH患者死亡率和不良肝脏事件的主要预测指标,由肝星状细胞(HSC)的激活所引起[3]。在MASH中,静息HSC被激活转变为增殖、纤维发生和收缩性增强的肌成纤维细胞,分泌和沉积纤维状的细胞外基质(ECM),导致肝脏瘢痕形成[3]。该过程包括了炎症、细胞应激、外泌体、ECM相互作用和游离胆固醇的一整个复杂信号网络,促进HSC的激活。因此,抑制HSC活化对于预防和减少MASH纤维化至关重要。
TEAD1是转录增强相关DNA结合结构域转录因子家族成员[4],是Hippo通路组分之一,与炎症、纤维化和癌症等疾病相关。TEAD1与转录共激活因子YAP 和TAZ(Hippo信号转导级联的末端核效应因子)相互作用,促进靶基因表达、细胞生长和存活。这种严格调控的信号级联涉及YAP/TAZ的磷酸化,限制其核转位及其与TEAD1的相互作用,从而影响靶基因的表达[5]。TEAD1靶基因,包括Ctgf和Cyr61,通过促进纤维化组织重塑和增强细胞增殖和分化来促进纤维发生[6]。尽管研究已经建立TEAD1与Ctgf和Cyr61等纤维化相关基因之间的联系,但TEAD1在激活HSC中的作用仍未被探索。
2024年5月,Cell Metabolism期刊报道了一项研究,发现核蛋白TM7SF3的缺失会加速肝星状细胞(HSC)的活化,从而激活纤维化程序和HSC增殖。机制上,TM7SF3敲除后剪接因子hnRNPU促进了Hippo通路转录因子TEAD1的选择性剪接,导致抑制性外显子5的缺失,产生更活跃的TEAD1形式,触发HSC激活。基于此,设计特异性反义寡聚体(ASO)来抑制TEAD1的选择性剪接,可以在体外促使HSC失活,并且减少MASH饮食诱导的小鼠肝纤维化,表明TM7SF3在减轻HSC活化和MASH相关纤维化进展中起着关键作用[7]。
七次跨膜蛋白TM7SF3是一种核蛋白,可以减弱内质网(ER)应激和未折叠蛋白反应的发展[8]。TM7SF3与多种RNA结合蛋白/剪接因子形成复合物,如HNRNPU、HNRNPK和RBM14,从而在基础和应激条件下抑制选择性剪接[9]。与大多数七次跨膜蛋白不同,TM7SF3广泛表达,包括在肝脏中。研究者前期发现,U2-OS细胞中的TM7SF3敲降(KD)导致基因表达谱的变化与肝纤维化/HSC激活谱式高度相似[9]。与此一致,研究者发现CCl4处理或MASH饮食(图一A)诱导的活化HSC中Tm7sf3 mRNA的表达降低。因此,研究者推测TM7SF3调节HSC活化和肝纤维化,并对此进行验证。使用由野生型(WT)肝细胞和非实质细胞(NPC)构建的肝脏类器官模型,混合HSC细胞进行培养,其中HSC来源于WT(WT-HSC)小鼠或诱导型全身TM7SF3 KO小鼠(KO-HSC;图一B)。在24孔超低粘附板上培养14天后,这些细胞组成球状的肝脏类器官,含有多种肝脏细胞类型,并表达更高水平的纤维化和炎症基因[10]。使用脂肪酸混合物处理肝脏类器官模拟MASH过程,可以激活其纤维化和炎性基因表达。于是,研究者使用较低剂量的脂肪酸混合物来处理含有WT-HSC或KO-HSC的类器官,发现在没有脂肪酸混合物处理条件下,与WT-HSC类器官相比,KO-HSC导致Tgfb1、Timp1和Mcp1的表达增加。脂肪酸混合物诱导WT-HSC类器官的脂质代谢基因上调,对纤维化和炎症基因表达的影响很小;相比之下, KO-HSC诱导了一系列纤维化和炎症相关的基因和蛋白质表达增加,包括Tgfb1、Col1a1、Timp1和Mcp1(图一C和D)以及ECM蛋白的产生和分泌显著增加(图一E)。使用siRNA体外沉默小鼠原代HSC中的Tm7sf3基因,qPCR证实KD后Tm7sf3表达减少了90%,以及纤维化基因表达明显高于对照组(图一F)。进一步评估TM7SF3在人原代HSC中的作用,TM7SF3 KD同样导致纤维化基因在mRNA和蛋白质水平上的表达增加(图一G)。此外,TM7SF3 KD后观察到HSC增殖增加,Ki67 mRNA水平升高(图一H)和Ki67阳性细胞数量增加(图一I)。以上结果表明,TM7SF3抑制了人和小鼠HSC的分化和活化,并减少肝脏类器官的纤维化和炎症。
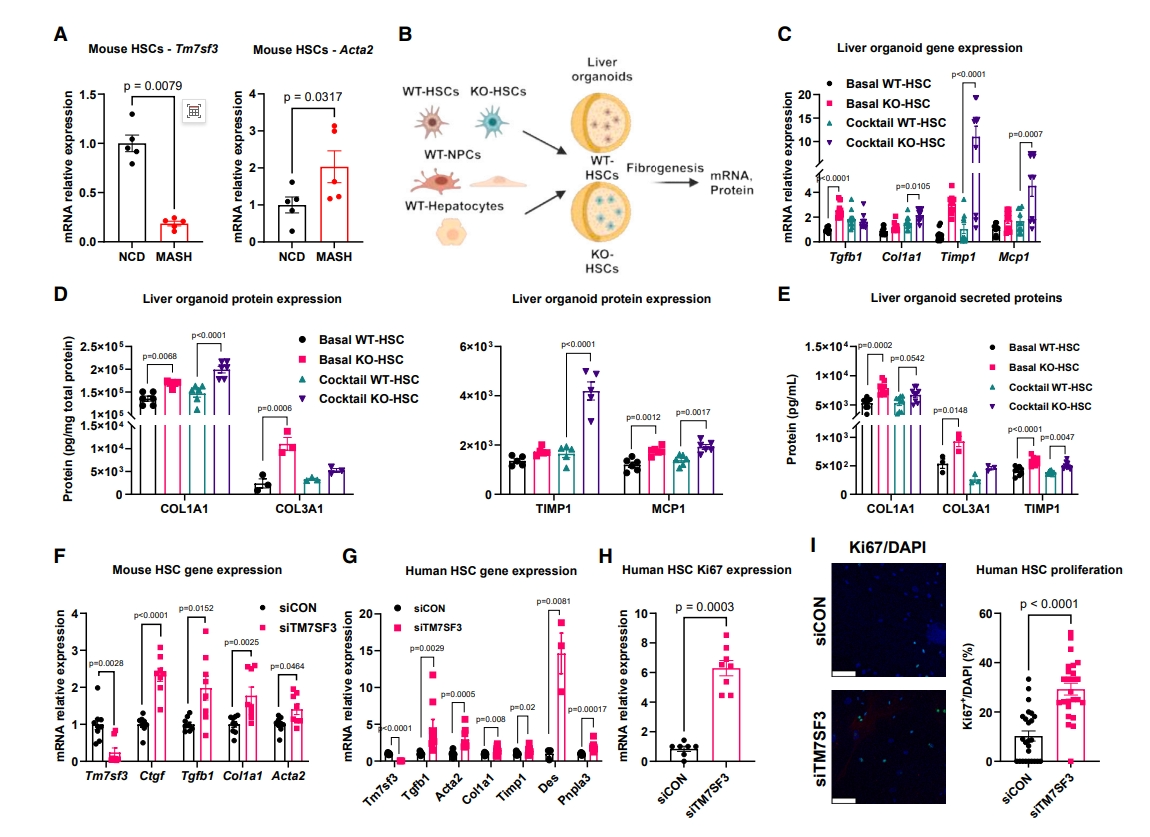
图一 TM7SF3 KO通过促进HSC活化和细胞增殖诱导肝脏类器官和HSC的纤维化[7]
研究者进一步评估TM7SF3 KO对HSC活化和肝纤维化的影响。通过将Tm7sf3-floxed小鼠与Lrat-Cre小鼠杂交构建肝脏HSC特异性Tm7sf3敲除小鼠(HSC-TM7SF3KO)。使用西方饮食(WD;AIN-76A)和他莫昔芬诱导HSC-TM7SF3KO小鼠并评估表型。如图二G所示,在正常饮食(NCD)的HSC-TM7SF3KO或WT小鼠中没有检测到明显的胶原蛋白积聚。在WD喂食6周后,与WT相比,HSC-TM7SF3KO小鼠的肝脏羟脯氨酸含量呈上升趋势。在WD喂食16周后,HSC-TM7SF3KO肝脏的α-SMA免疫染色和COL1A1和TIMP1蛋白表达高于WT(图二A-C)。这种表型与炎症标志物的表达增加相吻合,如F4/80、Mcp1和Cd68基因以及血清IL-1β、TNF-α和MCP1水平升高(图二D和E)。与WT相比,HSC-TM7SF3KO的血液丙氨酸氨基转移酶(ALT)水平显著升高(图二F)。然而,在肝脏甘油三酯(TG)或总胆固醇水平方面没有观察到显著变化。重要的是,通过天狼星红染色和羟脯氨酸测量评估,HSC-TM7SF3KO小鼠的肝纤维化明显高于WT(图二G和H)。以上数据进一步强调了TM7SF3在促进HSC活化和肝纤维化中的作用。
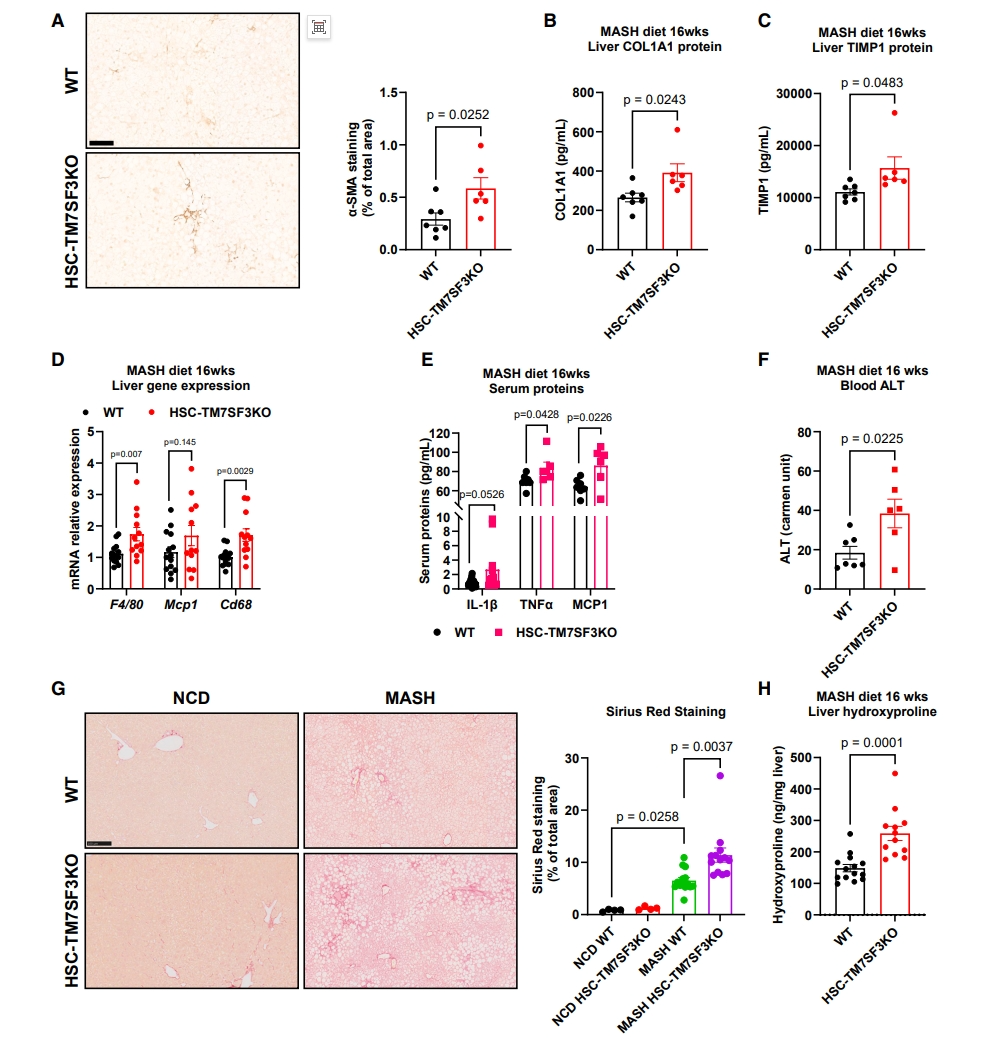
图二 HSC特异性TM7SF3 KO加重MASH诱导的肝纤维化[7]
选择性剪接(AS)可以通过剪接出多种不同基因形式来调节肝脏生理,如转录因子TEAD1。之前的研究表明,TEAD1在肝损伤后会发生AS,从而调节其活性[11]。TEAD1前体mRNA包含一个12 nt的外显子5,编码DNA结合螺旋H3下游的四个氨基酸VTSM。于是,研究者研究HSC中TEAD1的AS是否与肝损伤和MASH有关。发现与健康人群和MASLD患者相比,MASH患者肝脏中TEAD1的表达显著升高(图三A)。评估MASH饮食5个月的小鼠肝细胞、NPC和HSC中的TEAD1 AS,发现HSC中的TEAD1 AS高出约6倍, 肝细胞中TEAD1 AS没有增加(图三B)。TEAD1外显子5包括一个保守的丝氨酸残基,该位点磷酸化时,会强烈抑制TEAD1的DNA结合能力,使其相对无活性,而缺失这个外显子会增加TEAD1的转录活性[11]。事实上,研究者发现人类HSC和U2-OS细胞中的TM7SF3 KD会促进外显子跳跃,导致TEAD1△Ex5的增加(图三C和D)。由此,研究者设计一种名为“siTEAD1△Ex5”的siRNA,靶向抑制外显子5的跳跃剪接(图三E)。在人HSC中测试其抑制效率和特异性,显示siTEAD1△Ex5没有抑制TEAD1的表达,而siTEAD1导致了60%的下降(图三F和G)。重要的是,siTEAD1△Ex5有效沉默了TM7SF3 KD诱导的TEAD1的选择性剪接活性形式(图三F)。TEAD1靶基因CTGF和CYR61的减少,也证明siTEAD1△Ex5特异性抑制了TEAD1△Ex5活性形式(图三H和I)。siTEAD1△Ex5还抑制了TM7SF3 KD诱导的HSC活化标志物ACTA2和纤维化细胞因子Il-6的表达(图三J和K)。检测siTEAD1△Ex5在肝脏类器官系统中减少纤维化的能力,在用脂肪酸混合物培养14天的过程中,每3天用siTEAD1△Ex5或对照siCON转染肝脏类器官。结果显示,抑制TEAD1△Ex5导致纤维化基因和蛋白质表达显著降低,但不改变炎症标志物MCP1的表达(图三L和M)。有趣的是,与对照组相比,siTEAD1△Ex5抑制TEAD1△Ex5时,HSC静息状态的标志物Bambi的表达更高(图三L)。最后,评估TM7SF3和TEAD1△Ex5对HSC增殖的影响。TM7SF3 KD促进了HSC增殖(图三N)。在基础状态下抑制TEAD1△Ex5不影响HSC增殖。然而,在基础或TGFβ处理的人HSC中,共同沉默TM7SF3和TEAD1△Ex5可以消除TM7SF3 KD增强的细胞增殖作用(图三N)。以上数据表明,活性TEAD1通过HSC活化促进MASH的发展,并介导了TM7SF3 KD刺激的HSC活化和增殖作用。
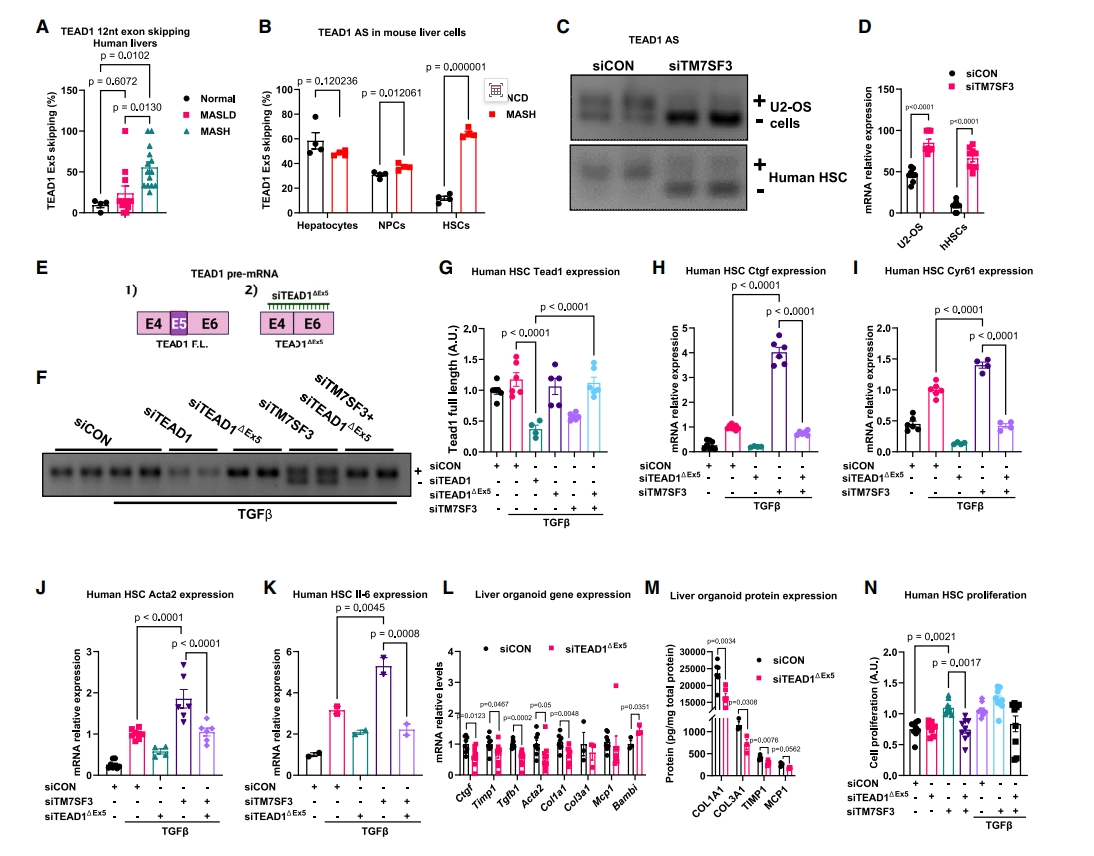
图三 TM7SF3通过调节TEAD1选择性剪接来调节HSC活化[7]
AS的调节通常是通过剪接因子与前体mRNA序列的相互作用来实现的[12]。为鉴定TM7SF3 KD诱导TEAD1 AS的直接作用剪接因子,研究者分析与TM7SF3结合的蛋白质列表,寻找可能含有位于TEAD1外显子5上游或下游100 bp的RNA结合基序序列的剪接因子。如图四A所示,异质核核糖核蛋白U(hnRNPU)是唯一具有接近TEAD1外显子5临近结合基序的剪接因子。进一步验证hnRNPU与TEAD1前体mRNA的相互作用,在人HSC提取物中用hnRNPU和TM7SF3的抗体分别进行RNA免疫沉淀(RIP),设计位于TEAD1外显子5下游的引物检测TEAD1前体mRNA(图四B)。与免疫球蛋白G(IgG)对照组相比,hnRNPU和TM7SF3抗体沉淀显著富集了TEAD1前体mRNA(图四C)。此外,沉默人HSC中的hnRNPU减少了TM7SF3抗体拉下的TEAD1前体mRNA的量(图四D)。相比之下,当TM7SF3在人HSC中沉默时,与对照组相比,hnRNPU与TEAD1前体mRNA的结合没有受到影响(图四E)。推测hnRNPU与TEAD1前体mRNA的结合导致外显子5的跳跃,在人HSC中单独或一起使用siRNA对KD hnRNPU和TM7SF3进行检测。hnRNPU KD降低了TM7SF3 KD诱导TEAD1剪接成其活性形式的能力(图四F和G)。此外,TM7SF3和hnRNPU的共同沉默降低了TEAD1靶基因的表达(图四H)以及TM7SF3 KD单独诱导的HSC激活(图四I)。这些结果表明,TM7SF3与hnRNPU结合并抑制其促进TEAD1外显子5跳跃的活性(图四Ja)。当TM7SF3耗尽时,hnRNPU不再受到抑制,因此TEAD1△Ex5增加进而促进HSC活化(图四Jb)。最后,Ki67阳性细胞检测人HSC中的sihnRNPU抑制TM7SF3 KD促进细胞增殖的程度与siTEAD1△Ex5相同(图四K)。以上这些结果表明,hnRNPU与TEAD1前体mRNA结合,诱导了外显子5跳跃剪接(图四Jb)。
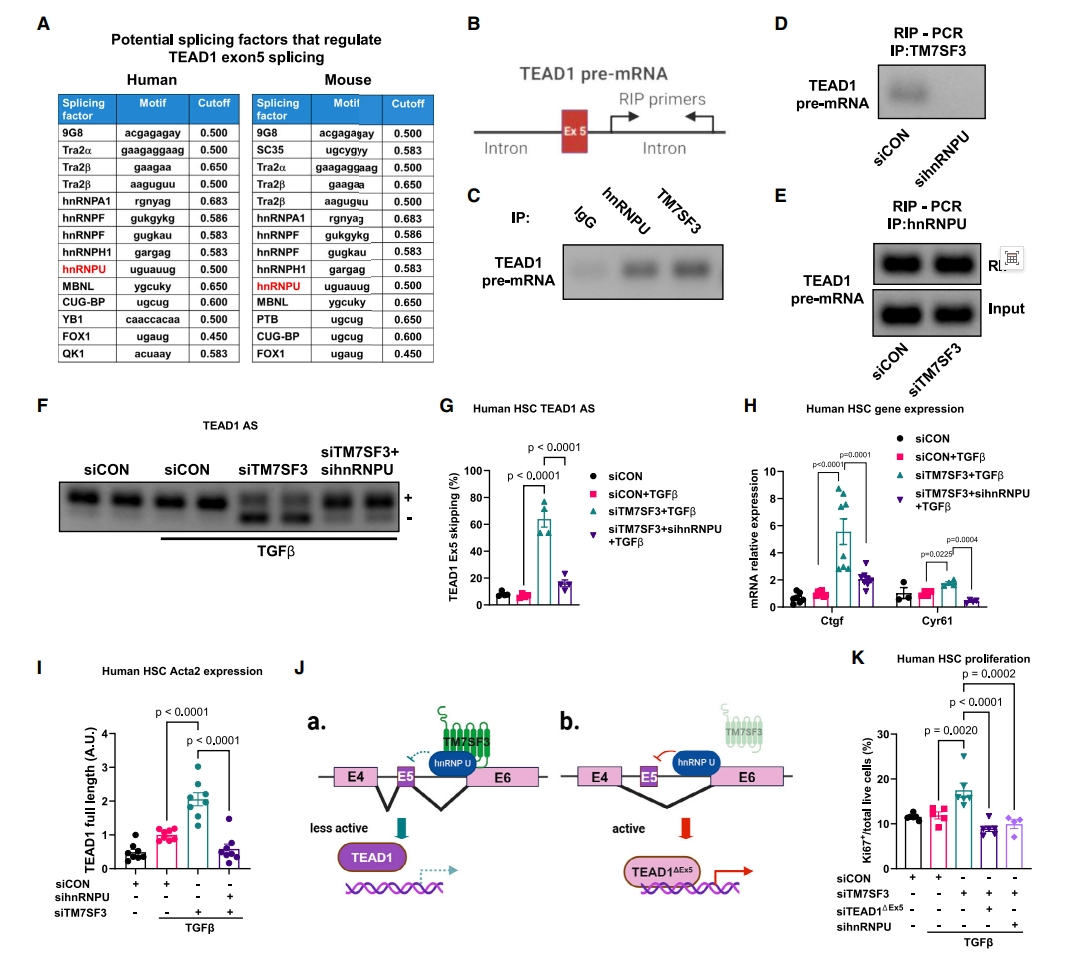
图四 TM7SF3通过结合hnRNPU剪接因子抑制TEAD1选择性剪接[7]
进一步评估TEAD1 AS对HSC活化和MASH进展的影响。研究者设计了一种反义寡聚体(ASO),靶向外显子5下游内含子5上的hnRNPU结合基序(ASO 56)(图五A)。用ASO 56或对照ASO处理人原代HSC 48小时,然后用TGFβ处理24小时。结果显示,TGFβ处理HSC增加了TEAD1△Ex5、TGFB1、ACTA2、TIMP1、Il-6和PDGFRB的表达;而用ASO 56预处理HSC会降低它们的表达(图五B),表明这种ASO方法靶向hnRNPU的有效性,也表明TGFβ增加TEAD1△Ex5表达的作用是通过hnRNPU介导的。hnRNPU与小鼠和人TEAD1前体mRNA的基序结合是相同的,因此,研究者还测试了ASO 56在小鼠中的作用。首先评估ASO 56对减少肝脏类器官纤维化程序的影响。在脂肪酸混合物诱导期间,每3天通过转染将ASO 56或对照ASO递送至肝脏类器官,发现ASO 56抑制了纤维化基因(图五C)和蛋白质表达(图五D和E);静息HSC标志物Bambi的表达更多(图五C);MCP1的基因和蛋白质表达降低(图五C-E)。
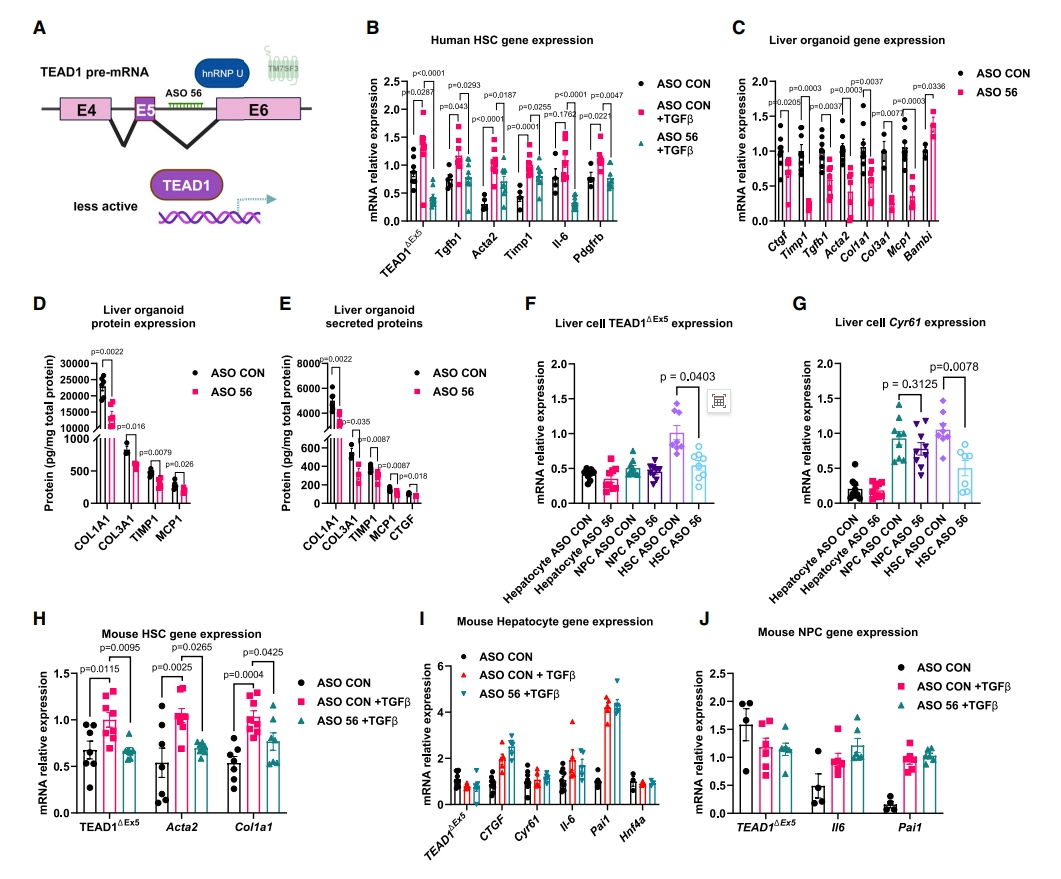
图五 靶向TEAD1前体mRNA的ASO使HSC失活[7]
注射到小鼠体内的ASO主要集中在肝脏中[13]。因此,研究者评估ASO 56在小鼠体内抑制TEAD1 AS的能力。单次注射ASO剂量(10 mg/kg;静脉注射),7天后收集肝细胞、NPC(去除HSC)和HSC的mRNA进行分析。尽管ASO 56不影响肝细胞或NPC中的TEAD1 AS,但是HSC中的TEAD1△Ex5减少了50%(图五F)。此外,与对照ASO相比,ASO 56降低了HSC中TEAD1靶基因Cyr61的基础表达(图五G)。原代小鼠HSC和NPC(去除HSC)以及肝细胞用ASO 56或对照ASO处理48小时,然后用TGFβ处理24小时。如图五H所示,ASO 56减少了外显子5跳跃,恢复到基础或对照状态。此外,ASO 56抑制了TGFβ诱导的Acta2和Col1a1的表达(图五H),且不影响TEAD1 AS或TGFβ诱导的肝细胞或NPC的Pai1或Il-6表达(图五I和J)。以上数据表明,靶向TEAD1前体mRNA的ASO可减少HSC活化。
最后,研究者评估ASO 56体内改善小鼠MASH表型的能力。从8周龄开始,雄性小鼠WD喂食6个月。在WD的最后2个月,小鼠接受五次静脉注射ASO 56或对照ASO(3 mg/kg)(图六A)。ASO 56处理不影响小鼠体重、肝脏质量或脂肪质量,降低了TEAD1靶基因Ctgf和Birc5的表达,而与MASH相关的Wwtr1表达增加不受影响(图六B-D)。此外,ASO 56降低了肝脏Tnfα表达(图六E)和IL-1β蛋白水平(图六F和H)。此外,与喂食NCD的小鼠相比,WD喂食并用对照ASO处理小鼠的HSC活化标志物PDGFRβ和α-SMA的表达显著增加;同时,ASO 56处理几乎完全逆转了这种诱导(图六F-H)。与这一结果相一致,ASO 56还使WD喂食小鼠的TIMP1表达正常化(图六I),降低了血液ALT水平(图六J),并减少了肝细胞衰老(图六K)。在WD 6个月后,ASO对照组小鼠出现了预期的纤维化程度;而在ASO 56处理的小鼠中,天狼星红染色和肝脏羟脯氨酸含量测量显示胶原蛋白含量显著降低(图六L和M)。以上数据表明,小鼠体内的ASO 56处理导致HSC纤维化减少,肝脏胶原沉积减少,具有抗MASH的作用。
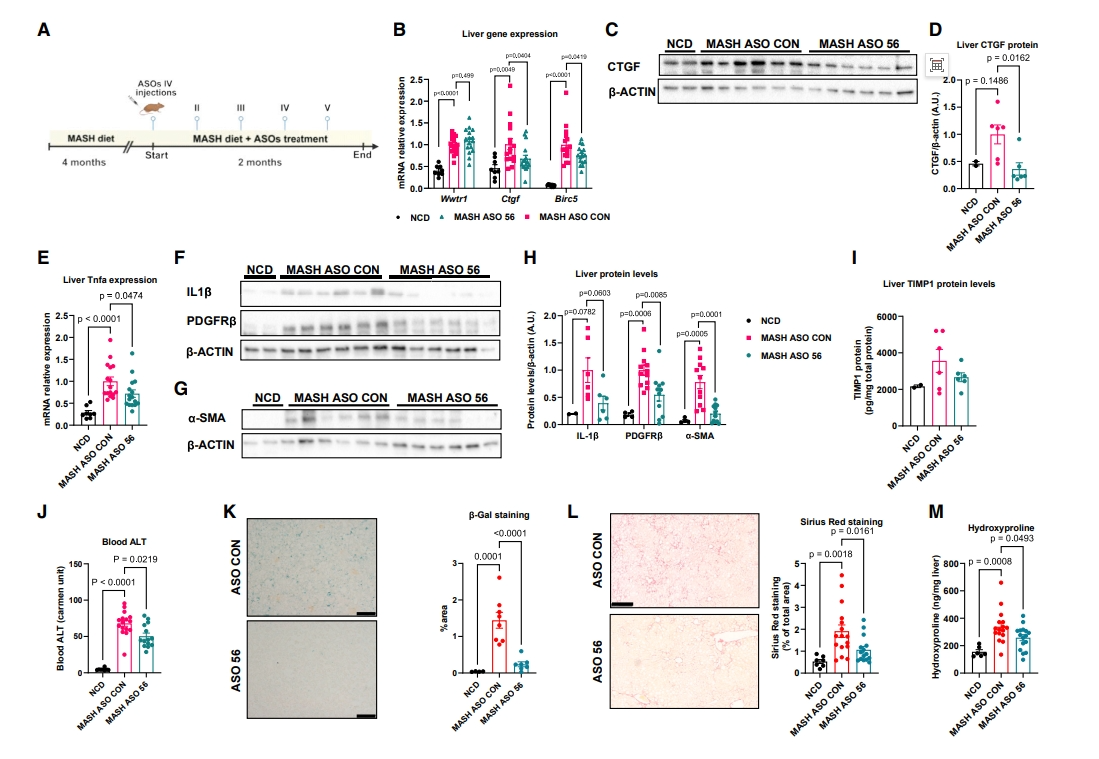
图六 靶向TEAD1前体mRNA的ASO体内促使HSC失活[7]
综上所述,该研究发现核定位的七次跨膜蛋白TM7SF3的缺失会在肝脏类器官、人原代HSC和代谢功能障碍相关脂肪肝炎(MASH)小鼠体内加速HSC的活化,从而激活纤维化程序和HSC增殖。TM7SF3抑制Hippo通路转录因子TEAD1 的选择性剪接,促进表达活性较低的TEAD1形式。而敲除TM7SF3后,剪接因子hnRNPU的释放促进了TEAD1的选择性剪接,导致抑制性外显子5缺失,产生了更活跃的TEAD1△Ex5形式,加速MASH 中的HSC激活和肝纤维化。该研究揭示了TM7SF3在抑制Hippo通路、HSC活化和MASH引起的纤维化发展方面的新作用,提示靶向性抑制TEAD1活化形式的ASO疗法在治疗MASH诱导肝纤维化中的应用潜力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Benedict M, Zhang X: Non-alcoholic fatty liver disease: An expanded review. World journal of hepatology 2017, 9(16):715-732.
2. Vieira Barbosa J, Lai M: Nonalcoholic Fatty Liver Disease Screening in Type 2 Diabetes Mellitus Patients in the Primary Care Setting. Hepatology communications 2021, 5(2):158-167.
3. Zisser A, Ipsen DH, Tveden-Nyborg P: Hepatic Stellate Cell Activation and Inactivation in NASH-Fibrosis-Roles as Putative Treatment Targets? Biomedicines 2021, 9(4).
4. Bürglin TR: The TEA domain: a novel, highly conserved DNA-binding motif. Cell 1991, 66(1):11-12.
5. Boopathy GTK, Hong W: Role of Hippo Pathway-YAP/TAZ Signaling in Angiogenesis. Frontiers in cell and developmental biology 2019, 7:49.
6. Mokhtari RB, Ashayeri N, Baghaie L, Sambi M, Satari K, Baluch N, Bosykh DA, Szewczuk MR, Chakraborty S: The Hippo Pathway Effectors YAP/TAZ-TEAD Oncoproteins as Emerging Therapeutic Targets in the Tumor Microenvironment. Cancers 2023, 15(13).
7. Isaac R, Bandyopadhyay G, Rohm TV, Kang S, Wang J, Pokhrel N, Sakane S, Zapata R, Libster AM, Vinik Y et al: TM7SF3 controls TEAD1 splicing to prevent MASH-induced liver fibrosis. Cell metabolism 2024, 36(5):1030-1043.e1037.
8. Isaac R, Goldstein I, Furth N, Zilber N, Streim S, Boura-Halfon S, Elhanany E, Rotter V, Oren M, Zick Y: TM7SF3, a novel p53-regulated homeostatic factor, attenuates cellular stress and the subsequent induction of the unfolded protein response. Cell death and differentiation 2017, 24(1):132-143.
9. Isaac R, Vinik Y, Mikl M, Nadav-Eliyahu S, Shatz-Azoulay H, Yaakobi A, DeForest N, Majithia AR, Webster NJG, Shav-Tal Y et al: A seven-transmembrane protein-TM7SF3, resides in nuclear speckles and regulates alternative splicing. Iscience 2022, 25(11):105270.
10. Harrison SP, Baumgarten SF, Verma R, Lunov O, Dejneka A, Sullivan GJ: Liver Organoids: Recent Developments, Limitations and Potential. Frontiers in medicine 2021, 8:574047.
11. Bangru S, Arif W, Seimetz J, Bhate A, Chen J, Rashan EH, Carstens RP, Anakk S, Kalsotra A: Alternative splicing rewires Hippo signaling pathway in hepatocytes to promote liver regeneration. Nature structural & molecular biology 2018, 25(10):928-939.
12. Lee Y, Rio DC: Mechanisms and Regulation of Alternative Pre-mRNA Splicing. Annual review of biochemistry 2015, 84:291-323.
13. Prakash TP, Graham MJ, Yu J, Carty R, Low A, Chappell A, Schmidt K, Zhao C, Aghajan M, Murray HF et al: Targeted delivery of antisense oligonucleotides to hepatocytes using triantennary N-acetyl galactosamine improves potency 10-fold in mice. Nucleic acids research 2014, 42(13):8796-8807.



