技术分享:GPR75缺失可预防非酒精性脂肪肝
非酒精性脂肪肝(NAFLD)已成为慢性肝病的主要原因,然而,目前还没有专门治疗该病的药物获批。NAFLD的特征是在肝脏积累过量的脂肪,且随着疾病的进展,可发展为纤维化、脂肪变性和非酒精性脂肪肝炎(NASH)。超重和肥胖经常合并发生NAFLD,约75%的超重个体和90%的极度肥胖个体同时患有NAFLD [1]。肥胖也会显著增加NAFLD患者的死亡率。目前NAFLD的治疗策略是行为矫正,通过增加身体活动和减少食物摄入以促进体重减轻[2]。然而,大约80%通过改变生活方式减轻体重的人出现了反弹,表明需要额外的治疗方式介入[3]。
最近一项大规模人类外显子组研究报告揭示了G蛋白偶联受体75(GPR75)的功能缺失突变与较低的体脂和BMI有关[4]。同样,靶向失活小鼠Gpr75可预防饮食诱导的肥胖(DIO)[5],提示该受体在体重调节中起着重要作用。然而,缺失GPR75促进低体脂和BMI的机制尚未明确。尽管许多基因的破坏会促进消瘦,但已被证明会导致一种脂肪代谢障碍,这与脂肪肝的风险增加相关。因此亟需明确对GPR75的扰动是否影响肝脏脂质的积累。
2024年5月,Cell Metabolism期刊报道了一项研究,证明了孤儿G蛋白偶联受体75(GPR75)在非酒精性脂肪肝(NAFLD)相关的肝脏脂质积累中的功能。研究者发现Gpr75在小鼠的大脑中表达丰富,包括调节食欲和肥胖的主要区域下丘脑。Gpr75敲除小鼠会自主减少高脂肪饮食的摄入量,以保持能量平衡。进一步对欧洲人群生物样本库进行分析表明,GPR75功能缺失突变与肝脂肪变性风险的降低相关[6]。
首先,研究者表征小鼠Gpr75的表达谱式。分析Gpr75的mRNA表达,发现在小鼠大脑中表达最丰富,而在肝脏中的表达可以忽略不计(图一A)。使用原位杂交(RNAScope)绘制Gpr75 mRNA的表达图谱,发现其广泛分布在整个大脑中。分析由小鼠下丘脑的18个单细胞RNA-seq数据集组成的HypoMap[7],发现在HypoMap所包含的384925个细胞中,Gpr75阳性细胞有11970个,占所有细胞的3.12%,且大多为神经元(10609个细胞,88.6%)。接下来,研究者重点研究Gpr75+VE前庭传出神经元,并重新生成均匀流形近似和投影(UMAP)图(图一B)。HypoMap可分成七个层级的聚类,在簇C185中,Gpr75+VE细胞存在于所有的130个神经元簇,其中C185-72: Fam122b.Vipr2.GABA-2数量最多,占所有Gpr75+VE细胞的4.26%,预测其位于视交叉上核(SCN,图一C-F)。进一步聚焦食欲和肥胖的关键调节因子Npy、Agrp和GABA共表达的“NAG”神经元[8],使用Npy-hrGFP小鼠确认大约四分之一的NAG神经元共表达Gpr75(图一G)。以上数据表明,Gpr75在小鼠大脑中异质性表达,包括显著调节食物摄入和脂质积累的区域和特定神经元群。
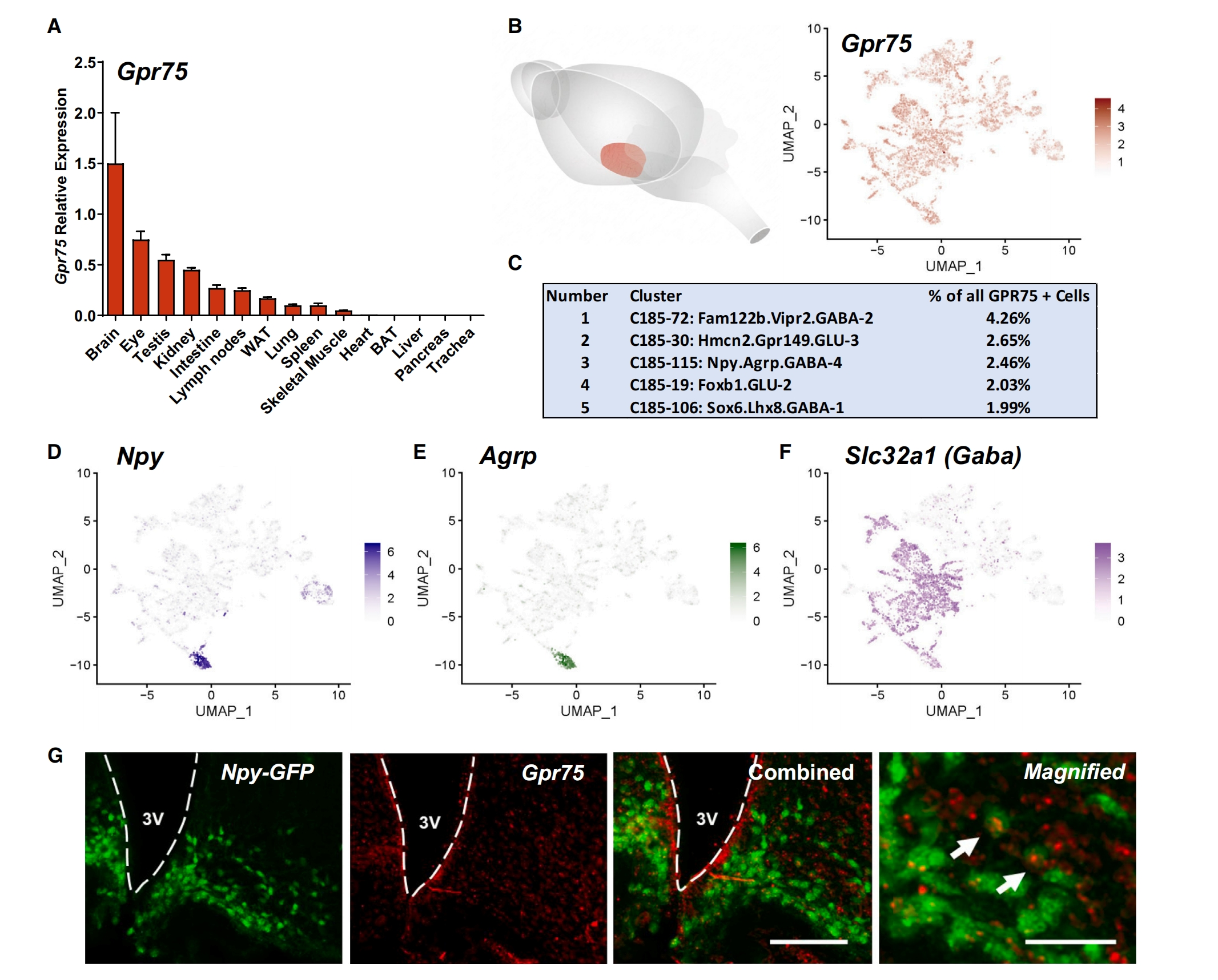
图一 表征Gpr75的表达[6]
接下来,研究者检测Gpr75是否为控制正常食欲所必需的。利用CRISPR-Cas9方法构建了Gpr75 KO小鼠,Gpr75缺失5个碱基对(bp)导致蛋白过早终止(图二A和B)。当正常饮食时,雄性和雌性Gpr75 KO小鼠消耗的热量与野生型(WT)小鼠相似(图二C-G)。然而,当喂食高脂饮食(HFD)时,雄性和雌性Gpr75 KO小鼠会自主减少摄入量,以保持消耗与正常饮食时相当的卡路里(图二C-G)。相比之下,WT小鼠在HFD饮食后显著增加了每日热量的摄入(图二D-G),促进了肥胖。膳食结构分析显示,与正常饮食相比,两种小鼠在摄食HFD时每天的摄入食量和持续时间都有所减少,这与HFD饮食更有热量和饱腹感相一致(图二H和I)。然而,WT小鼠通过更频繁的进食(图二J)和更短的进食间隔(图二K)增加了每日HFD热量摄入(图二D-G)。而Gpr75 KO小鼠在没有改变膳食频率和两餐之间时间的情况下,显著减少了HFD的摄入和饮食时间(图二H-L)。这些结果表明,当提供高热量饮食时,Gpr75 KO小鼠仅消耗适当数量的卡路里来维持能量平衡。评估能量消耗,观察到Gpr75 KO小鼠的体力活动明显增加(图二M–P),特别是在黑暗期开始时。然而,当小鼠正常饮食或急性4天HFD饮食后,两组小鼠在总体日常能量消耗方面未检测到差异(图二Q和R)。以上数据表明,与喂食HFD的WT小鼠相比,Gpr75 KO小鼠在黑暗期的身体活动更为活跃,这与它们在黑暗周期中相对于休息水平的能量消耗更高是一致的。
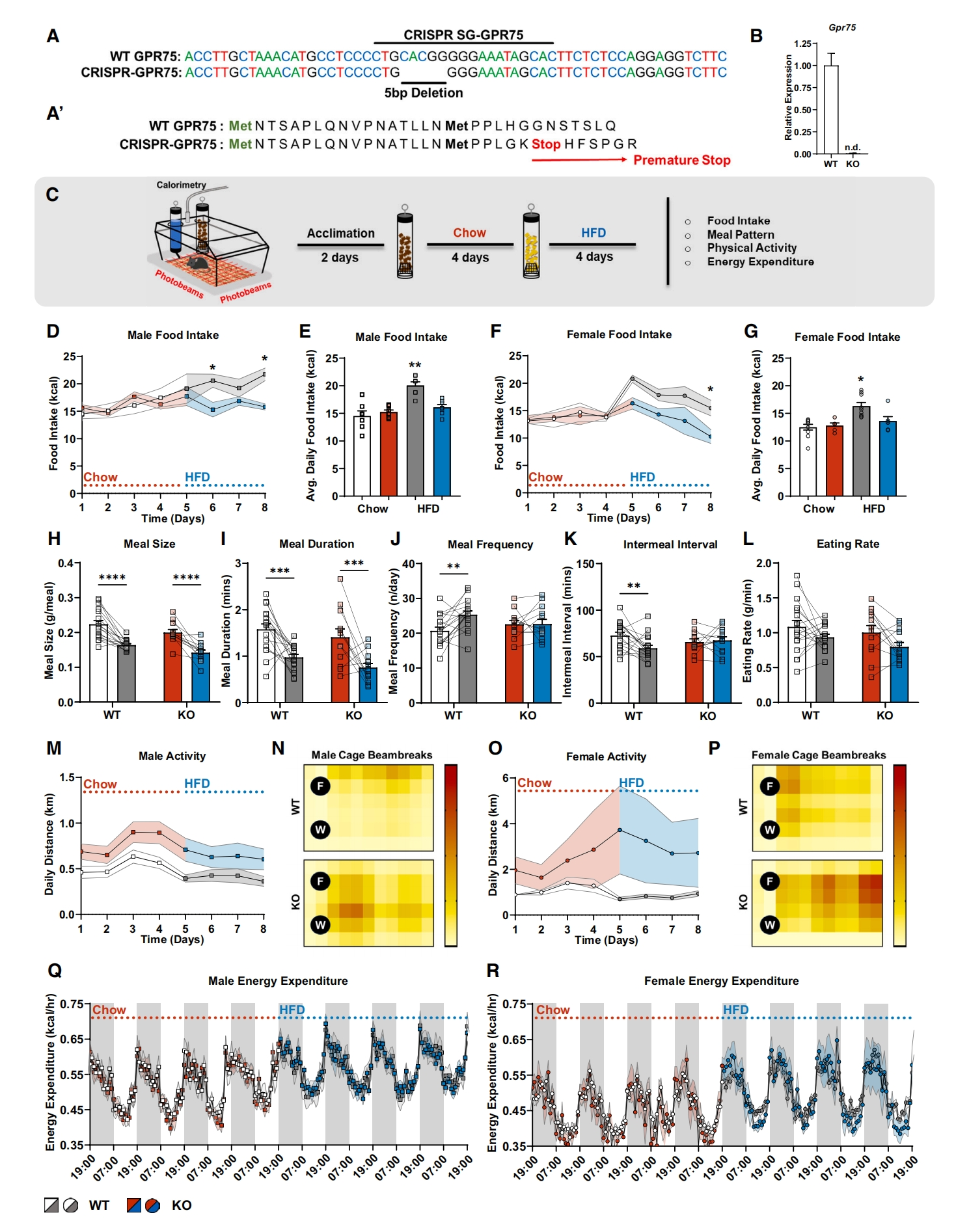
图二 Gpr75 KO小鼠在高脂饮食时食物摄入量减少且活动增加[6]
随后,研究者在Gpr75 KO小鼠中研究HFD饮食对体重和脂质积累的影响。与HFD诱导的WT小鼠体重增加相比,雄性Gpr75 KO小鼠的体重减少了50%,雌性KO小鼠体重减少了76%(图三A和F)。在脂肪量上,雄性KO小鼠减少了35%,雌性减少了74%(图三B和G),并且在内脏和皮下脂肪组织都出现体脂的减少(图三C-E、H-J)。性别比较显示,与雄性KO小鼠相比,HFD饮食诱导的雌性KO小鼠体重和体脂明显减少更多(图三K和L),内脏脂肪细胞也发生了显著变化(图三M)。进一步通过qPCR分析支持KO雌性小鼠白色脂肪组织的褐变特征(图三N-S)。以上数据表明,Gpr75功能破坏可以保护雄性和雌性小鼠免受高脂饮食诱导的体脂增加,其中对雌性小鼠的保护效果更为明显。
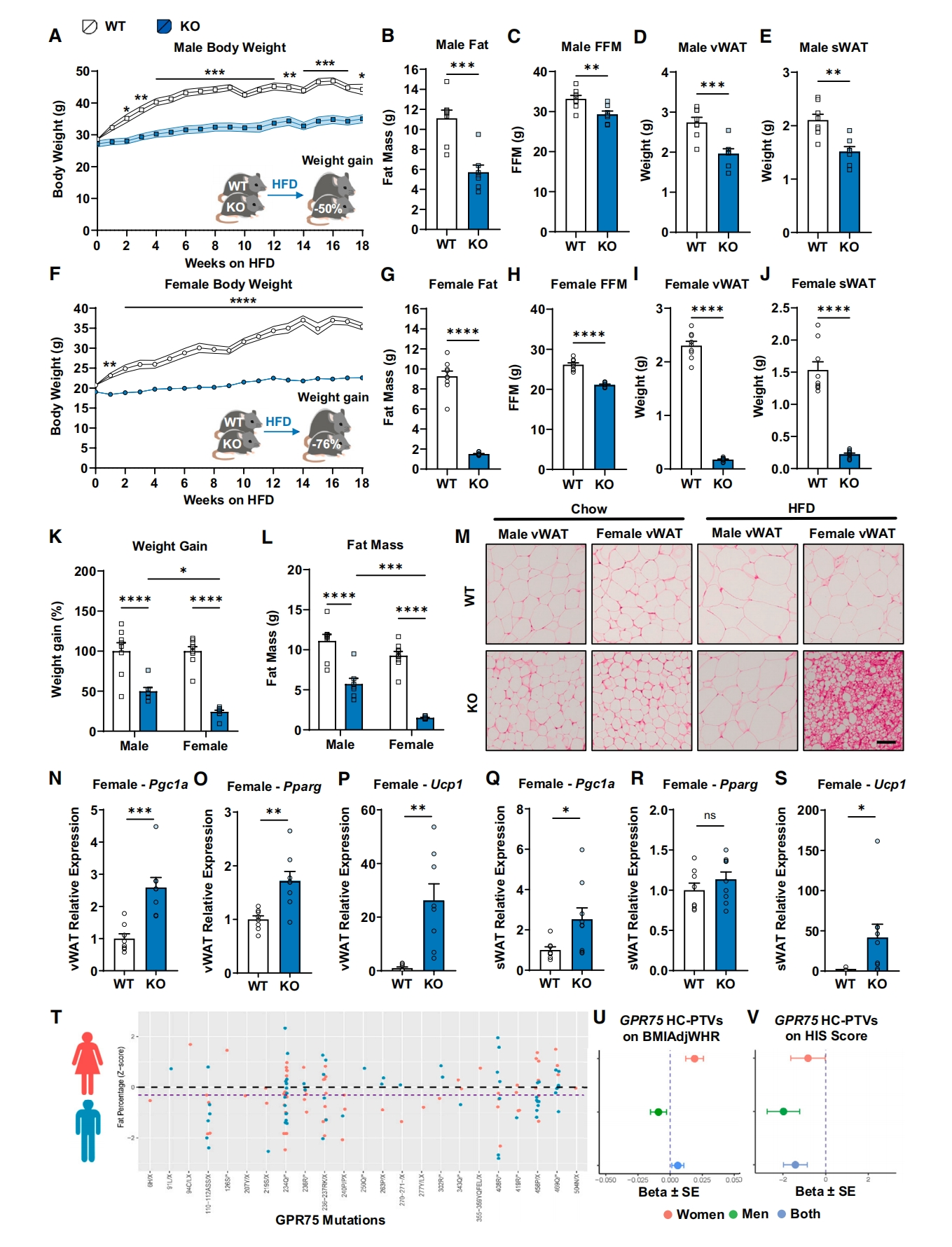
图三 Gpr75的缺失与小鼠和人类较低的肥胖率有关[6]
有研究报道称,GPR75功能缺失(LOF)变异与645626个人群数据分析的较低BMI和全身脂肪有关[4]。研究者推测GPR75可能对人体体脂的影响也具有性别效应。于是,研究者使用公开可用的由428719名欧洲个体组成的外显子组数据,鉴定出145名个体在GPR75编码区携带LOF变体,其中包含68名男性和77名女性。与非携带者相比,GPR75 LOF携带者的全身脂肪百分比较低,而特定GPR75突变相关的男性和女性的体脂百分比没有差异(图三T)。然而,当使用腰臀比(WHR)作为替代指标来检查GPR75 LOF对体脂分布的影响时,GPR75 LOF变体与女性更高的WHR相关,而男性则没有这种影响(图三U)。由于GPR75 LOF变异罕见,研究者通过肝功能测试检测GPR75 LOF变体是否可以预防或促进非酒精性肝病(NALD),检查了血液丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平以及肝脂肪变性指数(HIS)。结果显示,尽管GPR75 LOF携带者与非携带者相比,血液ALT和AST水平无法区分,但他们确实显示出BMI依赖的较低HIS评分(图三V)。这些结果表明,GPR75 LOF携带者的肝脏脂质积累的风险降低。
最后,研究者探究Gpr75对NAFLD的影响。给予Gpr75 KO和WT小鼠HFD饮食4.5个月,发现雄性和雌性Gpr75 KO小鼠的肝脏重量减轻,甘油三酯和脂质百分比降低(图四A-J),对应的脂滴储存标志物Pparg和Fabp4的表达较低(图四K、L、Q和R),细胞外基质标志物Col1a1、Col2a1、Timp1和aSMA的表达也降低(图四M-P、S-V),表明HFD诱导的肝纤维化较少。这些发现支持了Gpr75的缺失是通过有益地改变能量平衡来减少脂肪量,而不是像脂肪营养不良那样限制脂肪组织的扩张。以上数据表明,与WT小鼠相比,雄性和雌性Gpr75 KO小鼠免受HFD诱导的肝脏脂质积聚的影响,显著性降低NAFLD的严重程度。
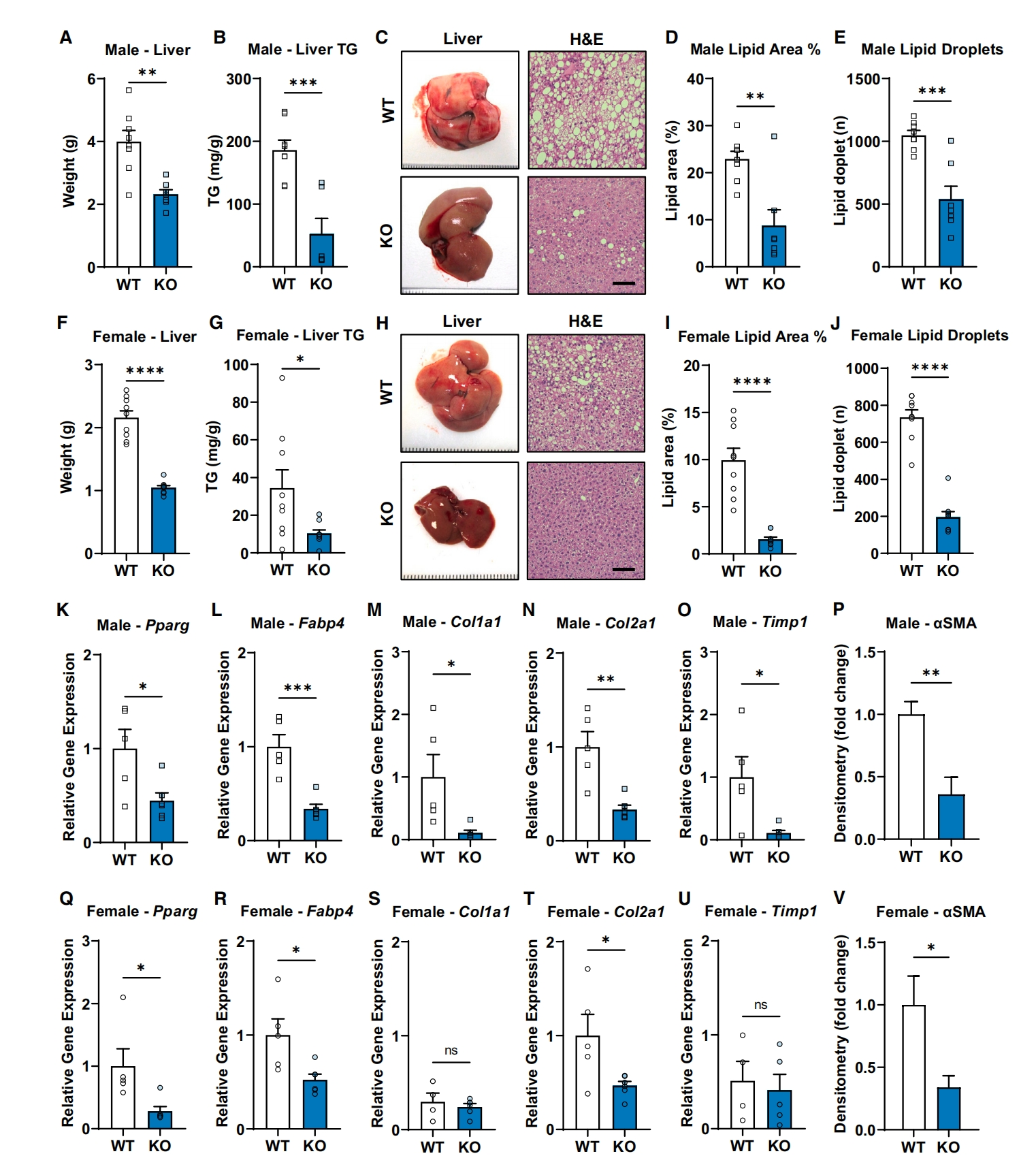
图四 Gpr75 KO小鼠免患脂肪肝[6]
综上所述,研究者首次绘制了大脑表达Gpr75的细胞图谱,发现其表达在调节食物摄入和脂质积累的区域和特定神经元。Gpr75的功能缺失可以显著性预防小鼠非酒精性脂肪肝的发展。欧洲人群分析也表明GPR75功能丧失突变与降低肝脂肪变性风险相关。该研究对GPR75的表达和功能进行了深入的探索,证明其是一个预防和治疗非酒精性脂肪肝的有效靶点,具有广阔的应用前景。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Polyzos SA, Kountouras J, Mantzoros CS: Obesity and nonalcoholic fatty liver disease: From pathophysiology to therapeutics. Metabolism: clinical and experimental 2019, 92:82-97.
2. Rinella ME, Sanyal AJ: Management of NAFLD: a stage-based approach. Nature reviews Gastroenterology & hepatology 2016, 13(4):196-205.
3. Wing RR, Phelan S: Long-term weight loss maintenance. The American journal of clinical nutrition 2005, 82(1 Suppl):222s-225s.
4. Akbari P, Gilani A, Sosina O, Kosmicki JA, Khrimian L, Fang YY, Persaud T, Garcia V, Sun D, Li A et al: Sequencing of 640,000 exomes identifies GPR75 variants associated with protection from obesity. Science 2021, 373(6550).
5. Hossain S, Gilani A, Pascale J, Villegas E, Diegisser D, Agostinucci K, Kulaprathazhe MM, Dirice E, Garcia V, Schwartzman ML: Gpr75-deficient mice are protected from high-fat diet-induced obesity. Obesity (Silver Spring, Md) 2023, 31(4):1024-1037.
6. Leeson-Payne A, Iyinikkel J, Malcolm C, Lam BYH, Sommer N, Dowsett GKC, Martinez de Morentin PB, Thompson D, Mackenzie A, Chianese R et al: Loss of GPR75 protects against non-alcoholic fatty liver disease and body fat accumulation. Cell metabolism 2024, 36(5):1076-1087.e1074.
7. Steuernagel L, Lam BYH, Klemm P, Dowsett GKC, Bauder CA, Tadross JA, Hitschfeld TS, Del Rio Martin A, Chen W, de Solis AJ et al: HypoMap-a unified single-cell gene expression atlas of the murine hypothalamus. Nature metabolism 2022, 4(10):1402-1419.
8. Heisler LK, Lam DD: An appetite for life: brain regulation of hunger and satiety. Current opinion in pharmacology 2017, 37:100-106.



