技术分享:活跃期早期运动促进小鼠骨骼生长
据调查,62%的男性和46%的女性渴望长得更高一些。儿童和青少年时期获得的骨骼长度和质量对于成年期的身高决定和骨骼健康至关重要[1]。众所周知,有多种可调节外部因素能影响骨骼生长,包括钙和维生素D等营养的摄入,以及体育活动和运动锻炼[2]。特别是运动具有增强骨骼质量和强度的潜力,可改善骨形成[3]。值得注意的是,什么时候运动是影响运动生理效应的重要变量之一,运动的效果可能因时间不同而有所差异[4]。
骨骼的生长主要依赖于生长板的增殖区和肥大区的软骨细胞活动,后者负责产生和组织细胞外基质,促使骨骼形成和纵向生长[5]。运动有利于骨骼代谢和全身能量稳态,可激活AMPK和sirtuins等分子机制,协同调节细胞代谢以满足运动所需[6]。而这些生物过程受生物钟调控,具有昼夜节律性,可能导致一天中不同时间的运动效果有所不同。然而,特定时间的运动是否影响骨骼生长及其潜在机制尚未得到充分研究。
2024年5月,Nature metabolism期刊报道了一项研究,发现在小鼠活跃期早期(人类视角为早晨)进行运动,可显著促进小鼠骨骼生长。转录组学和代谢组学方法表明,活跃期早期运动可上调骨骼生长相关基因的表达,并诱导与骨骼代谢相关的昼夜节律。氧化磷酸化(OXPHOS)在活跃期早期达到峰值,协同促进骨生长。药理学研究还发现OXPHOS激活剂能有效增加骨骼的长度和质量。基于此,研究者构建了一个信号网络来预测运动对骨骼生长的影响,揭示了人类运动生理学的复杂性[7]。
首先,研究者探索特定时间的运动对小鼠骨骼生长的影响。将雄性小鼠随机分成7组:久坐不动对照组(Sed)和6个运动组(Exe),运动组分别在6个时间点进行30分钟的跑步机跑步,每周运动5天。其中ZT1,ZT5和ZT9设置在小鼠休息期运动,ZT13、ZT17和ZT21为小鼠活跃期运动(图一a)。micro-CT结果显示,与Sed对照组相比,ZT1、ZT13、ZT17和ZT21运动组小鼠的四肢骨骼发育显著增强,而ZT5和ZT9运动组没有观察到明显的改善(图一b和c)。特别是在活跃期早期(ZT13)运动的雄性小鼠股骨长度增加了5%,骨体积分数(BV/TV)和骨小梁厚度(Tb.Th)分别增加了26%和54%(图一b和c)。在休息期或活跃期运动对小鼠的食物消耗或体重没有产生影响。检查股骨生长板形态,发现ZT1、ZT13、ZT17和ZT21运动组小鼠的增殖区(PZ)和肥大区(HZ)的高度显著增加,每列软骨细胞数量显著增加(图一d–h)。一致地,ZT13运动组小鼠软骨化中心的EdU+细胞显著增加(图一i和j),钙黄绿素染色显示股骨生长板成骨中心的矿物附着率(MAR)和骨形成率显著提高(图一k-l)。ZT1组小鼠MAR相比Sed对照组仅增加了1.8倍,而ZT13组小鼠增加了3倍(图一k-l)。另外,研究者还使用雌性小鼠重复该实验,获得的数据与雄性小鼠相一致。以上数据表明,在活跃期早期(ZT13)运动比在休息期(ZT1、ZT5、ZT9)、活跃期中期(ZT17)以及活跃期晚期(ZT21)更能加速骨骼生长。
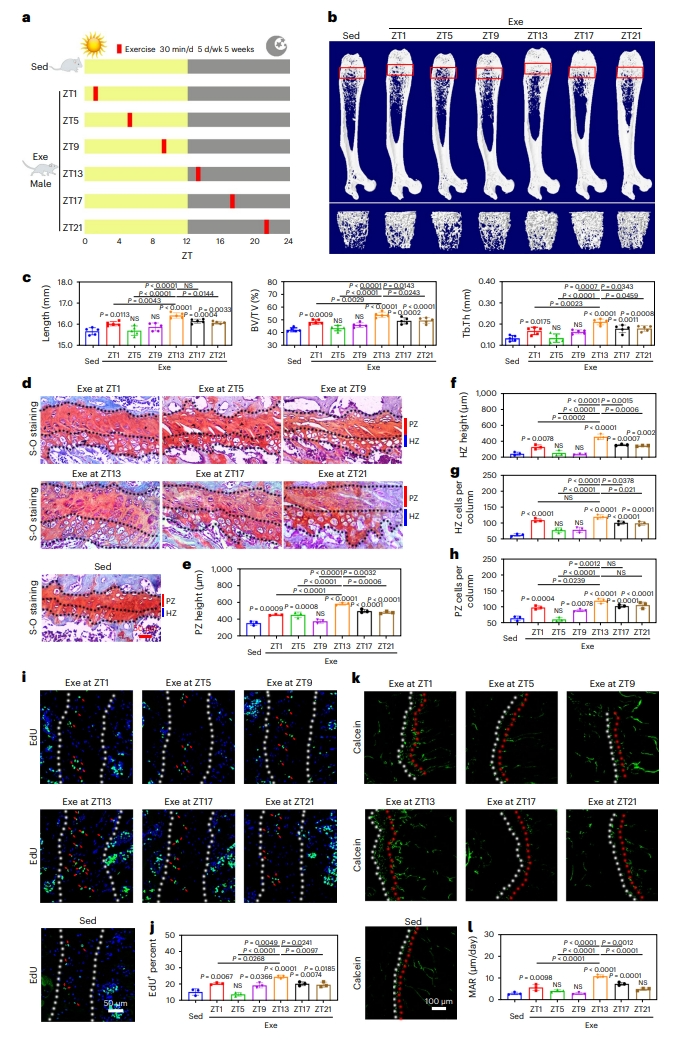
图一 活跃期早期运动可以显著促进小鼠骨骼生长[7]
接着,研究者研究特定时间点的运动对骨组织的反应,小鼠分别在ZT1、ZT13、ZT17或ZT21时间点跑步30分钟,运动5小时后收集小鼠软骨成骨组织进行转录差异比较分析(图二a)。结果显示,ZT13运动组有相当大比例的转录本和基因表达发生了显著变化,增加和减少分别占总转录本的10.1%和10.3%(图二b)。相反,ZT1运动组差异变化基因的比例较低,分别只有6.4%和3.9%;而ZT17和ZT21运动组的变化居中(图二b)。在所有运动组中有27个共同上调的基因(图二c)。GO和KEGG分析表明,ZT13运动组上调基因主要富集在骨生长、基质生物合成和能量代谢方面(图二d–f),以及成骨相关通路AMPK的特异性激活(图二g)。而HIF-1信号传导主要在ZT1运动组中富集(图二g)。ZT13运动组还表现出氧化磷酸化(OXPHOS)和三羧酸循环(TCA)相关基因显著富集,而ZT21和ZT1运动组则表现为糖酵解相关基因显著富集(图二f)。此外,27个共同上调的基因在骨化和基质生物合成中富集,尤其在ZT13运动组中的上调更加显著(图二h和i),以及Wnt信号通路、细胞周期和基质生物合成相关基因更加显著的表达上调(图二j)。具体而言,相较于其他组,ZT13运动组中细胞增殖标志物CCND2和SOX9,基质合成生物标志物COL2α1和ACAN的表达显著升高(图二k–n)。以上数据表明,活跃期早期运动可以显著增强骨骼生长相关基因的表达。
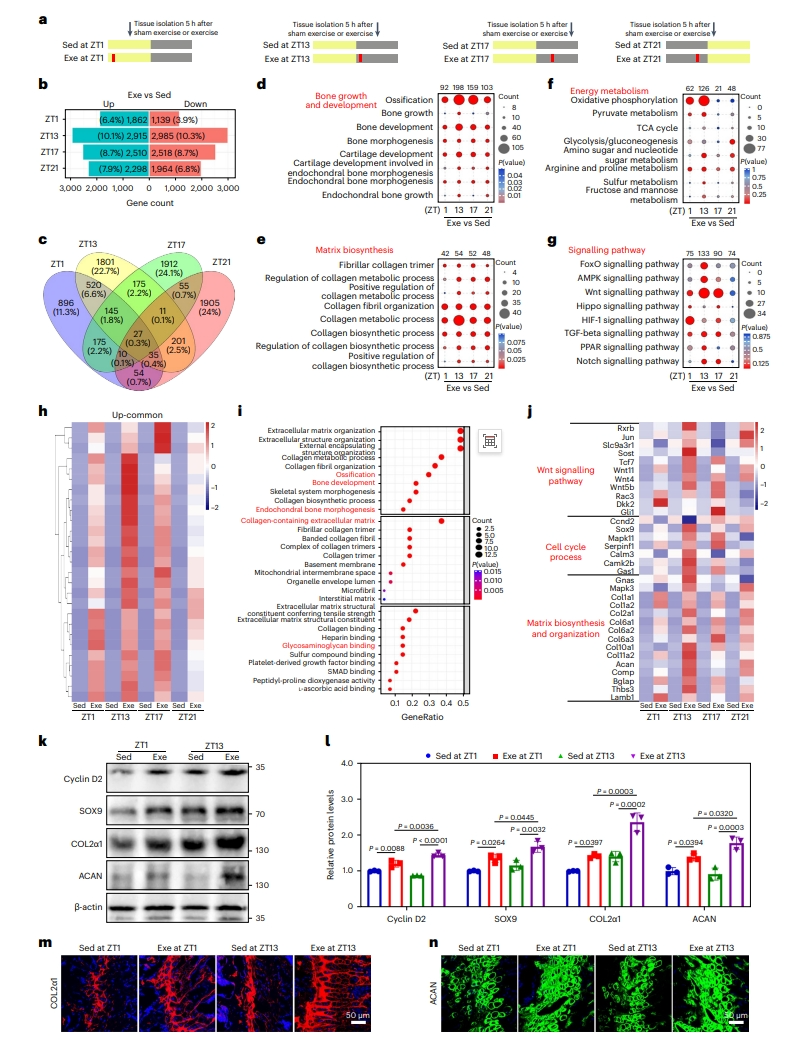
图二 活跃期早期运动促进骨骼生长相关基因的表达[7]
下一步,研究者探究活跃期早期运动的潜在影响因素。在各组小鼠运动后1小时开始收集0小时样品,之后每6小时收集一组样品,共设0、6、12、18、24、30、36、42和48小时9组样品(图三a)。Venn图显示,Sed对照组中软骨成骨组织大约1600个基因(占总数的6.7%)表现出节律性表达,而在ZT13运动组有6415个基因获得了新的振荡,明显超过其他运动时间点的反应(图三b)。ZT13运动组保持了与Sed对照组相当的相位分布,而ZT1、ZT5、ZT17或ZT21运动组出现明显的振荡基因相位的重新分布(图三c)。进一步根据基因表达模式将基因分配到多个聚类中,在Sed对照组中鉴定出4个表达模式相似的聚类,在活跃期运动(ZT13、ZT17或ZT21)可以保持与Sed对照组相似的表达模式,相反地在休息期运动(ZT1或ZT5)的昼夜节律表达模式发生了显著改变(图三d)。昼夜节律表达差异基因的GO分析显示,ZT13运动组主要富集在骨骼发育和代谢过程(图三e)。在核心昼夜节律转录机制方面,ZT13运动组表现为内在振荡的持续存在,而核心时钟基因Bmal1的节律性表达在ZT1运动组中基本缺失(图三f)。以上数据表明,活跃期早期运动可以增加节律性基因表达和维持昼夜节律稳态,最终协同作用促进骨骼生长。
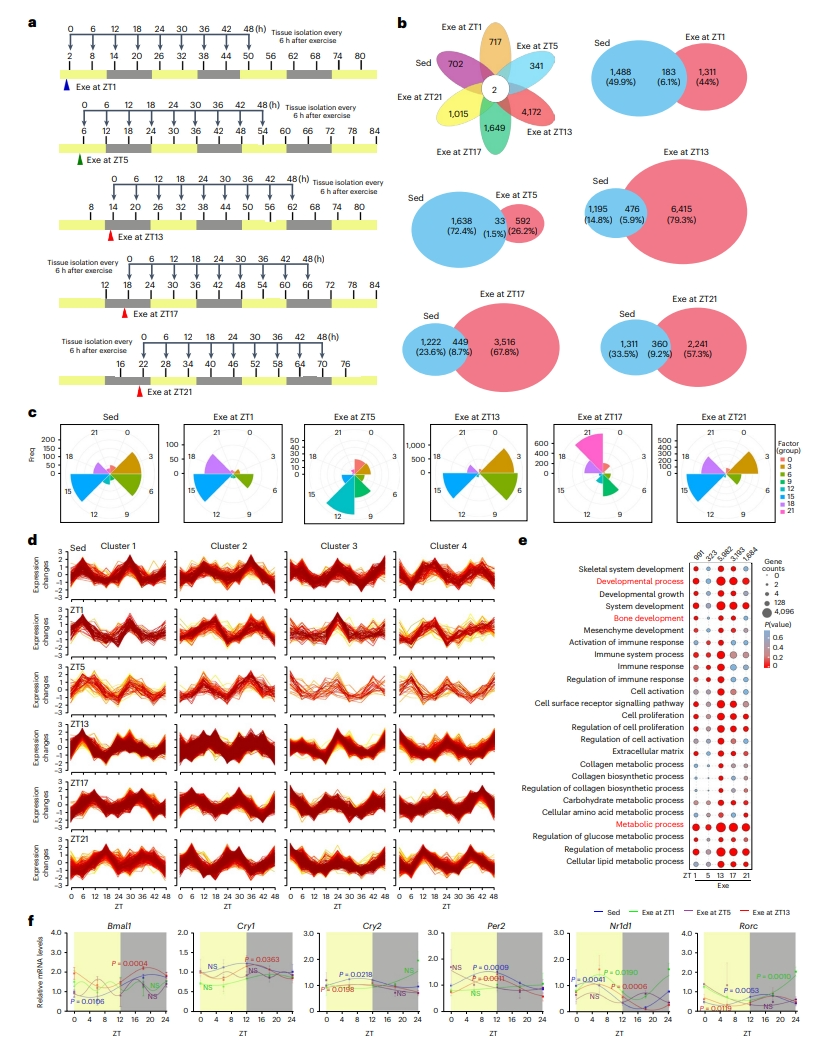
图三 活跃期早期运动与内在骨骼代谢节律协同激活骨骼生长相关基因表达[7]
研究者进一步探索活跃期早期运动促进骨骼生长的潜在机制。基于ZT13组在OXPHOS信号通路的富集(图二f),研究者使用PET-CT监测小鼠运动后2-[18F]-氟-2-脱氧-葡萄糖(18F-FDG)的摄取,发现运动导致股骨软骨成骨组织中的葡萄糖摄入量显著升高(图四a和b)。然而,ZT13运动组出现更加显著的ATP产生增加,氧化烟酰胺腺嘌呤二核苷酸(NAD+)/还原烟酰胺腺嘌呤二核苷酸(NADH)比值增加,表明不同时间点运动的葡萄糖代谢活性不同(图四c和d)。能量靶向代谢组研究发现,ZT13运动组与TCA和OXPHOS相关的代谢物增加,如α-酮戊二酸和L-苹果酸;相反,ZT1运动组出现糖酵解代谢产物升高,如β-D-果糖6-磷酸和乳酸(图四e)。系统分析转录组和代谢组数据,发现ZT13运动组编码TCA循环调节酶的9个差异表达基因(DEG)显著上调(图四f)。而ZT1运动组显示出编码糖酵解必需调节酶的DEG表达增加(图四g)。分析OXPHOS相关基因的表达模式,活跃期早期运动增加了OXPHOS基因节律性表达的幅度。相应地,编码OXPHOS关键酶的蛋白在ZT13运动组显著上调,而编码糖酵解酶的蛋白在ZT1运动组表达上调(图四h 和i)。以上数据表明,活跃期早期运动可引起更高水平的TCA循环、OXPHOS和产生更多的ATP。
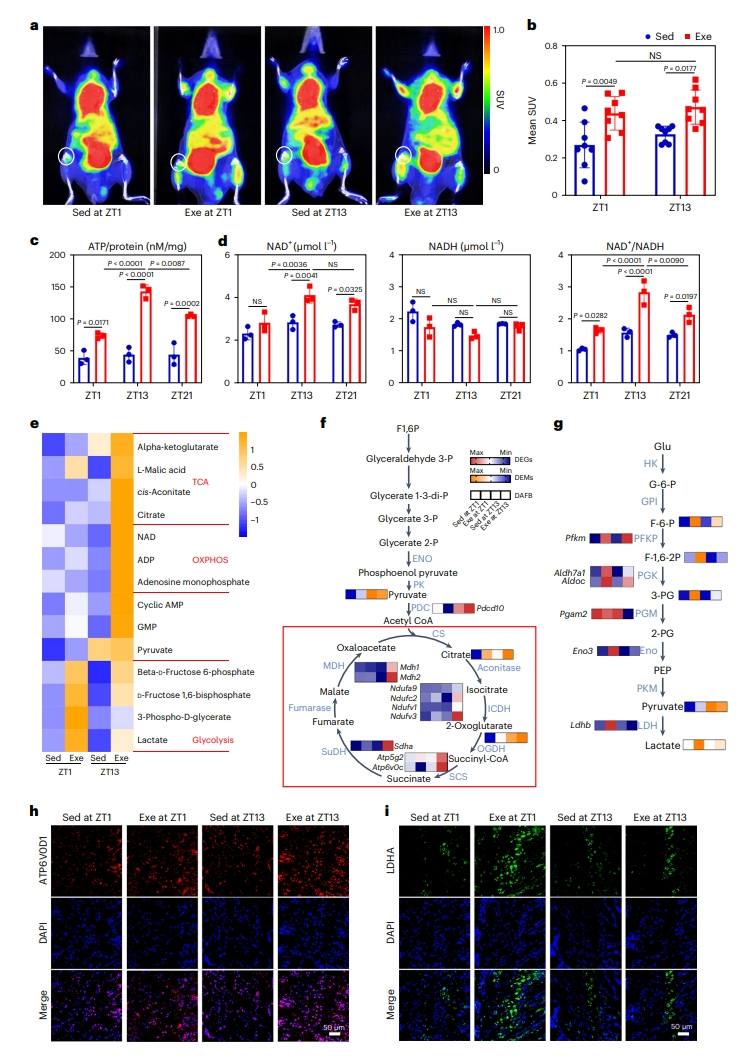
图四 活跃期早期运动显著激活OXPHOS[7]
随后,研究者探索增加骨骼长度和质量的策略。向野生小鼠腹膜或髓内注射OXPHOS激活剂5-氨基咪唑-4-羧酰胺核糖核苷(AICAR),剂量为每天200 mg/kg,持续注射28天。micro-CT结果显示,AICAR处理小鼠表现出显著增加的骨骼生长(图五a和b)。S-O染色分析显示,在活跃期早期ZT13注射AICAR的小鼠PZ软骨细胞数量显著增加(图五c和d),软骨细胞增殖和基质生物合成均显著增强(图五e–h)。以上数据表明,在活跃期早期药物激活OXPHOS可能是一种很有前景的刺激骨骼生长的方法。
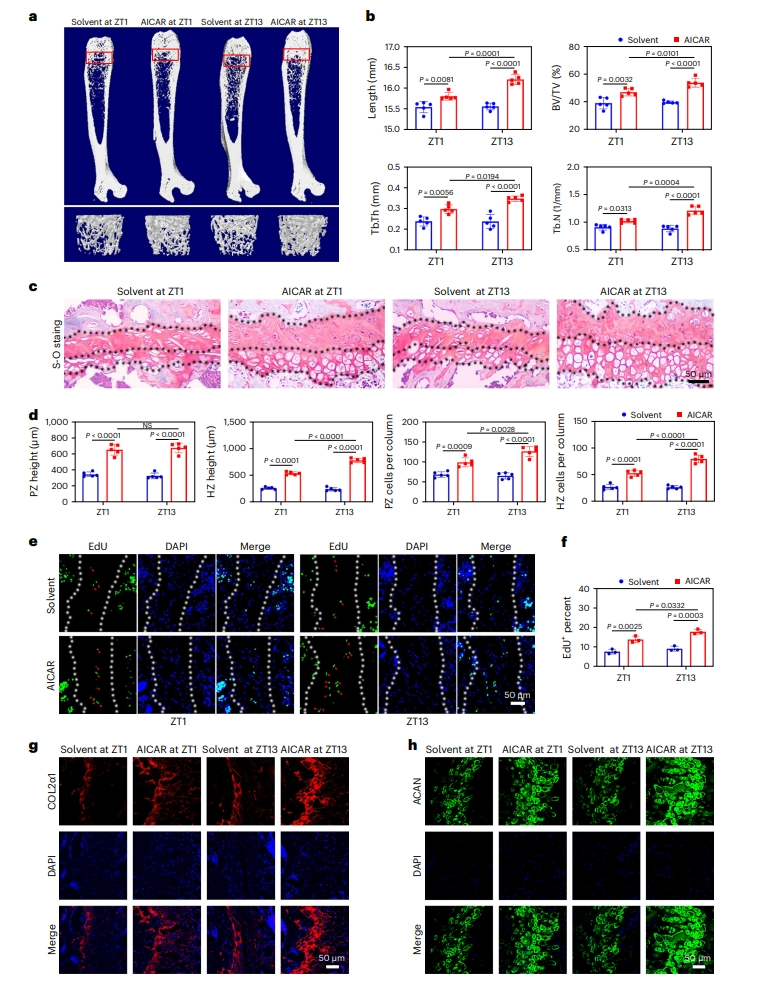
图五 活跃期早期药物激活OXPHOS可促进骨骼生长[7]
最后,研究者对参与骨骼发育的信号通路进行全面的分析,揭示了内源性信号的两个主要分支,分别对应于活跃期和休息期(图六)。第一个分支包括振荡蛋白和OXPHOS、WNT和AMPK信号通路的成分,在活跃期表现出高表达。而活跃期运动可激活WNT信号通路和OXPHOS,直接促进细胞增殖、基质合成和分泌。这些过程需要消耗大量的ATP,导致ADP的产生和随后的AMPK通路的激活,进一步促进细胞增殖、基质合成和分泌。在第二个分支中,如REV-ERBα和LDHA表现出振荡行为,在休息期达到峰值,有助于糖酵解,而糖酵解产生的ATP比OXPHOS少。因此,休息期运动可能主要增强糖酵解,提示其促进骨骼生长的效果可能较差。
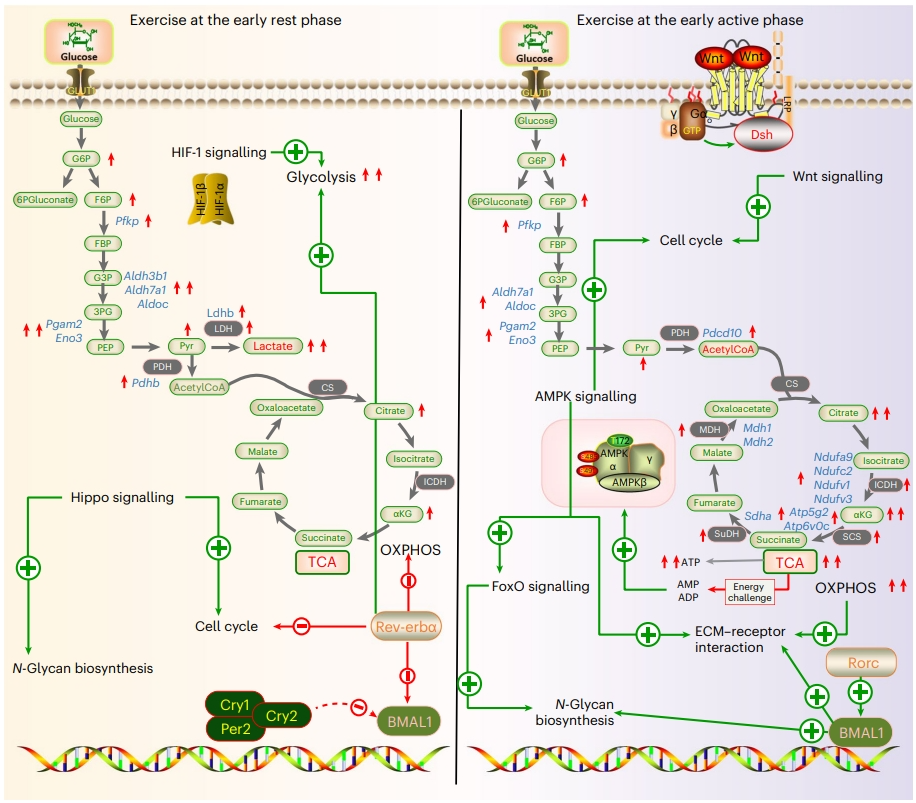
图六 不同时间运动促进骨骼生长的模式图[7]
综上所述,该研究对不同时间运动后的骨骼生长进行了比较分析,发现在小鼠活跃期早期跑步30分钟(人类视角为早晨),能显著增加骨骼长度和质量。机制上,由于活跃期早期的运动能够维持身体原本的生理节律性表达模式,使得运动受益达到最佳。进一步在小鼠活跃期早期药物注射激活氧化磷酸化(OXPHOS)也能有效促进骨骼生长。该研究为增强骨骼健康提供了有价值的见解,为开发针对特定代谢途径的治疗手段提供了科学依据,对促进骨骼生长具有潜在治疗意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Alves JGB, Alves GV: Effects of physical activity on children's growth. Jornal de pediatria 2019, 95 Suppl 1:72-78.
2. Bouillon R, Marcocci C, Carmeliet G, Bikle D, White JH, Dawson-Hughes B, Lips P, Munns CF, Lazaretti-Castro M, Giustina A et al: Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocrine reviews 2019, 40(4):1109-1151.
3. Tong X, Chen X, Zhang S, Huang M, Shen X, Xu J, Zou J: The Effect of Exercise on the Prevention of Osteoporosis and Bone Angiogenesis. BioMed research international 2019, 2019:8171897.
4. Schumacher LM, Thomas JG, Raynor HA, Rhodes RE, Bond DS: Consistent Morning Exercise May Be Beneficial for Individuals With Obesity. Exercise and sport sciences reviews 2020, 48(4):201-208.
5. Kronenberg HM: Developmental regulation of the growth plate. Nature 2003, 423(6937):332-336.
6. Fan W, Evans RM: Exercise Mimetics: Impact on Health and Performance. Cell metabolism 2017, 25(2):242-247.
7. Yu S, Tang Q, Lu X, Chen G, Xie M, Yang J, Yin Y, Zheng W, Wang J, Han Y et al: Time of exercise differentially impacts bone growth in mice. Nat Metab 2024, 6(6):1036-1052.



