技术分享:高脂饮食诱导精子线粒体RNA的父系代际传递
除了孟德尔遗传之外,父亲还能使用其他途径进行信息的代际传递。其中之一是利用储存在成熟精子中的小非编码RNA(sncRNA)库,它们复杂、动态且对环境敏感,随着受精被输送到受精卵中,影响着后代的胚胎发育和成年表型[1]。从精原干细胞分化为单倍体成熟精子可分成两个阶段,包括在睾丸生精小管的精子发生(小鼠约35天)以及随后在附睾的成熟过程(小鼠约7天)[2]。这两个阶段都可能对环境敏感的精子表观基因组造成影响[3]。目前公认的模型是精子sncRNA库在附睾运输过程中主要被附睾上皮细胞修饰[4],因此,环境扰动被认为主要在附睾阶段。然而,附睾中的精子是否直接受环境的影响及其作用机制尚不完全清楚。
2024年6月,Nature期刊报道了一项研究,使用孕前急性高脂饮食来分析附睾和睾丸对精子sncRNA库和后代健康的贡献,发现附睾精子而不是睾丸分化中的生殖细胞对环境敏感,并确定了线粒体编码的转运RNA(mt-tRNA)及其片段(mt-tsRNA)的增加是由饮食诱导和精子传递的。父亲精子的mt-tsRNA和体重指数(BMI)相关,受孕时父亲的BMI是后代代谢健康的独立决定因素,超重会使后代肥胖风险翻倍,并损害代谢健康。mt-tsRNA在受精时从精子传递到受精卵中,表明它们参与调控早期胚胎转录。线粒体功能障碍会上调mt-tsRNA,触发父系代际效应。该研究支持了受孕时父亲健康对后代代谢的重要性[5]。
首先,研究者探究精子对环境的易感性及其产生的父系代际效应。急性2周的HFD高脂饮食会引起小鼠显著的体重和脂肪增加以及葡萄糖耐量减少,但在恢复4周正常饮食后表型可得到恢复。于是,研究者分别用高脂饮食(HFD)或低脂饮食(LFD)喂养6周龄雄鼠2周,然后分别与年龄匹配的雌鼠交配产生eHFD或eLFD F1代,以及恢复正常饮食4周后再交配产生sHFD或sLFD F1代(图一a)。雄鼠2周的高脂饮食不会影响eHFD F1代的体重和成分,但会导致约30%的eHFD F1雄鼠出现葡萄糖耐量不良,根据这一点,将eHFD F1代分为HFD耐受(HFDt)和HFD不耐受(HFDi)两组(图一b)。8周后重新检测,HFDi小鼠仍然保持显著的葡萄糖耐量不良(图一c)和胰岛素抵抗(图一d)。相反,sHFD F1雄鼠在体重、身体成分或葡萄糖耐量方面都没有显著变化(图一b)。HFDt和HFDi之间的表型差异反映在代谢相关的肝脏、肌肉和白色脂肪组织的转录特征上(图一e和f)。利用莱比锡脂肪组织儿童队列中的儿童基因表达和全基因组关联研究数据[6],发现约30%的HFDi特征基因也在人类脂肪细胞中表达,并与儿童肥胖相关(图一g左)。在该基因集中,儿童肥胖的风险基因和保护基因分别与细胞线粒体功能、炎症和细胞可塑性通路相关(图一g右)。父母肥胖,特别是母亲肥胖,是儿童早发性肥胖的最强危险因素[7]。为进一步证明父亲对后代代谢的贡献,研究者分析来自LIFE儿童研究的数据[8]。结果发现,尽管母亲BMI与父亲和子女的BMI都有很强的相关性,但子女BMI也与父亲BMI独立相关(图一h)。在母亲较瘦的家庭中,父亲超重使后代肥胖风险加倍,而父亲肥胖将进一步恶化这种风险。父亲BMI的增加也与胰岛素抵抗相关,父母BMI对后代胰岛素敏感性具有独立且叠加的影响(图一i)。以上数据表明,受孕时父亲的体重对小鼠和人类后代代谢健康具有重要性。
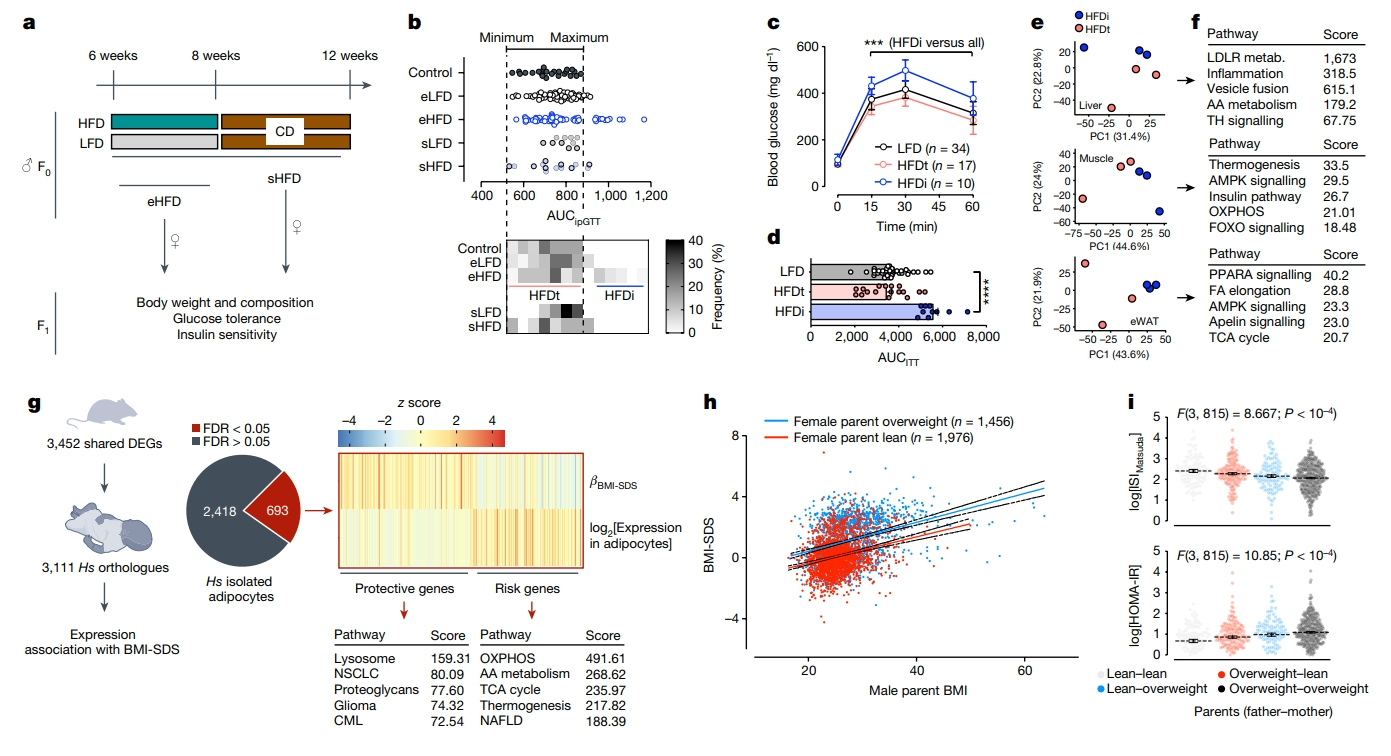
图一 受孕时父亲超重会影响后代代谢[5]
精子中的sncRNA是父系表观遗传效应的潜在饮食敏感介质[1],于是研究者聚焦sncRNA并剖析附睾和睾丸对父系代际效应的相对贡献。选择HFD或LFD喂养2周eHFD/LFD-F0雄鼠的球形精子和成熟精子,以及HFD喂养2周并恢复4周正常饮食的sHFD-F0雄鼠成熟精子分析sncRNA谱式。结果显示,不同样本中的类型分布符合预期,tsRNA和piwi-RNA(piRNA)分别是成熟精子和球形精子中最丰富的类型(图二a)。eHFD/LFD-F0成熟精子sncRNA测序数据的差异表达分析表明,约25%的精子sncRNA对急性高脂饮食敏感,主要是核tRNA表达显著减少和碎片化(图二b和c)。相反,mt-tRNA的表达和5′碎片化上调(图二c–e),约30%的注释序列达到统计学意义(图二b和d)。而sHFD-F0小鼠成熟精子sncRNA测序数据显示类型几乎没有变化。
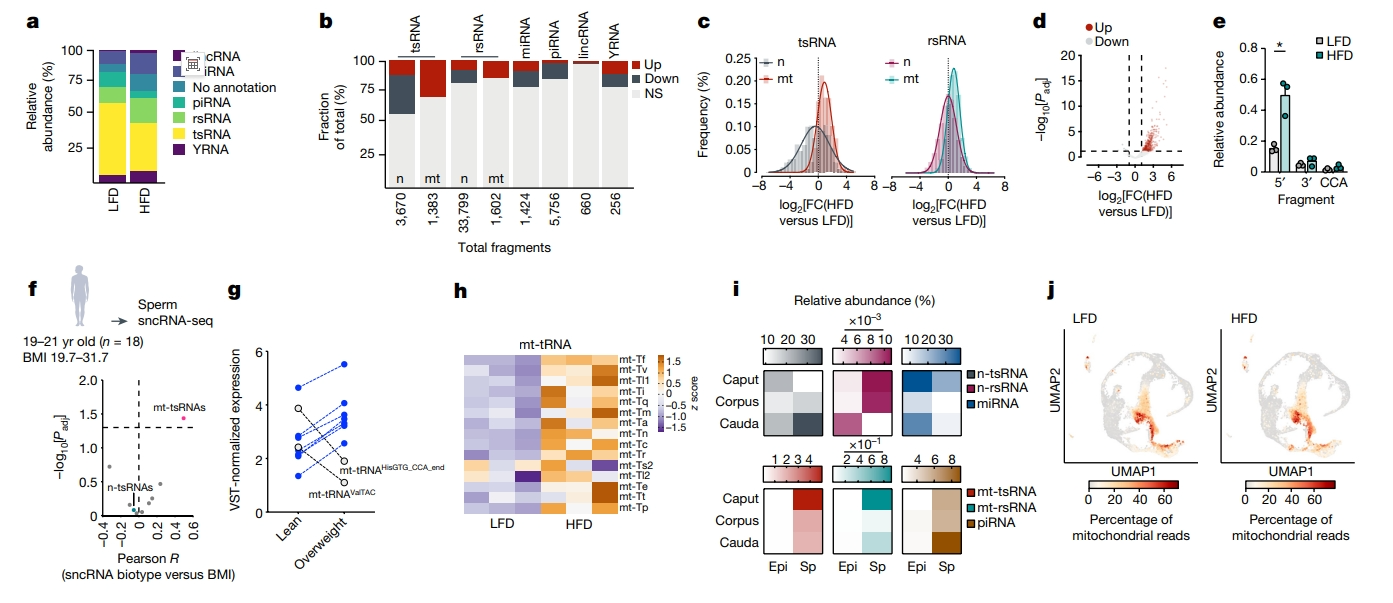
图二 精子mt-tsRNA是男性健康的传感器[5]
研究者进一步对年轻健康的芬兰志愿者(n=18,年龄范围19-21岁)的精液进行sncRNA测序,发现mt-tsRNA是唯一与BMI呈正相关的类型(图二f)。在mt-tsRNA注释的序列中,有0.5%的序列以连续的BMI变化差异表达(图二g)。这些发现进一步表明mt-sncRNA在应对小鼠和人类急性代谢挑战时具有重要功能。细胞核编码的tRNA主要由精子在附睾转运过程中从附睾小体或细胞质液滴获得,相反,mt-tRNA可以在精子中积极转录,因为mtDNA转录在成熟精子中具有特异活性[4]。事实上,通过RNA-seq在成熟精子中检测到全长mt-tRNA转录本,并在HFD喂养2周后上调(图二h)。此外,重新分析平行附睾取样的附睾小体或精子及其相关细胞质液滴的sncRNA-seq公共数据,发现mt-tsRNA和mt-rsRNA几乎只在精子中(图二i)。这与种系来源的sncRNA(如piRNA)相一致,与体细胞来源或混合来源的sncRNA(如microRNA和n-tsRNA)相反(图二i)。睾丸单细胞RNA-seq数据也显示,mtDNA转录在精母细胞阶段停止,且在高脂饮食后没有变化(图二j)。以上数据表明,精子mt-tsRNA是由高脂饮食诱导的sncRNA主要变化类型,并且由附睾响应环境变化,是男性健康的传感器。
接下来,研究者探索精子mtRNA的代际传递。将eHFD/LFD-F0 C57BL/6N雄鼠成熟精子和正常饮食ST母鼠(mtST)卵母细胞进行体外受精(IVF)产生杂交胚胎,ST和BL6 mtDNA存在416个单核苷酸多态性(SNP)差异。对约200个杂交的二细胞时期胚胎进行单胚胎转录组分析,利用SNP追踪mtRNA的亲本来源(图三a)。使用核转录组对单个胚胎进行主成分分析(PCA)聚类显示,LFD或HFD喂养的雄鼠所产胚胎之间完全重叠;使用线粒体转录组的相同分析显示LFD和HFD父系的雌性胚胎(图三b)和雄性胚胎(图三c)之间的差异聚类。HFD父系的雌性胚胎被均匀地分到单一的簇中(图三b),而雄性胚胎形成两个独立的簇(图三c),其中HFD_A胚胎(深蓝色,约占HFD雄性胚胎的30%)的特征是mt-tRNA的显著高表达。量化416个SNP的父系等位基因频率,发现与HFD_B和LFD胚胎相比,雄性HFD_A胚胎表现出更高的异质性,特别是在mt-tRNA的SNP(图三d-g)。以上数据表明,在生理环境下,受精时mtRNA从精子传递到后代胚胎中。
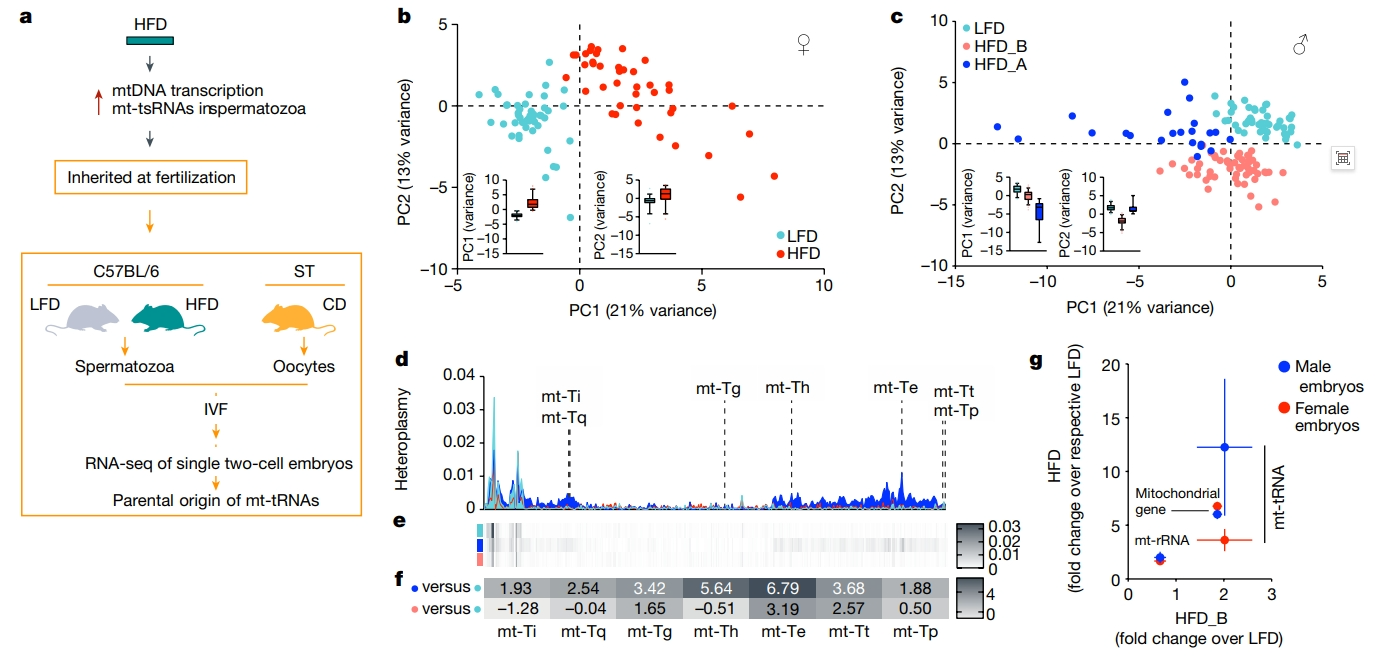
图三 精子mt-tRNA序列在受精后传递到后代胚胎中[5]
差异基因表达分析显示,与LFD(图四a)和HFD_B相比,HFD_A胚胎中存在大量的转录重编程,上调的基因主要富集在细胞代谢方面,其中氧化磷酸化位居榜首(图四b和c)。受精卵发育过程面临从输卵管到子宫的氧气浓度梯度变化,导致囊胚中的氧化磷酸化比卵裂期胚胎增加六倍(图四d)。着床前发育过程中氧化磷酸化的过早激活可导致胚胎的超微结构、线粒体结构和功能改变以及成年子鼠葡萄糖耐量不良,父系饮食会影响胚胎着床前的发育时间和早期胚胎代谢[9]。虽然HFD_A胚胎的发育时间保持不变,但它们的基因表达谱式表明氧化代谢的过早激活与父亲超重和mt-tRNA遗传有关(图四e)。氧化磷酸化对细胞和生物体生理学至关重要,小鼠急性和慢性暴露于高脂饮食会影响大脑、外周组织和生殖细胞的代谢稳态和线粒体功能[10]。通过比较对照组的组织转录组学,发现对高脂饮食小鼠的线粒体代谢重要的基因一致下调,如脂肪酸代谢(图四f)。在肌肉和精子中,这与mtDNA转录机制的上调有关(图四f)。F1早期胚胎和体细胞组织显示出线粒体代谢重要基因的一致上调,而只有早期胚胎维持了mt-tRNA的父系上调(图四f右)。因此,研究者推断,成熟精子中mt-tRNA的上调是对饮食诱导的线粒体功能障碍的一种代偿性反应。
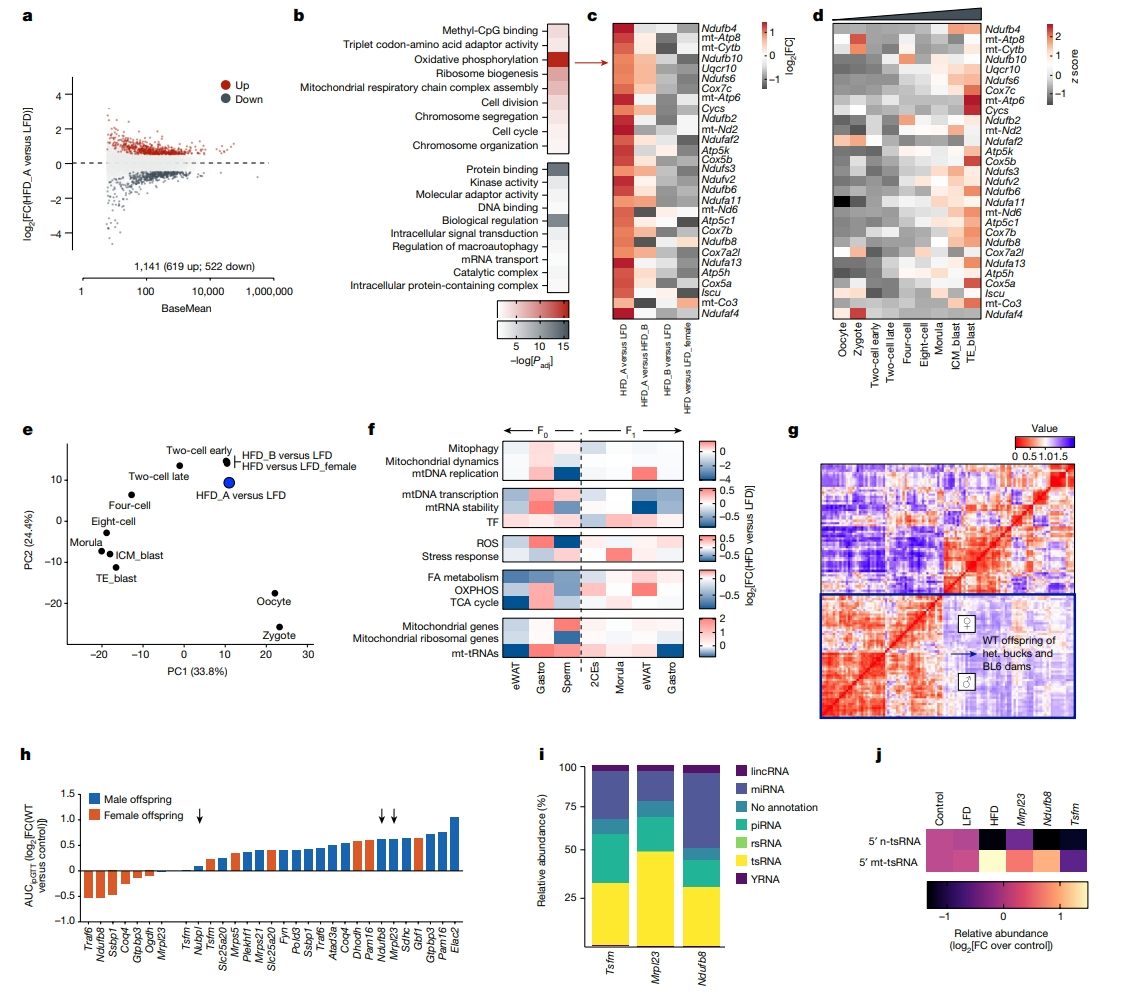
图四 线粒体代谢与父系表观遗传之间的双边关系[5]
最后,为了验证父系线粒体功能障碍可能影响精子mt-tRNA并导致葡萄糖耐量不良的假设,研究者使用IMPC的系统表型数据资源[11],提取亲本杂合子野生型(WT)后代的线粒体结构和功能基因的代谢参数。基于Pearson的WT后代表型的共相关分析表明了特定的父系效应,表现为主要在雄性后代中增加了肥胖和葡萄糖耐量不良(图四g和h)。研究者获得了三个突变系的冷冻精子:Mrpl23(线粒体核糖体蛋白L23)、Ndufb8(NADH:泛醌氧化还原酶亚基B8)和Tsfm(Ts翻译延伸因子,线粒体),其中Mrpl23和Ndufb8突变精子可重编程后代的新陈代谢,导致葡萄糖耐量不良,但Tsfm突变精子则不行(图四h),因此作为阴性对照。针对这三个突变系冷冻精子的sncRNA-seq分析,揭示了预期的类型分布(图四i),以及在Mrpl23和Ndufb8突变体中mt-tsRNA的显著积累,但在Tsfm中没有(图四j)。以上数据表明线粒体功能障碍可以触发父系代际效应。
综上所述,该研究表明雄性小鼠的高脂饮食诱导或线粒体功能障碍遗传,会导致雄性后代的葡萄糖代谢稳态受损。机制上,这与成熟精子中转录和片段化的mt-tRNA积累有关,并在受精时转移到受精卵中,进而影响后代健康。两个独立的人类队列分析表明精子中mt-tsRNA与BMI相关,并且受孕时父亲BMI是后代代谢健康的独立决定因素。该研究提示受孕时男性应当在饮食和体重方面有所注意,mt-tRNA可成为评价生活方式干预措施的候选者,从而降低父系表观遗传的代际传递影响后代代谢健康的风险。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭 诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Liu S, Sharma U: Sperm RNA Payload: Implications for Intergenerational Epigenetic Inheritance. International journal of molecular sciences 2023, 24(6):5889.
2. Oakberg EF: Duration of spermatogenesis in the mouse. Nature 1957, 180(4595):1137-1138.
3. Ly L, Chan D, Trasler JM: Developmental windows of susceptibility for epigenetic inheritance through the male germline. Seminars in cell & developmental biology 2015, 43:96-105.
4. Luo J, Tan X, Li H, Ding X: sncRNAs in Epididymosomes: The Contribution to Embryonic Development and Offspring Health. International journal of molecular sciences 2022, 23(18):10851.
5. Tomar A, Gomez-Velazquez M, Gerlini R, Comas-Armangué G, Makharadze L, Kolbe T, Boersma A, Dahlhoff M, Burgstaller JP, Lassi M et al: Epigenetic inheritance of diet-induced and sperm-borne mitochondrial RNAs. Nature 2024, 630(8017):720-727.
6. Landgraf K, Rockstroh D, Wagner IV, Weise S, Tauscher R, Schwartze JT, Löffler D, Bühligen U, Wojan M, Till H et al: Evidence of early alterations in adipose tissue biology and function and its association with obesity-related inflammation and insulin resistance in children. Diabetes 2015, 64(4):1249-1261.
7. Jääskeläinen A, Pussinen J, Nuutinen O, Schwab U, Pirkola J, Kolehmainen M, Järvelin MR, Laitinen J: Intergenerational transmission of overweight among Finnish adolescents and their parents: a 16-year follow-up study. International journal of obesity (2005) 2011, 35(10):1289-1294.
8. Poulain T, Baber R, Vogel M, Pietzner D, Kirsten T, Jurkutat A, Hiemisch A, Hilbert A, Kratzsch J, Thiery J et al: The LIFE Child study: a population-based perinatal and pediatric cohort in Germany. European journal of epidemiology 2017, 32(2):145-158.
9. Binder NK, Hannan NJ, Gardner DK: Paternal diet-induced obesity retards early mouse embryo development, mitochondrial activity and pregnancy health. PLoS One 2012, 7(12):e52304.
10. Martínez-Reyes I, Chandel NS: Mitochondrial TCA cycle metabolites control physiology and disease. Nat Commun 2020, 11(1):102.
11. Groza T, Gomez FL, Mashhadi HH, Muñoz-Fuentes V, Gunes O, Wilson R, Cacheiro P, Frost A, Keskivali-Bond P, Vardal B et al: The International Mouse Phenotyping Consortium: comprehensive knockout phenotyping underpinning the study of human disease. Nucleic Acids Res 2023, 51(D1):D1038-d1045.



