技术分享:人类骨骼肌衰老变化的多模态细胞图谱
肌肉减少症即肌肉萎缩和功能衰退,是一种十分常见的衰老症状。伴随年龄的增长,骨骼肌质量和功能明显丧失,不仅对生活造成严重的不便,甚至有致残的风险,是老年人发病率和死亡率的关键因素。年轻人的瘦肌肉质量约占体重的50%,而80岁以上人群下降到25%左右。骨骼肌由大型多核肌纤维组成,受到运动神经元在神经肌肉接头(NMJ)处接触并控制其收缩和伸张,具有不同的收缩和代谢活性,如I型肌纤维参与慢速收缩和依赖有氧代谢产能,II型肌纤维负责快速收缩和糖酵解产能[1, 2]。除肌纤维外,骨骼肌还含有多种单核细胞,包括肌肉干细胞(MuSC、卫星细胞)、纤维脂肪祖细胞(FAP)、脂肪细胞、成纤维细胞样细胞、免疫细胞、血管细胞和施旺细胞[3, 4]。肌肉质量和功能的维持需要肌纤维细胞与附近各种常驻细胞之间进行适当的相互作用[5, 6]。当肌肉发生损伤时,静息状态的MuSC被激活,进而修复受损的骨骼肌。可是,衰老对骨骼肌生态位的细胞互作以及相对细胞数量都造成负面影响,并且降低MuSC的再生能力[7]。然而,老年性肌肉减少症的细胞生物学及其潜在分子机制仍不明确。
2024年4月,Nature期刊上报道了一项研究,通过对不同年龄和性别的人类四肢骨骼肌进行单细胞转录组和染色质可及性图谱的综合性分析,描述了衰老过程中不同细胞群体的变化过程,包括在老年人中新细胞群体的出现,以及衰老相关细胞特异性和多细胞网络特征图谱。另外,还确定了少肌症易感性的染色质结构重要遗传因素。该研究为发现骨骼肌的医学、药理学和生活方式干预的潜在靶点提供了理论基础[8]。
首先,研究者验证人类骨骼肌随着衰老而发生的分子变化。招募17名男性和14名女性分为两个年龄组:15至46岁的成年人12位(平均年龄36岁)和74至99岁的老年人19位(平均年龄84岁),取下肢骨骼肌样本进行检测。每次取样都被分为不同的样本,分别用于组织学检测、单核RNA测序(snRNA-seq)、转座酶可及染色质的单核测定(snATAC-seq)和/或单细胞RNA测序(scRNA-seq)(图一a)。质量控制后,整个样本数据集包含387,444个细胞/核,其中snRNA-seq检测212,774个,scRNA-seq检测79,649个,snATAC-seq检测95,021个。sc/snRNA-seq数据集的均匀流形近似和投影(UMAP)可视化显示多核肌纤维区中I型和II型的集群分类和多核特征(图一a)。在单核细胞中,肌肉常驻细胞类型主要为肌肉干细胞(MuSC)、基质细胞(FAP、成纤维样细胞和脂肪细胞)、血管细胞(周细胞、平滑肌细胞)、内皮细胞、免疫细胞(髓细胞、淋巴细胞和肥大细胞)和胶质细胞(施旺细胞,图一b)。snATAC-seq结果与sc/snRNA-seq结果相似(图一c)。另外,广义线性混合模型[9]显示与年龄相关的减少的肌细胞核,特别是II型肌纤维、MuSC和周细胞,以及年龄相关增加的脂肪细胞、成纤维样细胞和免疫细胞(图一d)。随着年龄的增长,单个细胞/核之间表现出显著的转录异质性,并与染色质可及性的变化相关(图一e),提示表观遗传不稳定性的增加可能促进细胞类型的改变。
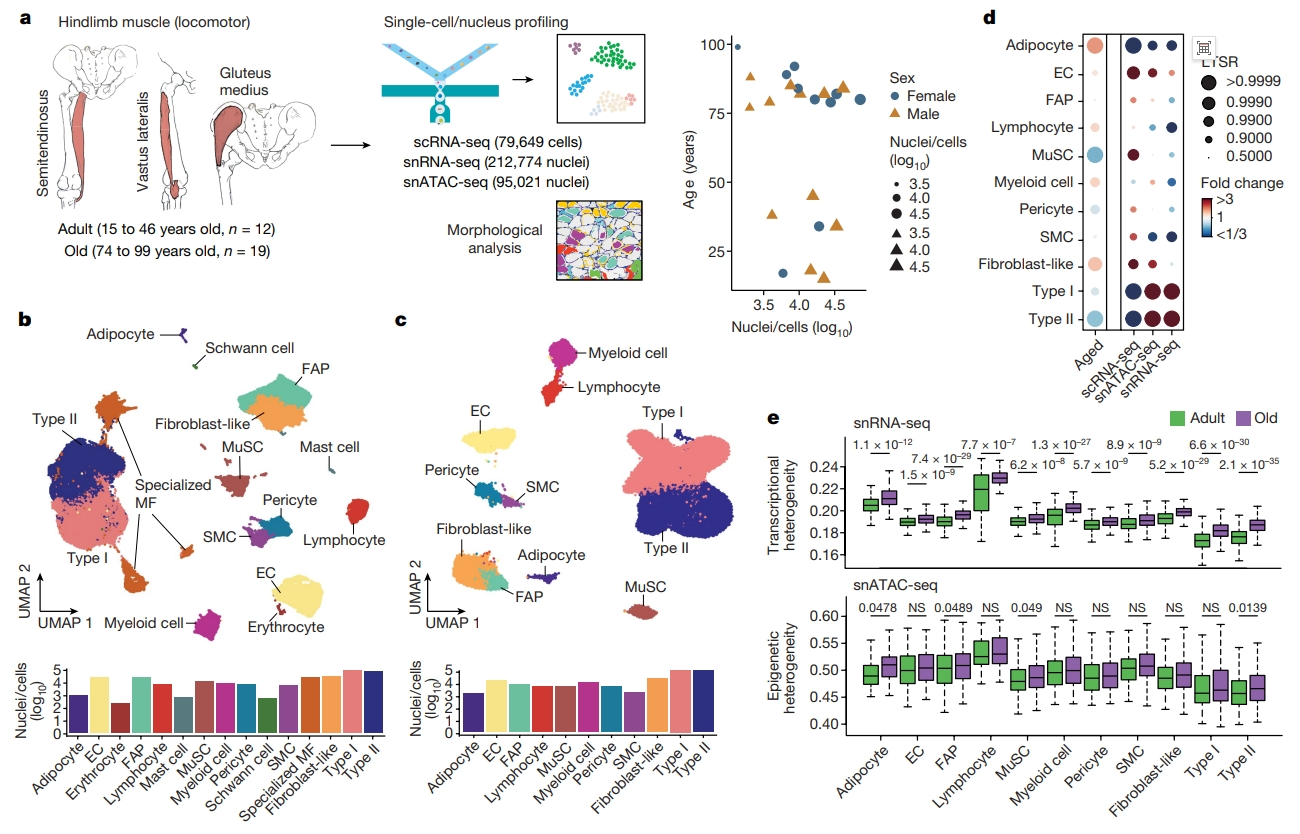
图一人类骨骼肌衰老的多模态细胞图谱[8]
接下来,研究者试图阐明老年人肌肉萎缩的分子驱动因素及其过程。首先通过已知的肌纤维类型特异性标志物对snRNA-seq数据进行评分,分析不同年龄段肌细胞核的异质性。除了MYH7+肌核(I型,TNNT1+)外,还筛选出II型肌核(TNNT3+),其中后者包括MYH2+肌核(IIA型)、MYH1+肌核(IIX型),以及同时表达MYH2和MYH1的混合肌核(IIA/IIX型,图二a)。衰老诱导了II型肌核的普遍减少,其中IIX亚型的减少更为明显,其次是IIA/IIX混合型;同时伴随着I型肌核在两性中的相对增加,变化的程度与个体的年龄高度相关(图二b)。进一步的snRNA-seq鉴定了在肌腱连接处和NMJ处特别存在的肌细胞核(图二c)。肌腱连接处肌核表现出细胞-基质相互作用相关基因(COL22A1,ADGBR4)的富集,NMJ肌核表现出与突触传递反应相关基因(PHLDB2,CHRNE)的富集(图二c)。亚聚类确定了在成年或老年肌肉中富集的其他基因,例如对II型肌纤维特异性的ENOX1+肌核在成人组中富集,相反,TNNT2+、ID1+、DCLK1+和SAA2+肌核在老年组中富集(图二c和d)。所有亚群都通过热点分析进行了确认,该分析将基因表达谱聚类到模型中(图二e-g)。ENOX1+肌核可能代表健康的II型肌纤维群体,这与快速收缩的碳水化合物代谢相关基因的高表达水平相一致(图二f)。ID1+、DCLK1+和SAA2+老年肌细胞核表达了高水平的NMJ相关基因和细胞粘附基因(图二f)。另外,免疫荧光分析证实TNNT2在老年肌纤维中的高表达(图二g和h)。以上实验结果表明,随着年龄的增长,肌纤维的肌核类型发生显著的改变。
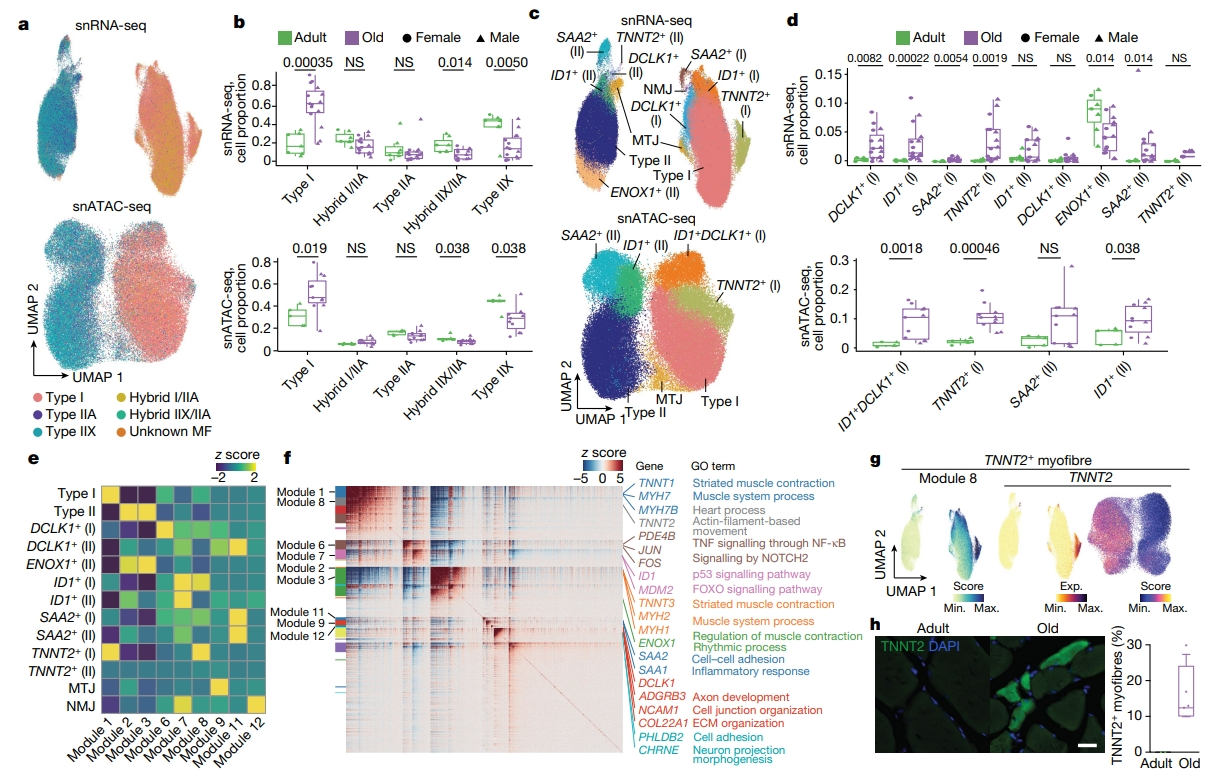
图二 不同年龄阶段肌核的异质性[8]
然后,研究者进行拟时序分析,观察I型和II型肌纤维随时间变化的过程,来研究肌纤维转录变化的方向性(图三a)。这些肌细胞核的转录终点与出现在老年肌肉新群体的转录谱相对应。当绘制受衰老逐渐影响的特定骨骼肌功能时,如肌节或萎缩相关基因,这一趋势也很明显(图三b)。值得注意的是,I型肌核随着年龄的增长轨迹是渐进性的,而II型肌核则是陡峭的(图三a),这种差异与II型肌纤维对衰老更敏感相一致,衰老导致它们的优先损失。相比之下,I型肌纤维在衰老的肌肉中持续存在,并积累进行性损伤,随着时间的推移,进一步加剧肌肉功能障碍。对伪时间的进一步分析并根据转录差异可分为十大簇,其中大多数反映了I型的渐进性和II型肌纤维的陡峭性退化过程(图三c和d)。例如:随着年龄的增长,炎性相关基因(NFKB1、TXNIP)、自噬相关基因(NBR1、ATG7)和氧化应激反应相关基因(SOD2、NFE2L2)的轨迹在I型肌核中稳步增加,而在II型肌核中则表现为骤增(cluster 1);Notch信号相关基因 (HES1, NOTCH2)在I型和II型肌纤维中的增加趋势相似(cluster 1,2和10)。IL-6信号相关基因(IL6ST, SOCS3)在I型肌核中增加趋势更为明显(cluster 3);去神经支配相关(胆碱能突触;ITPR1, GNG12)在两种肌纤维中都明显增加(cluster 10);氧化磷酸化(IDH2, MDH1)和脂肪酸降解(ACADM, ACAT1)在I型肌核中下调(cluster 8);糖酵解相关基因(PKM, HK1)在I型肌核中上调(cluster 6)(图三d)。
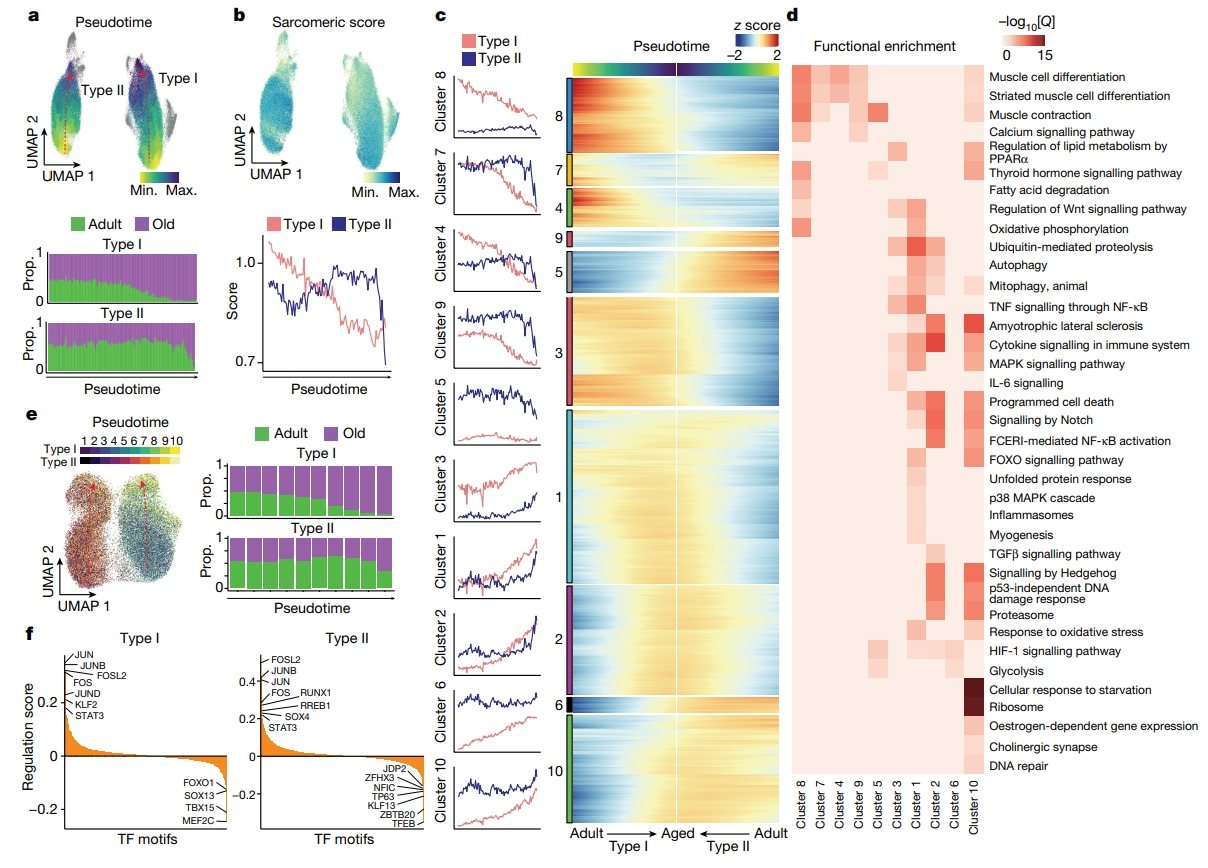
图三 肌纤维细胞的衰老基因表达调控网络变化显著[8]
接下来,研究者使用典型相关分析(CCA)整合snRNA-seq和snATAC-seq数据集,形成了I型和II型肌纤维细胞衰老轨迹(图三e)。使用这些配对的细胞核,根据峰与基因的可及性相关性,将snATAC-seq峰与其靶基因联系起来,确定了28193个独特的染色质可及性峰与I型肌纤维中的10707个基因显著相关,27901个峰与II型肌纤维的10669个基因显著相关。将峰-基因相互作用亚群的高密度定义为调节染色质(DORC)结构域。沿着衰老轨迹区分了I型或II型肌细胞核中数十种假定的转录激活因子和阻遏因子(图三f),例如,与细胞应激相关的转录因子(FOSL2、JUN、FOS、JUNB、STAT3)表达上调。另外,一些转录因子是肌纤维特异性表达的,例如,I型肌纤维富集TBX15,II型肌纤维富集JDP2,这两种转录因子通过抑制AP-1复合物活性与糖酵解肌纤维代谢和心肌细胞保护有关,它们的富集可能是老年肌纤维类型特异性功能障碍的原因[10, 11]。以上实验结果表明衰老过程中肌纤维类型和基因表达调控网络发生显著变化。
随着年龄的增长,MuSC响应损伤激活进行组织修复的能力大大降低。通过snRNA-seq数据,研究者共鉴定出三个表达 PAX7和一个表达MYOG的MuSC亚群(图四a)。将PAX7+ MuSC在不同状态下进行亚分类:静息的MuSC(qMuSC)、早期启动激活/增殖的MuSC(epMuSC)以及后期激活/增殖的MuSC(lpMuSC)。由于MYOG+ MuSC富含肌源性分化基因(ACTC1),将其命名为分化型MuSC (dMuSC)(图四a)。随着年龄的增长,MuSC的异质性持续存在,但老年肌肉中epMuSC的比例有所增加(图四b)。与MuSC干性功能及增殖能力相关的信号通路都随着年龄的增长而减弱(图四c)。除epMuSC外,其他MuSC亚型的线粒体氧化磷酸化功能都随着年龄的增长而显著增强(图四c)。在qMuSC,细胞外基质(ECM)重塑相关基因(ITGBL1)显著下调,肌生成相关基因(MEF2D)显著上调,炎症和应激通路相关基因的表达也显著上调,并在≥84岁时达到峰值(图四c)。snATAC-seq分析显示,较老的qMuSC富含调节晚期肌生成阶段的TF的结合基序,如分化相关的NFYA, NFYB, NFYC[12]和应激相关的ETS2, EGR1[13](图四d)。相反,qMuSC中生长激素相关TF(PGR, NR3C1, AR)的结合基序随着年龄的增长而丢失。以上结果表明,衰老状态下MuSC很难对肌肉损伤或体内稳态信号做出反应。
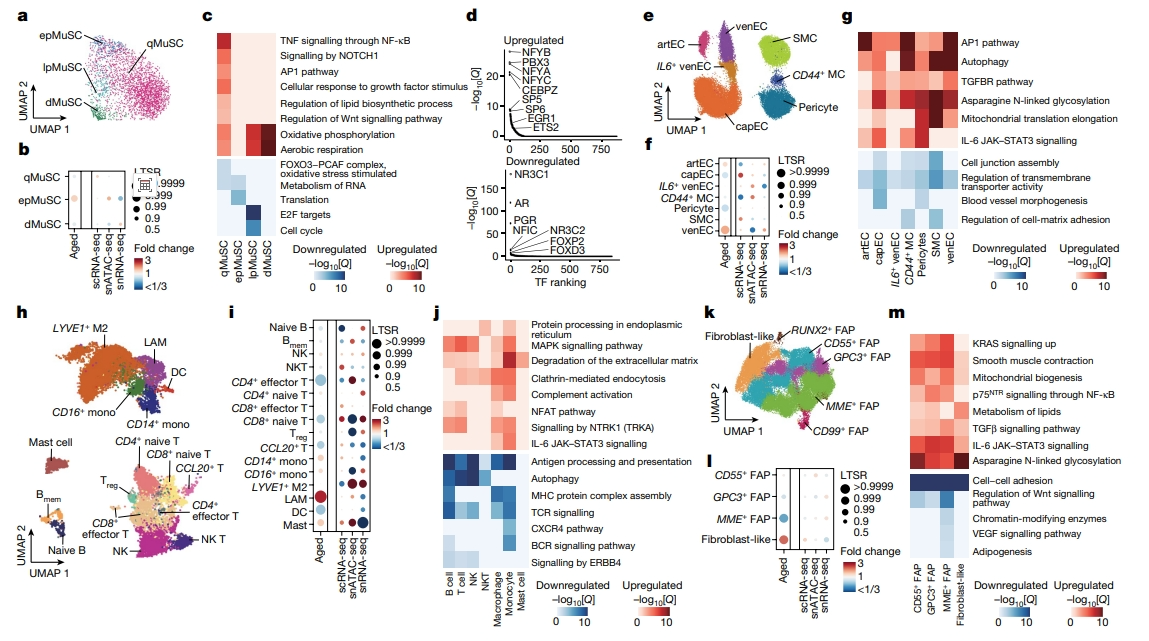
图四 人类骨骼肌中常驻单核细胞群体的衰老变化[8]
接下来,研究者在sc/snRNA-seq数据集中对单核细胞进行亚聚类。在血管隔室中,共鉴定出四种亚型的内皮细胞(EC):(1)表达SEMA3G的动脉内皮细胞;(2)表达CA4的毛细血管内皮细胞;(3)表达ACKR1的静脉EC(venEC);(4)表达IL6的venEC亚群(IL6+ venEC)(图四e)。在老年肌肉中,毛细血管内皮细胞和周细胞的比例下降,而动脉内皮细胞和静脉内皮细胞的比例增加(图四f)。随着年龄的增长,与细胞连接组装和跨膜转运蛋白活性相关的基因显著下调,并上调炎症(IL-6和AP-1)、纤维化(TGF-β)和自噬通路相关基因等(图四g),表明衰老通过增加促炎和压力相关信号改变骨骼肌血管完整性。在免疫细胞中,从sc/snRNA-seq和snATAC-seq数据中鉴定了髓细胞和淋巴细胞的不同亚群,包括单核细胞、巨噬细胞、肥大细胞、树突状细胞、B细胞、自然杀伤(NK)细胞、T细胞等(图四h)。其中肥大细胞、脂质相关巨噬细胞(LAM)和单核细胞在老年肌肉中增加,而一些T细胞亚型和树突状细胞减少(图四i)。骨骼肌中活化的肥大细胞与癌症诱导的肌肉萎缩有关[14],除了肥大细胞外,所有免疫细胞亚群都随着年龄的增长下调稳态免疫功能(图四j),表明衰老状态下免疫功能显著下降。在基质细胞室中,鉴定了各种亚型的成纤维成脂细胞(FAP),包括CD55+、CD99+、GPC3+、MME+和RUNX2+,以及THY1+的成纤维样细胞(图四k)。成纤维样细胞随着年龄的增长而显著增加,而MME+ FAP则减少(图四l)。较老的FAP亚型在很大程度上具有衰老特征,表现为与生长发育相关的信号通路(VEGF和Wnt)下调,促纤维化(TGF-β信号传导)和促炎(IL-6信号传导)信号通路以及天冬酰胺N-连接糖基化的上调(图四m),表明随着年龄的增长,基质细胞向具有活性ECM重塑特征的激活状态转变。
接着,研究者使用CellChat分析衰老对人类骨骼肌细胞间通讯的影响。配体-受体相互作用主要涉及单核细胞而非肌纤维细胞,并且相互作用的总数随着年龄变化几乎多了近一倍(图五a)。与其他细胞类型相比,随着年龄的增长,主要涉及髓细胞和淋巴细胞的相互作用,以及在较小程度上涉及FAP、成纤维样细胞和I型肌纤维的相互作用增加得更大(图五b)。由此,研究者重点关注了炎症、ECM和生长因子作为衰老引起肌肉萎缩过程的潜在影响因素(图五c)。促纤维化因子TGFβ随着年龄的增长而增加,主要由免疫细胞(TGFB1),MuSC (TGFB2)和I型肌纤维(TGFB2, TGFB3)产生,并通过其受体(TGFBR1, TGFBR2, TGFBR3)作用于多种细胞类型(图五d和e)。在与肌肉质量控制有关的生长因子中,促萎缩激活素信号随着年龄的增长而上调,激活素受体(ACVR1, ACVR1B, ACVR2A, ACVR2B)在肌细胞核中上调,激活素配体INHBB在EC、FAP、MuSC和成纤维细胞样细胞中上调(图五f和g),免疫荧光结果也证实激活素受体ACVR2A表达显著增加(图五h)。以上实验结果表明,随着年龄的增长,人类骨骼肌中的细胞间通讯发生显著变化。
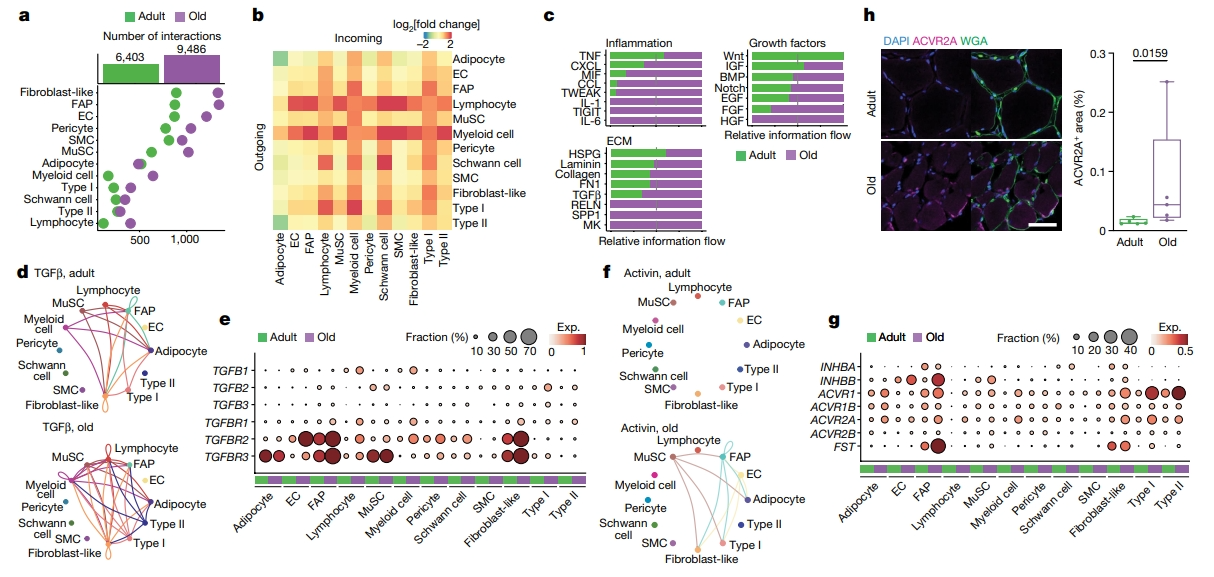
图五 骨骼肌细胞成分的相互作用组分析[8]
最后,研究者进行连锁不平衡(LD)评分回归(LDSC)分析,确定snATAC-seq数据中的细胞类型特异性可及性区域是否富含肌肉力量和与肌肉疾病或代谢功能相关表型的GWAS变体(图六a)。研究者确定了3158个候选变体,其中,在肌纤维细胞GDNF基因座上发现了rs1862574位点可能影响肌肉的神经支配;还观察到TRIM63(MuRF1)中的rs3008232位点,ANGPL2中的rs1281155位点,FOXO1中的rs571800667位点,它们都是肌肉萎缩的关键驱动因素[15, 16]。接下来,研究者使用deltaSVM[17]框架来预测调控变体对TF结合的影响。结果发现,在其中一个潜在的变体rs6488724中,重叠峰位于MGP的启动子中(图六b),该启动子参与肌肉再生[18]。这种单核苷酸多态性(SNP)产生了一个G-to-A突变,增加了TF-HSF2的结合亲和力,HSF2参与了肌节伴侣的转录调控,以维持收缩性器官。研究者还发现了FKBP5基因座内含子区域的rs73746499(图六c),该位点产生一个A-to-G的突变,破坏雄激素受体的结合亲和力,雄激素受体是维持肌肉质量的关键转录因子之一。以上实验结果表明,不同细胞类型的基因特征与肌肉减少症的遗传易感性之间存在潜在关系。
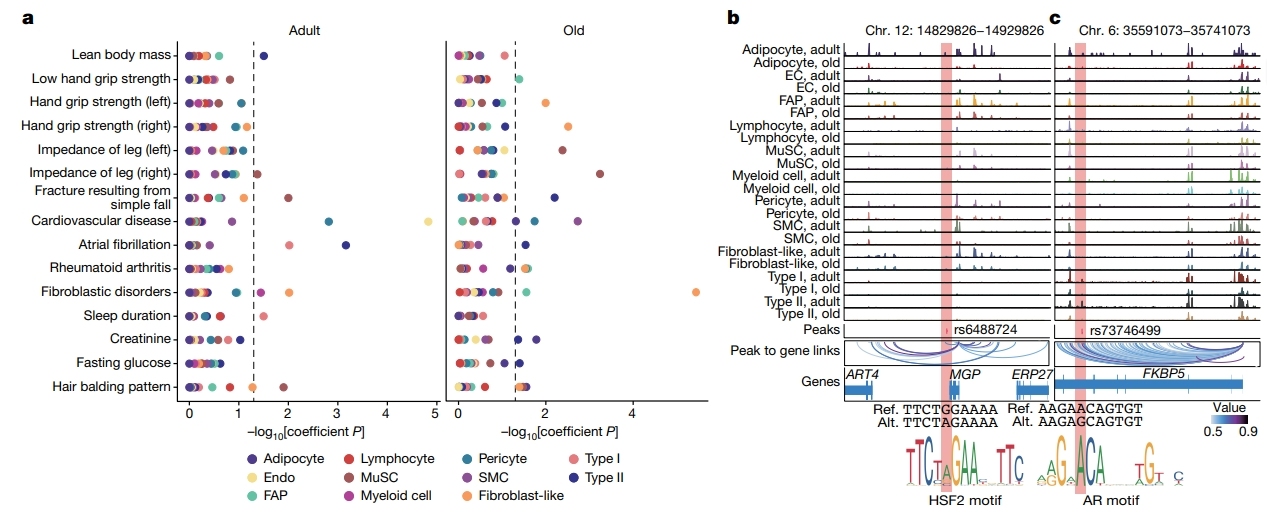
图六 遗传变异与肌少症易感位点的潜在关系[8]
综上所述,研究者利用单细胞/单核转录组和染色质可及性单核测序,构建了人类骨骼肌衰老变化的细胞参考图谱,描述了不同的细胞群体在衰老过程中的变化过程。该研究为理解老年性少肌症提供了一系列完整的细胞和分子解释,对推动健康老龄化相关研究提供了理论基础,为开发衰老及损伤骨骼肌相关治疗提供了潜在靶点,具有重要的医学意义。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Soendenbroe C, Andersen JL, Mackey AL: Muscle-nerve communication and the molecular assessment of human skeletal muscle denervation with aging. American journal of physiology Cell physiology 2021, 321(2):C317-C329.
2. Murgia M, Toniolo L, Nagaraj N, Ciciliot S, Vindigni V, Schiaffino S, Reggiani C, Mann M: Single Muscle Fiber Proteomics Reveals Fiber-Type-Specific Features of Human Muscle Aging. Cell Rep 2017, 19(11):2396-2409.
3. Eraslan G, Drokhlyansky E, Anand S, Fiskin E, Subramanian A, Slyper M, Wang J, Van Wittenberghe N, Rouhana JM, Waldman J et al: Single-nucleus cross-tissue molecular reference maps toward understanding disease gene function. Science 2022, 376(6594):eabl4290.
4. Perez K, Ciotlos S, McGirr J, Limbad C, Doi R, Nederveen JP, Nilsson MI, Winer DA, Evans W, Tarnopolsky M et al: Single nuclei profiling identifies cell specific markers of skeletal muscle aging, frailty, and senescence. Aging 2022, 14(23):9393-9422.
5. Sartori R, Hagg A, Zampieri S, Armani A, Winbanks CE, Viana LR, Haidar M, Watt KI, Qian H, Pezzini C et al: Perturbed BMP signaling and denervation promote muscle wasting in cancer cachexia. Science translational medicine 2021, 13(605):eaay9592.
6. Madaro L, Passafaro M, Sala D, Etxaniz U, Lugarini F, Proietti D, Alfonsi MV, Nicoletti C, Gatto S, De Bardi M et al: Denervation-activated STAT3-IL-6 signalling in fibro-adipogenic progenitors promotes myofibres atrophy and fibrosis. Nature cell biology 2018, 20(8):917-927.
7. Sousa-Victor P, Garcia-Prat L, Munoz-Canoves P: Control of satellite cell function in muscle regeneration and its disruption in ageing. Nature reviews Molecular cell biology 2022, 23(3):204-226.
8. Lai Y, Ramirez-Pardo I, Isern J, An J, Perdiguero E, Serrano AL, Li J, Garcia-Dominguez E, Segales J, Guo P et al: Multimodal cell atlas of the ageing human skeletal muscle. Nature 2024, 629(8010):154-164.
9. Yoshida M, Worlock KB, Huang N, Lindeboom RGH, Butler CR, Kumasaka N, Dominguez Conde C, Mamanova L, Bolt L, Richardson L et al: Local and systemic responses to SARS-CoV-2 infection in children and adults. Nature 2022, 602(7896):321-327.
10. Lee KY, Singh MK, Ussar S, Wetzel P, Hirshman MF, Goodyear LJ, Kispert A, Kahn CR: Tbx15 controls skeletal muscle fibre-type determination and muscle metabolism. Nature communications 2015, 6:8054.
11. Hill C, Wurfel A, Heger J, Meyering B, Schluter KD, Weber M, Ferdinandy P, Aronheim A, Schulz R, Euler G: Inhibition of AP-1 signaling by JDP2 overexpression protects cardiomyocytes against hypertrophy and apoptosis induction. Cardiovascular research 2013, 99(1):121-128.
12. Rigillo G, Basile V, Belluti S, Ronzio M, Sauta E, Ciarrocchi A, Latella L, Saclier M, Molinari S, Vallarola A et al: The transcription factor NF-Y participates to stem cell fate decision and regeneration in adult skeletal muscle. Nature communications 2021, 12(1):6013.
13. Machado L, Geara P, Camps J, Dos Santos M, Teixeira-Clerc F, Van Herck J, Varet H, Legendre R, Pawlotsky JM, Sampaolesi M et al: Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell stem cell 2021, 28(6):1125-1135 e1127.
14. Widner DB, Liu C, Zhao Q, Sharp S, Eber MR, Park SH, Files DC, Shiozawa Y: Activated mast cells in skeletal muscle can be a potential mediator for cancer-associated cachexia. Journal of cachexia, sarcopenia and muscle 2021, 12(4):1079-1097.
15. Taillandier D, Polge C: Skeletal muscle atrogenes: From rodent models to human pathologies. Biochimie 2019, 166:251-269.
16. Zhao J, Tian Z, Kadomatsu T, Xie P, Miyata K, Sugizaki T, Endo M, Zhu S, Fan H, Horiguchi H et al: Age-dependent increase in angiopoietin-like protein 2 accelerates skeletal muscle loss in mice. The Journal of biological chemistry 2018, 293(5):1596-1609.
17. Lee D, Gorkin DU, Baker M, Strober BJ, Asoni AL, McCallion AS, Beer MA: A method to predict the impact of regulatory variants from DNA sequence. Nature genetics 2015, 47(8):955-961.
18. Ahmad S, Jan AT, Baig MH, Lee EJ, Choi I: Matrix gla protein: An extracellular matrix protein regulates myostatin expression in the muscle developmental program. Life sciences 2017, 172:55-63.



