技术分享:5:2间歇性禁食可改善非酒精性脂肪肝炎
非酒精性脂肪肝(NAFLD)是全球最常见的慢性肝病,由于肥胖的流行,其发病率预计在未来几十年将进一步上升[1]。NAFLD被认为是代谢综合征的肝脏表现,可发展为更严重的非酒精性脂性肝炎(NASH)和肝硬化,甚至是肝细胞癌(HCC)[2]。NASH/HCC不仅给社会带来了巨大的经济负担,还降低了个人的生活质量。有研究表明,基于饮食限制(DR)的方法如间歇性禁食(IF)、限时饮食(TRF)或模拟断食饮食(FMD)可以降低代谢综合征患者的体重、血压和脂质积累[3],并调节肠道菌群以促进肠道再生,减少炎症性肠病,减轻糖尿病引起的认知障碍[4]。近几年最受欢迎的饮食干预措施方案是5:2间歇性禁食,即每周5天自由进食,非连续2天为断食日,断食热量摄入限制在500-1000 kcal。尽管越来越多的证据表明基于饮食限制的干预措施对肥胖和非肝脏相关病理的受益,但禁食对NASH和HCC发展的潜在益处及其分子机制仍然未知。
2024年6月,Cell Metabolism期刊报道了一项研究,发现5:2间歇性禁食方案可预防和改善NASH和纤维化,并限制HCC进展。禁食时间、长度和数量决定了禁食受益效果。机制上,PPARα和糖皮质激素信号通路诱导的PCK1协同作为禁食反应的肝脏执行者。从小鼠活动期开始5:2间歇性禁食,可强烈诱导糖皮质激素信号和游离脂肪酸诱导的PPARα信号。体内联合敲降Ppara和Pck1,消除了禁食对抗炎症和纤维化的益处。该研究支持了5:2间歇性禁食方案是一种很有前景的NASH干预措施 [5]。
首先,研究者探究间歇性禁食(IF)能否预防NASH的发展。将8周龄雄性C57BL/6J小鼠分为三组不同饮食喂食32周:正常饮食组、西方饮食(WD)的NASH造模组、采用5:2间歇性禁食方案的WD组(WD-IF(5:2))(图一A)。IF(5:2)为每周非连续2天禁食日仅能自由饮水,禁食周期因小鼠是夜间活动,从晚上7点开始,持续24小时,其余5天小鼠自由进食(图一A)。结果显示,与正常饮食组小鼠相比,WD组小鼠体重显著增加,EchoMRI测量的脂肪量显著增加,附睾和腹股沟白色脂肪组织增加(图一B-C)。而与WD组相比,WD-IF(5:2)组小鼠对WD诱导的肥胖具有抵抗力(图一B-C),血清胆固醇和空腹血糖水平均显著降低(图一D-E),表现出肝脏病理改善,血清丙氨酸转氨酶(ALT)水平、肝重量显著降低(图一F-H),肝脏甘油三酯、NAFLD活性评分(NAS)显著降低,肝脏脂肪变性、退行性空泡和炎症都有所改善(图一I-K),肝纤维化和炎症显著降低,特别是巨噬细胞(F4/80+)、MHCII+ 细胞、血小板(CD42b+)和CD8+ T细胞的肝内浸润减少(图一K-P)。以上数据表明,IF(5:2)方案不仅可以减轻由饮食引起的肥胖和代谢功能障碍,而且还可以减轻NASH的发展。
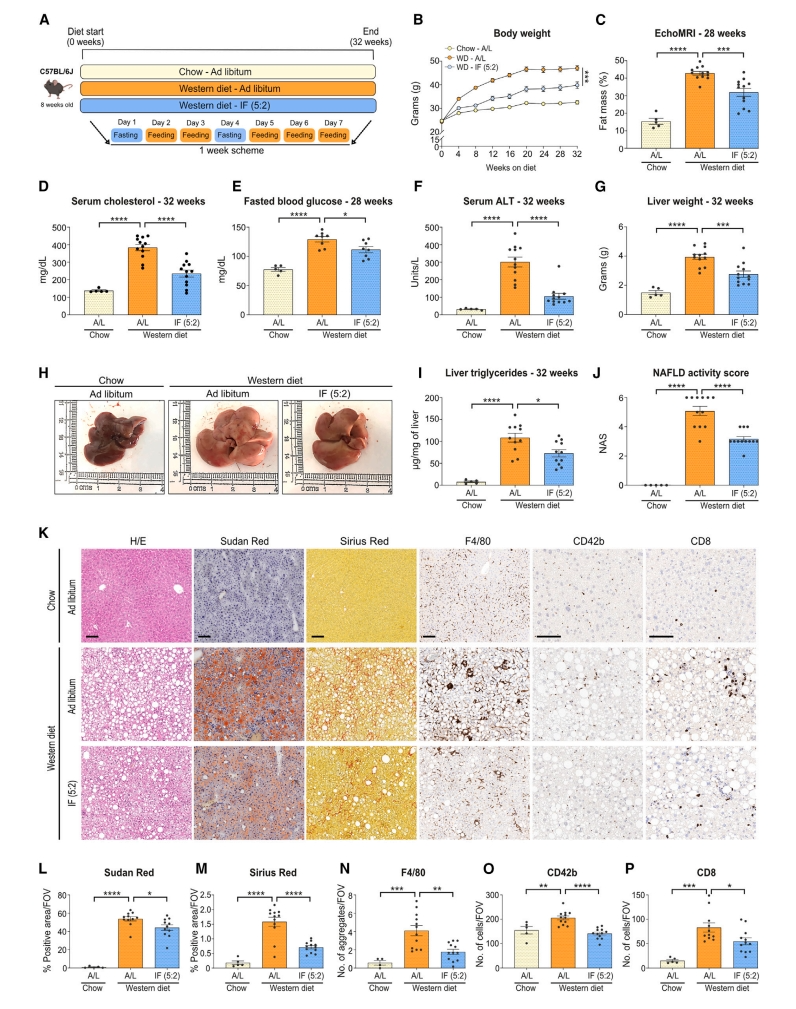
图一 IF(5:2)可减轻西方饮食引起的小鼠肥胖和NASH[5]
接下来,研究者探索IF(5:2)方案是否影响总热量摄入和/或全身代谢(图二A)。发现三组小鼠在一周内的平均每日食物摄入量无显著差异(图二B),这是因为禁食小鼠在断食后出现了暴食反应,弥补了禁食期的食物摄入不足(图二C和D)。在全身代谢方面,观察到与WD组相比,WD-IF(5:2)组小鼠的呼吸交换比(RER)显著降低(图二E-F),脂肪酸氧化和生酮副产物β-羟基丁酸盐(酮体)在禁食24小时后显著增加(图二G)。研究者进一步研究哪些参数对有效禁食至关重要,将8周龄雄性C57BL/6J小鼠喂食胆碱缺乏型高脂肪饮食(CD-HFD)32周以诱导NASH,并分为三组:自由饮食对照组、IF (5:2-12h)组和IF (6:1-24h)组。其中IF (5:2-12h)组每周非连续禁食2天,每个禁食周期从晚上7点到早上7点持续12小时;IF (6:1-24h)组每周只禁食1天,每个禁食周期从晚上7点到第二天晚上7点持续24小时(图二H)。结果发现,与CD-HFD对照组相比,IF (6:1-24h)组小鼠肝脏甘油三酯、肝脂肪变性、纤维化和免疫浸润显著降低(图二I-O),蛋白质组分析证实IF (6:1-24h)小鼠的肝脏胶原沉积/纤维化和炎症反应减少(图二P和Q)。以上数据表明,IF (6:1-24h)方案不仅在系统性肥胖和代谢参数方面,而且在肝脏病理学方面,都具有更佳的疗效;当每周禁食的总持续时间(24小时)保持不变时,禁食周期的长度(连续24小时>两次12小时)起着更突出的作用。
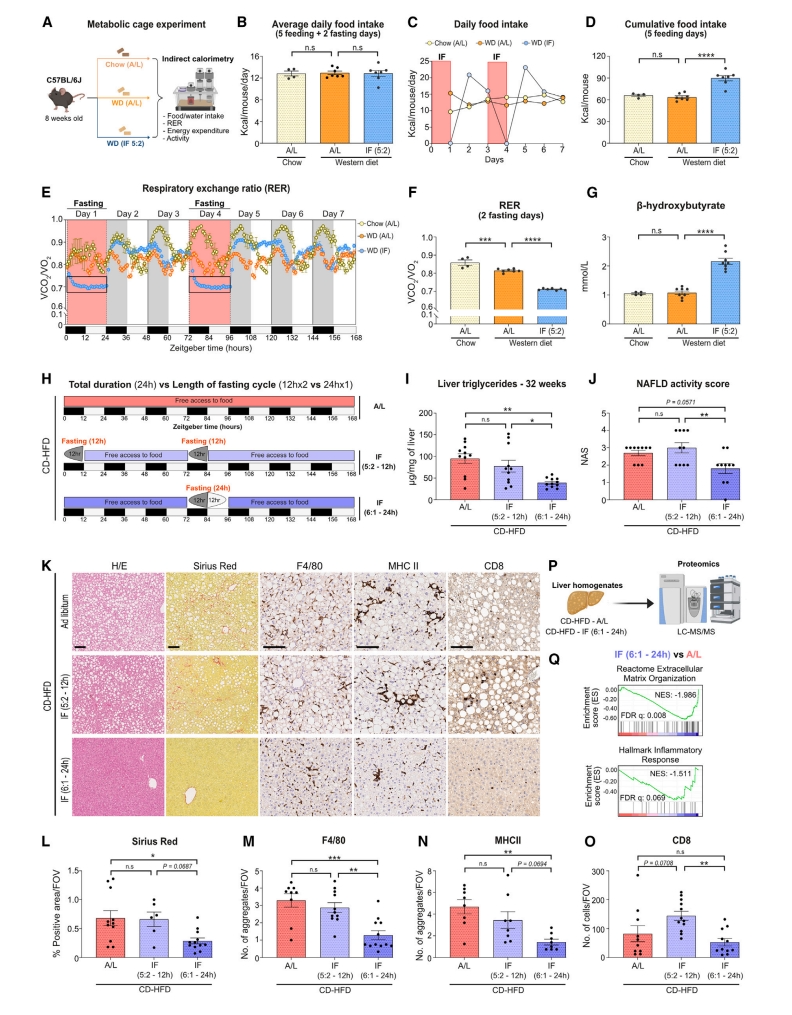
图二 禁食受益与总热量摄入无关,取决于禁食周期的长度[5]
下一步,研究者探索禁食缓解NASH的作用机制。将8周龄C57BL/6J小鼠喂食NASH饮食5周,分为自由饮食组和IF(5:2)方案饮食组,自由饮食组在喂食状态下收样,而IF(5:2)小鼠分为24小时禁食状态和禁食完再喂食4小时状态下收样(图三A)。对三组小鼠肝匀浆进行无偏蛋白质组学分析(图三B),发现不同营养状态调控了不同的蛋白质组(图三C)。差异表达蛋白的分析表明,IF(5:2)禁食状态小鼠与自由饮食组小鼠之间的几种已知禁食反应蛋白发生了显著变化,包括关键的糖异生酶(PCK1和VNN1)、参与脂肪酸氧化的酶(CYP4A10、CYP4A14、ACOT2和CROT)以及生酮速率限制酶(HMGCS2)在禁食期间均增加,而参与从头脂肪生成的关键酶(FASN和SCD1)显著下调(图三D)。基因集富集分析(GSEA)显示IF(5:2)禁食状态小鼠的脂肪酸代谢和PPAR信号通路相比自由饮食组小鼠显著富集(图三E);IPA分析证实脂肪酸氧化、生酮和PPARα/RXRα激活通路富集(图三F);通过IPA搜索上游调节因子发现PPARα是禁食反应的中心介质(图三G)。分析小鼠血清非酯化脂肪酸(NEFA)水平显示,IF(5:2)小鼠在禁食状态下增加,再喂食后迅速下降(图三H)。与自由饮食组小鼠相比,IF(5:2)禁食状态小鼠的血清皮质酮水平升高(图三I)。皮质酮是肝细胞中糖皮质激素受体(GR)的天然配体,GR与皮质酮结合后易位到细胞核,激活脂肪酸氧化、线粒体生物发生和糖异生相关的转录程序[6]。于是,研究者检测到PPARα靶基因Pdk4、GR靶基因Fkbp5和Mt2a、以及脂肪酸氧化、糖异生和线粒体生物发生相关基因在禁食状态下显著增加,并且再喂食后迅速下降(图三J-M)。相反,脂肪生成基因如Acaca和Fasn在禁食状态下显著减少,而再喂养后逆转(图三N)。免疫印迹显示,与正常饮食组小鼠相比,NASH小鼠的PPARα靶基因PDK4和PCK1显著减少(图三O),该现象在NASH患者中相比无肝脏病理的肥胖患者也观察到显著降低表达(图三P)。以上数据表明,PPARα和脂肪酸氧化是禁食缓解NASH的效应中心。
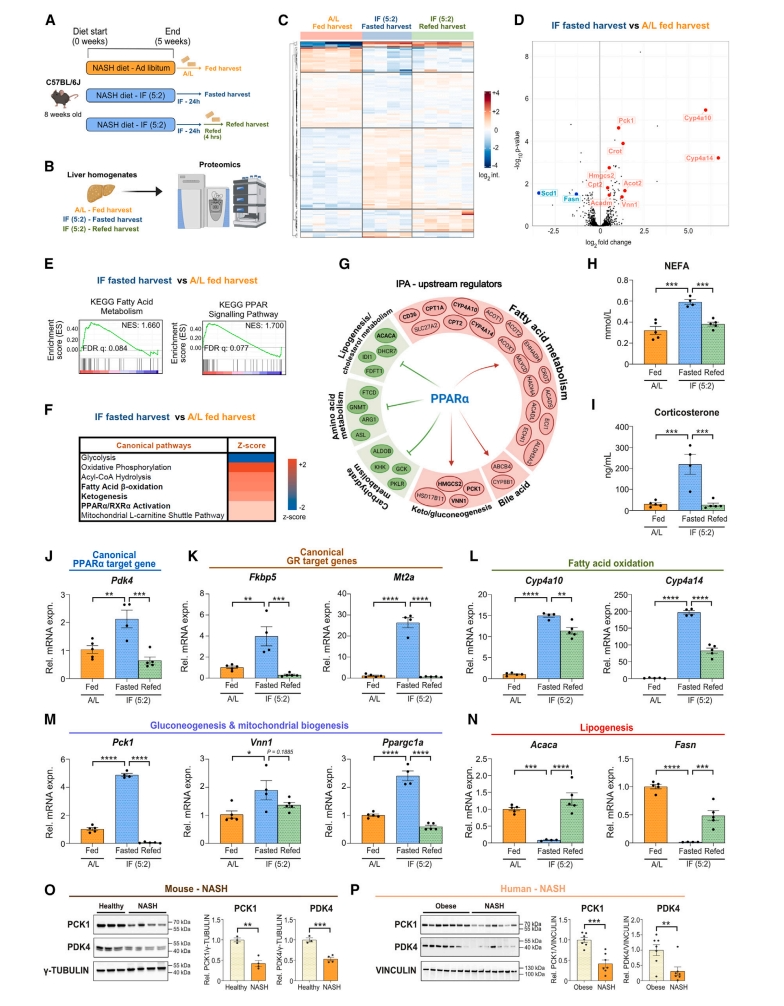
图三 PPARα是禁食缓解NASH的主要调节因子[5]
研究者深入探究在活动期(晚上7点)或非活动期(早上7点)开始的禁食受益差异(图四A),发现血清酮体、皮质酮在活动期禁食组小鼠中升高更为明显,而血清NEFA水平、脂肪酸氧化基因Cyp4a10和Cyp4a14的增加在两组禁食组中相似(图四B-F)。糖皮质激素靶基因Fkbp5和Mt2a的表达在活动期禁食组显著升高(图四G),这与皮质酮水平的升高相一致。在蛋白水平上,活动期禁食组诱导了更高的PCK1表达和pAMPKT172/ AMPK比值,而pAktS473/Akt比值的降低没有显著差异(图四H和I)。以上数据表明在活动期即晚上7点至晚上7点禁食可诱导更显著的肝脏反应,包括增加糖皮质激素信号传导和AMPK激活。
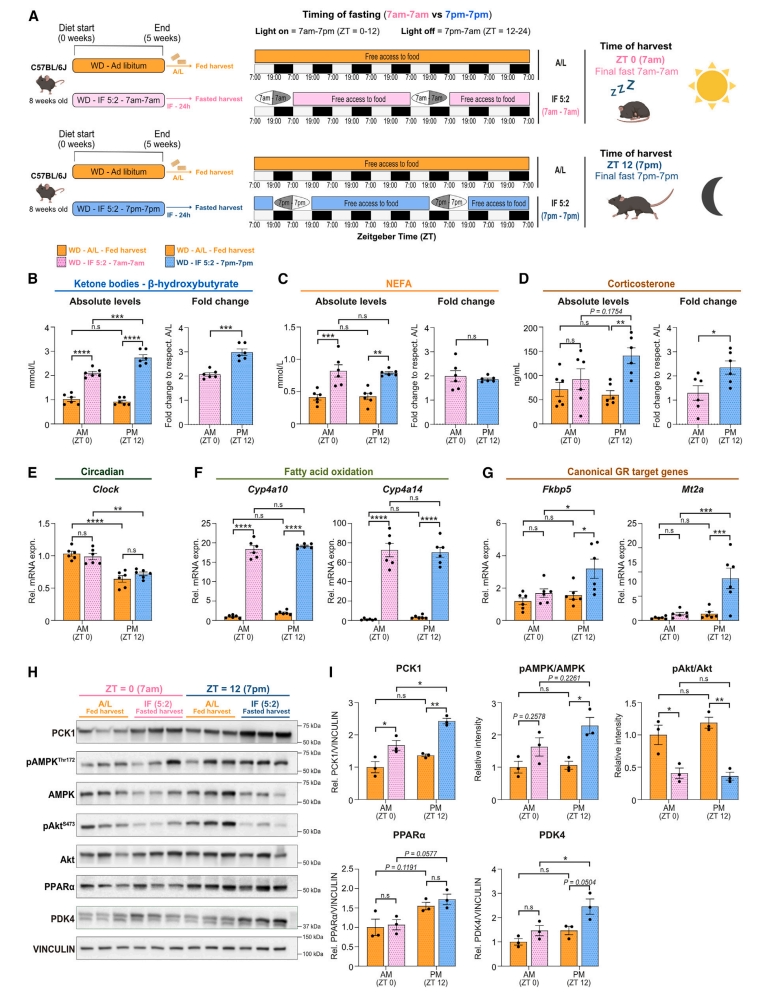
图四 活动期禁食才能强烈诱导糖皮质激素信号传导和PCK1表达[5]
禁食诱导血清非酯化脂肪酸(NEFA)和糖皮质激素(GC)增加,随后激活肝细胞中的PPARα和GR(图五A)。为了辨别其因果作用,研究者使用腺相关病毒载体AAV8分别或同时敲降Ppara或Pck1,然后小鼠WD自由饮食或IF(5:2)5周(图五B-C)。系统禁食反应(血糖和血清NEFA)在Ppara和/或Pck1敲降后保持不变,而禁食诱导的血清酮体升高在敲降后显著降低(图五D),脂肪酸氧化和生酮发生相关基因表达显著受损(图五E和F)。肝脏RNA测序和主成分分析显示,联合敲降消除了禁食诱导的PPAR信号和脂肪酸代谢富集,同时显示出炎症和纤维化相关途径的显著富集(图五G和H)。尽管禁食小鼠的体重都有所下降(图五I),但是单独或联合敲降Pck1会加剧增加血清ALT(图五J)。组织病理学分析显示,Ppara和/或Pck1敲降加重了WD诱导的免疫浸润和纤维化(图五K-M)。Pck1敲降后,REACTOME Rho GTP酶效应器信号显著富集(图五N),pAktS473/Akt比率显著增加,PDGFRβ和Desmin染色的显著升高,表明肝星状细胞活化(图五O-U)。以上数据表明,PPARα和PCK1作为禁食反应的肝脏执行者,二者的敲降不仅消除了禁食诱导的肝脏转录程序,而且在不影响全身肥胖或代谢的情况下加剧了肝脏病理。
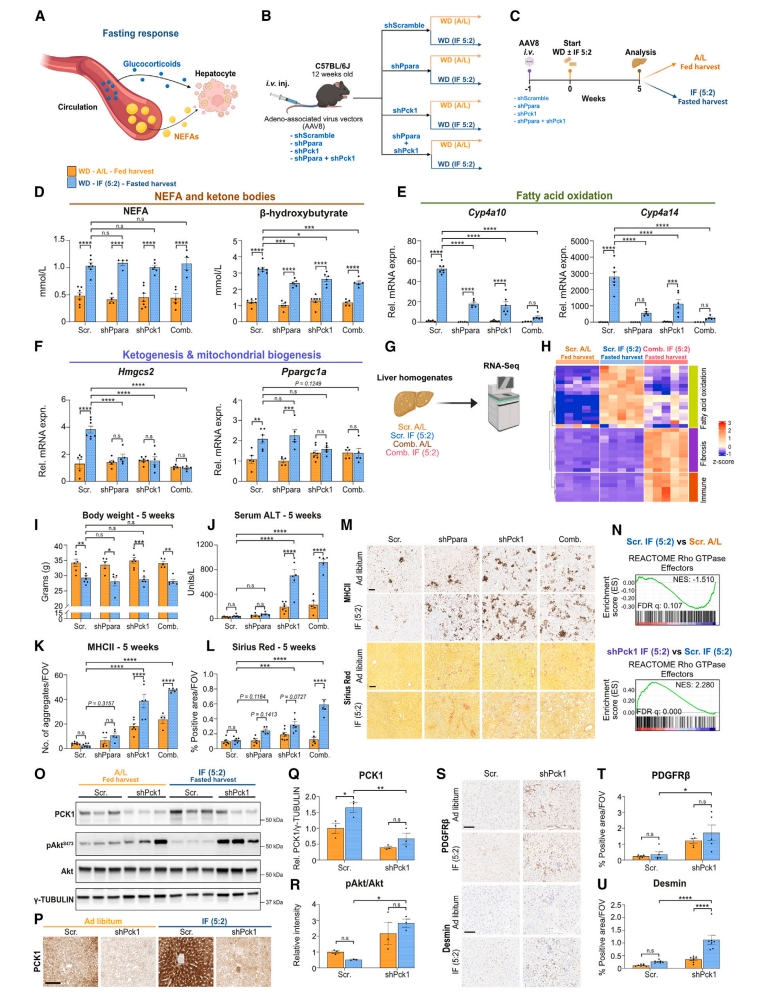
图五 PPARα和PCK1对于介导禁食缓解NASH至关重要[5]
最后,研究者探索IF(5:2)方案治疗已建立NASH的潜力。将8周龄雄性C57BL/6J小鼠WD喂食5个月后,分成体重匹配的两组,一组持续WD喂食4个月,另一组则进行活动期IF(5:2)方案(图六A)。与WD对照组相比,NASH后的IF(5:2)组仍能降低小鼠体重和脂肪量,以及血清ALT、ALP和胆固醇水平(图六B和C)。WD对照组小鼠中有36%显示出肿瘤病变,还表现出明显的肝脏肿大、肝脂肪变性、纤维化和免疫浸润,而IF(5:2)组小鼠则获得显著缓解(图六D-I),表明IF(5:2)方案可以改善已建立的NASH。进一步检测NASH向HCC的转变,采用WD或CD-HFD饮食造模15个月(图六J-K),发现IF(5:2)组小鼠的体重、脂肪质量、血清ALT和胆固醇显著降低,肝脏肿瘤发生率和数量、纤维化和免疫细胞浸润均显著降低(图六L-U)。以上数据表明,IF(5:2)方案不仅以治疗方式干预了NASH发展,而且显著减弱了后续HCC进展。
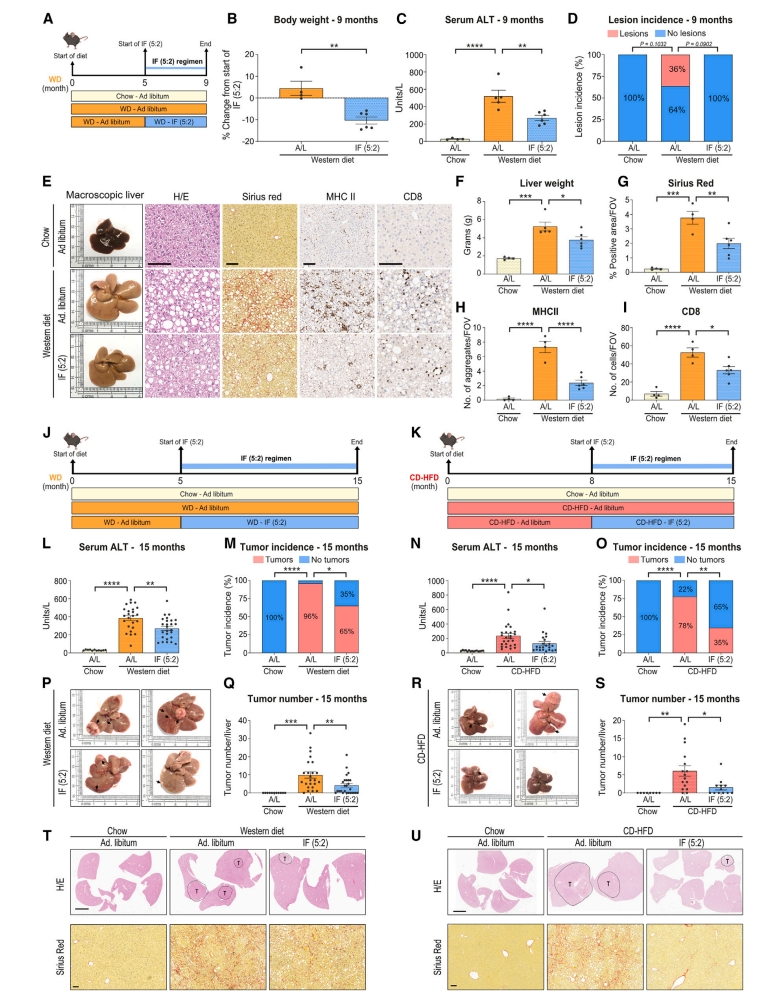
图六 间歇性禁食可缓解已建立的NASH及其随后的HCC转变[5]
综上所述,研究者使用不同饮食诱导的小鼠NASH模型,研究间歇性禁食对NASH及其随后的HCC转变的治疗潜力。活动期开始的5:2间歇性禁食可作为预防和治疗方案,可有效改善NASH和纤维化,并显著减缓了NASH向HCC的发展。表明5:2间歇性禁食方案是一种很有前景的经济且有效的NASH干预措施,值得进一步探索其(从早上7点开始禁食24小时,每周不连续禁食2天)在人体的治疗潜力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Anstee QM, Reeves HL, Kotsiliti E, Govaere O, Heikenwalder M: From NASH to HCC: current concepts and future challenges. Nat Rev Gastroenterol Hepatol 2019, 16(7):411-428.
2. Gallage S, Avila JEB, Ramadori P, Focaccia E, Rahbari M, Ali A, Malek NP, Anstee QM, Heikenwalder M: A researcher's guide to preclinical mouse NASH models. Nat Metab 2022, 4(12):1632-1649.
3. Wilkinson MJ, Manoogian ENC, Zadourian A, Lo H, Fakhouri S, Shoghi A, Wang X, Fleischer JG, Navlakha S, Panda S et al: Ten-Hour Time-Restricted Eating Reduces Weight, Blood Pressure, and Atherogenic Lipids in Patients with Metabolic Syndrome. Cell Metab 2020, 31(1):92-104.e105.
4. Rangan P, Choi I, Wei M, Navarrete G, Guen E, Brandhorst S, Enyati N, Pasia G, Maesincee D, Ocon V et al: Fasting-Mimicking Diet Modulates Microbiota and Promotes Intestinal Regeneration to Reduce Inflammatory Bowel Disease Pathology. Cell Rep 2019, 26(10):2704-2719.e2706.
5. Gallage S, Ali A, Barragan Avila JE, Seymen N, Ramadori P, Joerke V, Zizmare L, Aicher D, Gopalsamy IK, Fong W et al: A 5:2 intermittent fasting regimen ameliorates NASH and fibrosis and blunts HCC development via hepatic PPARα and PCK1. Cell Metab 2024, 36(6):1371-1393.e1377.
6. Præstholm SM, Correia CM, Grøntved L: Multifaceted Control of GR Signaling and Its Impact on Hepatic Transcriptional Networks and Metabolism. Frontiers in endocrinology 2020, 11:572981.



