技术分享:中性粒细胞转录图谱揭示抗原提呈亚群的抗肿瘤潜能
中性粒细胞是人体中对抗病原体的最丰富、最有效且最快速的防御细胞,可以感知各种信号如炎症和创伤,从而启动趋化作用调节肿瘤微环境(TME)[1, 2]。然而,人体中性粒细胞的半衰期短,仅有6-8小时,大大限制了多数单细胞RNA测序(scRNA-seq)方法对其进行高通量分析[3]。尽管中性粒细胞在全身器官和肿瘤中广泛分布,但因其较低的mRNA含量(每百万细胞仅0.33 μg,而巨噬细胞和单核细胞可达2.55 μg)[4],导致目前对人体中性粒细胞的转录多样性和时空异质性的理解仍处于初级阶段。在功能方面,中性粒细胞发挥抗肿瘤还是促肿瘤的功能是肿瘤免疫领域争议的焦点之一。长期以来,肿瘤相关中性粒细胞被认为具有免疫抑制作用,会加重患者的预后。然而,最近发现它们可通过释放活性弹性蛋白酶、一氧化氮合酶或活性氧(ROS)来杀死癌症细胞[5, 6]。因此,亟需系统性描绘肿瘤浸润中性粒细胞的细胞多样性,解析其基因表达谱式的多样性以及生态位结构。
2024年3月,Cell期刊报道了一项涵盖17个癌种的中性粒细胞转录图谱研究,整合了来自肝癌、胆管癌、胆囊癌等143例患者共计225例样本中性粒细胞的单细胞转录组数据(其中自测数据占79.29%)。肿瘤相关中性粒细胞表现出惊奇的复杂性,可分为10种不同状态,包括炎症、血管生成和抗原提呈亚群。在大多数癌症中,抗原提呈型中性粒细胞与患者的良好生存率相关,可被亮氨酸代谢和随后组蛋白H3K27ac修饰所引发,进一步诱导新抗原特异性和抗原非依赖性T细胞反应。这种抗原提呈型中性粒细胞过继治疗或富含亮氨酸饮食可微调免疫平衡,增强在各种小鼠癌症模型中的抗PD-1免疫疗法的治疗效果。该研究不仅表明了中性粒细胞在不同癌症中的差异,还揭示了抗原提呈亚群在抗肿瘤治疗中的潜能[7]。
由于中性粒细胞在实体瘤中浸润程度差异很大,目前对于特定癌症类型和浸润程度还没达成共识。于是,研究者首先探索浸润模式来选择合适的癌症类型,测试8种常见的免疫定量算法分析癌症基因组图谱(TCGA)数据,涵盖了31种实体瘤的8766个样本。基于三种算法制定出中性粒细胞浸润评分,揭示了中性粒细胞浸润的组织选择性模式可分为3种亚型,包含29.6%的高浸润性(肺癌、肾癌)、30.0%异质性(胃肠癌)和40.4%低浸润性(图一A)。通过比较免疫亚型中的中性粒细胞水平,观察到优先浸润到炎症或纤维化抑制性TME中(图一B),与之前报道的中性粒细胞浸润模式和功能相一致。基于此,研究者设计了一种标准化中性粒细胞分选方案和计算策略,重点关注浸润程度高或中等的癌种,成功地对64名患者的103个样本进行测序,同时对已发布数据集进行计算分析,最终构建了来自17个癌种143名患者共计225个样本的179908个中性粒细胞图谱,其中12个癌症类型数据(79.29%)是自测数据(图一C)。研究者对中性粒细胞转录组进行聚类,观察到癌症和组织类型之间的高度异质性(图一D),可分为10种不同状态(图一E和F)。例如,HLA-DR+CD74+ 亚群显示出MHC-II类分子的高表达和癌症的普遍浸润,还有可能代表炎症反应(CXCL8+IL1B+)和特异性趋化性(CXCR2+)特征的亚群(图一F)。表明该中性粒细胞图谱不仅捕捉到了已知的中性粒细胞亚群特征,还揭示了潜在的非典型亚群特征,为中性粒细胞研究提供了潜在资源,数据已发布到http://www.pancancer.cn/neu/。
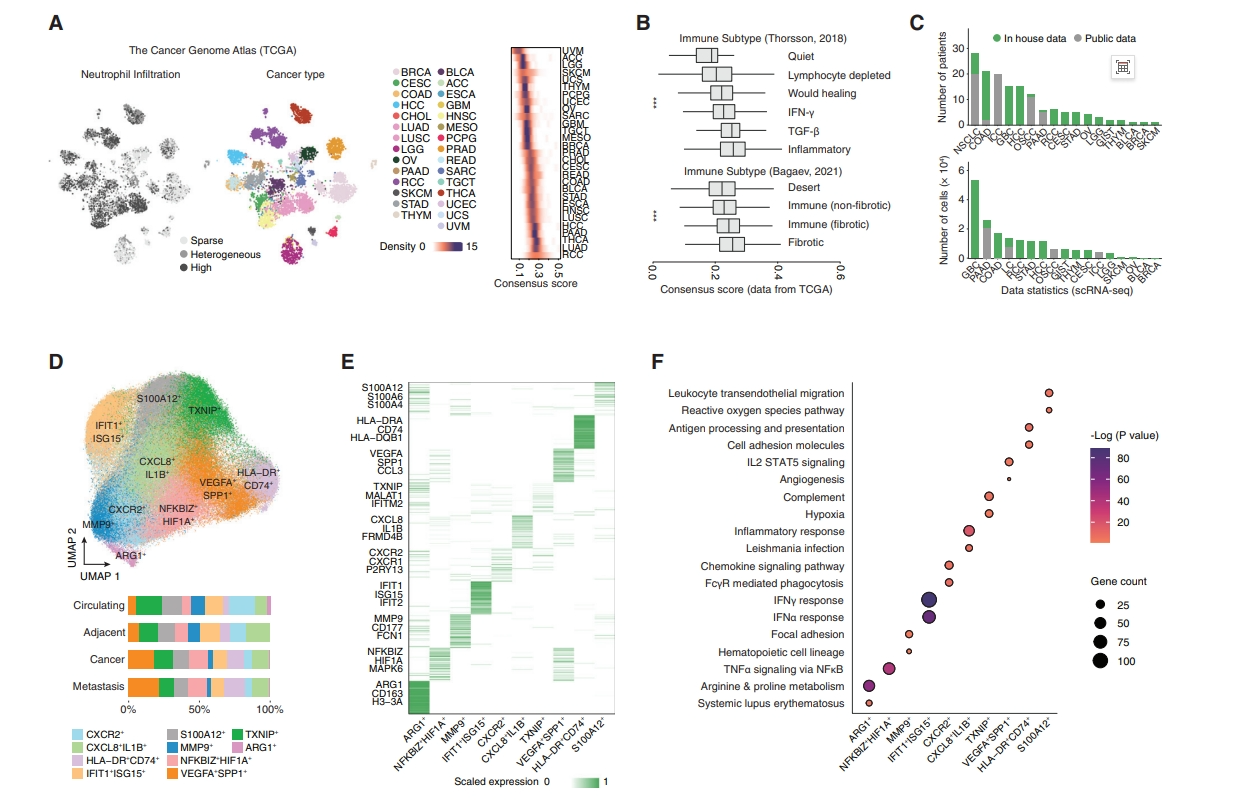
图一 泛癌中性粒细胞单细胞图谱的构建[7]
随后,研究者探索中性粒细胞不同亚群的分支(图二A)。根据Ro/e分析(观察到的细胞数与预期细胞数的比率),HLA-DR+CD74+ 和VEGFA+SPP1+ 中性粒细胞是癌症最富集的亚群(图二B),但显示出癌症类型偏好。前者主要在非小细胞肺癌(NSCLC)、膀胱癌(BLCA)和卵巢癌(OV)中富集,而在肾细胞癌(RCC)和口腔鳞状细胞癌(OSCC)中浸润减少;后者在NSCLC、BLCA和OV中表现出稀疏浸润,但在RCC和胃腺癌(STAD)中富集。在独立的多癌-TMA队列(n=68)中,通过流式细胞术(n=24)和多重免疫组织化学(mIHC)对上述发现进行验证(图二C-E)。该队列包括8种癌症类型,包括乳腺癌(BRCA)、结肠腺癌(COAD)、肝内胆管癌(ICC)、肝细胞癌(HCC)、STAD、NSCLC、RCC和胰腺癌(PAAD)。为了探索中性粒细胞亚群与患者生存率的关系,研究者分析了TCGA泛癌数据集的中性粒细胞子集特征,发现 VEGFA+SPP1+ 亚群与最差患者预后相关(图二F,8癌-TMA队列),而HLA-DR+ 与最佳预后相关。进一步在独立的8癌-TMA队列中通过mIHC证实了HLA-DR+ 中性粒细胞的预后相关性(图二G)。以上数据表明,HLA-DR+中性粒细胞可能在大多数癌症类型中代表一个关键的抗肿瘤中性粒细胞亚群。
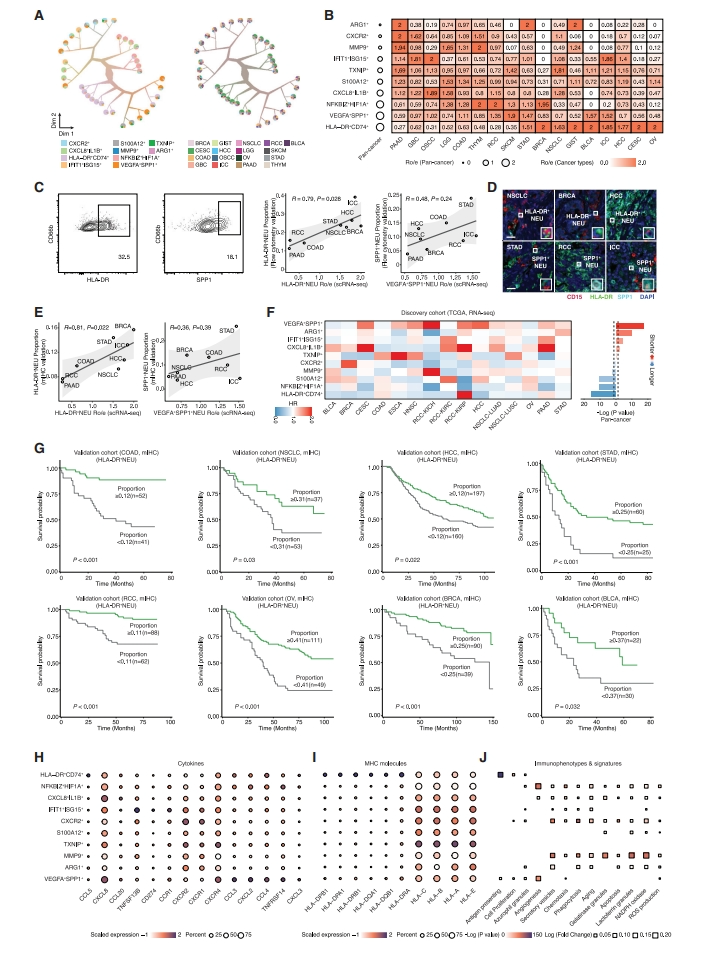
图二 中性粒细胞的分子特征及其生存相关性[7]
接下来,研究者比较不同中性粒细胞亚群的细胞因子谱式(图二H)。IFIT1+ISG15+ 中性粒细胞与PD-L1(CD274)的高表达相关,表明其免疫抑制作用。只有HLA-DR+CD74+ 中性粒细胞显示出MHC-II类分子如HLA-DRA和HLA-DRB1的特异性富集(图二I)。然而,几乎所有的中性粒细胞亚群都表达高水平的MHC-I类分子,与所有有核细胞的表达相一致[8]。与此同时,中性粒细胞子集的免疫表型特征显示出显著的多样性(图二J),而几乎所有的亚群都显示出高衰老特征,支持了肿瘤相关中性粒细胞大多处于成熟状态的观点。鉴于中性粒细胞生物学的已知昼夜节律特征[9],进一步比较在一天中不同时间采样的表型特征,观察到中性粒细胞在白天的成熟度和趋化性水平较高。这些数据共同强调了中性粒细胞的亚群特异性分子标志。
长期以来,中性粒细胞一直被认为是成熟和最终分化的细胞。然而,它们成熟状态的多样性是如何实现的仍是未知。于是,研究者应用了一种基于向量场的深度学习算法来推断谱系特化和分化的渐进步骤。观察到沿着中性粒细胞状态的连续分化,HLA-DR+CD74+ 中性粒细胞的伪时序值最高(图三A)。根据中性粒细胞的肿瘤特异性和伪时序对其进行排序,发现HLA-DR+CD74+ 中性粒细胞可能处于终末分化的成熟状态(图三B)。为了验证这一发现,研究者首先使用流式细胞术评估了24名8癌种患者肿瘤内中性粒细胞的成熟标志物CD11b和CD16,发现HLA-DR+ 中性粒细胞亚群显著更高表达(图三C)。随后,使用mIHC在癌症中证实HLA-DR+ 中性粒细胞的成熟标记物CD11b和MPO表达增强(图三D和E)。总之,这些数据表明HLA-DR+ 中性粒细胞可能是终末成熟中性粒细胞亚群之一。
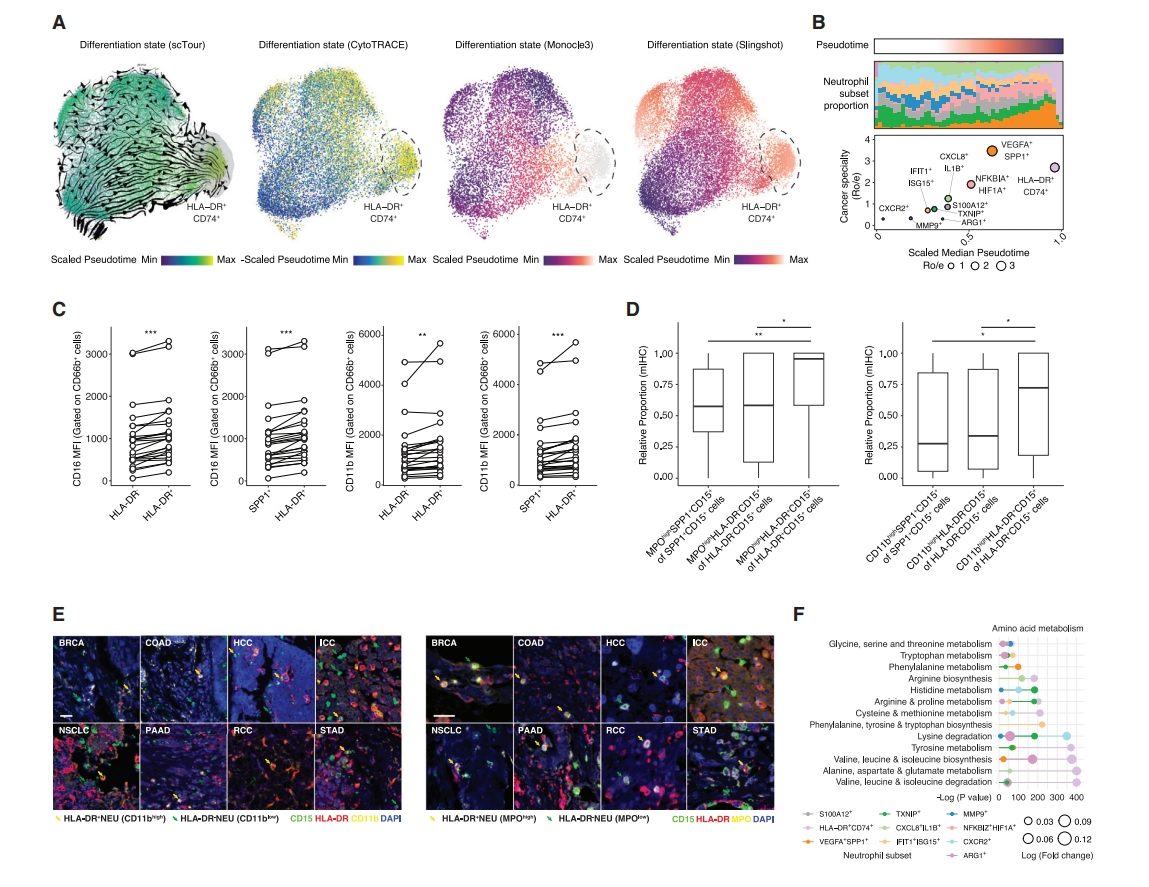
图三 HLA-DR+ 中性粒细胞的终末成熟分化和代谢重编程[7]
研究者量化亚群的代谢通路活性,发现HLA-DR+ 中性粒细胞显示出氨基酸代谢的显著富集如缬氨酸、亮氨酸和异亮氨酸(图三F)。而在免疫抑制性VEGFA+SPP1+ 中性粒细胞中,激活维生素代谢和聚糖代谢占主导地位,提示氨基酸代谢启动HLA-DR程序。为系统性检查氨基酸对中性粒细胞的影响,研究者设计一种包括所有20个氨基酸的体外筛选策略,来研究它们对健康供体循环中性粒细胞抗原提呈的影响(图四A)。特别地,亮氨酸上调HLA-DR(图四B)、共刺激分子如CD80(图四C),显著促进MHC-II复合物组装的基因表达(图四D),增强抗原加工蛋白酶(图四E),并促进抗原负载过程(图四F)。RNAseq分析也证实亮氨酸对MHC-II类的影响,但对MHC-I类没有影响(图四G),表明亮氨酸可以有效启动中性粒细胞抗原提呈程序。对亮氨酸处理后中性粒细胞进行非靶向代谢组学分析,观察到ATP和脂肪酸产生出现显著差异(图四H)。ATP产生主要发生在线粒体中,亮氨酸处理导致线粒体聚集和表型改变(图四I),显著增强了线粒体耗氧率(OCR)(图四J)。透射电子显微镜(TEM)分析表明亮氨酸处理可诱导特定的形态特征,如线粒体长度变长,膜上出现更多的伪足(图四K)。通过量化单个HLA-DR+ 中性粒细胞的线粒体呼吸特征,观察到复合物I在亮氨酸处理后显示出更高的活性,而复合体III和IV的特征活性较弱或中等(图四L)。抑制复合物I的活性使得HLA-DR+ 中性粒细胞比例降低(图四M)。进一步用13C-标记亮氨酸处理来自健康供体的中性粒细胞,发现亮氨酸被催化成乙酰辅酶A,进入三羧酸(TCA)循环,并通过报道的分解代谢途径[10]产生显著增多的谷氨酸和谷氨酰胺(图四N)。一致地,在亮氨酸处理过程中启动了CoA生物合成信号,乙酰辅酶A激活剂显著上调了HLA-DR,抑制乙酰辅酶A显著降低了HLA-DR水平,而其恢复可挽救HLA-DR表达(图四O),表明乙酰辅酶A对HLA-DR的依赖性调节。鉴于乙酰辅酶A和H3K27ac之间的已知联系,研究者观察到亮氨酸处理后H3K27ac增强(图四P),而组蛋白H3本身没有变化。CUT&Tag显示MHC-II基因上的H3K27ac显著上调(图四Q),但对H3K27me3和H3K4me3没有影响(图四R和S),表明亮氨酸可以影响H3K27ac,从而激活MHC-II基因如HLA-DRA和HLA-DQB1、其转录因子和调节元件如MHC-II超级增强子(图四T)。以上数据表明,亮氨酸分解代谢通过线粒体和代谢表观遗传调控如乙酰辅酶A/H3K27ac/MHC-II轴调控抗原提呈机制。
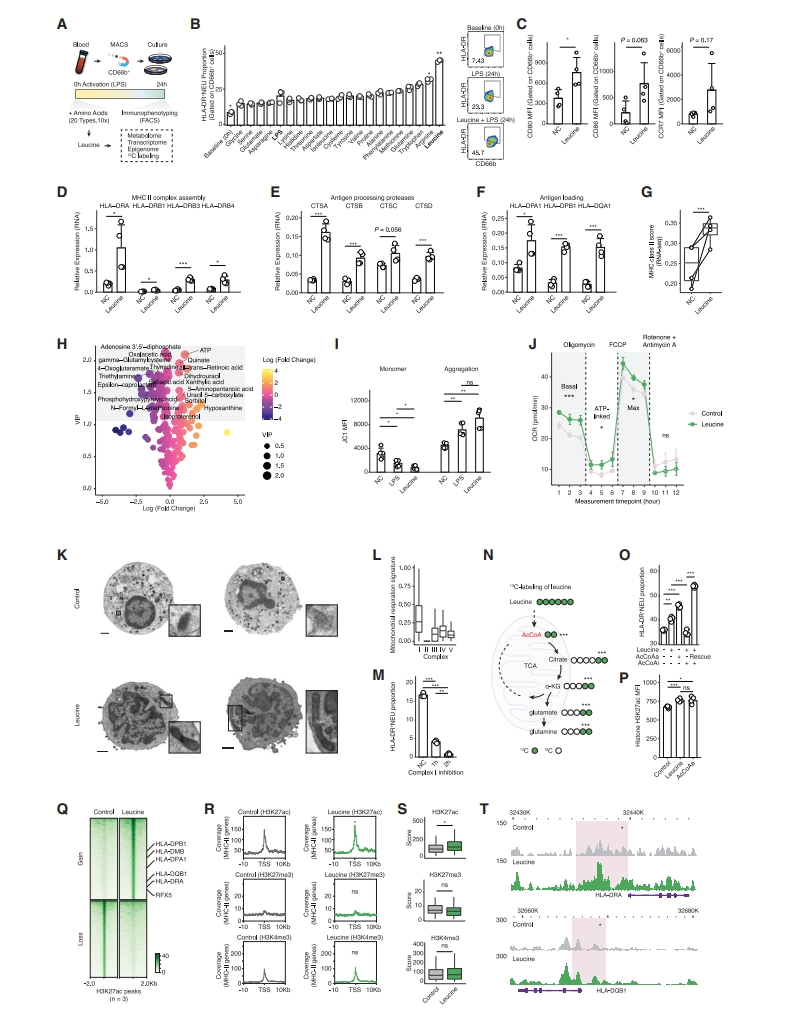
图四 亮氨酸通过代谢表观遗传学调控启动HLA-DR+ 中性粒细胞的产生[7]
由于HLA-DR+ 中性粒细胞有利于预后,研究者进一步研究其潜在抗肿瘤作用机制。首先对匹配的肿瘤样本进行RNA-seq,去卷积免疫细胞谱式,进行免疫细胞比例聚类,观察到模式化的中性粒细胞-T细胞浸润谱式(图五A)。研究者提取50个空间转录组数据集,覆盖9个癌种178330个点,计算HLA-DR+ 中性粒细胞与主要免疫谱系之间的相关性。在RCC样本中,CD8+ T细胞显示出与HLA-DR+ 中性粒细胞的强烈共定位,在OV和CRC样本中观察到类似的结果(图五B),表明抗原提呈中性粒细胞在空间上与T细胞相连。将中性粒细胞亚群(从肿瘤中分选)与自体CD3+ T细胞(从PBMC中分选)共培养3天,发现HLA-DR+中性粒细胞可以促进T细胞表达TNFα(图五C)。随后在单细胞水平上量化等位基因特异性HLA基因表达,HLA-DRB1、HLA-DPA1和HLA-DQB1显示出高频率(图五D)。用人MHC-II抗原(gp100、CMV)处理中性粒细胞,再与自体T细胞共培养,发现分选的HLA-DR+ 中性粒细胞引起了自体T细胞的抗原特异性反应,尽管比阳性对照(DC)弱些(图五E),提示HLA-DR+ 中性粒细胞可能提呈肿瘤新抗原而引发反应性T细胞响应。为了验证这一假设,将HLA-DR+ 中性粒细胞与突变衍生的新抗原(TP53、KRAS、IDH2和BAP1)孵育24小时,再与自体CD3+ T细胞共培养,观察到大多数出现新抗原刺激T细胞反应(图五F),尽管对不同供体的响应不同。当HLA-DR+ 中性粒细胞与T细胞的比例为10:1时,KRASG12V或KRASG12D新抗原可激活T细胞的有效新抗原反应(图五G),以及强反应性TCR基因重排(图五H),与DC相当(图五I)。并在多癌-TMA队列中验证了反应性T细胞和抗原提呈型中性粒细胞的共同定位(图五J)。以上数据表明,抗原提呈型中性粒细胞可以有效诱导反应性T细胞响应。
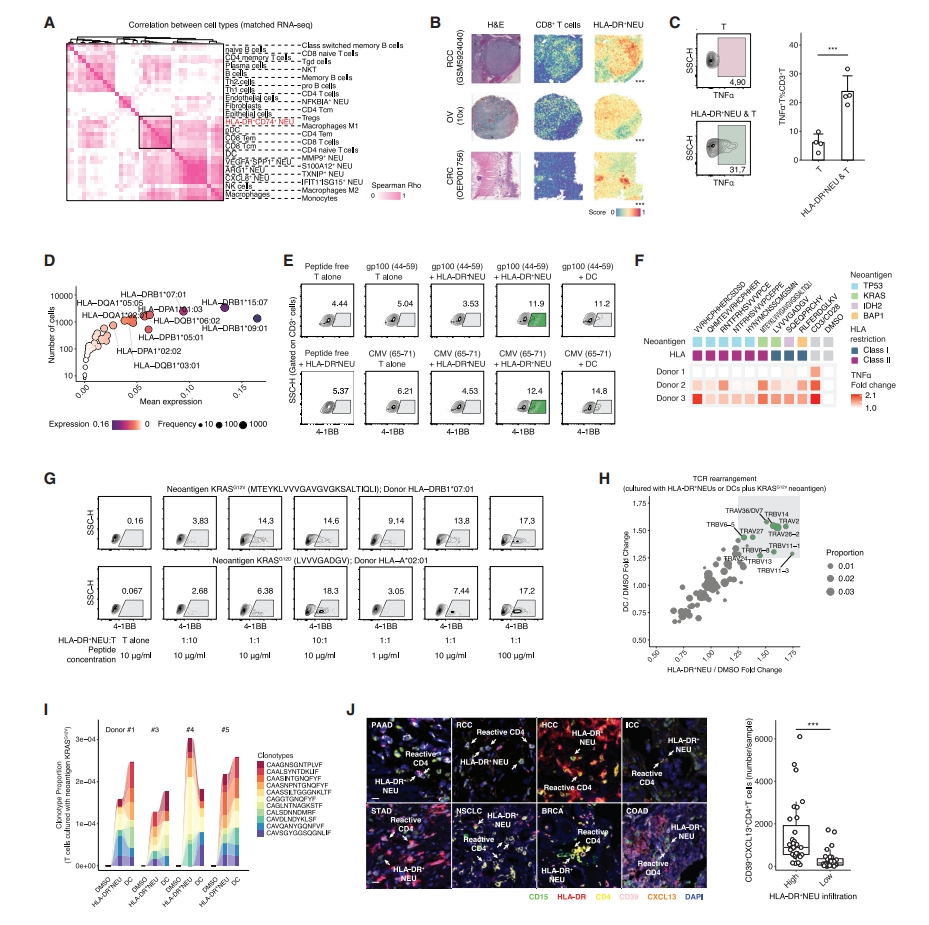
图五 HLA-DR+ 中性粒细胞及其相关T细胞反应[7]
接着,研究者探究HLA-DR+ 中性粒细胞能否在体内增强免疫疗法。收集来自7种小鼠癌症类型的scRNA-seq数据,在小鼠中观察到类似的亚群,如Cd74+、Spp1+Vegfa+ 和Isg15+中性粒细胞(图六A),以及H2-Aa(HLA-DQA同源物)、H2-Ab1(HLA-DQB1同源物)和Cd74在Cd74+ 亚群中的表达和抗原提呈特征(图六B),并使用mIHC证实了该亚群(图六C)。在体外用亮氨酸刺激小鼠循环中性粒细胞,观察到Cd74、Cd80和Cd86的上调(图六D)。而来自缺乏亮氨酸转运蛋白或分解代谢酶(Lat1KO、Bcat2KO和DbtKO)敲除小鼠的循环中性粒细胞对亮氨酸处理没有反应(图六D)。为研究抗原提呈中性粒细胞与肿瘤表型之间的体内相关性,构建了特异性缺失抗原提呈中性粒细胞的小鼠MHC-IIflox/flox;Ly6GCre-tdTomato,皮下注射小鼠癌症细胞LLC、MC38和Hepa 1-6,观察到肿瘤生长增加(图六E),肿瘤内Cd4和Cd8 T细胞浸润均显著减少(图六F)。给予小鼠富含亮氨酸的饮食(1.5%亮氨酸饮水),观察到Cd74+ 中性粒细胞增加(图六G)和T细胞浸润增加(图六H和I)。以上数据表明,短期亮氨酸饮食有利于抗TME,并诱导癌症细胞表型的轻微变化。
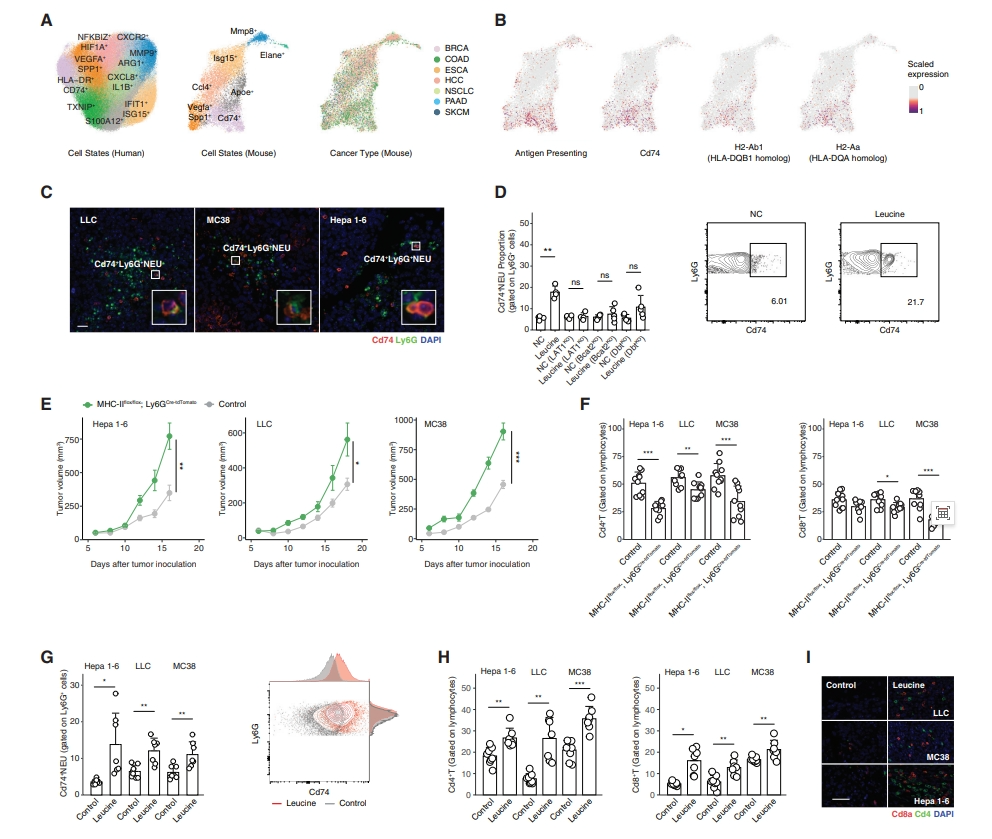
图六 抗原提呈中性粒细胞与体内免疫表型的相关性[7]
最后,研究者探究Cd74+ 中性粒细胞对小鼠癌症的治疗作用。亮氨酸饮食加上抗PD-1治疗显著减少了肿瘤体积,促使疾病稳定(图七A)。分离小鼠循环中性粒细胞,用亮氨酸刺激后递送到肿瘤中,显著缩小了肿瘤体积,但仍没有产生稳定的疾病结果(图七B)。结合PD-1抗体和Cd74+ 中性粒细胞过继治疗,可在所有肿瘤模型中观察到强大的抗肿瘤效果(图七C)。相反,Cd74敲除中性粒细胞与抗PD-1联合显示出较弱的疗效。进一步在临床免疫治疗中检测抗原提呈中性粒细胞,在接受免疫疗法的8个队列包括SKCM、STAD、HCC、BLCA和NSCLC患者中,观察到HLA-DR+ 中性粒细胞与更好的生存率或响应程度显著正相关(图七D和E)。根据患者来源的肿瘤组织块(PDTF)策略,在抗PD-1免疫疗法耐药的HCC样本中测试过继性离体治疗。共培养3天后,CD4和CD8 T细胞均显示出细胞毒性分子(IFNg和TNFa)和反应性分子(4-1BB和CD39)的上调(图七F),以及更强的T细胞反应性和细胞毒性(图七G)。以上数据强调了抗原提呈型中性粒细胞在免疫疗法中的协同抗癌作用。
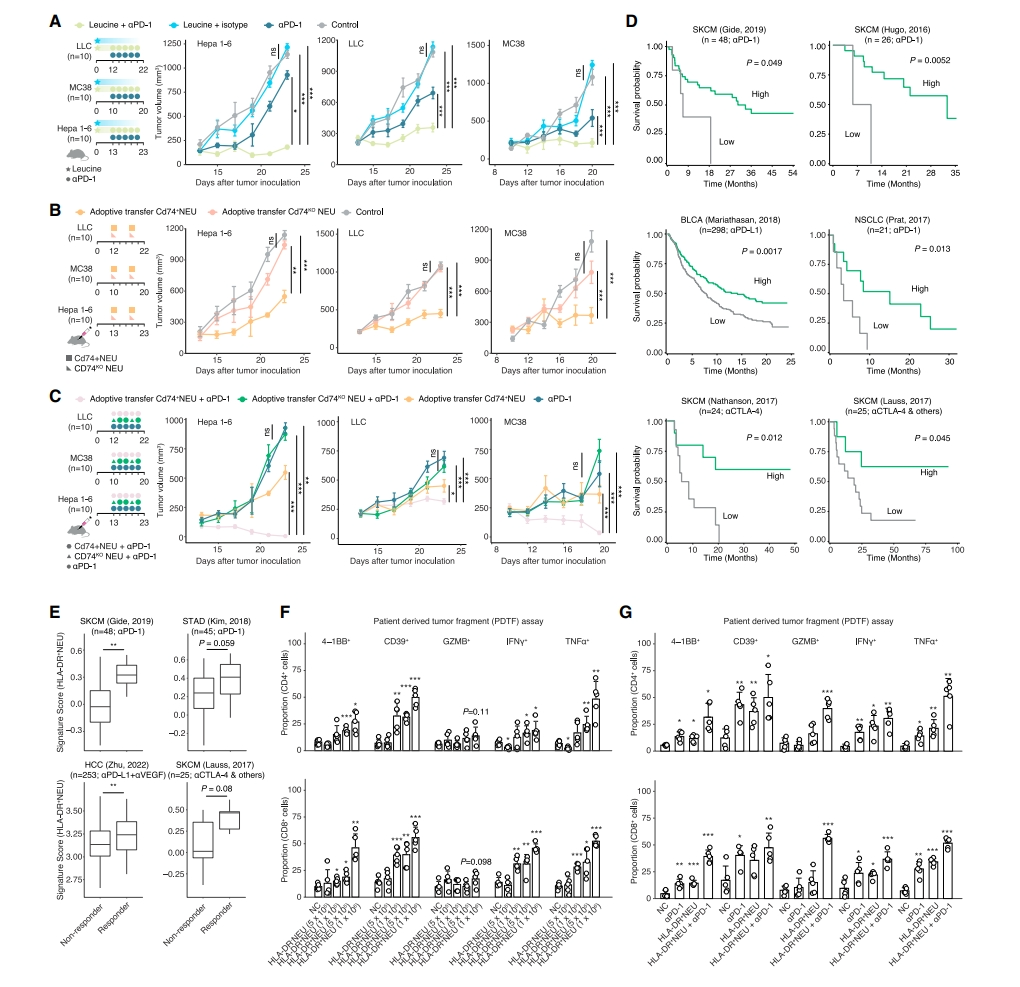
图七 抗原提呈型中性粒细胞的疗效评估[7]
综上所述,研究者构建了17个癌种(225例样本)中性粒细胞单细胞转录组图谱,揭示了肿瘤相关中性粒细胞的表型多样性,如抗原提呈型、促血管新生型等,发现与良好预后相关的HLA-DR+CD74+亚群可诱导T细胞抗原特异反应并促进形成“热肿瘤”微环境,是潜在的免疫治疗增敏策略。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Burn GL, Foti A, Marsman G, Patel DF, Zychlinsky A: The Neutrophil. Immunity 2021, 54(7):1377-1391.
2. Hedrick CC, Malanchi I: Neutrophils in cancer: heterogeneous and multifaceted. Nature reviews Immunology 2022, 22(3):173-187.
3. Summers C, Rankin SM, Condliffe AM, Singh N, Peters AM, Chilvers ER: Neutrophil kinetics in health and disease. Trends in immunology 2010, 31(8):318-324.
4. Wigerblad G, Cao Q, Brooks S, Naz F, Gadkari M, Jiang K, Gupta S, O'Neil L, Dell'Orso S, Kaplan MJ et al: Single-Cell Analysis Reveals the Range of Transcriptional States of Circulating Human Neutrophils. J Immunol 2022, 209(4):772-782.
5. Cui C, Chakraborty K, Tang XA, Zhou G, Schoenfelt KQ, Becker KM, Hoffman A, Chang YF, Blank A, Reardon CA et al: Neutrophil elastase selectively kills cancer cells and attenuates tumorigenesis. Cell 2021, 184(12):3163-3177.e3121.
6. Hirschhorn D, Budhu S, Kraehenbuehl L, Gigoux M, Schröder D, Chow A, Ricca JM, Gasmi B, De Henau O, Mangarin LMB et al: T cell immunotherapies engage neutrophils to eliminate tumor antigen escape variants. Cell 2023, 186(7):1432-1447.e1417.
7. Wu Y, Ma J, Yang X, Nan F, Zhang T, Ji S, Rao D, Feng H, Gao K, Gu X et al: Neutrophil profiling illuminates anti-tumor antigen-presenting potency. Cell 2024, 187(6):1422-1439.e1424.
8. Hewitt EW: The MHC class I antigen presentation pathway: strategies for viral immune evasion. Immunology 2003, 110(2):163-169.
9. Adrover JM, Aroca-Crevillén A, Crainiciuc G, Ostos F, Rojas-Vega Y, Rubio-Ponce A, Cilloniz C, Bonzón-Kulichenko E, Calvo E, Rico D et al: Programmed 'disarming' of the neutrophil proteome reduces the magnitude of inflammation. Nature immunology 2020, 21(2):135-144.
10. Zaganjor E, Yoon H, Spinelli JB, Nunn ER, Laurent G, Keskinidis P, Sivaloganathan S, Joshi S, Notarangelo G, Mulei S et al: SIRT4 is an early regulator of branched-chain amino acid catabolism that promotes adipogenesis. Cell Rep 2021, 36(2):109345.



