技术分享:利用微囊化可增殖人肝细胞类器官治疗肝功能衰竭的临床前研究
急性肝功能衰竭的致死率很高,目前肝脏移植仍是治疗肝功能衰竭的唯一有效方法[1]。由于供体肝源短缺,肝细胞移植(HTx)可作为肝脏移植的替代策略。可是,HTx的临床应用仍受到多种阻碍,比如人原代肝细胞(PHH)短缺及其质量控制困难[2]。科学家们为获得人肝细胞做了大量努力,例如从多能干细胞分化获得或者从成纤维细胞转分化而来,这些类肝细胞已被用于动物模型的肝衰竭治疗。然而,它们在改善肝功能方面还不够完善,而且涉及到体外遗传操作也易于引发体内移植的安全性担忧[3]。近期,科学家们开发出多种将PHH体外去分化为类前体细胞并大量扩增的培养系统,其中有一种可在没有遗传操作的情况下实现将PHH去分化为可增殖人肝细胞(ProliHH)[4]。ProliHH显示出肝细胞和肝前体细胞的双表型特征,可在体外扩增至少1万倍,并且在3D类器官系统中重新分化为近似PHH的成熟状态。ProliHH类器官的肝脏基因表达和相应肝脏功能都得到了显著改善,可维持长达数周,且不影响细胞活力和功能,使其成为肝细胞治疗的潜在供体细胞[5]。
微囊化细胞移植技术是一种细胞治疗的递送方式。基于卓越的生物相容性和物理稳定性[6],天然海藻酸钠可作为一种免疫保护和半渗透性屏障,为封装细胞提供营养和氧气,并释放其分泌蛋白质[7]。这种微囊化PHH通常可直接移植到腹膜内,不需要额外预处理,其疗效已在多种肝衰竭模型中被证明。鉴于ProliHH类器官的供体细胞优势,亟需评价其微囊化递送方式的疗效和安全性。
2024年4月,Cell Stem Cell期刊报道了微囊化递送可增殖人肝细胞(ProliHH)类器官的临床前研究,利用海藻酸钠包裹ProliHH肝脏类器官(eLO)进行腹膜移植以治疗肝衰竭。eLO治疗可提高肝切诱导的肝衰竭模型(ePH)的小鼠存活率,并改善高血氨和低血糖等症状,对于对乙酰氨基酚(APAP)诱导的肝衰竭也有一定的治疗效果。eLO治疗可改善ePH小鼠的肠道形态和通透性,降低血清内毒素和炎症水平,从而促进肝脏再生。eLO治疗具有很好的体内安全性,对受体小鼠没有不良影响,且无致瘤性,为eLO临床研究奠定了坚实的基础[8]。
研究者前期开发了一种PHH去分化培养系统,可将一管冷冻保存的PHH(约106-107个细胞)在6次传代内扩增获得1×1010个细胞[5]。基于该培养体系,研究者在2D培养中大规模扩增ProliHH,进而在超低附着板中培养获得成熟的3D肝脏类器官(LO),最后用海藻酸钠进行封装获得eLO(图一A)。eLO大小均匀,平均直径为435±48 μm,可维持至少1周没有明显形态变化(图一B-D)。通过钙黄绿素和同型二聚体乙酯1(EthD-1)染色证实培养过程中eLO的活力保持在85%,与LO活力(90%)相当(图一E)。Pearson分析显示,eLO在转录组水平上接近于LO(图一F)。实时荧光定量PCR(qPCR)分析显示,eLO中成熟肝基因ALB、AAT、CYP1A2、ASS1表达上调(图一G)。ELISA测定出人白蛋白(hAlb)和α1-抗胰蛋白酶(AAT)的高表达和分泌(图一H)。eLO在I期酶(CYP1A2、CYP2C9、CYP2D6、CYP3A)和II期酶UGT1A1活性(图一I和J)、氨清除和尿素合成(图一K)方面表现出与LO相似的代谢活性。此外,通过PAS染色检测,LO和eLO均显示出显著的糖原存储(图一L)。以上数据表明,封装后的ProliHH仍保持成熟的肝细胞特征,即微胶囊包裹不影响LO成熟的肝细胞功能。
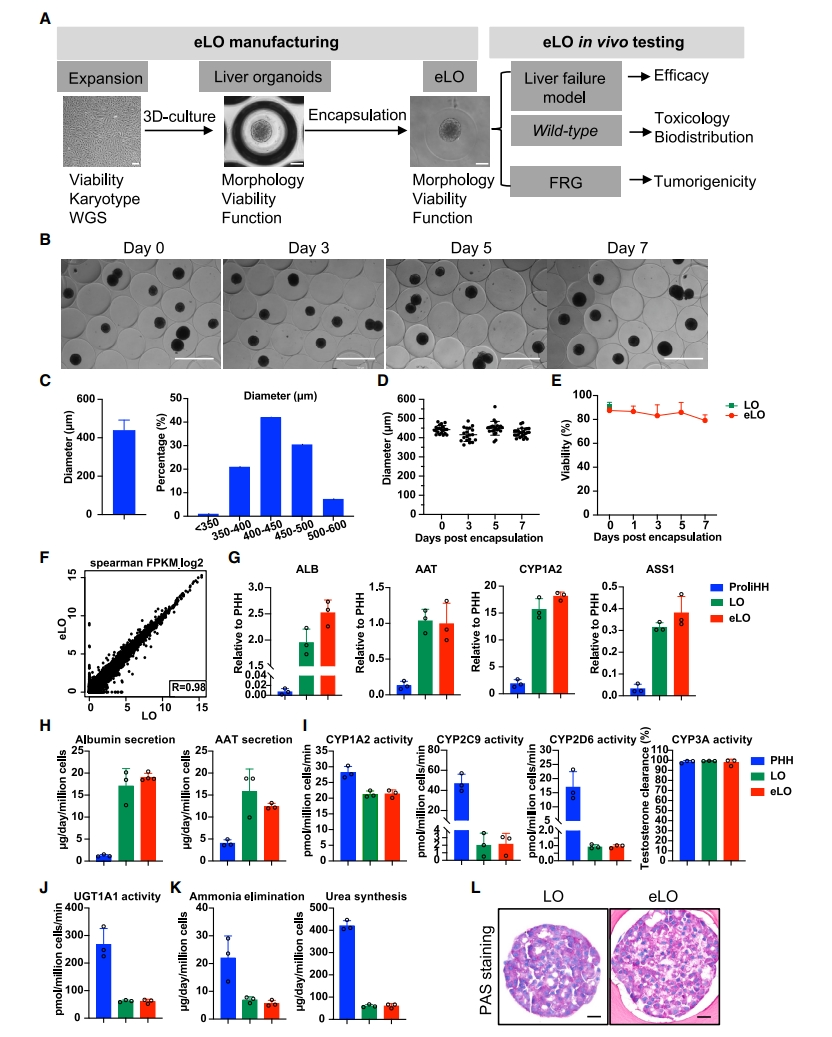
图一 eLO的生产与质控[8]
接着,研究者评价eLO能否治疗肝功能衰竭小鼠。通过切除野生型小鼠的左、中和右前叶肝脏,构建手术诱导的肝衰竭模型(ePH),来模拟肝切除术后肝衰竭(PHLF)表型(图二A)。ePH后6小时腹腔移植封装5×106个ProliHH的eLO、封装的原代小鼠肝细胞(ePMH)和空微胶囊(EMC)进行治疗,在第4天观察到前面两组的小鼠存活率显著提高(图二B)。监测肝功能衰竭的恢复情况,发现eLO治疗后血清hAlb浓度在μg/mL水平以上可达6天(图二C),表明eLO至少提供了6天的肝功能支持。与对照EMC组相比,eLO处理小鼠的肝损伤相关参数包括ALT、AST、ALT、TBA和T-BIL的水平显著降低,且在第二天开始下降(图二D和E),并保持正常的活化部分凝血活酶时间(aPTT,图二F)。组织病理学分析显示,ePH后第2天,EMC对照小鼠中观察到肝细胞肿胀、脂肪变性、核凝聚,中央静脉明显出血,肝窦缺失和四处分布的肝细胞坏死,而eLO治疗小鼠第2天仅有较轻的脂肪变化、微血管异常明显减少,第3天可以观察到正常的核形态和恢复的血窦形态(图二G)。此外,研究者还探究eLO能否为对乙酰氨基酚(APAP)诱导的肝功能衰竭小鼠提供肝功能支持。小鼠在禁食过夜后给予APAP,并在3小时后腹腔注射eLO或EMC。在EMC组中观察到86%的死亡率,而eLO显著提高了存活率(图二H)。eLO治疗后,APAP诱导的AST和ALT水平显著降低(图二I)。与EMC对照组小鼠相比,eLO治疗小鼠在第1天表现出更少的血窦扩张、脂肪变化和血细胞阻塞,并在第2天逐渐恢复,Ki67+肝细胞数量在第2天显著增加(图二J)。以上数据表明,eLO治疗改善了ePH/APAP诱导的肝功能衰竭小鼠的生存率。
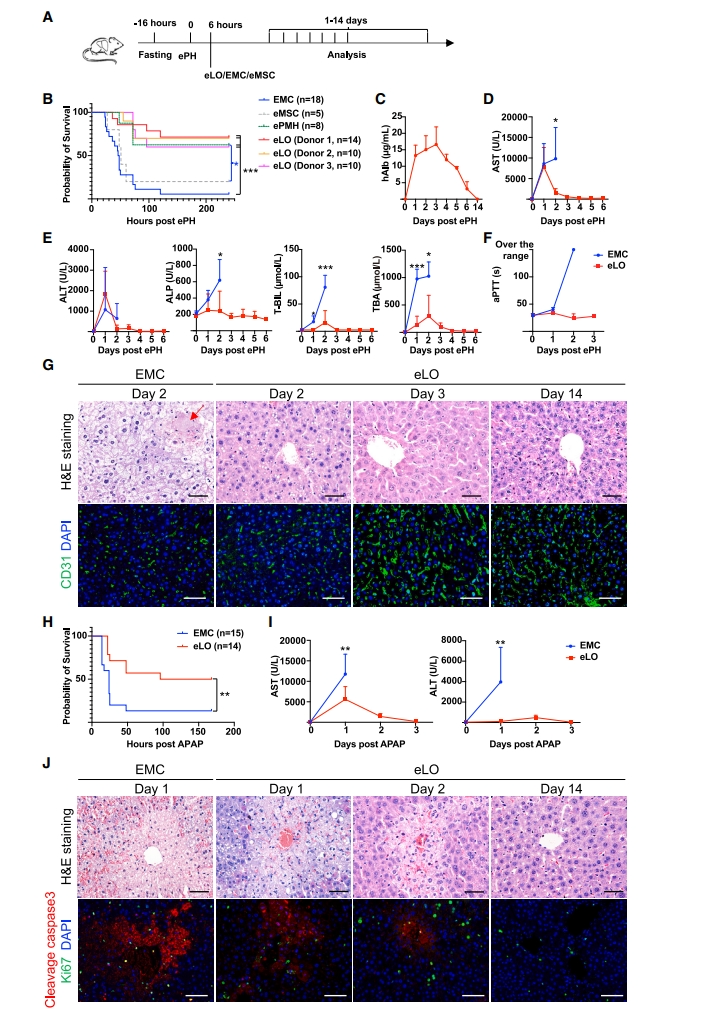
图二 eLO治疗可改善ePH/APAP诱导的肝功能衰竭小鼠的生存率[8]
ePH引起的肝功能衰竭与高钾血症和低血糖有关[9]。研究者观察到,EMC组的血浆氨水平在第1天显著升高,并在第2天继续升高,相比之下,eLO治疗小鼠的血浆氨水平在第1天已经低于EMC组,在第2天显著降低(图三A)。免疫染色发现,eLO中的氨解毒酶鸟胺酸氨甲酰基转移酶(OTC)和氨基甲酰磷酸合成酶 1(CPS1)在第2天和第3天高表达(图三B),表明eLO在氨解毒中的作用。在第2天对eLO治疗小鼠的肝脏进行全基因组表达谱分析,发现eLO治疗后,包括参与氨解毒的基因在内的整体肝脏代谢相关基因得到了改善(图三C),qPCR也证实了OTC、CPS1和ASS1的表达上调(图三D),表明eLO治疗后内源性氨解毒得到改善。除高氨血症外,EMC对照组小鼠在ePH后2天内血糖水平急剧下降,而eLO治疗小鼠的血糖水平在前2天略有下降,此后逐渐恢复(图三E)。PAS染色显示,与新制备的eLO相比,在第2天和第3天的eLO中糖原储存减少(图三F),表明ePH后eLO的糖原被消耗。对肝糖原进行分析,发现EMC对照组小鼠的糖原储存显著减少。相反,eLO治疗小鼠的肝糖原在第2天减少,后面逐渐增加,并在第14天恢复(图三G)。以上数据表明,eLO移植提供了肝功能支持,并改善了ePH诱导的高氨血症和低血糖症。
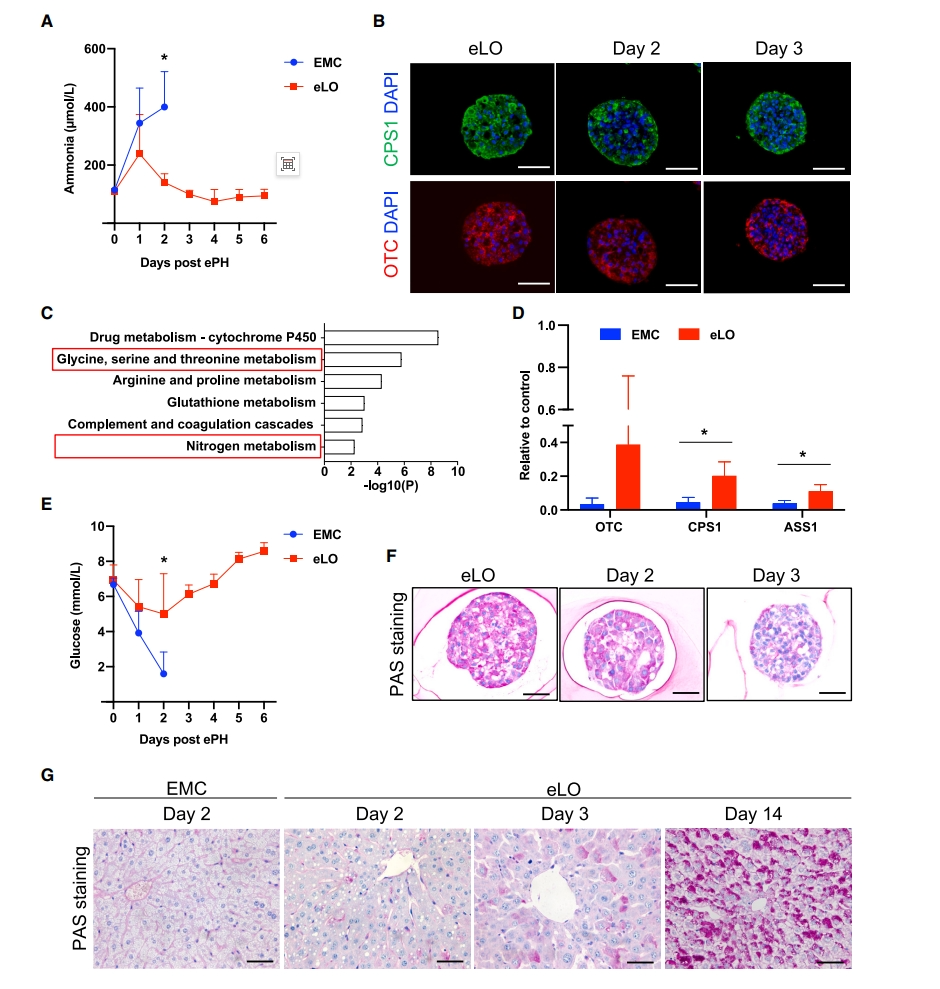
图三 eLO移植改善了高氨血症和低血糖[8]
下一步,研究者分析eLO移植是否促进肝脏再生。在EMC和eLO移植后的第2、3和14天收集肝组织。从外观上看,EMC组肝脏呈苍白,未见明显再生,肝脏与体重之比仍较低,约1.6%。相比之下,eLO治疗组的肝脏逐渐恢复到粉红色,并明显增大(图四A),肝脏与体重比在第14天逐渐恢复到4.7%(图四B)。转录组数据显示,与EMC对照小鼠相比,eLO治疗组在第2天和第3天上调了参与细胞周期和细胞增殖基因的表达(图四C)。qPCR证实关键的细胞周期蛋白包括Ccnd1、Ccne1、Ccna2和Ccnb2,在EMC对照小鼠中显著低表达,而在eLO治疗组显著上调(图四D)。与表达谱数据一致,eLO治疗组小鼠的Ki67+和PCNA+细胞数量在第2、3天达到峰值,而在EMC组中检测到少量增殖的肝细胞(图四E和F)。以上数据表明,eLO移植可以提供额外的肝功能,促进ePH后的肝脏再生。
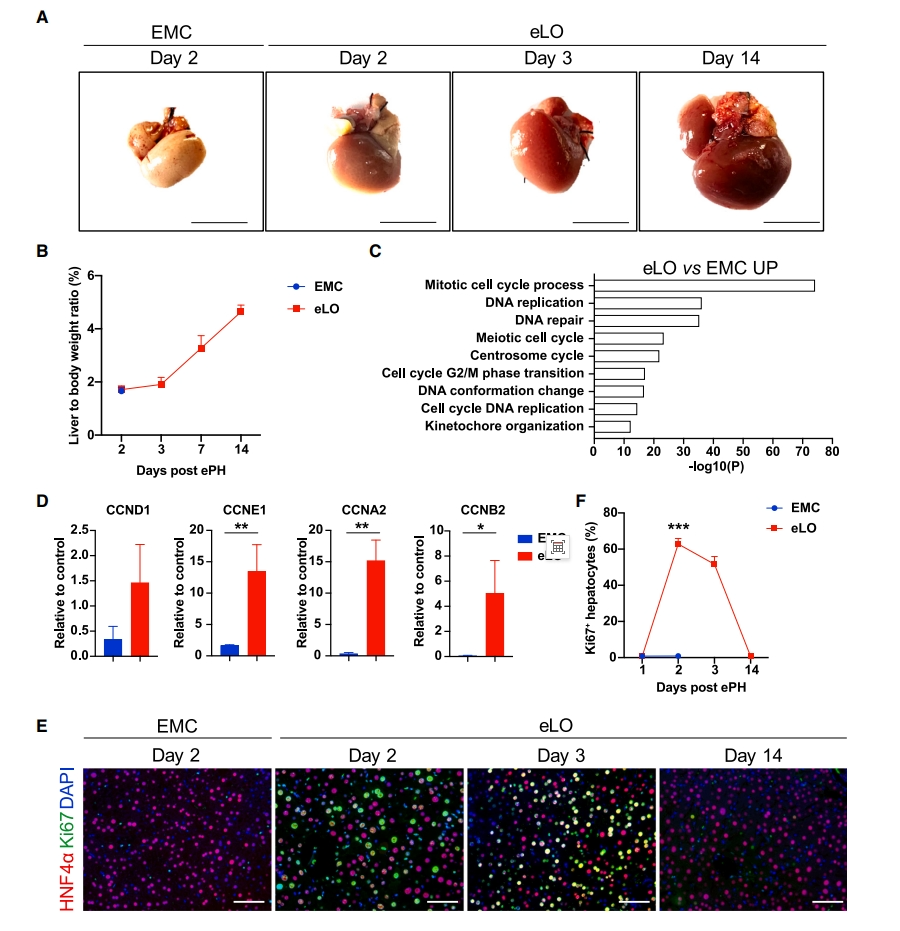
图四 eLO移植促进肝脏再生[8]
高浓度的内毒素对肝再生有害,可引起强烈的炎症并抑制细胞周期进程[10]。于是,研究者推测在EMC对照小鼠中,肝细胞可能处于抑制增殖状态,而在eLO治疗后,这种增殖抑制可能随着内毒素和炎症细胞因子水平的降低而减弱。实验检测到EMC对照小鼠的内毒素水平升高,而在eLO治疗后,内毒素始终保持在较低水平(图五A)。收集血清进行细胞因子阵列检测,发现白细胞介素包括IL-6、IL-7、IL-16、IL- 17和IL-1ra,促炎趋化因子包括CCL1、CCL2、CXCL10、CXCL19、CXCL12,肿瘤坏死因子TNF-α和单核细胞趋化蛋白5(MCP-5),在eLO治疗小鼠中显著下调(图五B)。炎症基因如IL-1b、CCL2、CXCL2和CXCL14的表达在eLO治疗肝脏中显著降低(图五C)。在ePH后的第2天,两组小鼠的F4/80+巨噬细胞数量均降至相似水平(图五D)。EMC对照小鼠的髓过氧化物酶阳性(MPO+)中性粒细胞数量增加(图五D和E)。以上数据表明,eLO移植减少了肝脏炎症。研究者进一步测试增加内毒素水平后,eLO对ePH小鼠的治疗作用是否会被取消。发现在eLO移植后第1天注射低剂量脂多糖(LPS)来增加内毒素水平,小鼠存活率显著降低(图五F),ELISA检测到炎症因子表达升高(图五G)。这些小鼠肝脏表现出明显的坏死区域、免疫细胞浸润和少量Ki67+肝细胞(图五H)。
图五 eLO治疗可改善ePH增加的内毒素和炎症反应[8]
ePH小鼠在EMC对照组中表现出小肠固体粪便、黏膜损伤和肠道通透性增加,而eLO治疗小鼠肠道形态正常,肠道通透性降低(图五I和J),提示eLO可能通过保护肠道屏障来降低内毒素水平。有报道称PHx改变了胆汁酸谱,对肠道通透性有毒性[11]。研究者注意到,在eLO治疗小鼠中,总胆汁酸(TBA)水平显著降低(图五K),负责胆汁酸稳态的基因发生了显著改变(图五L和M)。猜测胆汁酸成分的改变是否引起肠道通透性的增强。为此,eLO移植的ePH小鼠喂食1%的胆酸(CA)后,检测到存活率显著降低(图五N),以及肠道通透性增加,并显著上调IL-6水平(图五O和P)。以上数据表明,eLO治疗除了提供肝功能外,还能保护肠道屏障,降低PHLF引起的内毒素水平。
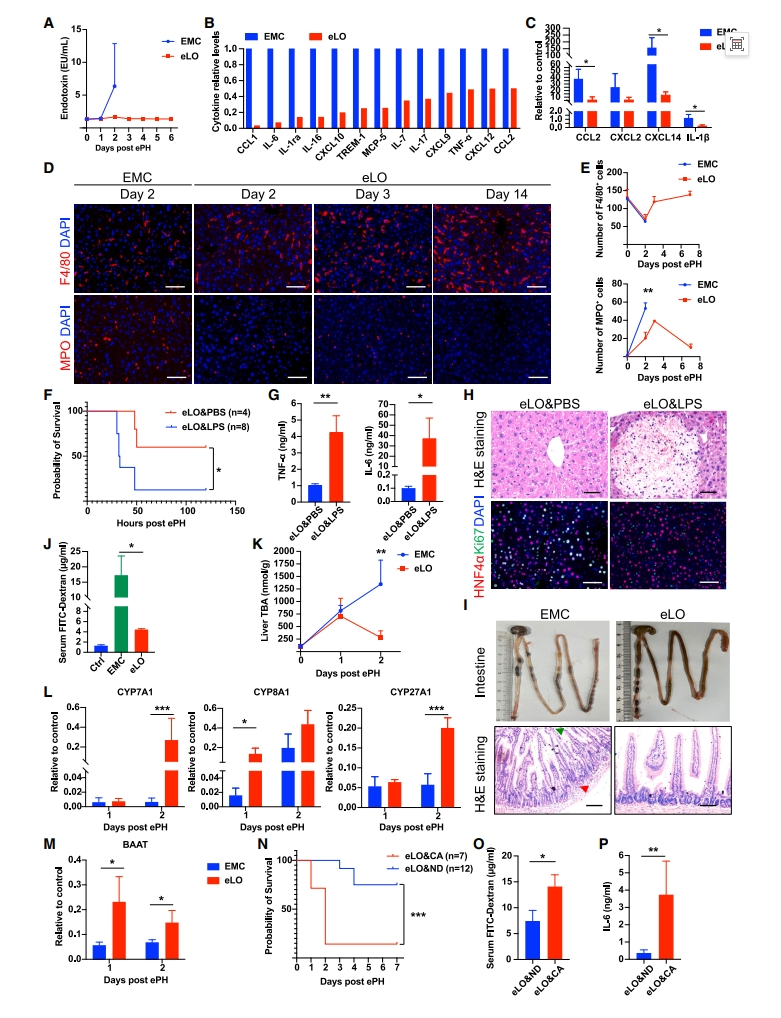
最后,研究者进行eLO治疗的安全性评价。采用5×106和1×107两种剂量的eLO进行腹腔移植,1周内监测急性毒性,同时采用生理盐水作为对照(图六A),观察到所有组内动物的体重变化具有可比性(图六B),表明eLO治疗未显示急性毒性。在eLO移植后第3、7、60天,通过全血分析进行标准血液学评估,任何一组间均无明显变化(图六C),表明eLO移植未引起血液学毒性。在移植后第60天采集主要器官,肝、肾、睾丸、肠、心、脾、肺均无形态学或组织学变化(图六 D)。通过检测野生型小鼠中的人特异性mtDNA来评估eLO的生物分布。在第7天从腹膜提取的eLO中检测到高水平的人mtDNA(图六E),其他所有小鼠器官的人类mtDNA均为阴性。以上数据表明,移植eLO不会引起急性毒性、亚急性毒性,eLO生物分布局限于海藻酸钠微胶囊里,没有整合到其他组织中。
图六 移植eLO的毒性和生物分布检测[8]
在致瘤性方面,研究者将来自两个供体的ProliHH培养6代后,核型分析显示94%的细胞保持正常核型(图七A和B)。全基因组测序(WGS)未检测到ProliHH的总染色体畸变或拷贝数变化(图七C)。应用两种生物信息学工具分析体细胞突变,供体1和供体2分别鉴定出94个和14个重叠的单核苷酸变异(SNV),且都是非功能性SNV(图七D),表明ProliHH的基因组水平高度稳定。为了确定ProliHH是否可能发生恶性转化,将其原位移植到Fah-/-Rag2-/-Il2rg-/-(FRG)小鼠中,5个月后评估肿瘤发生情况。结果显示,在25只移植PHH和78只移植ProliHH的小鼠中,分别只有1只和2只出现肿瘤(图七E和F)。以上数据表明,ProliHH在培养过程中可以保持遗传稳定性,使得移植后无致瘤性。
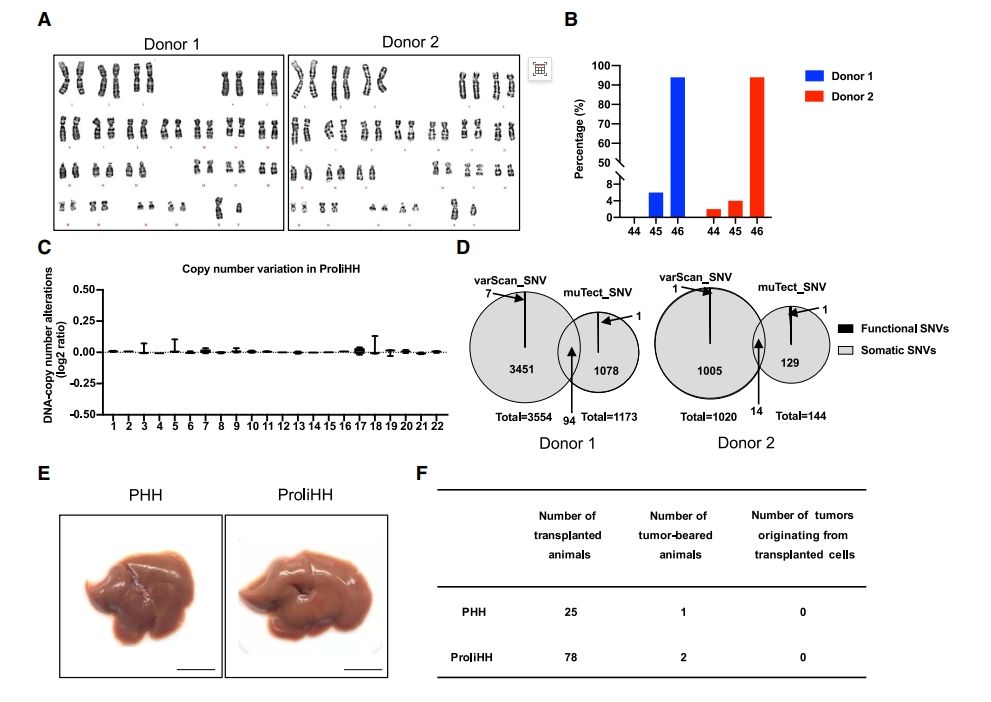
图七ProliHH基因组稳定且无致瘤性[8]
综上所述,该研究在前期建立的人原代肝细胞体外扩增和类器官构建技术基础上,利用天然免疫低源性的海藻酸钠材料,建立了微囊化肝脏类器官(eLO)制备技术以实现免疫隔离。该技术能长时间的维持eLO的活力与功能,解决了异体细胞移植的免疫排斥问题。通过一系列体内体外实验,首次临床前研究证明了微囊化肝脏类器官腹腔移植治疗肝衰竭有效性和安全性。在机制上,eLO治疗在提供肝脏功能支持外,还可以通过保护肠道屏障,降低肠道来源的内毒素,从而促进肝脏再生改善肝衰竭。该研究为肝衰竭治疗开创了新型治疗方法,为肝细胞治疗的临床转化奠定了坚实的基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Vasques F, Cavazza A, Bernal W: Acute liver failure. Current opinion in critical care 2022, 28(2):198-207.
2. Sun Z, Yuan X, Wu J, Wang C, Zhang K, Zhang L, Hui L: Hepatocyte transplantation: The progress and the challenges. Hepatology communications 2023, 7(10):e0266.
3. Meier RPH, Navarro-Alvarez N, Morel P, Schuurman HJ, Strom S, Bühler LH: Current status of hepatocyte xenotransplantation. International journal of surgery (London, England) 2015, 23(Pt B):273-279.
4. Hu H, Gehart H, Artegiani B, LÖpez-Iglesias C, Dekkers F, Basak O, van Es J, Chuva de Sousa Lopes SM, Begthel H, Korving J et al: Long-Term Expansion of Functional Mouse and Human Hepatocytes as 3D Organoids. Cell 2018, 175(6):1591-1606.e1519.
5. Zhang K, Zhang L, Liu W, Ma X, Cen J, Sun Z, Wang C, Feng S, Zhang Z, Yue L et al: In Vitro Expansion of Primary Human Hepatocytes with Efficient Liver Repopulation Capacity. Cell Stem Cell 2018, 23(6):806-819.e804.
6. Lopez-Mendez TB, Santos-Vizcaino E, Pedraz JL, Hernandez RM, Orive G: Cell microencapsulation technologies for sustained drug delivery: Clinical trials and companies. Drug discovery today 2021, 26(3):852-861.
7. Kang A, Park J, Ju J, Jeong GS, Lee SH: Cell encapsulation via microtechnologies. Biomaterials 2014, 35(9):2651-2663.
8. Yuan X, Wu J, Sun Z, Cen J, Shu Y, Wang C, Li H, Lin D, Zhang K, Wu B et al: Preclinical efficacy and safety of encapsulated proliferating human hepatocyte organoids in treating liver failure. Cell Stem Cell 2024, 31(4):484-498.e485.
9. Soto-Gutiérrez A, Kobayashi N, Rivas-Carrillo JD, Navarro-Alvarez N, Zhao D, Okitsu T, Noguchi H, Basma H, Tabata Y, Chen Y et al: Reversal of mouse hepatic failure using an implanted liver-assist device containing ES cell-derived hepatocytes. Nat Biotechnol 2006, 24(11):1412-1419.
10. Wüstefeld T, Rakemann T, Kubicka S, Manns MP, Trautwein C: Hyperstimulation with interleukin 6 inhibits cell cycle progression after hepatectomy in mice. Hepatology 2000, 32(3):514-522.
11. Li DK, Chaudhari SN, Lee Y, Sojoodi M, Adhikari AA, Zukerberg L, Shroff S, Barrett SC, Tanabe K, Chung RT et al: Inhibition of microbial deconjugation of micellar bile acids protects against intestinal permeability and liver injury. Sci Adv 2022, 8(34):eabo2794.



