技术分享:描绘小鼠胆汁淤积损伤与再生的时空转录图谱
哺乳动物的肝脏由重复肝小叶结构单元组成。肝小叶沿着中央到外周具有区域特异性代谢功能,容易发生典型的区域特异性损伤[1]。例如,非酒精性脂肪肝和对乙酰氨基酚毒性通常与小叶的中央静脉区损伤有关,而胆汁淤积性疾病则倾向于发生在胆管周围的门静脉区[2]。胆汁淤积性损伤会导致胆管反应,表现为胆管细胞增生、门静脉区发生炎症和纤维化,随后出现肝功能障碍[3]。有研究表明,胆管细胞是导管反应的主要细胞来源[4]。门静脉区肝细胞重编程成类肝前体细胞(LPLC)可分化为肝细胞和胆管细胞,是肝脏再生的主要贡献者[5]。但是重编程产生的LPLC只有一部分会贡献到胆管细胞,说明LPLC及其微环境可能存在异质性。鉴于胆管疾病中复杂的细胞-细胞相互作用和胆管细胞在其中的重要参与,从空间维度上解析胆管细胞和邻近细胞之间的潜在相互作用尤为重要。
2024年4月,Nature Genetics期刊报道了一项研究,利用高精度大视场时空组学Stereo-seq和单细胞转录组测序技术DNBelab C4,系统性描绘了小鼠胆汁淤积损伤与再生的时空转录图谱。时空动态分析揭示了胆管细胞驱动的信号传导在门静脉区损伤修复反应中的关键作用。胆管细胞表达与脂质相关巨噬细胞的募集和分化相关的基因,这些基因产生增强导管反应的反馈信号。此外,胆管细胞表达高TGFβ,这与损伤期间类肝前体细胞分化为胆管细胞以及门静脉区肝细胞增殖抑制有关。发现Atoh8是限制肝细胞增殖的重要因子,在损伤消退后迅速下调,促使肝细胞对增殖信号作出反应。该研究为深入探究胆汁淤积性损伤的细胞动力学和分子机制奠定了基础,为胆管疾病的治疗提供新的视角和潜在靶点[6]。
3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(DDC)可以诱导胆管堵塞引起门静脉区损伤,用于模拟人类胆汁淤积疾病[7]。DDC诱导的胆汁淤积还伴有肝细胞增殖受损,且肝细胞增殖可在DDC停药后逐渐恢复。研究者收集了DDC损伤和撤药期间六个时间点的C57BL/6小鼠肝脏,包括正常肝脏(DDC处理前第0天,D0)、DDC损伤第8天和第17天(D8和D17)、撤药恢复第2、7和21天(R2、R7和R21,图一a)。对22个肝脏切片进行空间增强分辨率组学测序(Stereo-seq),并将数据集聚合到分析单元(bin)中,每个bin大约覆盖一个肝细胞和几个非实质细胞,共获得1085863个bin(图一b)。基于37个中央静脉区和32个门静脉区的标志基因得分将bin分成9层来注释区域[8](图一c)。分区后采用连续切片的苏木精伊红(H&E)染色和报告基因染色进行验证核实无误(图一d)。接着,研究者对bin进行无监督聚类分析,获得17个聚类,并根据细胞类型特异性标志物进行定义。采用Krt19和Krt7注释胆管细胞区(图一e);Spp1和Sox9表达以及Krt19和Krt7阴性注释LPLC区;显示肝细胞标志物但不显示祖细胞或胆管细胞标志物的其他簇被注释为肝细胞区(图一e)。胆管细胞区和LPLC区的百分比在损伤期间增加(图一f)。为补充Stereo-seq的结果,研究者对另一组独立小鼠进行了scRNA-seq,获得24种主要细胞类型(图一g)。进一步应用稳健细胞类型分解(RCTD),将时间点匹配的scRNA-seq数据和Stereo-seq的bin数据进行整合(图一h)。发现在损伤最严重的阶段(D17),胆管细胞、血管平滑肌细胞(VSMC)、门周肝血管内皮细胞(PP_LVEC)、淋巴内皮细胞(LyEC)、成纤维细胞和髓系细胞表现出门静脉区富集分布(图一h和i)。以上数据表明,通过整合Stereo-seq和scRNA-seq数据,可在细胞水平的空间分辨率上捕捉胆汁淤积性损伤和再生的典型特征,绘制出DDC胆汁淤积性损伤与再生的时空转录图谱。
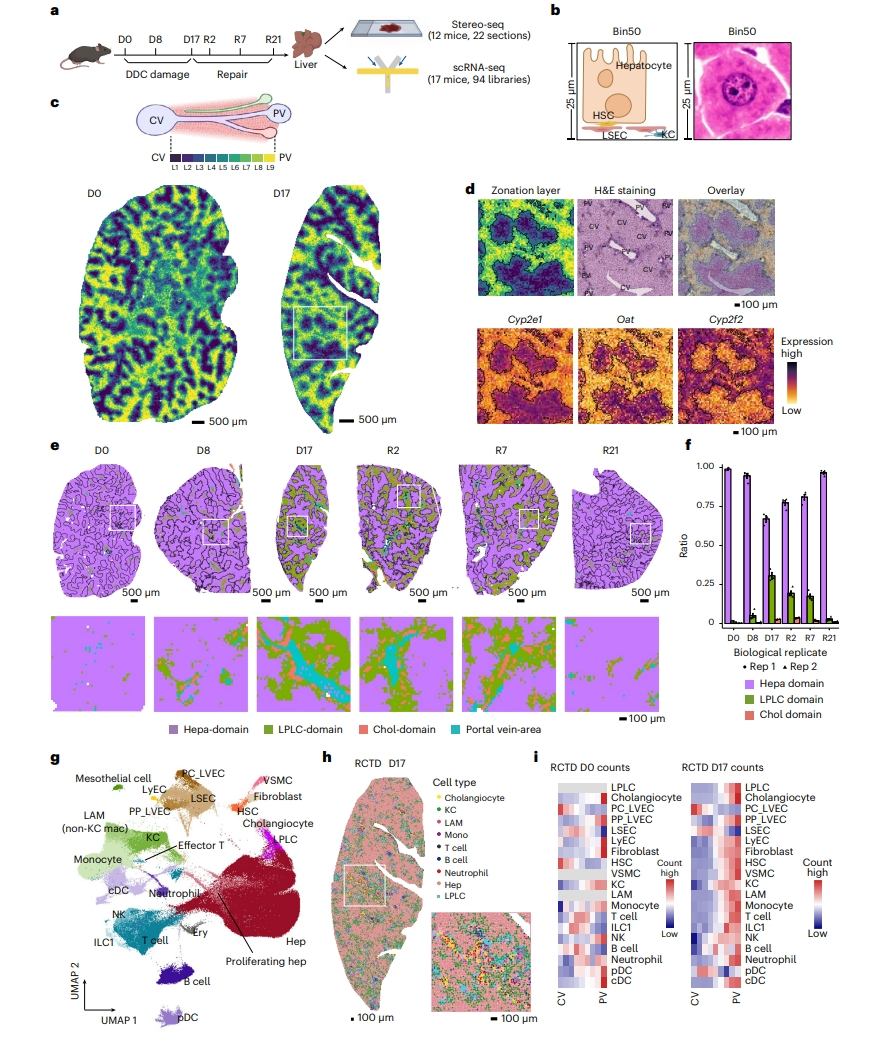
图一 DDC胆汁淤积性损伤与再生的时空转录图谱[6]
接下来,研究者探究胆汁淤积性损伤区域的损伤反应时空动力学。使用Stereo-seq数据在时间水平和空间水平上分析差异表达基因(DEG)交集。结果显示,DCC损伤后,参与核糖体、炎症反应和细胞外基质(ECM)重塑的通路在胆管细胞区和LPLC区上调(图二a)。使用Stereo-seq数据分析损伤反应的模块得分,发现氧化应激在D8时增加,并显示出广泛的分布,损伤相关分子模式(DAMP)、衰老、炎症和纤维化在D17时在胆管细胞区和LPLC区上调(图二b和c)。进一步量化每种细胞类型的损伤反应,发现DAMP主要在库普弗细胞(KC)、脂质相关巨噬细胞(LAM)、单核细胞和中性粒细胞中上调(图二d)。氧化应激在肝细胞和LPLC中被高度激活,在基质细胞、内皮细胞和胆管细胞中适度增加(图二d)。损伤反应主要发生在先天免疫细胞中,但不发生在淋巴细胞中(图二d)。对肝内皮细胞,特别是肝窦内皮细胞(LSEC)和LyEC进行表征。通过细胞评分分析,观察到中央静脉区的LSEC评分略有增加(图二e)。如之前研究报告所述[9],门静脉区的LyEC评分更强,表明LyEC增加(图二e),并通过Pdpn+ Ck19− 的免疫染色得到了验证(图二f)。功能富集分析表明,LSEC上调白细胞活化基因,包括Vcam1和Cxcl16。而LyEC不强烈表达趋化因子。然而,在LyEC中检测到ECM成分基因Col23a1、Timp2和Reln以及细胞粘附基因Sema3a(图二g)。据报道,Sema3a通过Nrp1和Plxna1/Plxna4作为巨噬细胞的引诱剂[10]。确实Nrp1和Plxna1在LAM中高度表达(图二h),与相邻LyEC和LAM中的高相互作用得分相关(图二i和j)。
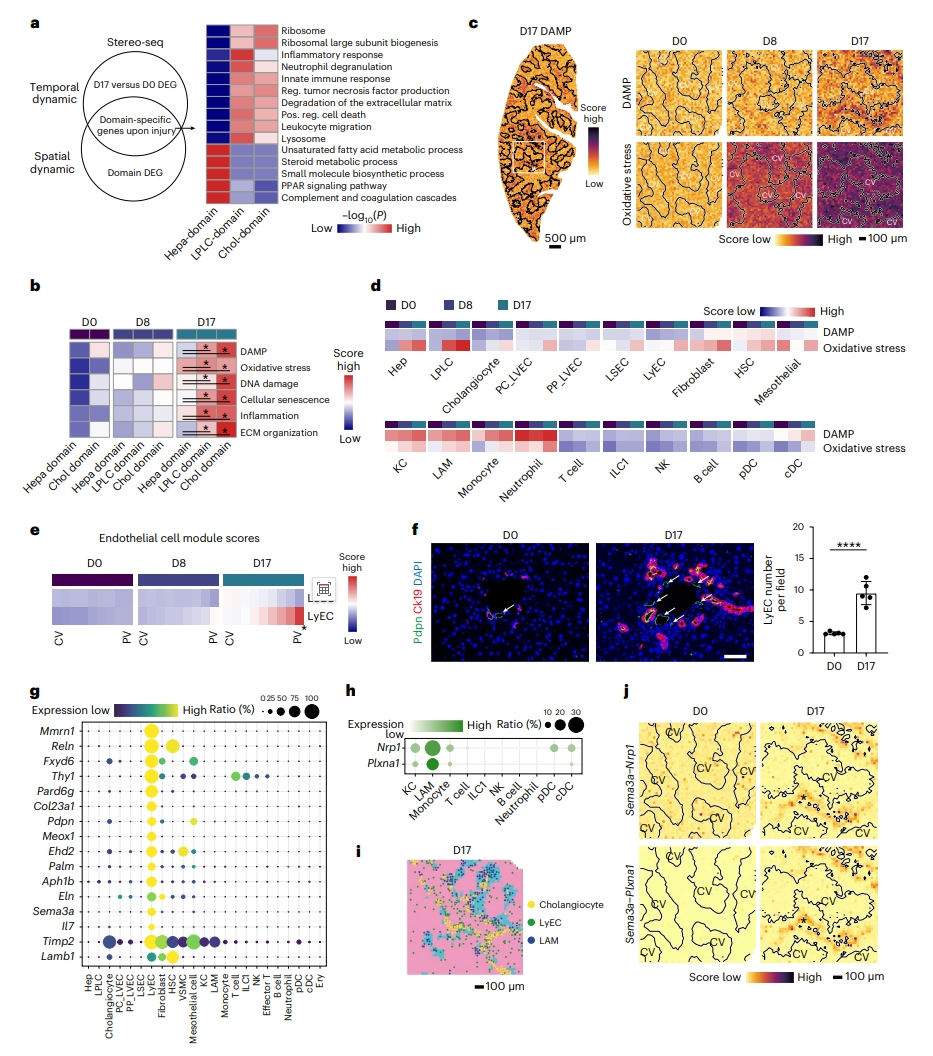
图二 胆汁淤积性损伤的损伤反应时空动力学 [6]
接下来,研究者分析空间细胞的相互作用,特别是胆管细胞和其他细胞类型之间的相互作用。基质细胞和先天免疫细胞在胆管细胞区的细胞得分高于其他区域,提示它们与胆管细胞的强烈相互作用。通过scRNA-seq数据预测D17期间的配体-受体相互作用,并选择在门静脉区分布的相互作用,确定了226对损伤上调的门静脉区配体-受体对(图三a)。值得注意的是,其中胆管细胞表达的配体和受体数量最多(图三b),并与大多数细胞类型相互作用,如单核细胞和成纤维细胞。根据配体-受体对的功能分类,发现胆管细胞参与了最多的信号传导,其特征是高水平的输出信号(配体),主要对应于免疫细胞募集、促增殖、ECM重塑和其他功能(图三c)。胆管细胞还显示出最高强度的传入信号(受体),主要与导管反应有关,包括WNT、HGF、IGF、FGF、TWEAK、EGF和NOTCH信号(图三c)。Fzd1、Fzd5、Erbb2、Igf2r、Fgfr4和Tnfrsf12a受体在胆管细胞中高表达,并在损伤后进一步升高(图三d)。有趣的是,已知的导管反应诱导基因Tnfsf12(TWEAK)主要由LAM表达,表明LAM可能在导管反应中发挥作用(图三e)。损伤期间,胆管细胞高度表达单核细胞/巨噬细胞、中性粒细胞和自然杀伤T细胞的化学诱导基因(图三f)。来自胆管细胞的配体-受体对的分布与D17处中性粒细胞和单核细胞的邻近浸润增强相关(图三g和h)。损伤期间,靠近胆管细胞的LAM数量增加(图三h)。与其他细胞类型和区域相比,胆管细胞表达更高比例的Csf1(图三f和i),并且Csf1-Csf1r相互作用在D17的门静脉区增加,表明胆管细胞在单核细胞分化为LAM中可能起到作用。LAM在短时间内急剧增加,并与胆管细胞接近,表明LAM可能来源于单核细胞。研究者使用Ms4a3-Cre;Rosa26-LSL-tdTomato小鼠标记单核细胞来源的细胞(图三j),观察到在D7时,小鼠中85.8%的单核细胞被tdTomato+ 标记。在F4/80+ Clec4f− LAM中,77.8%在D7为tdTomato阳性(图三j),表明大多数LAM来源于单核细胞。以上数据表明,胆管细胞驱动的信号传导可能在胆汁淤积的发病机制中协调细胞-细胞的相互作用。
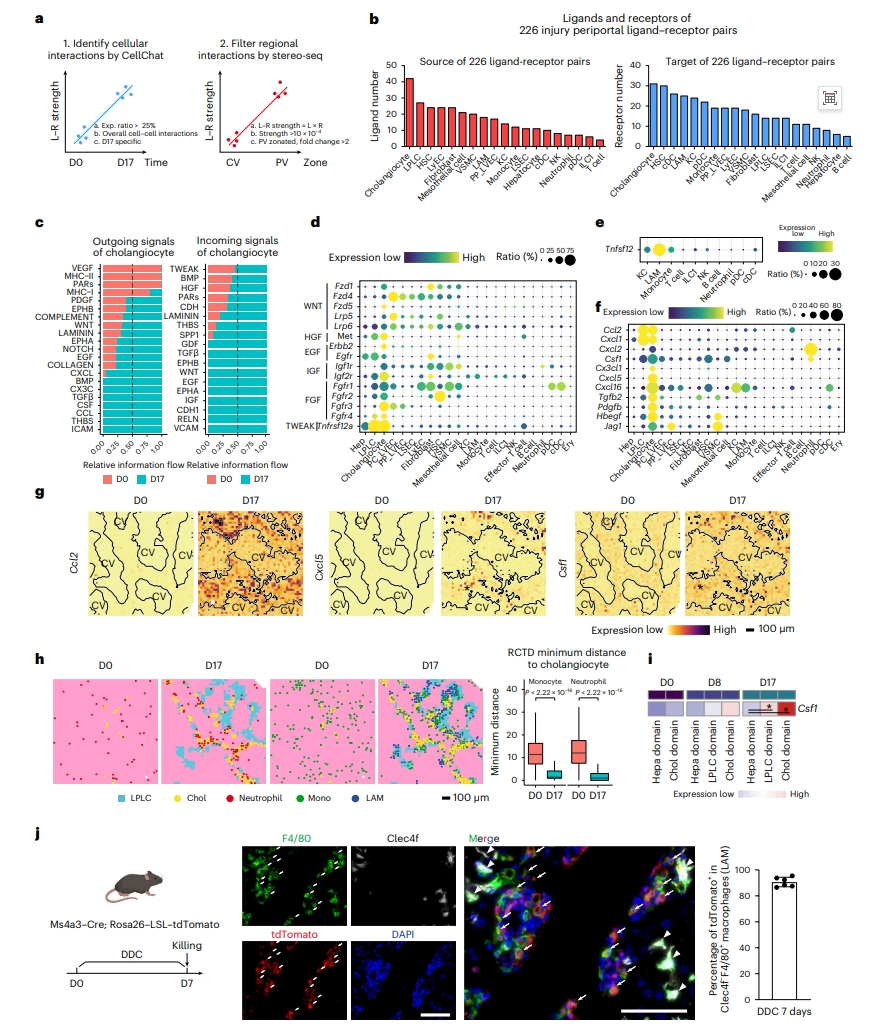
图三 整合转录组学发现胆管细胞驱动信号在门静脉区损伤反应的协调中枢功能[6]
LPLC在scRNA-seq中被分成两种亚型LPLC1和LPLC2(图四a)。两种亚型对成熟胆管细胞标志物Krt19和Krt7均为阴性,而胆管细胞基因Epcam和Hnf1b在LPLC2中表达,但在LPLC1中不表达(图四b)。免疫染色证实,一部分Hnf4a+ Opn+ LPLC对代表LPLC2的Hnf1b呈阳性,而Hnf4a+ Opn+ Hnf1b− 细胞被分配为LPLC1(图四c)。基于RNA细胞轨迹分析显示出两种轨迹,一种是部分通过LPLC1增殖的肝细胞,另一种是经过LPLC1和LPLC2增殖的胆管细胞(图四d),表明LPLC2处于接近胆管细胞转变的状态。使用RCTD分析,观察到LPLC2位于胆管细胞附近,而LPLC1在门静脉区广泛分布(图四e),这与免疫染色数据一致(图四c)。进行无监督聚类,可将LPLC区分为两个亚型LPLC domain 1和LPLC domain 2,后者更靠近胆管细胞区(图四f)。轨迹分析表明从LPLC domain 1过渡到LPLC domain 2,然后是胆管细胞区(图四g)。通过分析两个LPLC区配体进一步区分细胞外信号,在LPLC domain 1中特异性检测到的唯一配体是Spink1,它与EGF信号传导有关(图四h)。相反,LPLC domain 2具有几种特异性配体,包括基质重塑相关基因Mmp2、Mmp7、Timp1和Postn以及抗炎基因Pf4(图四h),它们在门静脉区显示出更高的表达(图四i)。此外,对胆管细胞形成至关重要的TGFβ信号活性在LPLC domain 2中增加(图四j)。TGFβ配体的分析显示,Tgfb2在LPLC domain 2中低表达,而在胆管细胞区中高表达(图四k)。以上数据表明,胆管细胞与LPLC2中TGFβ信号传导的激活有关。
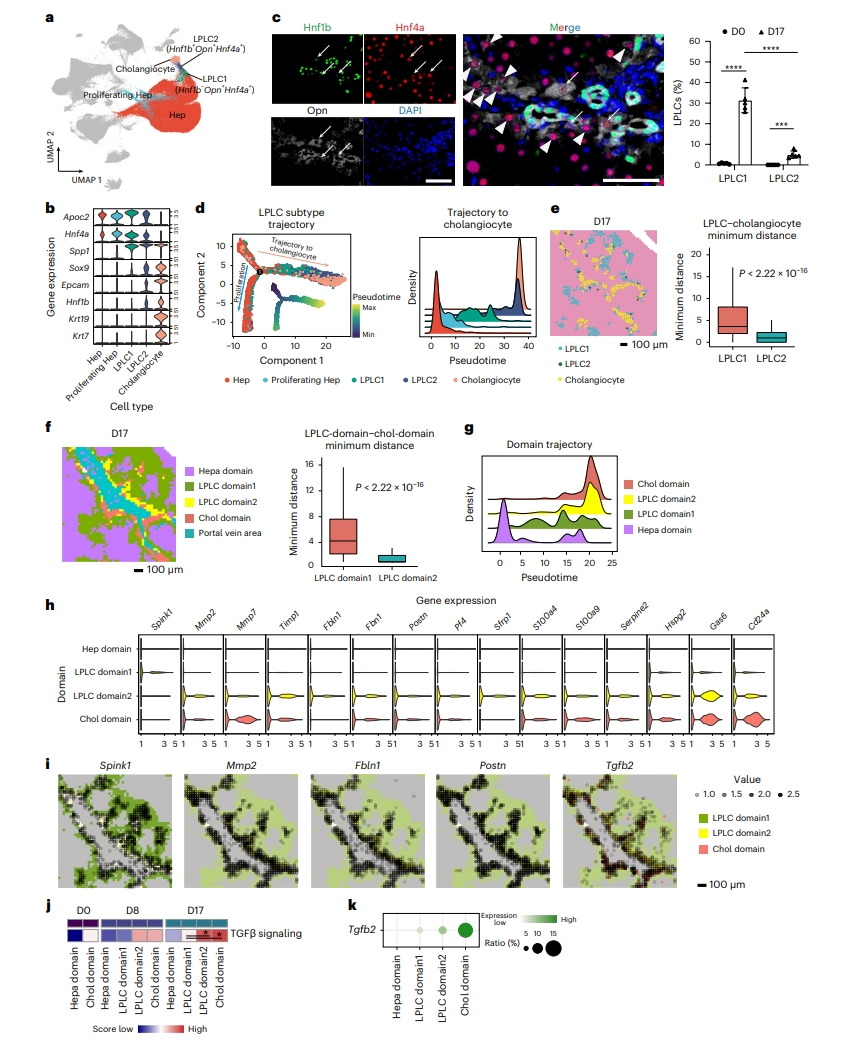
图四 鉴别LPLC的空间异质性[6]
接下来,研究者分析DDC停药后肝脏修复再生情况。使用模块评分和RCTD评估胆管细胞周围损伤激活细胞的动力学,发现大多数细胞类型都富集在R2(图五a和b)。天然免疫细胞,包括单核细胞、LAM和中性粒细胞,在R7时减少,在R21时降至正常水平(图五a和b)。胆管细胞和成纤维细胞的数量在R21晚期减少(图五a和b),表明它们持续参与修复。损伤反应通路在R2时保持激活,而氧化应激在R2迅速减少(图五c和d)。在R7时,氧化应激和DNA损伤反应都恢复到接近正常的水平(图五c和d)。炎症反应也显著降低(图五c和d),这与先天免疫细胞的减少有关(图五a)。相反,DAMP、衰老和纤维化通路在R7时保持较高水平(图五c和d)。评估趋化因子在胆管细胞中的表达是否发生改变,发现胆管细胞分泌的趋化因子,包括Ccl2、Cxcl1和Cxcl5,在R7时显著下调(图五e)。Csf1和Tnfsf12在胆管细胞和髓系细胞中也分别下调(图五e和f),表明这些细胞之间的反馈回路减少。此外,损伤诱导的增殖受体如Fzd1、Egfr和Igf1r在R7时的胆管细胞中减少(图五g)。免疫相互作用和增殖反应的下调可能早于修复过程中胆管细胞的消退(图五e,g和h)。以上数据表明,在门静脉区修复再生的过程中,胆管细胞的免疫反应功能下降。
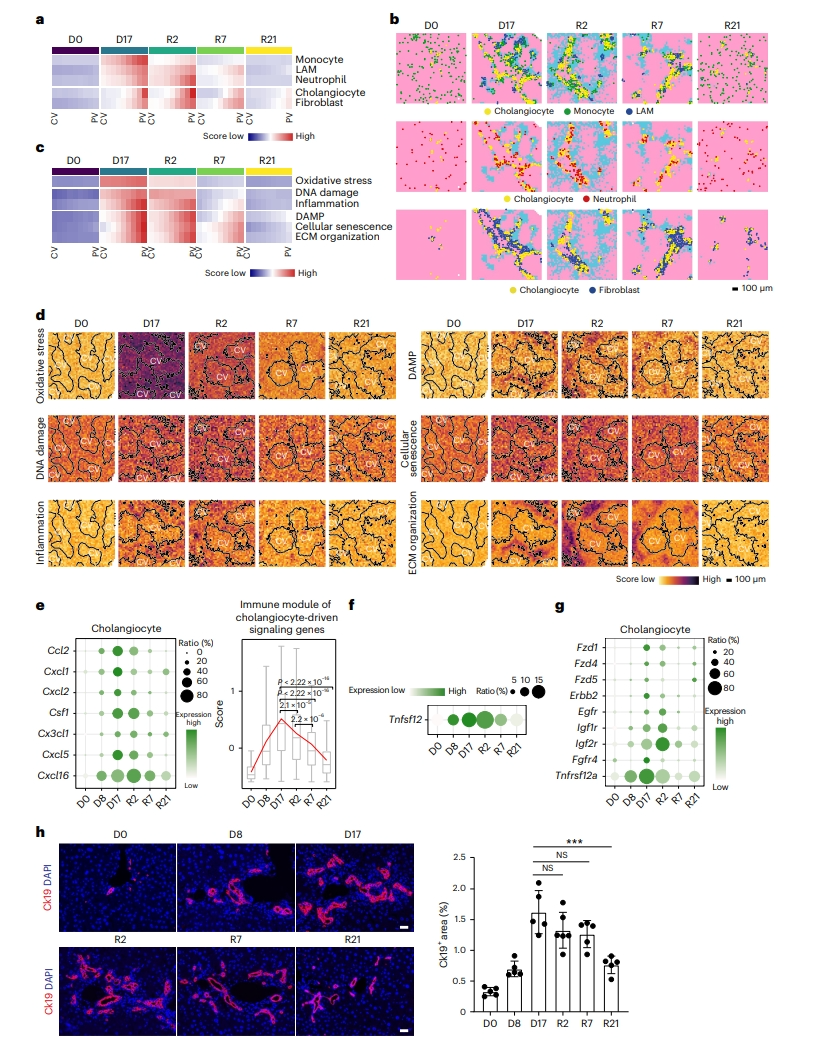
图五 肝再生过程中损伤消退和胆管细胞减少的时空动态变化[6]
最后,研究者使用Stereo-seq来探索修复再生过程中肝细胞增殖动力学。中央静脉区的细胞在R2时显示出最高的增殖率,并沿着肝小叶增殖逐渐降低(图六a)。G2/M期和S期基因模块的空间分布与Mki67的表达模式相当(图六a)。抑制经典WNT信号的相互作用[11],包括Sfrp1–Fzd2、Wnt5a–Ror2和Dkk2–Lrp6,在R2门静脉区增加(图六b)。原位杂交验证了Sfrp1和Wnt5a的门静脉区分布(图六c)。这些抑制因子主要由胆管细胞和成纤维细胞产生,表明它们可能在WNT信号传导中发挥抑制作用。TGFβ信号传导持续激活可减少肝细胞再生[12]。TGFβ相互作用例如Tgfb2–Tgfbr1和Tgfb1–Tgfbr1在门静脉区升高(图六b)。胆管细胞是表达Tgfb2的主要细胞(图六d)。因此,门静脉区肝细胞中TGFβ信号水平显著激活。这些结果表明胆管细胞表达与抑制门静脉区肝细胞再生有关的配体。
中央静脉区促增殖因子Wnt2、Wnt9b和Rsp3以及门静脉区EGF和IGF信号在D17时的整个肝小叶上调(图六b)。然而,肝细胞在损伤过程中没有增殖(图六a),表明可能存在抑制机制。为了鉴定肝细胞增殖的负调控因子,应用单细胞调控网络推断和聚类(SCENIC)使用Stereo-seq数据构建基因调控网络,鉴定出32个候选调控因子(图六e)。Klf9、Ppargc1a、Mef2d和Atoh8在D17时增加,在R2时减少(图六e)。基于Atoh8在肝癌中经常下调,其过表达抑制肝癌的发生,提示其在调节增殖中发挥作用。Atoh8在D17的表达是R2的五倍(图六f)。体内递送shRNA敲降Atoh8,定量PCR证实Atoh8和下游基因Hamp60被有效下调(图六g)。免疫染色显示,在Atoh8敲降的肝脏中,Ki67+肝细胞的数量增加(图六g),且在门静脉区的分布略高些。在D17对Atoh8敲降的肝细胞进行RNA-seq,发现细胞周期基因如Ccnb1、Cdk1和Mcm7显著上调,而WNT下游基因表现出最小的变化(图六h和i)。对已发表的染色质免疫沉淀数据进行再分析[13],显示细胞周期基因包括Ccnd1、Cdk1和Mcm7是Atoh8的下游靶基因,提示Atoh8可能抑制这些基因转录。以上数据表明,Atoh8在DDC损伤过程中抑制肝细胞再生。
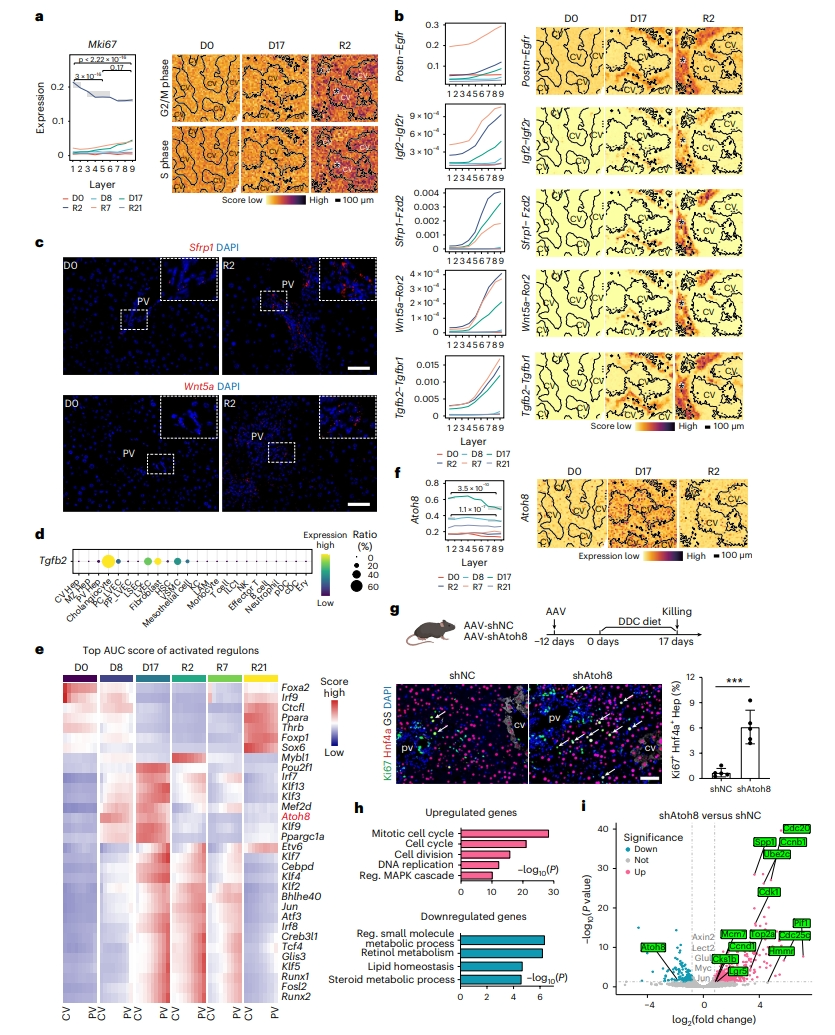
图六 肝再生过程中调控因子的时空动态变化[6]
综上所述,该研究国际首创以细胞级别的精度,描绘了胆汁淤积与再生过程的时空动态图谱,并突破性发现胆管细胞作为信号枢纽,与区域性免疫细胞重塑和肝细胞重编程高度相关。该研究创新地发现了Atoh8是一个限制肝细胞增殖的关键因子。这为理解和治疗胆汁淤积疾病开辟了新方向,为研究组织损伤再生开创了新范式。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:茄子
参考文献
1. Cunningham RP, Porat-Shliom N: Liver Zonation - Revisiting Old Questions With New Technologies. Front Physiol 2021, 12:732929.
2. Sato K, Marzioni M, Meng F, Francis H, Glaser S, Alpini G: Ductular Reaction in Liver Diseases: Pathological Mechanisms and Translational Significances. Hepatology 2019, 69(1):420-430.
3. Banales JM, Huebert RC, Karlsen T, Strazzabosco M, LaRusso NF, Gores GJ: Cholangiocyte pathobiology. Nature reviews Gastroenterology & hepatology 2019, 16(5):269-281.
4. Jörs S, Jeliazkova P, Ringelhan M, Thalhammer J, Dürl S, Ferrer J, Sander M, Heikenwalder M, Schmid RM, Siveke JT et al: Lineage fate of ductular reactions in liver injury and carcinogenesis. The Journal of clinical investigation 2015, 125(6):2445-2457.
5. Gao C, Peng J: All routes lead to Rome: multifaceted origin of hepatocytes during liver regeneration. Cell regeneration (London, England) 2021, 10(1):2.
6. Wu B, Shentu X, Nan H, Guo P, Hao S, Xu J, Shangguan S, Cui L, Cen J, Deng Q et al: A spatiotemporal atlas of cholestatic injury and repair in mice. Nature genetics 2024, 56(5):938-952.
7. Mariotti V, Strazzabosco M, Fabris L, Calvisi DF: Animal models of biliary injury and altered bile acid metabolism. Biochimica et biophysica acta Molecular basis of disease 2018, 1864(4 Pt B):1254-1261.
8. Halpern KB, Shenhav R, Matcovitch-Natan O, Toth B, Lemze D, Golan M, Massasa EE, Baydatch S, Landen S, Moor AE et al: Single-cell spatial reconstruction reveals global division of labour in the mammalian liver. Nature 2017, 542(7641):352-356.
9. Lukacs-Kornek V: The Role of Lymphatic Endothelial Cells in Liver Injury and Tumor Development. Frontiers in immunology 2016, 7:548.
10. Casazza A, Laoui D, Wenes M, Rizzolio S, Bassani N, Mambretti M, Deschoemaeker S, Van Ginderachter JA, Tamagnone L, Mazzone M: Impeding macrophage entry into hypoxic tumor areas by Sema3A/Nrp1 signaling blockade inhibits angiogenesis and restores antitumor immunity. Cancer Cell 2013, 24(6):695-709.
11. Cruciat CM, Niehrs C: Secreted and transmembrane wnt inhibitors and activators. Cold Spring Harb Perspect Biol 2013, 5(3):a015081.
12. Bird TG, Müller M, Boulter L, Vincent DF, Ridgway RA, Lopez-Guadamillas E, Lu WY, Jamieson T, Govaere O, Campbell AD et al: TGFβ inhibition restores a regenerative response in acute liver injury by suppressing paracrine senescence. Sci Transl Med 2018, 10(454) :eaan1230.
13. An integrated encyclopedia of DNA elements in the human genome. Nature 2012, 489(7414):57-74.



