技术分享:一种调控胆固醇稳态的肠道来源新激素
胆固醇稳态对细胞功能和机体健康至关重要,它由各种组织共同协调,以维持膳食胆固醇吸收、从头合成、胆汁清除和排泄之间的平衡[1]。膳食胆固醇和胆汁胆固醇由分布在肠上皮细胞顶端表面的NPC1L1蛋白吸收,随后被包装成乳糜微粒,释放到淋巴管中,最终进入血液循环。从头合成胆固醇是一个耗能过程,其中3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)是限速酶,其活性受转录以及转录后水平调控[2]。甾醇调节元件结合蛋白2(SREBP2)是一个主转录因子,控制着HMGCR以及其他参与胆固醇合成和吸收的基因表达[3]。SREBP2是位于细胞内质网的胆固醇敏感调节器,响应细胞胆固醇水平的严格调控,其作用机制较为清晰[4]。
SREBP2通过与SCAP紧密结合定位在内质网膜上。当细胞缺乏胆固醇时,SCAP作为载体与SREBP2形成复合物, 并被CopII蛋白包裹, 从内质网转运到高尔基体。在高尔基体中, 位点1蛋白酶(S1P)将SREBP2的内质网膜腔内部分剪切成两个单体, 接着, S2P裂解其跨膜区域, 剪去羧基端尾巴成为成熟体mSREBP2。mSREBP2以同源二聚体的形式转位至细胞核内作为转录因子发挥作用,增强参与胆固醇合成和吸收的基因表达[2]。相反,当细胞胆固醇水平升高时,胆固醇与SCAP结合,触发SCAP与胰岛素诱导基因(INSIG)的结合,进而将SCAP锚定在内质网中,使得SREBP向高尔基体的运输和随后的胆固醇代谢相关基因的转录激活被抑制[4]。
因此,胆固醇作为信号分子,通过抑制SCAP-SREBP复合体转运活性来负反馈调节细胞的胆固醇合成。当膳食胆固醇的吸收增加会抑制内源胆固醇的合成,而吸收不足时会激活细胞的内源胆固醇合成。肠道是胆固醇吸收的场所,而肝脏是胆固醇合成的主要器官。在肠道胆固醇吸收和肝脏胆固醇合成之间是否还存在着独立于胆固醇自身分子的调节通路尚不清楚。
2024年3月,Cell期刊报道了一种胆固醇诱导肠道分泌的新激素Cholesin,能够抑制肝脏的胆固醇合成和极低密度脂蛋白分泌,从而降低循环胆固醇水平。Cholesin由一个功能未知的基因编码,人类为C7orf50,小鼠为3110082I17Rik。机制上,Cholesin是由肠道响应胆固醇吸收时分泌,并与肝细胞表面的孤儿G蛋白偶联受体GPR146结合,通过抑制PKA信号传导,实现抑制肝脏SREBP2调控的胆固醇合成。Cholesin-GPR146轴介导了肠道胆固醇吸收对肝脏胆固醇合成的抑制作用,提示Cholesin有望成为治疗高胆固醇血症和动脉粥样硬化的有效药物[5]。
首先,研究者探究介导肠道胆固醇吸收和肝脏胆固醇合成的潜在调节因子。小鼠禁食16小时后喂食含有0.02%胆固醇的常规饮食(RD)或1.25%高胆固醇的西方饮食(WD),1小时后进行血浆蛋白分析。去除白蛋白和IgG,并富集低丰度蛋白质,使用银染观测血浆蛋白(图一A)。结果显示WD喂养后,在23 kDa左右出现了一个增强的条带,质谱(MS)测序鉴定为人类蛋白C7orf50的同源物(图一A)。这种蛋白质在不同物种之间表现出高度保守性,基于后续特征,研究者将其命名为“Cholesin”。然后,研究者探究喂食是否对血浆Cholesin水平产生影响。喂食两种饮食后,小鼠血浆Cholesin水平都快速增加,其中喂食WD反应更强,在1小时达到约1200 pM的峰值(图一B)。在人类中也观察到类似的结果,饮食后血浆Cholesin水平显著升高(图一C)。为确定Cholesin来源,研究者分析蛋白质的组织分布,并用Cholesin缺失小鼠(KO)作为对照,发现Cholesin在小肠和结肠高度表达,在胃部中度表达(图一D)。基于这些结果,研究者构建了肠道特异性Cholesin敲除(IKO)小鼠(图一E)。通过酶联免疫吸附试验(ELISA)测定血浆Cholesin水平,发现WD喂食后,野生型(WT)小鼠血浆Cholesin水平从500 pM增加到1200 pM,而IKO小鼠仅约为400 pM,且两种小鼠的肠道总胆固醇(TC)水平相当(图一F),表明敲除Cholesin对肠道胆固醇含量没有潜在影响。为进一步证实胆固醇促进Cholesin分泌的作用,给小鼠灌胃胆固醇显著增加了WT小鼠的Cholesin分泌,而IKO小鼠的变化不大(图一G)。以上数据表明,Cholesin是一种胆固醇诱导的肠道分泌激素。
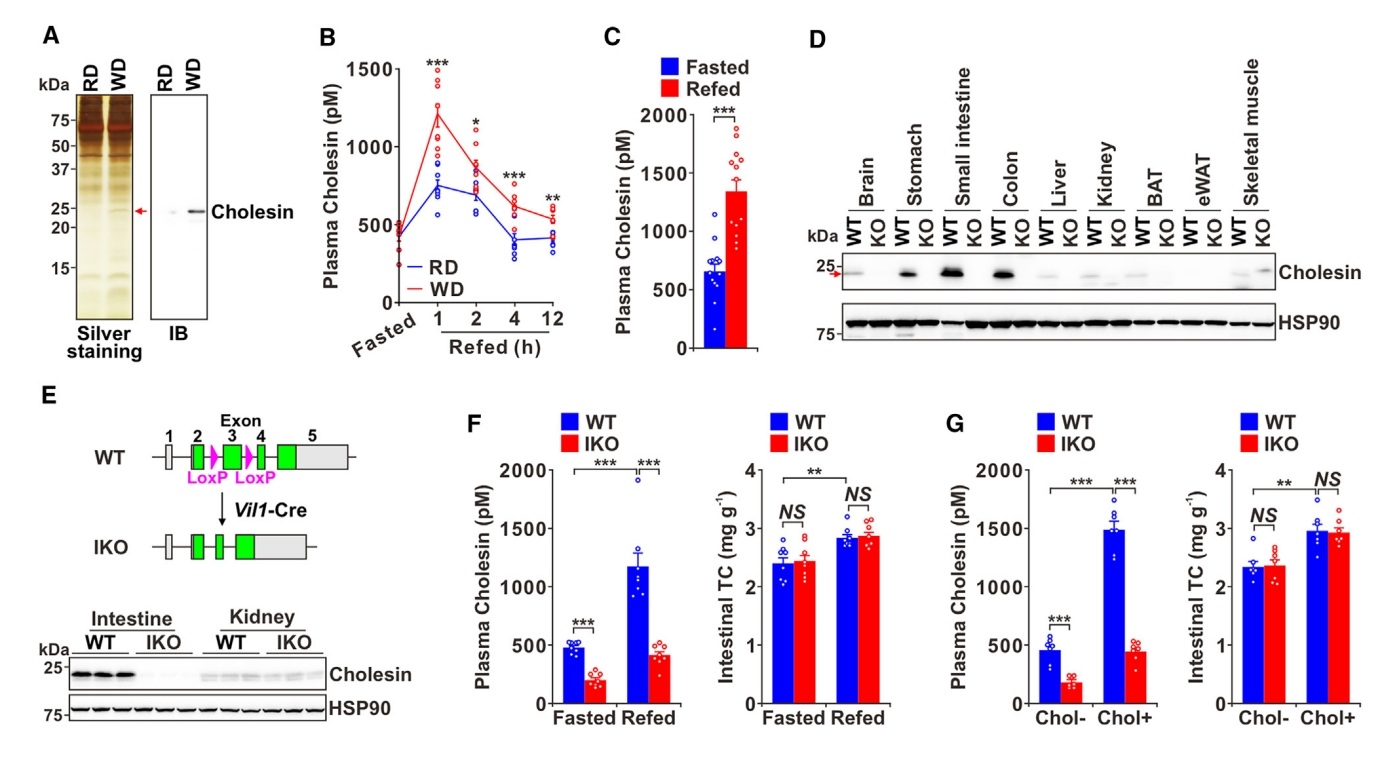
图一 西方饮食喂养促进Cholesin分泌[5]
胆固醇由分布在肠上皮细胞顶端表面的NPC1L1蛋白吸收[6]。于是,研究者推测由胆固醇吸收诱导的Cholesin可能也在肠上皮细胞中表达。构建了Cholesin-GFP敲入小鼠,并将其与肠上皮细胞标志蛋白Apoa1-mCherry敲入小鼠杂交,在子代小鼠中观察到Cholesin-GFP与APOA1-mCherry共定位(图二A)。在稳定表达FLAG标记的Cholesin的人结直肠癌细胞HCT116中评估不同胆固醇水平对Cholesin分泌的影响。结果显示,随着胆固醇浓度的增加,培养基中Cholesin水平呈剂量依赖性增加(图二B)。此外,HCT116细胞的NPC1L1敲降(KD)破坏了胆固醇吸收和Cholesin分泌(图二C)。进一步使用NPC1L1抑制剂Ezetimibe[7]处理和Npc1l1敲除小鼠进行体内实验,发现两种方法都能有效阻断肠道胆固醇吸收和Cholesin分泌(图二D和E),证实Cholesin分泌需要NPC1L1依赖的胆固醇摄取。以上数据表明,NPC1L1介导的胆固醇摄取促进了Cholesin的分泌。
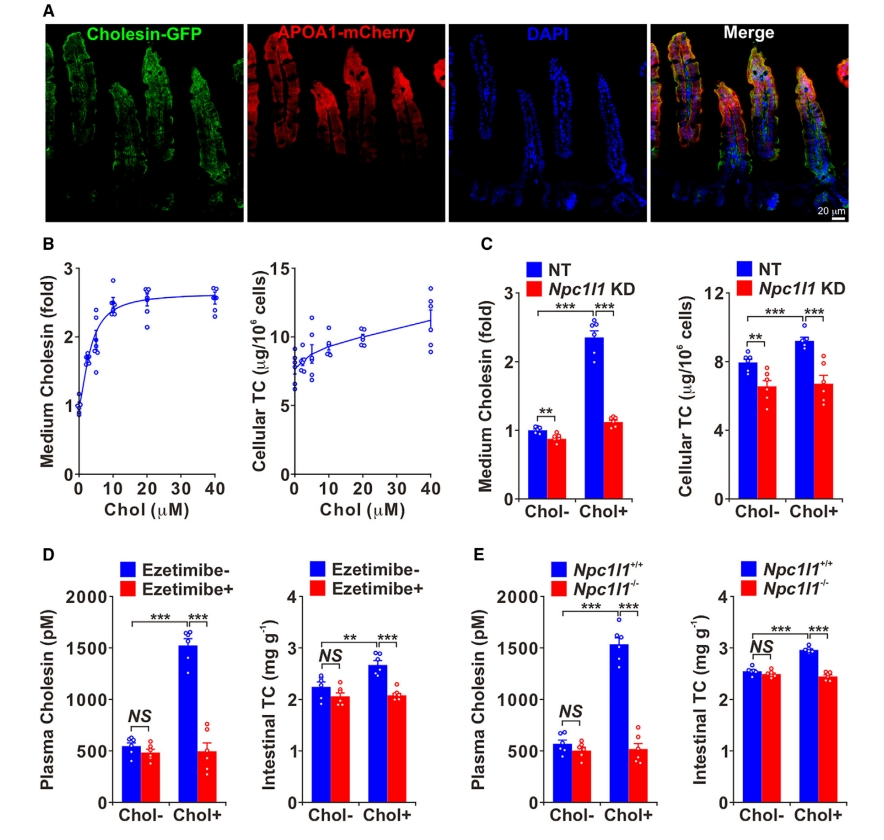
图二 NPC1L1介导的胆固醇摄取促进Cholesin分泌[5]
鉴于Cholesin和胆固醇之间的联系,研究者继续探索Cholesin在胆固醇代谢中的作用。Cholesin IKO雄性和雌性小鼠在RD或WD喂养后的血浆总胆固醇水平显著升高、血浆甘油三酯(TG)水平也略有提高(图三A)。相应地,IKO小鼠的肝脏胆固醇含量增加(图三B),而体重、脂肪量、食物和水分摄入、呼吸交换率(RER)、运动和血糖水平没有受到影响。使用快速蛋白液相色谱法(FPLC)分析血浆脂蛋白,显示IKO小鼠的HDL-C、LDL-C和VLDL-C均增加(图三C),表明Cholesin缺乏会导致血浆胆固醇水平升高。随后,研究者在mRNA和蛋白质水平上检测胆固醇合成基因的表达。Cholesin IKO导致喂食RD和WD的小鼠肝脏中SREBP2活性和胆固醇生成基因表达增加(图三D和E)。需要注意的是,WD喂食小鼠肝脏中胆固醇生成基因的表达水平较低,表明肠道胆固醇吸收抑制了肝脏胆固醇合成。此外,IKO小鼠参与脂肪酸合成的基因表达水平增强(图三D和E)。为评估Cholesin是否影响极低密度脂蛋白(VLDL)的分泌,研究者将一种脂蛋白脂肪酶抑制剂poloxamer-407注射到小鼠体内,发现IKO雄性和雌性小鼠在RD或WD喂食后血浆的胆固醇和甘油三酯的分泌速率均显著提高,VLDL的结构蛋白APOB的分泌也显著增加(图三F)。以上数据表明,Cholesin缺乏至少部分通过增加肝脏胆固醇合成和VLDL分泌来提高血浆胆固醇水平。
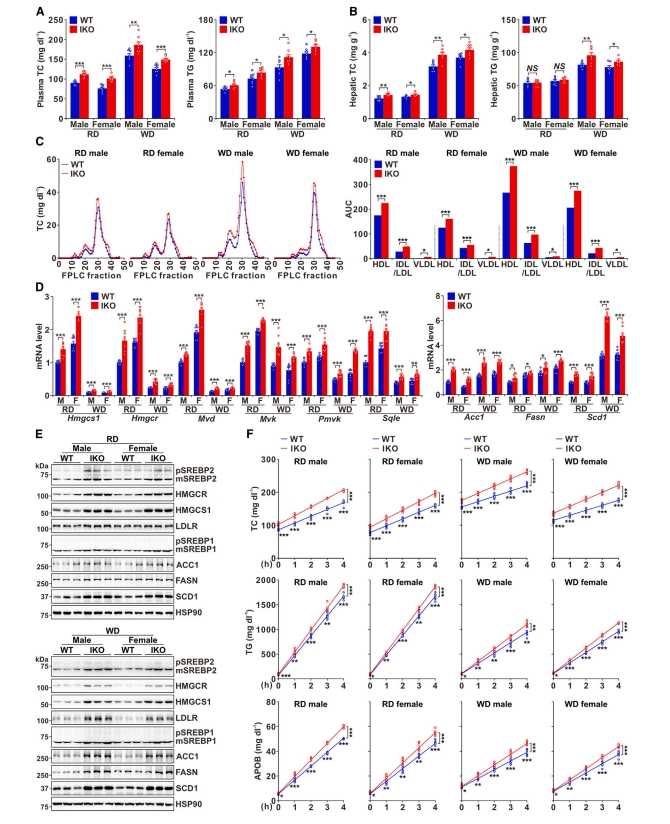
图三 Cholesin缺乏增强肝脏胆固醇合成和VLDL分泌速率[5]
接下来,研究者探究Cholesin的靶组织,将纯化的GST-Cholesin与不同小鼠组织的冷冻切片孵育,进行结合试验。在肝脏、脂肪、肾脏和骨骼肌组织中观察到强的结合信号(图四A)。为鉴定Cholesin的受体,研究者先使用流式细胞术来评估不同细胞系结合Cholesin的能力,发现人乳腺癌细胞系MCF7表现出最强的Cholesin结合。随后,在稳定表达Cas9的MCF7细胞中使用慢病毒文库进行全基因组筛选,该文库包含靶向19050个编码人类蛋白质基因的65383个sgRNA、靶向miRNA的21864个sgRNA和3000个非靶向对照sgRNA。收集没有Cholesin结合信号的细胞基因组DNA,进行sgRNA测序和分析(图四B),确定首选候选者为GPR146(图四C),这是一种参与胆固醇合成调控的保守孤儿G蛋白偶联受体(GPCR)[8]。于是,构建了Gpr146-/-小鼠,发现在Gpr146-/-小鼠的组织和原代肝细胞中,Cholesin结合完全消失(图四A,D和E)。GST下拉分析和微量热泳动(MST)证实,Cholesin与GPR146具有高亲和力结合(图四F和G)。基于GPR146的保守性和预测结构,研究者用丙氨酸替换6个氨基酸,构建了GPR146突变体(Mut)。与WT GPR146相比,Mut GPR146对Cholesin的亲和力明显减低,并且无法恢复Gpr146-/- 原代肝细胞中Cholesin的结合(图四D-G)。以上数据表明,GPR146是Cholesin的受体。研究者继续在小鼠原代肝细胞中研究GPR146的下游信号通路,发现Cholesin处理破坏了GPR146和鸟嘌呤核苷酸结合蛋白G(i)亚基α1(GNAI1)之间的相互作用,而这种作用被Mut GPR146所减弱(图四H)。一致地,Cholesin处理降低了WT原代肝细胞中cAMP水平,但没有降低Gpr146-/- 原代肝细胞的cAMP水平,而添加WT GPR146恢复了Cholesin对Gpr146-/- 肝细胞cAMP水平的抑制作用(图四I)。以上数据表明,Cholesin通过GPR146偶联的Gαi信号抑制cAMP的产生。
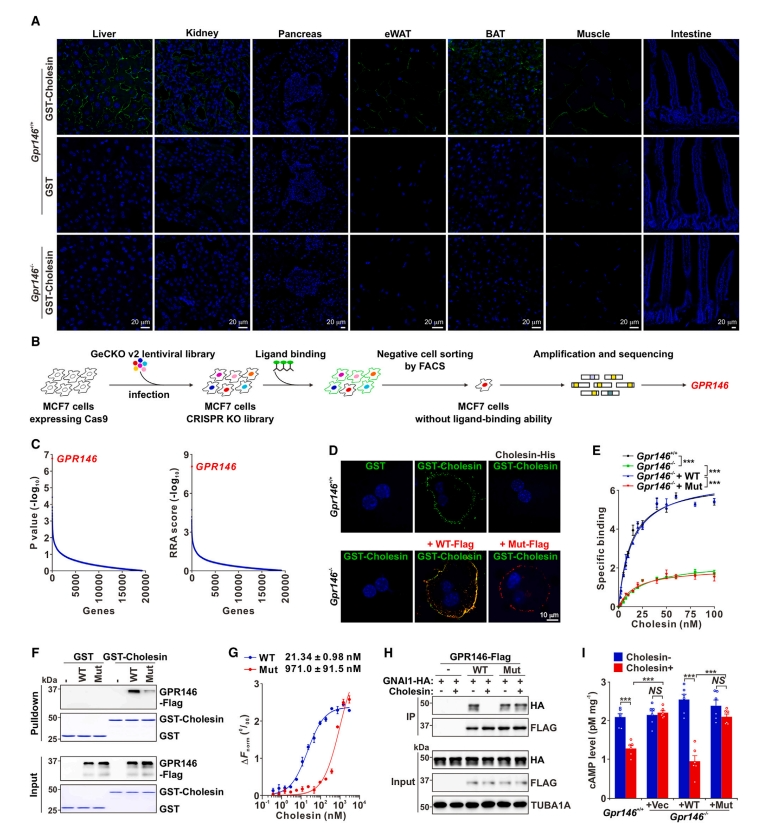
图四 GPR146是Cholesin的受体[5]
下一步,研究者探究体内Cholesin是否通过GPR146抑制小鼠的胆固醇合成。在对照组Gpr146fl/fl小鼠中,注射Cholesin降低了胆固醇生成基因的表达以及肝脏和血浆胆固醇含量(图五A-D)。先前研究表明,血浆胆固醇水平主要受肝源性GPR146的影响[8]。因此,研究者检测了腺病毒过表达WT和Mut GPR146对肝特异性Gpr146 敲除(LKO)小鼠胆固醇合成的影响。结果显示,Gpr146 LKO小鼠的胆固醇合成、血浆胆固醇和甘油三酯水平降低,添加WT GPR146,恢复了Cholesin对胆固醇和甘油三酯水平的抑制作用(图五A-D)。以上数据表明,GPR146对Cholesin减少胆固醇合成至关重要。GPR146已被证明通过激活ERK1/2通路刺激胆固醇合成[9]。然而,尚不确定Cholesin对cAMP/PKA的调节是否会影响ERK的激活并随后抑制胆固醇合成。在Gpr146 LKO小鼠中观察到ERK1/2(pERK1/2)活性降低(图五B)。与其对原代肝细胞中cAMP/PKA信号传导的抑制作用一致(图四I),Cholesin处理降低了对照组小鼠中的cAMP/PKA信号传导,但在Gpr146 LKO小鼠中没有这种作用(图五B)。类似地,在小鼠中给予Cholesin,以GPR146依赖的方式抑制pERK1/2水平。添加WT GPR146,而不是Mut GPR146,恢复了Cholesin对cAMP/PKA和ERK1/2信号传导的抑制作用,进一步验证了这些结论(图五B)。Gpr146基因位于人类和小鼠基因组中的Cholesin基因内,并以相反的方向转录,Gpr146的KO对Cholesin mRNA表达没有影响,反之亦然。以上结果表明,Cholesin抑制cAMP/PKA信号传导,从而至少部分通过ERK1/2信号级联减少胆固醇合成。
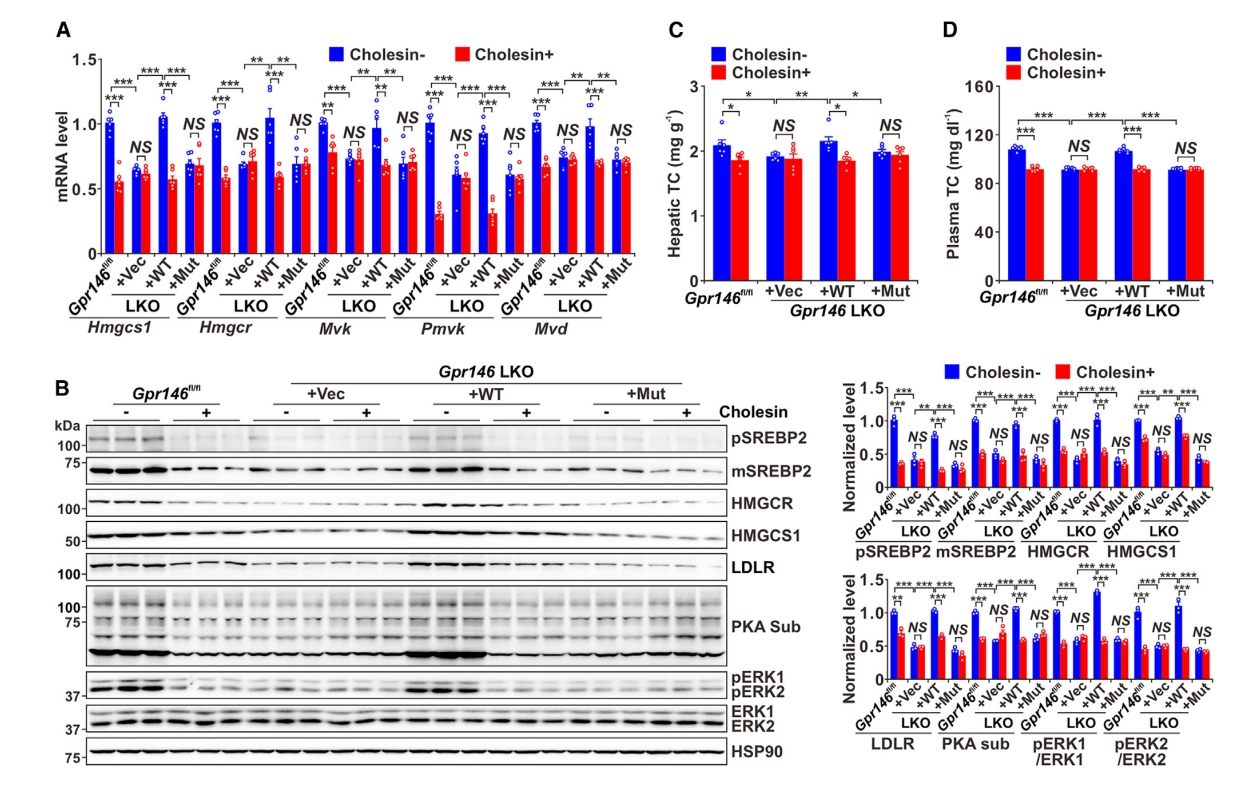
图五 Cholesin通过GPR146抑制胆固醇合成[5]
他汀类药物是治疗高胆固醇血症的常用处方药,通过抑制HMGCR活性和增加LDLR介导的胆固醇摄取来减少胆固醇合成[10]。然而,他汀类药物的功效受到质疑,因为它们能够显著增加Hmgcr和其他胆固醇基因的表达[11]。考虑到Cholesin对降低胆固醇生成基因表达的影响,研究者比较了单独使用或与瑞舒伐他汀(Ros)联合使用Cholesin能否对Ldlr -/- 小鼠的动脉粥样硬化提供保护作用(图六A)。结果发现,Cholesin处理显著降低了胆固醇生成基因表达和血浆胆固醇水平(图六B-E),也显著减少了动脉粥样硬化病变(图六F)。同样,Ros治疗降低了胆固醇合成、血浆胆固醇水平和动脉粥样硬化病变,但导致胆固醇生成基因表达上调,而两者的联合治疗对血浆胆固醇水平和动脉粥样硬化病变产生了更明显的抑制作用(图六B-F)。以上数据表明,无论是单独使用Cholesin还是与他汀类药物联合使用,都对高胆固醇血症和动脉粥样硬化具有显著的保护作用。
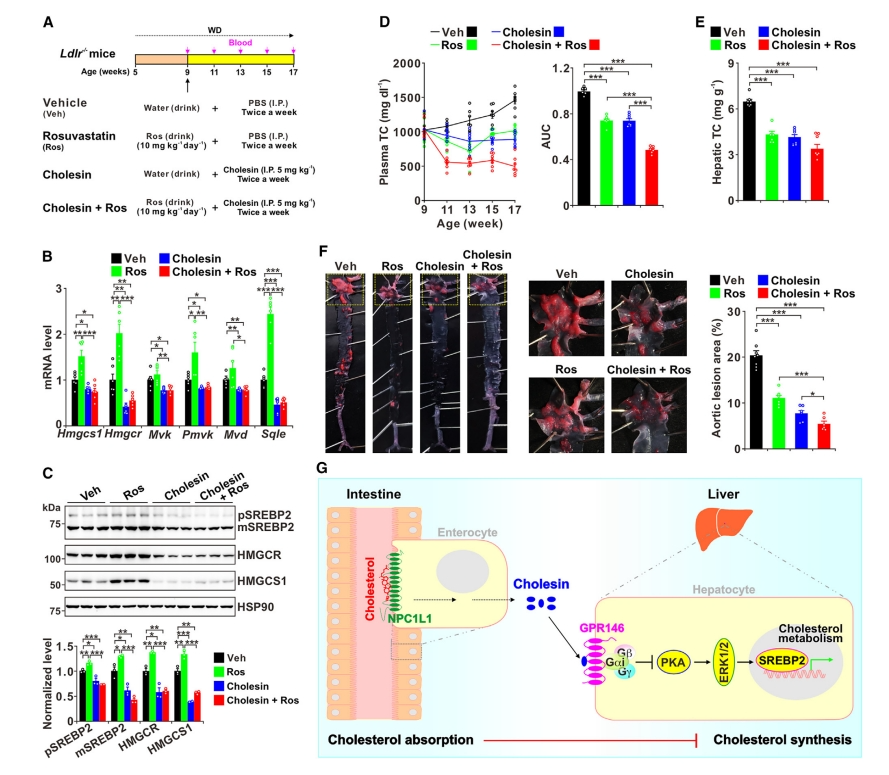
图六 Cholesin可改善高胆固醇血症和动脉粥样硬化[5]
综上所述,该研究新鉴定了一种肠道分泌的激素——Cholesin。机制上,NPC1L1介导胆固醇吸收诱导了Cholesin的分泌;随后,Cholesin与肝脏高表达的GPR146结合,导致cAMP/PKA-ERK1/2信号级联的抑制和SREBP2调控的肝脏胆固醇合成的下调(图六G)。该研究阐明了Cholesin在调控胆固醇稳态中的重要作用,为胆固醇代谢中肠道和肝脏之间复杂的相互作用提供了有价值的见解。该研究还证实Cholesin-GPR146轴对高胆固醇血症和动脉粥样硬化具有保护作用,为动脉粥样硬化等胆固醇代谢异常疾病提供了潜在靶点。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Luo J, Yang H, Song BL:Mechanisms and regulation of cholesterol homeostasis. Nat Rev Mol Cell Biol 2020, 21(4):225-245.
2. Brown MS, Radhakrishnan A, Goldstein JL: Retrospective on Cholesterol Homeostasis: The Central Role of Scap. Annual review of biochemistry 2018, 87:783-807.
3. Shimano H, Sato R: SREBP-regulated lipid metabolism: convergent physiology - divergent pathophysiology. Nature reviews Endocrinology 2017, 13(12):710-730.
4. Horton JD, Goldstein JL, Brown MS: SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. J Clin Invest 2002, 109(9):1125-1131.
5. Hu X, Chen F, Jia L, Long A, Peng Y, Li X, Huang J, Wei X, Fang X, Gao Z et al: A gut-derived hormone regulates cholesterol metabolism. Cell 2024, 187(7):1685-1700.e1618.
6. Jia L, Betters JL, Yu L: Niemann-pick C1-like 1 (NPC1L1) protein in intestinal and hepatic cholesterol transport. Annu Rev Physiol 2011, 73:239-259.
7. Garcia-Calvo M, Lisnock J, Bull HG, Hawes BE, Burnett DA, Braun MP, Crona JH, Davis HR, Jr., Dean DC, Detmers PA et al: The target of ezetimibe is Niemann-Pick C1-Like 1 (NPC1L1). Proc Natl Acad Sci U S A 2005, 102(23):8132-8137.
8. Han F, Liu X, Chen C, Liu Y, Du M, Zhou Y, Liu Y, Song BL, He HH, Wang Y: Hypercholesterolemia risk-associated GPR146 is an orphan G-protein coupled receptor that regulates blood cholesterol levels in humans and mice. Cell Res 2020, 30(4):363-365.
9. Yu H, Rimbert A, Palmer AE, Toyohara T, Xia Y, Xia F, Ferreira LMR, Chen Z, Chen T, Loaiza N et al: GPR146 Deficiency Protects against Hypercholesterolemia and Atherosclerosis. Cell 2019, 179(6):1276-1288.e1214.
10. Reihnér E, Rudling M, Ståhlberg D, Berglund L, Ewerth S, Björkhem I, Einarsson K, Angelin B: Influence of pravastatin, a specific inhibitor of HMG-CoA reductase, on hepatic metabolism of cholesterol. N Engl J Med 1990, 323(4):224-228.
11. Schonewille M, de Boer JF, Mele L, Wolters H, Bloks VW, Wolters JC, Kuivenhoven JA, Tietge UJ, Brufau G, Groen AK: Statins increase hepatic cholesterol synthesis and stimulate fecal cholesterol elimination in mice. Journal of lipid research 2016, 57(8):1455-1464.



