技术分享:运动诱导Musclin通过调控纤维脂肪祖细胞命运重建肌肉稳态
运动是一种强大的生理刺激,可为许多器官系统带来益处,降低疾病风险[1]。运动时由肌纤维收缩产生的自分泌和旁分泌肌细胞因子,累积在肌肉中形成独特的微环境。运动主要通过这种调节内部微环境的方式来维持肌肉稳态。人们在日常运动过程中可能发生急性肌肉或肌腱损伤,如果受伤后长时间限制患肢活动,可能导致废用性肌肉萎缩[2, 3]。肌肉损伤或萎缩时会出现肌肉纤维化和脂肪浸润[4, 5],过度的胶原沉积或脂肪细胞积聚逐渐取代功能性肌肉,最终导致肌肉退化[6]。因此,在损伤肌肉的恢复过程中,防止发生异常的细胞外基质(ECM)重塑至关重要。
纤维脂肪祖细胞(FAP)是肌肉组织中的多能祖细胞,与肌肉纤维化和脂肪浸润等息息相关[7, 8]。FAP的细胞命运很大程度上取决于微环境,提示运动引起的微环境扰动可能影响其生物行为。据报道在多种条件下,一些肌细胞因子可通过调节FAP的生物行为来介导肌肉稳态[9, 10]。然而,在肌肉损伤或萎缩情况下,由何种肌细胞因子介导运动对FAP的细胞命运调控,及其对肌肉恢复的作用机制尚不明确。
2024年2月,Cell Stem Cell期刊的一篇研究证明运动可通过调控纤维脂肪祖细胞(FAP)的细胞命运重建肌肉稳态,由一种名为Musclin的肌细胞因子介导了运动对ECM重塑和肌肉损伤恢复的作用。具体而言,运动诱导的Musclin通过上调FILIP1L抑制了FAP增殖并促进其凋亡。Musclin/FILIP1L还能下调CD47的表达,促进巨噬细胞对凋亡FAP的吞噬作用。外源性Musclin给药具有治疗作用,有望成为治疗肌肉萎缩或急性肌肉损伤的潜在方法,具有巨大的临床应用前景[11]。
首先,研究者进行小鼠肌萎缩和急性肌损伤造模,分别在小鼠接受或不接受6周的跑台实验后构建肌肉萎缩模型(失神经和肌腱横断模型,DNTT)或心脏毒素(CTX)急性肌肉损伤模型(图一A)。结果发现,在DNTT模型中,尽管两组小鼠肌肉的胶原沉积随着时间的推移而增加,但运动组的病理性纤维化程度显著低于久坐组(图一B-D)。标准化各组基线,运动组的相对变化也显著低于久坐组(图一E和F)。同样地,在CTX模型中,与久坐组相比,运动组的纤维化受到抑制(图1G–1K)。评估运动对脂肪浸润的影响,显示运动组的脂肪浸润面积以及肌肉组织中的脂肪生成也显著低于久坐组(图一L-N)。以上数据表明,长期运动可以有效防止肌肉萎缩或急性损伤期间的纤维化或脂肪浸润,并促进肌肉再生。
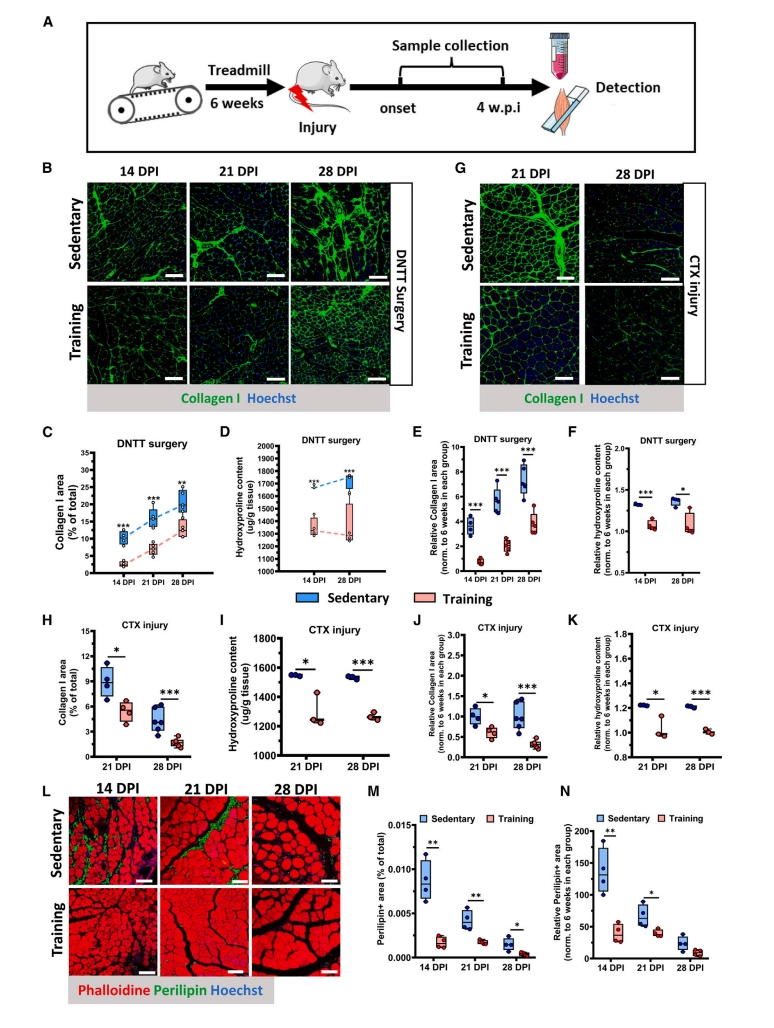
图一 运动可减轻萎缩或急性损伤肌肉的纤维化和脂肪浸润[11]
FAP与肌肉中的胶原沉积和脂肪浸润有关,并与肌肉干细胞(MuSC)的激活和肌肉再生相关[12]。由此,研究者推测运动可能调控FAP的生物行为。在DNTT或急性肌肉损伤(CTX诱导或甘油诱导)后,运动组小鼠的FAP数量保持在较低水平(图二A、G、M),FAP增殖减少(图二B、H和N),以及凋亡增加(图二C、I和O)。使用Pdgfra-H2B::eGFP小鼠标准化肌纤维数量,证实从运动到损伤后FAP减少(图二D和E、J和K、P和Q)。在DNTT或CTX诱导的肌肉损伤模型中,运动组或久坐组之间未观察到FAP中纤维生成标志物的差异(图二F和R)。然而,在运动后,FAP中脂肪生成标志物的表达显著下调(图二L),表明运动抑制FAP的脂肪生成,但不抑制纤维生成。血小板反应蛋白-1(TSP-1,由基因Thbs1编码)可由机械应力在FAP中诱导并促进MuSC的增殖[13]。结果显示,与久坐小鼠相比,运动后小鼠原发性FAP中TSP-1的mRNA水平显著上调(图二S),提示运动可能增强FAP支持肌肉组织再生的能力。以上结果表明,在肌肉损伤或萎缩期间,运动可抑制FAP的数量和脂肪生成。
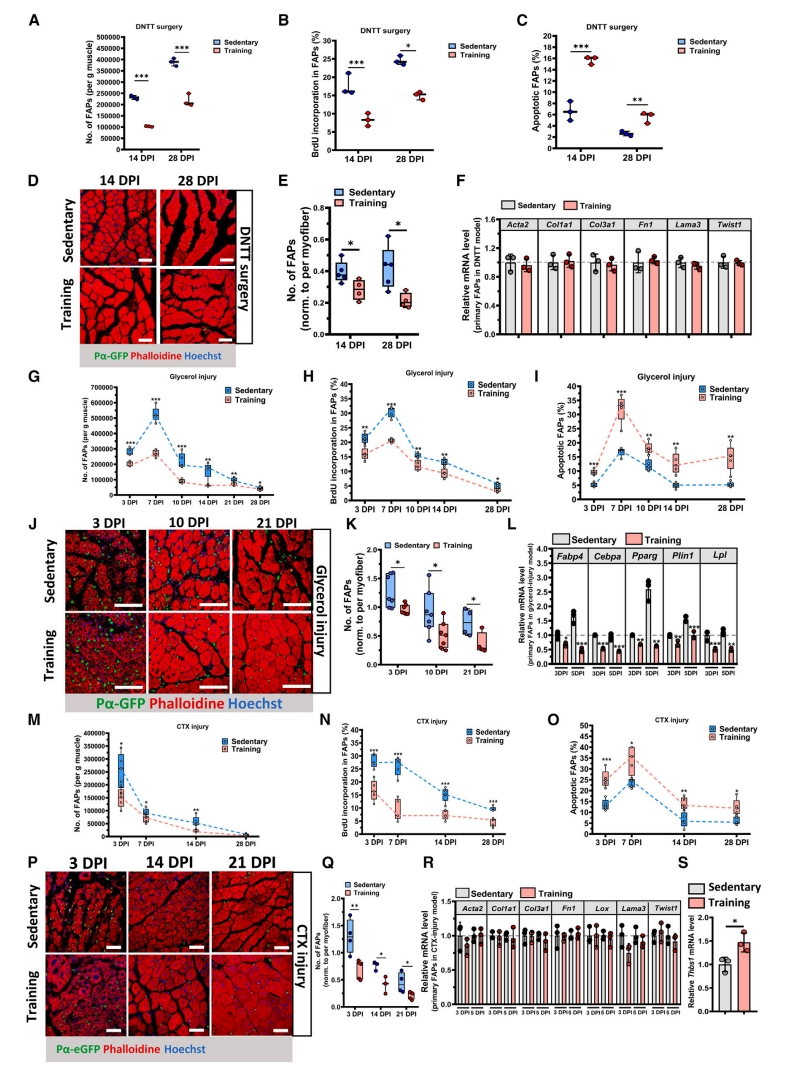
图二 运动可减少萎缩或损伤肌肉中FAP的数量 [11]
然后,研究者评估运动组和久坐组小鼠肌肉组织中的肌细胞因子。发现由Ostn基因编码的肌肉素Musclin,在运动组小鼠肌肉组织中显著上调,并且肌纤维是Musclin的主要来源(图三A和B)。研究者构建他莫昔芬诱导的肌纤维细胞特异性Ostn基因敲除小鼠(Acta1-CreESR1;Ostnf/f,OscKO),发现OscKO小鼠中Musclin的表达量很低,且不能通过运动上调(图三C)。使用OscKO小鼠构建肌肉损伤模型,发现在所有三种模型中,运动对FAP的调控都被显著消弱(图三D-L)。以上数据表明,Musclin是一种运动诱导的关键调节因子,可抑制FAP增殖并促进其凋亡。
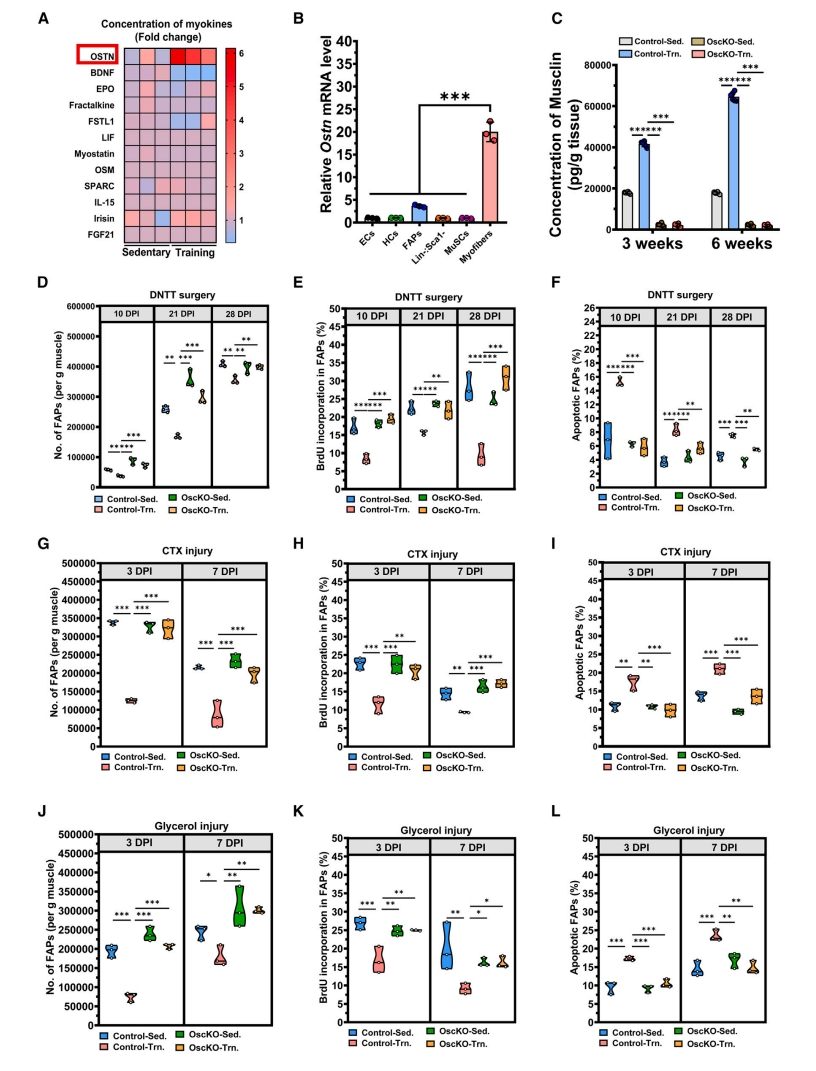
图三 Musclin缺失削弱了运动减少FAP的能力[11]
接下来,研究者研究添加外源性Musclin的作用效果。ELISA结果显示,连续5天的小鼠腹腔注射Musclin可使小鼠肌肉Musclin的浓度增加到与运动组小鼠相似的水平(图四A)。在Pdgfra-H2B::eGFP小鼠的三种肌肉萎缩和损伤模型中,Musclin处理组的eGFP阳性细胞数量显著减少(图四B、G、M),FAP的数量显著减少(图四C和D,H和I,N和O),细胞增殖减少(图四E,J,P),凋亡程度增加(图四F,K,Q)。FAP细胞周期相关基因的表达显著降低,细胞凋亡相关基因的表达显著升高(图四L和R)。以上结果表明,Musclin参与调节FAP细胞命运。
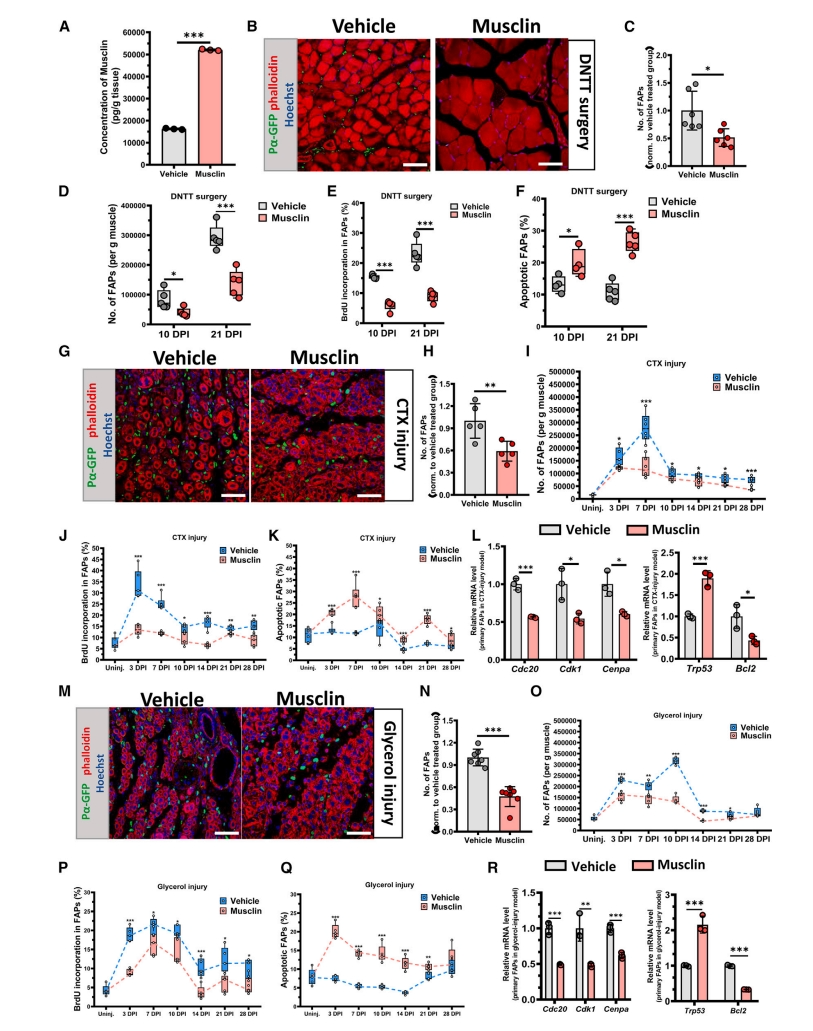
图四 外源性Musclin可抑制体内FAP的数量[11]
随后,研究者探究Musclin调节FAP的机制。检测Musclin处理24和72小时后的FAP转录组,发现在72小时,Filip1l表达显著上调。有研究表明,Filip1l基因参与调节细胞增殖和凋亡[14-16]。由此,研究者推测FILIP1L可能是Musclin诱导FAP凋亡的关键调节因子。构建FAP敲除Filip1l的Pdgfra-CreERT;Filip1lf/f小鼠(FilcKO小鼠)并进行造模,之后腹腔注射Musclin,发现FilcKO小鼠中Musclin对FAP的抑制效果显著减弱(图五A-C,G-I,J-L),Musclin对纤维化和脂肪浸润的抑制效果也显著减弱(图五D-F,M-P)。以上实验结果表明,Filip1l介导了Musclin对FAP的细胞命运调控和ECM重塑。研究者进一步在体外证明了Musclin通过NPR3-AKT-FoxO3a通路调控FILIP1L的表达。
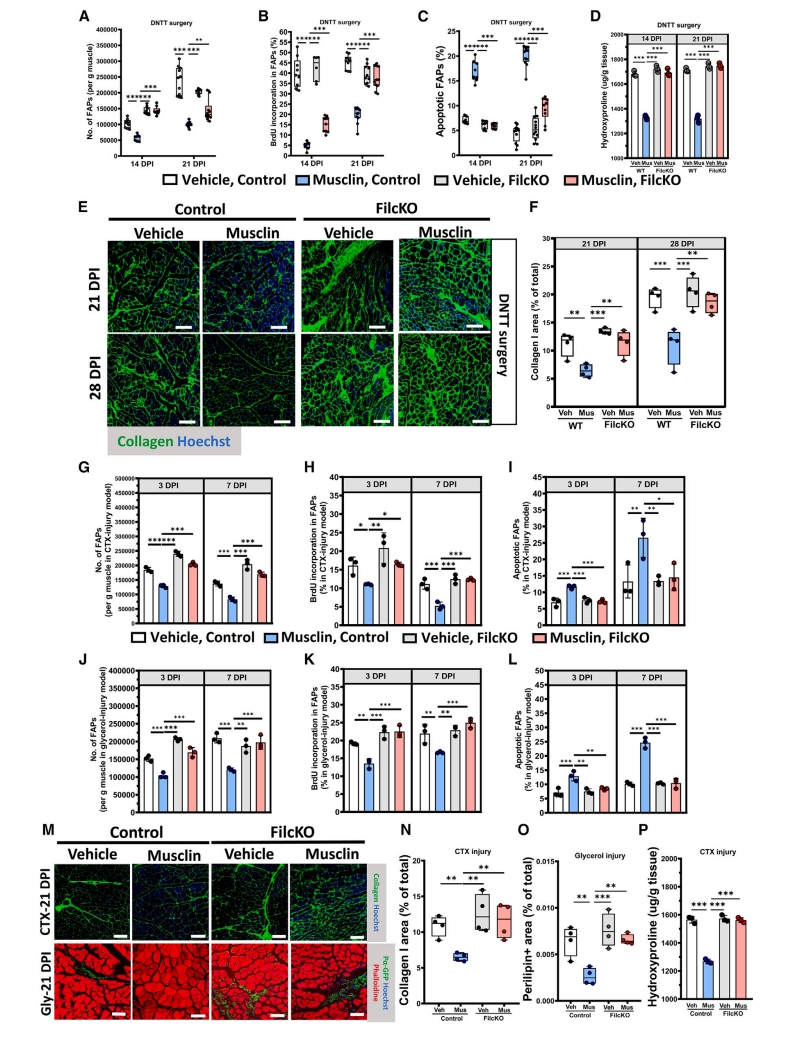
图五 FILIP1L对Musclin调节FAP细胞命运至关重要[11]
最后,研究者探究Musclin是否参与凋亡FAP的清除过程。流式细胞术显示,体外巨噬细胞在吞噬Musclin处理后凋亡的FAP方面非常有效(图六A);在小鼠体内,Musclin处理组的CFSE阳性巨噬细胞的百分比同样显著高于对照组(图六B),表明Musclin促进巨噬细胞吞噬清除凋亡的FAP。CD47通过与巨噬细胞表面SIRPα 结合,发出“别吃我”信号。研究者发现CTX损伤后,运动组小鼠CD47的mRNA表达显著下调(图六C)。此外,在体内和体外Musclin处理组的FAP中,CD47的mRNA表达也显著下调(图六D和E)。吞噬作用效率在CD47过表达的FAP中显著降低(图六F和G),但在CD47-KO的FAP中显著增强(图六H),证实CD47是凋亡FAP清除的重要调节因子。FILIP1L通过激活磷酸化促进β-catenin的降解,进而影响下游基因的转录,并且β-catenin可以上调CD47的表达[14, 17]。由此,研究者进行FILIP1L敲降实验,结果发现,Musclin对CD47的抑制作用明显减弱(图六I)。另外,在FAP中过表达FILIP1L激活了β-catenin的磷酸化,并下调了CD47的表达(图六J-L)。在此基础上过表达β-catenin后,FILIP1L抑制的CD47 mRNA表达基本恢复(图六M)。以上数据表明,Musclin通过FILIP1L/β-catenin通路调控CD47的表达。
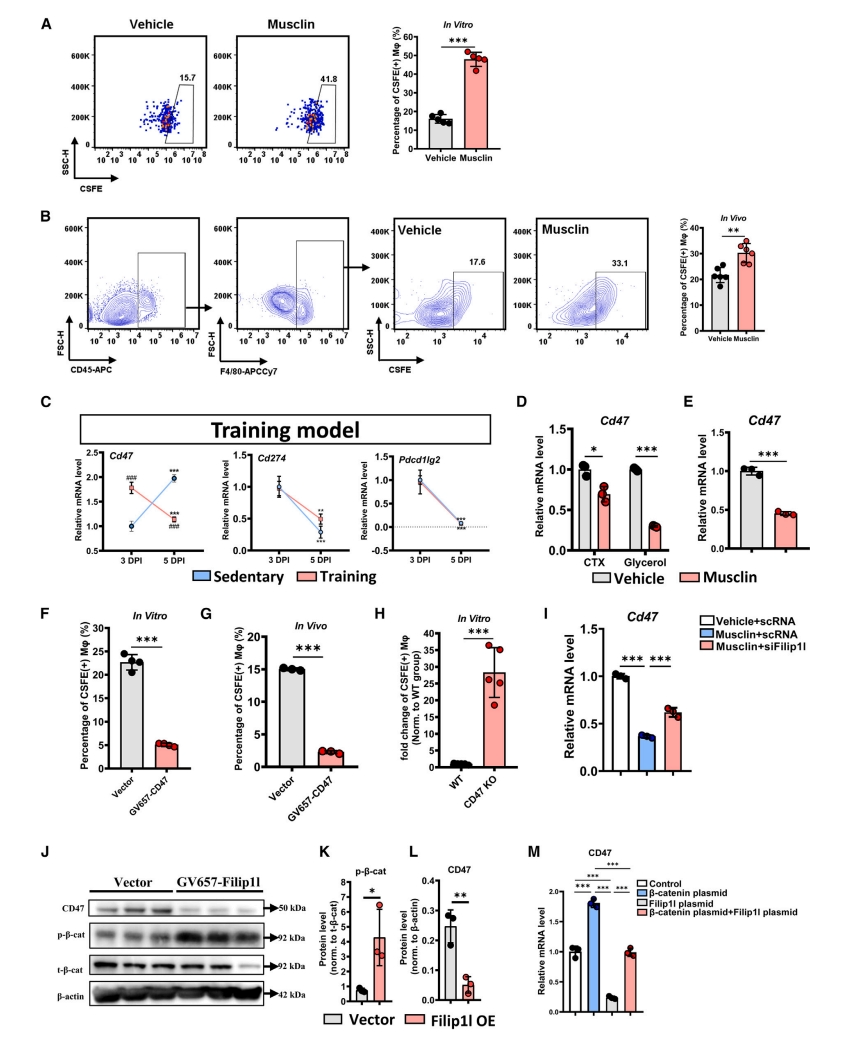
图六 Musclin通过FILIP1L/β-catenin通路调控凋亡FAP的清除[11]
综上所述,研究者通过构建了运动后急性肌肉损伤或萎缩小鼠模型,发现运动可以抑制FAP的增殖,并达到缓解肌肉纤维化及脂肪浸润的效果,促进肌肉再生。Musclin是运动调控FAP细胞命运的关键因子,Musclin缺失后运动对FAP细胞的抑制作用显著减弱。Musclin通过AKT/FILIP1L/β-catenin通路抑制下游CD47的表达,进而促进巨噬细胞对凋亡FAP的吞噬作用。该研究揭示了运动形成的肌肉微环境可以防止FAP的过度积累,有效缓解了肌肉损伤或萎缩情况下胶原沉积和脂肪形成,有利于防止异常的ECM重塑。提示临床上合理使用外源性Musclin具有抑制FAP过度积累的治疗作用,为急性肌肉损伤或萎缩等疾病提供了一种潜在的治疗方法。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
邮箱:gtp_order@sibcb.ac.cn
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Warburton DER, Bredin SSD: Health benefits of physical activity: a systematic review of current systematic reviews. Curr Opin Cardiol 2017, 32(5):541-556.
2. Tipton KD: Dietary strategies to attenuate muscle loss during recovery from injury. Nestle Nutrition Institute workshop series 2013, 75:51-61.
3. Tipton KD: Nutritional Support for Exercise-Induced Injuries. Sports medicine 2015, 45 Suppl 1:S93-104.
4. Mahdy MAA: Skeletal muscle fibrosis: an overview. Cell and tissue research 2019, 375(3):575-588.
5. Barry JJ, Lansdown DA, Cheung S, Feeley BT, Ma CB: The relationship between tear severity, fatty infiltration, and muscle atrophy in the supraspinatus. Journal of shoulder and elbow surgery 2013, 22(1):18-25.
6. Natarajan A, Lemos DR, Rossi FM: Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell Cycle 2010, 9(11):2045-2046.
7. Uezumi A, Fukada S, Yamamoto N, Takeda S, Tsuchida K: Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol 2010, 12(2):143-152.
8. Lemos DR, Babaeijandaghi F, Low M, Chang CK, Lee ST, Fiore D, Zhang RH, Natarajan A, Nedospasov SA, Rossi FM: Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors. Nature medicine 2015, 21(7):786-794.
9. Huh JY: The role of exercise-induced myokines in regulating metabolism. Archives of pharmacal research 2018, 41(1):14-29.
10. Dong J, Dong Y, Chen Z, Mitch WE, Zhang L: The pathway to muscle fibrosis depends on myostatin stimulating the differentiation of fibro/adipogenic progenitor cells in chronic kidney disease. Kidney Int 2017, 91(1):119-128.
11. Kang X, Qian J, Shi YX, Bian XT, Zhang LD, Li GM, Wang LT, Zhao J, Dong ZY, Yang MM et al: Exercise-induced Musclin determines the fate of fibro-adipogenic progenitors to control muscle homeostasis. Cell stem cell 2024, 31(2):212-226 e217.
12. Uezumi A, Ito T, Morikawa D, Shimizu N, Yoneda T, Segawa M, Yamaguchi M, Ogawa R, Matev MM, Miyagoe-Suzuki Y et al: Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of cell science 2011, 124(Pt 21):3654-3664.
13. Kaneshige A, Kaji T, Zhang L, Saito H, Nakamura A, Kurosawa T, Ikemoto-Uezumi M, Tsujikawa K, Seno S, Hori M et al: Relayed signaling between mesenchymal progenitors and muscle stem cells ensures adaptive stem cell response to increased mechanical load. Cell stem cell 2022, 29(2):265-280.e266.
14. Kwon M, Kim JH, Rybak Y, Luna A, Choi CH, Chung JY, Hewitt SM, Adem A, Tubridy E, Lin J et al: Reduced expression of FILIP1L, a novel WNT pathway inhibitor, is associated with poor survival, progression and chemoresistance in ovarian cancer. Oncotarget 2016, 7(47):77052-77070.
15. Lu H, Hallstrom TC: Sensitivity to TOP2 targeting chemotherapeutics is regulated by Oct1 and FILIP1L. PloS one 2012, 7(8):e42921.
16. Park YL, Park SY, Lee SH, Kim RB, Kim JK, Rew SY, Myung DS, Cho SB, Lee WS, Kim HS et al: Filamin A interacting protein 1-like expression inhibits progression in colorectal cancer. Oncotarget 2016, 7(44):72229-72241.
17. Gowda P, Patrick S, Singh A, Sheikh T, Sen E: Mutant Isocitrate Dehydrogenase 1 Disrupts PKM2-beta-Catenin-BRG1 Transcriptional Network-Driven CD47 Expression. Molecular and cellular biology 2018, 38(9).



