技术分享:线粒体DNA复制应激触发促炎性内体清除通路
线粒体DNA(mtDNA)编码氧化磷酸化系统的核心亚基,同时也是一种主要的损伤相关分子模式(DAMP),当其释放到细胞质、细胞间隙或进入血液循环时,会激活先天免疫系统。与核DNA不同,mtDNA缺乏保护性组蛋白,特别容易受到线粒体损伤因子(如ROS)的攻击,导致受损或受压的mtDNA从线粒体释放到细胞质中。错误的mtDNA复制、修复或包装也会导致细胞应激通路的激活[1]。线粒体转录因子A (TFAM)是一种mtDNA结合蛋白,对线粒体裂变期间的mtDNA复制、类核形成和mtDNA分离至关重要[2]。TFAM的部分缺失或单倍剂量不足(Tfam+/−)会引起mtDNA应激,导致类核增大、线粒体伸长以及 mtDNA 释放到细胞质中,进而激活 cGAS-STING 先天免疫信号通路[3]。这种应激反应会诱导干扰素刺激基因(ISG)的表达,启动细胞和小鼠的抗病毒免疫,甚至还能增强核DNA的修复能力[4]。然而,线粒体动力学如何改变,以及mtDNA应激如何导致mtDNA释放和先天免疫信号传导的潜在机制尚不清楚。
2024年2月,Nature Cell Biology期刊上报道了一项研究,发现在各种mtDNA复制应激和单纯疱疹病毒1感染条件下,与TFAM结合的增大类核逃离线粒体,进入初级和次级内体进行处理。增大类核在内体途径转运过程中发生内体破裂,最终导致mtDNA介导的cGAS-STING通路激活。这一过程由线粒体裂变检查点所介导,该途径先于先天免疫系统的激活,提示其可能是在病毒感染和其他病理状态下阻断mtDNA介导炎症的潜在治疗靶点[5]。
首先,研究者测定在应激情况下释放的细胞质mtDNA的性质,在TFAM缺陷的人原代肺成纤维细胞(IMR-90)中进行荧光原位杂交(FISH,图一a和b)。Airyscan成像显示,一部分增大的类核位于线粒体外(图一a和c)。进一步免疫荧光显示,cGAS定位于这些线粒体外的增大类核上(图一a和d)。尽管TFAM缺陷细胞的TFAM信号较弱且往往难以检测,但仍观察到TFAM与释放的类核和cGAS共定位。有研究表明,在单纯疱疹病毒1(HSV-1)等多种病毒的感染期间,也会出现类核的增大[6],并且病毒编码的HSV-1 UL12.5核酸酶的表达也会导致类核增大和mtDNA释放,从而引发抗病毒药物反应,最终耗尽mtDNA[7]。于是,研究者以TFAM 作为标记,在细胞感染HSV-1后4、6、8 和 10 小时进行线粒体外的类核成像。结果显示定位于线粒体外的类核增大,并在感染后8小时达到峰值(图一e和f)。以上数据表明,在多种mtDNA应激条件下,类核从线粒体中释放出来,且仍然与TFAM相结合。
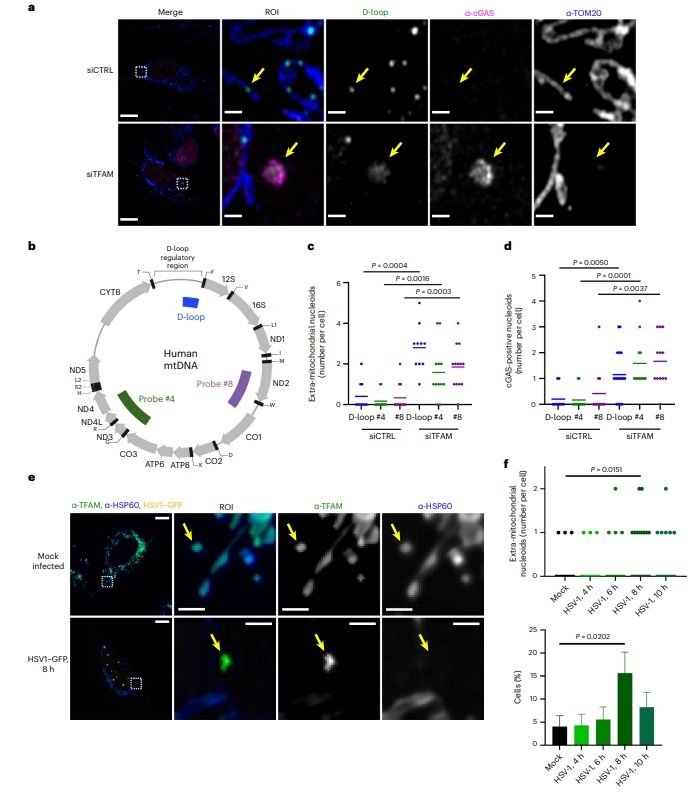
图一 mtDNA应激导致出现TFAM结合的线粒体外类核[5]
接下来研究者探究增大的类核是如何从线粒体中逃逸的。在细胞凋亡过程中,BAX与BAK发生寡聚化,在线粒体外膜中形成极大的大孔,从而介导mtDNA的释放,激活cGAS-STING通路[8, 9]。然而,在TFAM 缺陷的小鼠胚胎成纤维细胞 (MEF) 或 U2OS 细胞中没有检测到BAX孔的存在。于是,研究者尝试通过光电关联显微镜(CLEM)来捕获mtDNA释放事件。用DNA嵌入染料PicoGreen、cGAS-mCherry、TOM20-Halo和mTurquoise-LC3(用于基准信息)标记TFAM缺陷型U2OS细胞,使用Airyscan显微镜进行活细胞成像,直到观察到正在进行的明显mtDNA释放,此时细胞立即固定在显微镜载物台上(图二a),然后使用扫描电子显微镜(SEM)对其进行成像,最后与CLEM数据相校准(图二b)。结果发现一个膜包裹的结构,呈现PicoGreen和cGAS-mCherry阳性,但TOM20-Halo和mTurquoise-LC阴性,且该结构来自于TOM20阳性的线粒体(图二c和d)。以上数据表明,增大的受压类核通过先前未被定义的膜包裹区室的方式逃离线粒体。
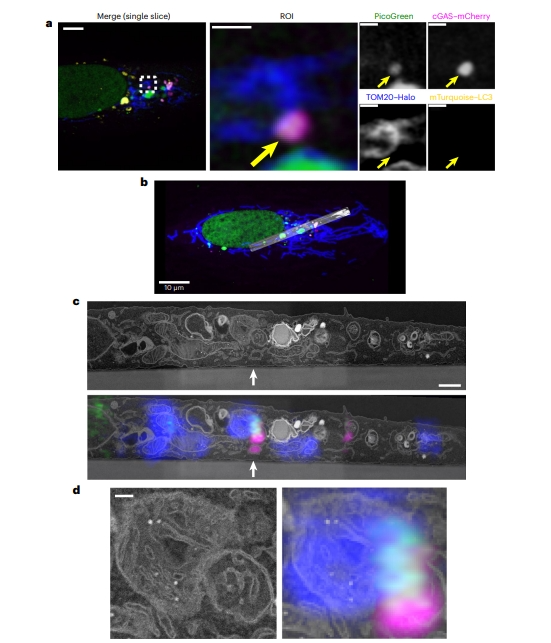
图二 增大类核通过膜包裹区室的方式逃离线粒体[5]
随后,研究者表达HSV-1 UL12.5来诱导mtDNA应激和释放,并进行CLEM实验。对固定后的细胞进行成像,采用TFAM-绿色荧光蛋白(GFP)标记线粒体外mtDNA。研究者分析了TFAM-GFP阳性的三个区域,它们与cGAS-mCherry共定位,但不与TOM20-Halo和mTurquoise-LC3共定位(图三a)。通过聚焦离子束显微镜(FIB-SEM)成像并校准CLEM数据集后,观察到所有这三个感兴趣区域(ROI)均与膜包裹区室相对应(图三b和c)。于是,研究者提出这一新发现的类核转运途径是对多种形式mtDNA应激的一种反应,而不是对基因性TFAM耗竭的特殊反应。
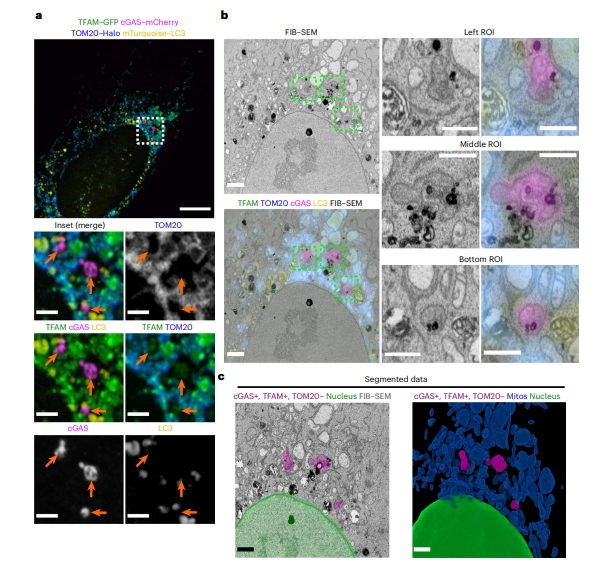
图三 HSV-1 UL12.5触发类核的膜运输[5]
研究者利用平行的冷冻电子断层扫描,在Tfam+/− MEF中观察到类似于多囊泡的多膜结构,它们是一种次级内体[10]。初级内体在RAB5介导下从质膜接收内吞物,并以RAB7依赖性方式将内吞物分类到次级内体[11]。于是,猜测线粒体外部的增大类核可能被转运到初级内体中,后者成熟为次级内体并最终被溶酶体清除(图四a)。研究者使用了HSV-1感染模型来测试这一假设,观察到线粒体外TFAM与RAB7共定位,并且线粒体外的TFAM/RAB7斑点在感染后8小时达到峰值(图四b和c),与TFAM标记的类核动力学相似(图一e和f)。接着检测HSV-1感染后胞质DNA与初级内体标志物mCherry-RAB5的共定位,并使用PicoGreen标记DNA,发现与mCherry-RAB5共定位的线粒体外DNA在感染早期增加(图四d-g)。类核出现在RAB5+初级内体区室比RAB7+次级内体区室更早(图四c和f),提示缺陷类核离开线粒体后,通过内体途径运输并最终被降解(图四a)。
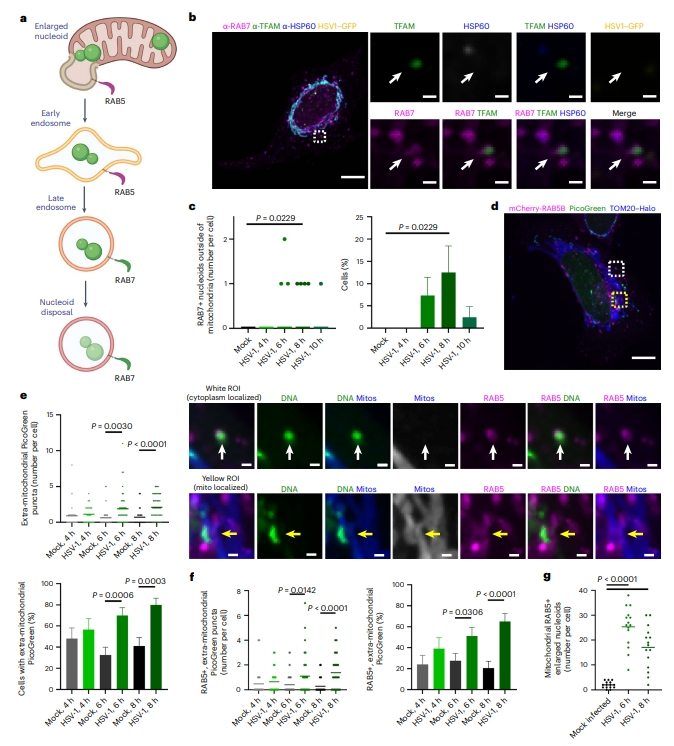
图四 HSV-1感染触发类核的内体运输[5]
接下来,研究者探究类核定位到内体后如何激活cGAS。RAB5在多种情况下可被募集至线粒体外膜[12]。值得注意的是,在类核离开线粒体的同一时间点观察到mCherry-RAB5与线粒体内的增大类核共定位(图四d-g)。于是,研究者研究RAB5突变体的作用,共表达UL12.5与RAB5显性失活突变体,发现阻断RAB5激活后,不仅减少了类核与RAB7的共定位,而且还减少了类核与cGAS的共定位,并导致线粒体外mtDNA总量减少(图五a),表明RAB5活性是类核转运至次级内体以及最终与cGAS共定位所必需的。随后,研究者检测cGAS阳性mtDNA与破裂内体标志物半乳糖凝集素8(Gal8)的共定位,发现cGAS标记的mtDNA与Gal8的共定位比例很高(80%,图五b和c),提示内体的破裂促使cGAS识别经内体途径运输的mtDNA。
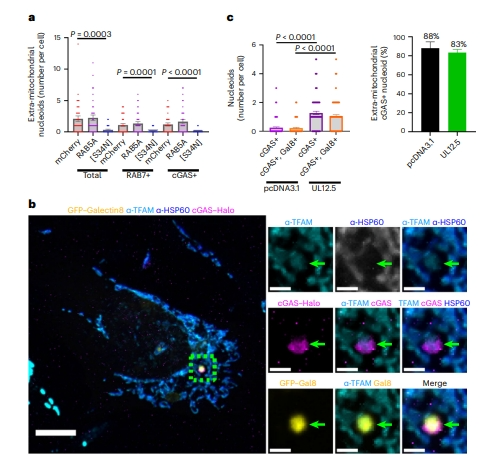
图五 次级内体破裂促使经内体途径运输的mtDNA被cGAS识别[5]
基于上述结果,研究者提出内体途径介导了缺陷类核的处理,而该途径不能有效运输过量释放的类核,导致内体破裂激活cGAS-STING信号传导。研究者通过测量5-乙炔基-2'-脱氧尿苷(EdU)掺入率来评估TFAM缺陷MEF中增大类核的复制状态。在4小时短检测周期内,与相同细胞内较小的典型对照相比,增大的类核中EdU掺入率显著降低(图六a-e)。为确定增大的类核是否定位于mtDNA复制位点,免疫荧光检测mtDNA复制体的成分,发现Twinkle、mtSSB和POLG2都与增大的类核共定位(图六f)。以上数据表明,增大类核包含的mtDNA具有复制活性降低属性。
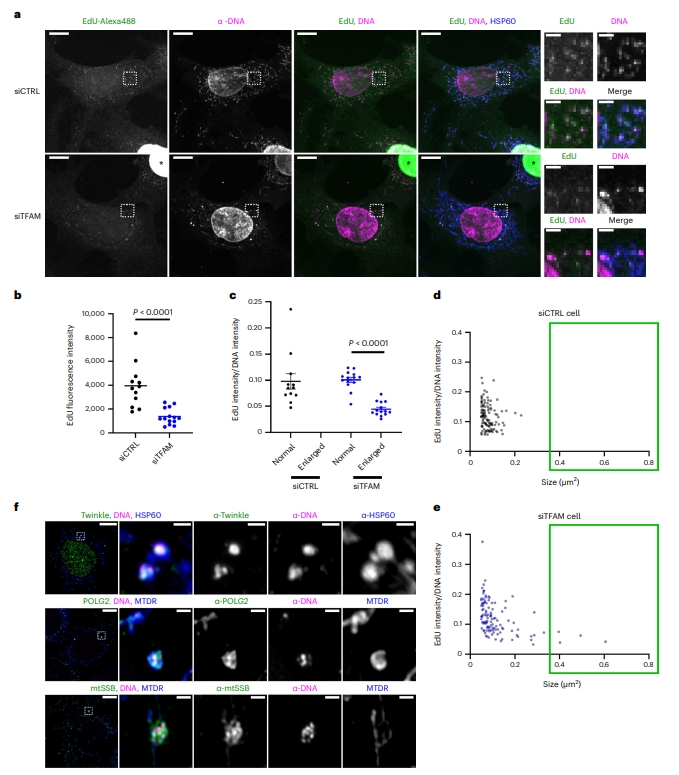
图六 增大类核与不完全的mtDNA复制相关[5]
由于线粒体裂变与线粒体-内质网(ER)接触位点的mtDNA复制和分离紧密耦合[13], DRP1介导了线粒体裂变的最后步骤,其缺陷会导致出现增大的“簇状”类核[14, 15]。在DRP1缺陷细胞中,研究者发现了增多的增大类核被释放,并且与cGAS和RAB7共定位(图七a和b),导致ISG的表达增加(图七c),有力复制了TFAM缺陷和UL12.5过表达的表型。ER与线粒体结合后,线粒体和 ER 上的肌动蛋白聚合是线粒体裂变进行的必要条件,首先发生线粒体肌动蛋白聚合[16, 17]。使用标记细胞器特异性肌动蛋白的探针检测TFAM缺陷细胞[18],发现线粒体相关肌动蛋白在增大的类核上富集(图七d和e),但ER相关肌动蛋白没有显著富集(图七f和g),提示TFAM缺陷细胞在线粒体裂变的中间阶段停止,即停在mtDNA复制最后步骤完成之后和ER肌动蛋白聚合开始之前,将此阶段定义为裂变检查点。
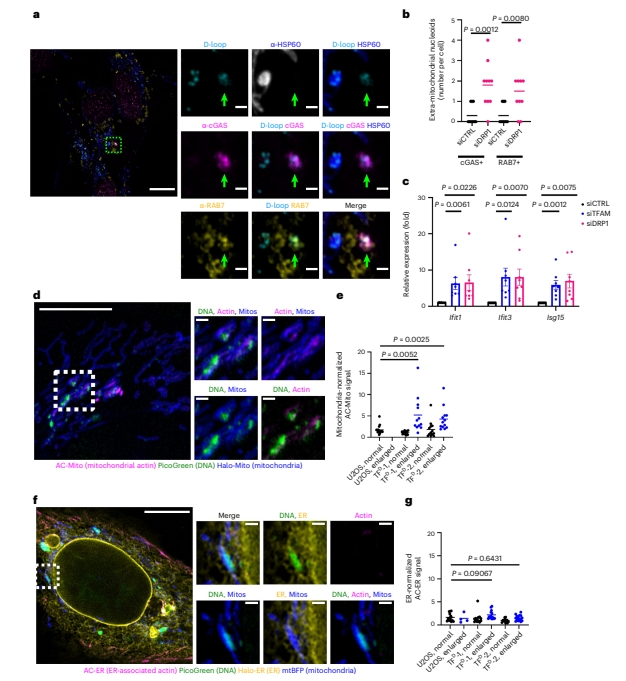
图七 线粒体裂变检查点确保mtDNA复制完整和子代分离[5]
mtDNA合成完成后,TOP3A介导线粒体基因组的去连接和物理分离[19]。研究者使用TOP3A缺陷细胞,发现TOP3A缺陷同样触发mtDNA释放到RAB5标记的内体中(图八a–c),进一步表明类核不能完成分离会触发其逃离线粒体并通过内体途径运输。最后,采用线粒体靶向的阿霉素处理野生型细胞,对mtDNA造成物理损伤,发现这也足以触发增大类核的释放及其与RAB7和cGAS的共定位(图八d和e)。以上数据表明,mtDNA复制失败、分离缺陷或损伤都会阻碍线粒体裂变,导致增大的类核通过内体途径运输。
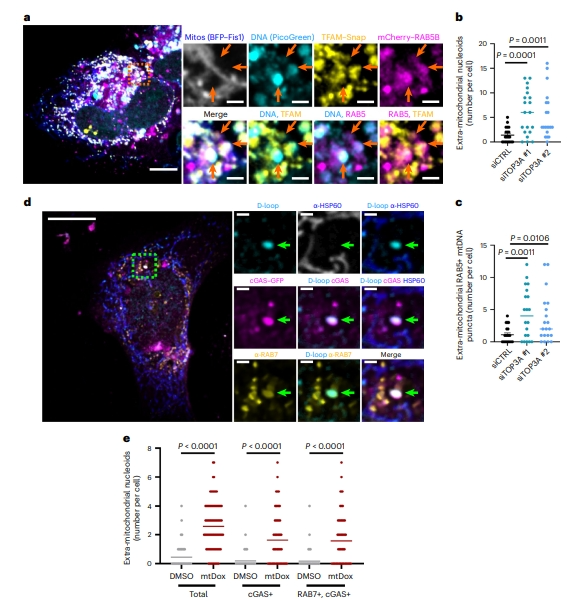
图八 mtDNA分离缺失或mtDNA损伤会触发类核的内体运输[5]
综上所述,研究者发现阻断mtDNA复制与分离、mtDNA损伤和/或其他应激会触发晚期线粒体裂变检查点,以确保在线粒体裂变后遗传到每个子代线粒体的mtDNA完整性和未损伤。这种线粒体裂变检查点可去除这些有缺陷的类核,将其运输到内体进行处理,使得含有mtDNA的次级内体破裂进而激活mtDNA介导的cGAS-STING免疫信号。该研究结果提示mtDNA复制、线粒体裂变和内体途径是预防多种疾病和衰老相关炎症的潜在靶点,可用于阻断mtDNA释放或加速清除免疫刺激性mtDNA。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Newman LE, Shadel GS: Mitochondrial DNA Release in Innate Immune Signaling. Annu Rev Biochem 2023, 92:299-332.
2. Kasashima K, Sumitani M, Endo H: Human mitochondrial transcription factor A is required for the segregation of mitochondrial DNA in cultured cells. Experimental cell research 2011, 317(2):210-220.
3. West AP, Khoury-Hanold W, Staron M, Tal MC, Pineda CM, Lang SM, Bestwick M, Duguay BA, Raimundo N, MacDuff DA et al: Mitochondrial DNA stress primes the antiviral innate immune response. Nature 2015, 520(7548):553-557.
4. Wu Z, Oeck S: Mitochondrial DNA Stress Signalling Protects the Nuclear Genome. 2019, 1(12):1209-1218.
5. Newman LE, Weiser Novak S, Rojas GR, Tadepalle N, Schiavon CR, Grotjahn DA: Mitochondrial DNA replication stress triggers a pro-inflammatory endosomal pathway of nucleoid disposal. 2024, 26(2):194-206.
6. Moriyama M, Koshiba T, Ichinohe T: Influenza A virus M2 protein triggers mitochondrial DNA-mediated antiviral immune responses. Nature communications 2019, 10(1):4624.
7. Duguay BA, Smiley JR: Mitochondrial nucleases ENDOG and EXOG participate in mitochondrial DNA depletion initiated by herpes simplex virus 1 UL12.5. Journal of virology 2013, 87(21):11787-11797.
8. McArthur K, Whitehead LW, Heddleston JM, Li L, Padman BS, Oorschot V, Geoghegan ND, Chappaz S, Davidson S, San Chin H et al: BAK/BAX macropores facilitate mitochondrial herniation and mtDNA efflux during apoptosis. Science 2018, 359(6378).
9. Riley JS, Quarato G, Cloix C, Lopez J, O'Prey J, Pearson M, Chapman J, Sesaki H, Carlin LM, Passos JF et al: Mitochondrial inner membrane permeabilisation enables mtDNA release during apoptosis. The EMBO journal 2018, 37(17):e99238.
10. Fader CM, Colombo MI: Autophagy and multivesicular bodies: two closely related partners. Cell death and differentiation 2009, 16(1):70-78.
11. Wandinger-Ness A, Zerial M: Rab proteins and the compartmentalization of the endosomal system. Cold Spring Harb Perspect Biol 2014, 6(11):a022616.
12. Hsu F, Spannl S, Ferguson C, Hyman AA, Parton RG: Rab5 and Alsin regulate stress-activated cytoprotective signaling on mitochondria. 2018, 7:e32282.
13. Lewis SC, Uchiyama LF, Nunnari J: ER-mitochondria contacts couple mtDNA synthesis with mitochondrial division in human cells. Science 2016, 353(6296):aaf5549.
14. Smirnova E, Shurland DL, Ryazantsev SN, van der Bliek AM: A human dynamin-related protein controls the distribution of mitochondria. The Journal of cell biology 1998, 143(2):351-358.
15. Ban-Ishihara R, Ishihara T, Sasaki N, Mihara K, Ishihara N: Dynamics of nucleoid structure regulated by mitochondrial fission contributes to cristae reformation and release of cytochrome c. Proceedings of the National Academy of Sciences of the United States of America 2013, 110(29):11863-11868.
16. Ji WK, Hatch AL, Merrill RA, Strack S, Higgs HN: Actin filaments target the oligomeric maturation of the dynamin GTPase Drp1 to mitochondrial fission sites. Elife 2015, 4:e11553.
17. Schiavon CR, Zhang T, Zhao B, Moore AS, Wales P, Andrade LR, Wu M, Sung TC, Dayn Y, Feng JW et al: Actin chromobody imaging reveals sub-organellar actin dynamics. Nature methods 2020, 17(9):917-921.
18. Schiavon CR, Zhang T, Zhao B, Moore AS, Wales P, Andrade LR: Actin chromobody imaging reveals sub-organellar actin dynamics. 2020, 17(9):917-921.
19. Nicholls TJ, Nadalutti CA, Motori E, Sommerville EW, Gorman GS, Basu S, Hoberg E, Turnbull DM, Chinnery PF, Larsson NG et al: Topoisomerase 3α Is Required for Decatenation and Segregation of Human mtDNA. Molecular cell 2018, 69(1):9-23.e26.



