技术分享:线粒体功能缺陷阻碍肠上皮细胞的膳食脂质加工
线粒体功能障碍导致氧化磷酸化(OXPHOS)缺乏和代谢缺陷,可影响几乎任何细胞类型,并导致严重疾病。虽然线粒体疾病常被称为脑肌病,但其通常涉及多个器官,包括胃肠道[1]。由于胃肠道的线粒体疾病如厌食症、腹痛、慢性便秘、腹泻或持续呕吐等症状并不危及生命或无特异性,经常被人们所忽视。人类基因组含有17个线粒体氨基酰-tRNA合成酶(mt-AaRS)基因,负责编码线粒体蛋白质合成系统使用的所有mt-AaRS。其中,DARS2可催化tRNA氨基酰化反应,生成天冬氨酰-tRNA。DARS2缺失可抑制线粒体DNA编码的呼吸链亚基的产生,导致严重的线粒体功能障碍[2]。另外,有研究表明神经内分泌和平滑肌细胞的缺陷与胃肠道症状有关[3]。消化后的膳食脂肪被肠上皮细胞(IEC)吸收,并在内质网中形成前乳糜微粒,然后运输到高尔基体进行成熟,最后分泌到循环中[4]。线粒体在肠上皮细胞中的作用仍未被大量探索,特别是在膳食脂质加工和运输中的作用尚不清楚。
2024年1月,Nature期刊报道了一项研究,发现肠上皮细胞的线粒体功能缺陷可阻碍乳糜微粒的产生以及膳食脂质向外周组织的运输。研究发现在肠上皮细胞特异性敲除线粒体天冬氨酸-tRNA合成酶DARS2,导致小鼠近端小肠上皮细胞积聚了大量脂滴且不能成熟和分泌。进行无脂肪饮食可减少DARS2缺陷肠上皮细胞中脂滴的积累。这一DARS2缺陷导致近端小肠上皮细胞乳糜微粒明显减少以及高尔基体结构紊乱,最终影响脂质向血浆和外周器官(包括肝脏、脂肪组织)的转运。该研究揭示了线粒体在肠上皮细胞的膳食脂质加工和运输中的作用,为理解线粒体疾病患者的肠道并发症提供了理论支持[5]。
首先,研究者探索线粒体在肠上皮细胞(IEC)中的作用。通过将Dars2fl/fl小鼠与Vil1-cre小鼠杂交,获得在IEC中特异性缺失DARS2的小鼠,简称为Dars2IEC-KO。该小鼠出生比例遵循孟德尔遗传规律,但体重减轻,存活不超过4周(图一a和b)。免疫印迹分析7日龄Dars2IEC-KO小鼠的IEC总蛋白,可见DARS2被有效敲除(图一c)。与同窝对照组Dars2fl/fl相比,组织化学染色显示Dars2IEC-KO小鼠小肠上皮细胞的细胞色素 C氧化酶(COX)缺陷,以及透射电子显微镜(TEM)显示线粒体肿胀、嵴较少不密集和碎片化(图一d和e)。与对照组相比,7日龄Dars2IEC-KO小鼠小肠的长度较短且表现出组织结构紊乱、绒毛变钝、杯状细胞和吸收性肠上皮细胞数量减少,上皮细胞增殖显著降低,镜下还观察到存在大的胞质空泡,经油红O(ORO)染色和包裹脂滴的蛋白PLIN2免疫染色证实这些大空泡为脂滴(LD),与对照组的少量微小脂滴形成鲜明对比(图一f)。脂质组学分析显示,Dars2IEC-KO小鼠肠道中脂质水平显著升高,特别是三酰基甘油(TAG)种类(图一g),相反,肝脏TAG水平显著降低(图一h)。此外,Dars2IEC-KO小鼠血清中葡萄糖和高密度脂蛋白(HDL)含量减少,而总胆固醇、低密度脂蛋白(LDL)和TAG水平正常(图一i)。以上数据表明,肠上皮细胞中DARS2缺失会导致膳食脂质运输受损,从而积累形成大脂滴。
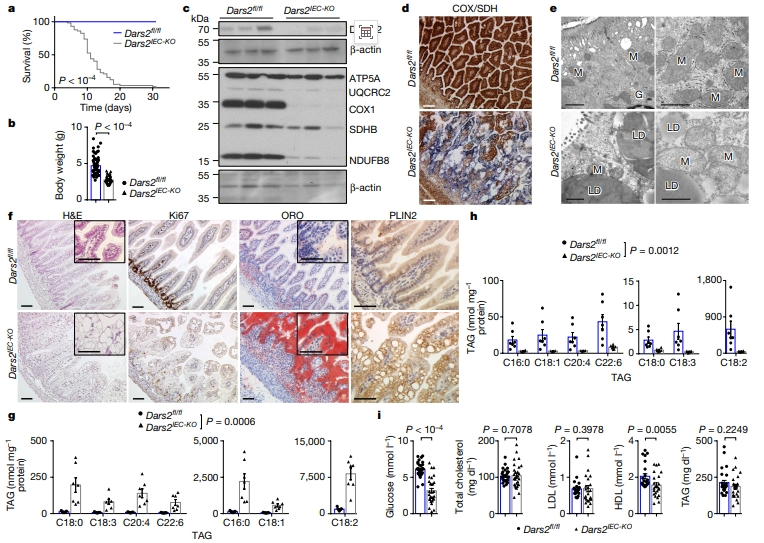
图一 肠上皮细胞特异性缺失DARS2导致大量脂质积聚[5]
这种Dars2IEC-KO小鼠肠上皮细胞的脂质积累增加可能与母乳中高脂肪含量或者胚胎发育过程中DARS2缺失引起的发育缺陷有关[6]。于是,研究者使用成年Dars2fl/fl Villin-creERT2小鼠(简称Dars2tamIEC-KO)评估他莫昔芬诱导IEC特异性DARS2缺失的表现。连续5天给予他莫昔芬可导致Dars2tamIEC-KO小鼠体重迅速减轻,因此在最后一次给药后7-8天对小鼠实施安乐死收样检测(图二a)。免疫印迹和蛋白质组学分析证实DARS2的有效敲除和OXPHOS亚基的严重耗竭(图二b)。解剖Dars2tamIEC-KO小鼠,观察到胃肠道扩张、充满液体,近端小肠呈白色。TEM分析显示,Dars2tamIEC-KO肠上皮细胞中大部分线粒体出现肿胀,嵴较少不密集和破碎现象(图二c)。在Dars2tamIEC-KO小鼠的近端和远端小肠中,增殖细胞、杯状细胞和吸收性肠上皮细胞数量减少,干细胞标志物的表达也显著减少(图二d)。同Dars2IEC-KO小鼠相似,Dars2tamIEC-KO小鼠近端小肠的肠上皮细胞也充满了大的脂滴,但远端小肠的肠上皮细胞不含大的脂滴(图二e)。脂质组学分析还显示,Dars2tamIEC-KO小鼠的肠上皮细胞中TAG数量增加(图二f),而血清血糖、TAG和总胆固醇水平没有显著变化(图二g)。以上数据表明,成年小鼠IEC中DARS2缺失引起的线粒体功能障碍会导致近端小肠上皮细胞中脂质的显著积聚。
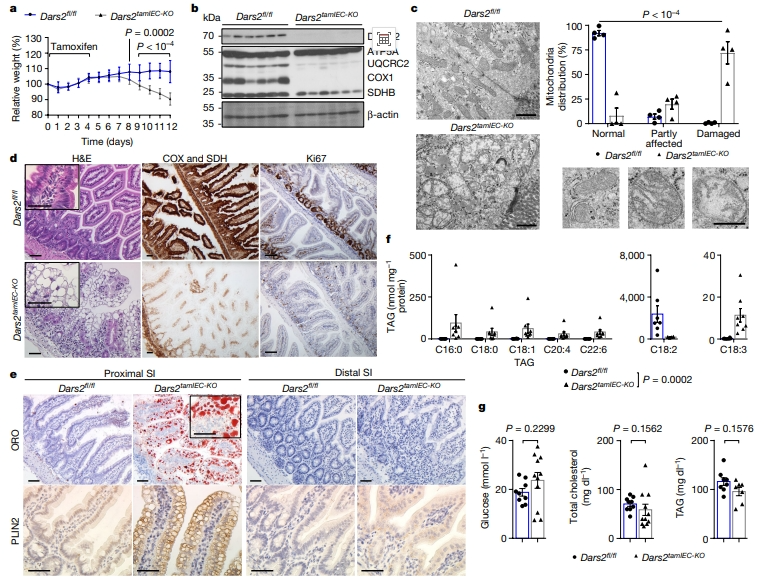
图二 诱导成年小鼠IEC中DARS2缺失导致近端肠上皮细胞的脂质积累[5]
研究者推测Dars2tamIEC-KO小鼠近端肠上皮细胞中积累的大脂滴可能来源于膳食脂肪。为评估膳食脂肪的贡献,研究者采用无脂肪饮食(FFD,含有小于0.5%的脂肪)和NCD(含有3.4%的脂肪)喂养进行比较。他莫昔芬给药诱导FFD喂养的Dars2tamIEC-KO小鼠同样导致了有效的DARS2缺失、OXPHOS缺陷和体重减轻,小肠也表现出IEC增殖受损和干细胞基因表达减少(图三a)。然而,FFD喂养组在近端小肠的肠上皮细胞中仅存在少量的小脂滴,与NCD喂养组的大量且高度丰富的大脂滴形成了鲜明对比(图三a),表明Dars2tamIEC-KO小鼠在近端肠上皮细胞中积累的脂质来自于饮食摄入。
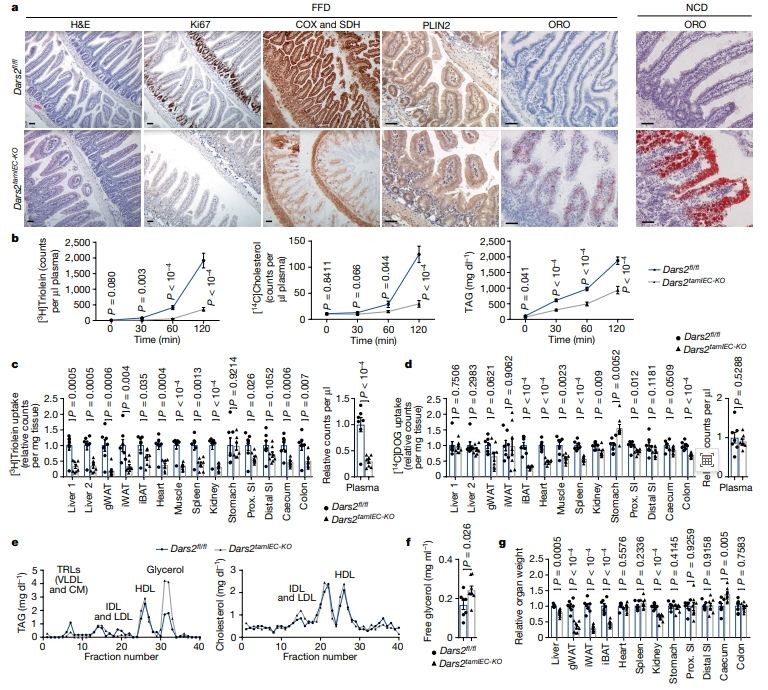
图三 DARS2缺失导致肠上皮细胞的膳食脂质运输受损[5]
接着,研究者进行代谢追踪实验。给予禁食的Dars2tamIEC-KO小鼠和同窝对照组小鼠口服[3H]三油酸甘油酯和[14C]胆固醇,他莫昔芬注射后7天,在脂蛋白酶抑制剂tyloxapol存在的情况下追踪血浆中的示踪剂,其中tyloxapol处理可阻断血管内脂蛋白加工。发现与对照组小鼠相比,Dars2tamIEC-KO小鼠血浆中[3H]三油酸甘油酯、[14C]胆固醇和TAG的水平显著降低(图三b),表明DARS2缺失抑制了肠上皮细胞对膳食脂质的运输。进一步口服测试[3H]三油酸甘油酯和[14C]脱氧葡萄糖([14C]DOG),在他莫昔芬诱导后7天检测不同组织中示踪剂的积累。发现与对照组小鼠相比,Dars2tamIEC-KO小鼠显示[3H]三油酸甘油酯向血浆和大多数外周组织包括肝脏的转运显著减少(图三c)。相比之下,Dars2tamIEC-KO小鼠显示出正常的[14C]DOG转运到血浆中,但在包括脂肪组织和心脏在内的其他外周器官中仅为中度减少(图三d),表明肠上皮细胞中DARS2缺失主要影响膳食中脂质的加工。此外,血浆脂蛋白分析显示,Dars2tamIEC-KO小鼠富含TAG的脂蛋白(TRL)水平降低,包括乳糜微粒(CM)和极低密度脂蛋白(VLDL),而HDL和LDL没有受到影响(图三e);以及血浆甘油量增加,而性腺和腹股沟白色脂肪组织的重量减少(图三e-g)。以上数据表明,在肠上皮细胞特异性缺失DARS2后,膳食脂质向循环系统的运输出现了渐进性损害。
肠细胞吸收的大多数膳食脂质以乳糜微粒(CM)的形式运输到肠道,CM的产生需要微粒体甘油三酯转移蛋白(MTTP)介导的脂质与内质网(ER)的ApoB48一起包装到前CM中,然后转移到高尔基体中进行成熟和随后的细胞外分泌[4]。在注射他莫昔芬后的第5天和第7天,Dars2tamIEC-KO小鼠的肠上皮细胞表达正常水平的ApoB48(图四a)。然而,相比肝脏来源的ApoB100,Dars2tamIEC-KO小鼠血浆中分离出的富含甘油三酯的脂蛋白中的ApoB48水平降低,这与肠道向循环释放的CM减少相一致(图四b)。近端小肠的TEM显示,对照组小鼠的CM分泌在延伸的高尔基体内或肠上皮的基底外侧表面,而在Dars2tamIEC-KO小鼠观察到分泌途径紊乱,缺乏含有CM的高尔基体(图四c)。相反,DARS2缺陷肠上皮细胞的细胞质中充满了非常大且多的脂滴,ER腔内也发现脂质颗粒(图四c)。为了研究高尔基体的紊乱是否先于脂滴的形成,研究者用定位于高尔基的跨膜蛋白TGN38和E-cadherin、PLIN2抗体对肠组织切片进行免疫染色。他莫昔芬给药5天后,在Dars2tamIEC-KO小鼠的大多数近端小肠上皮细胞中观察到高尔基体明显破碎,仅检测到少量脂滴(图四d)。而他莫昔芬给药8天后,才观察到大量的脂滴形成并伴随着明显的高尔基体弥散。以上数据表明,DARS2缺陷会损害CM的产生,并诱导渐进性高尔基体紊乱,最终导致肠上皮细胞中脂滴的大量积累。
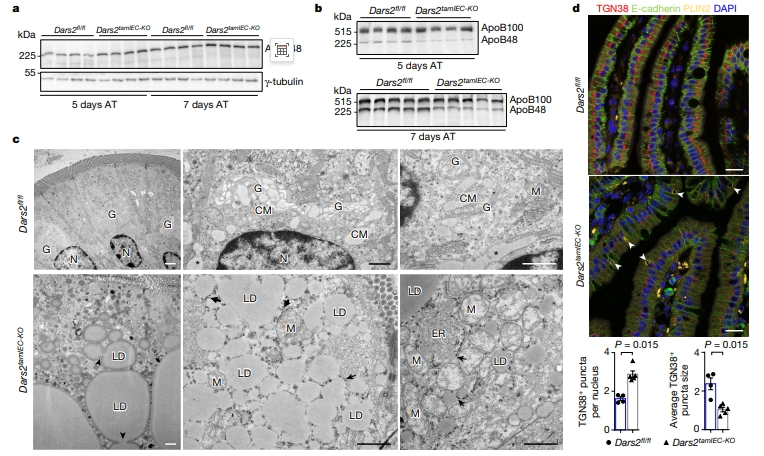
图四 DARS2缺陷损害CM的产生和高尔基体的结构[5]
综上所述,该研究揭示了肠上皮细胞线粒体对膳食脂质加工与运输的作用。线粒体功能障碍损害了近端小肠上皮细胞成熟乳糜微粒的形成和/或从内质网到高尔基体的运输,甚至渐进性造成高尔基体结构紊乱,最终导致膳食脂质向外周组织的运输受损,并在胞质脂滴中积累和存储。临床上在部分线粒体疾病患者中出现了体重难以增加和发育不良相关的肠道并发症,该研究为此提供了机制基础。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:茄子
参考文献
1. Finsterer J, Frank M: Gastrointestinal manifestations of mitochondrial disorders: a systematic review. Therapeutic advances in gastroenterology 2017, 10(1):142-154.
2. Dogan SA, Pujol C, Maiti P, Kukat A, Wang S, Hermans S, Senft K, Wibom R, Rugarli EI, Trifunovic A: Tissue-specific loss of DARS2 activates stress responses independently of respiratory chain deficiency in the heart. Cell Metab 2014, 19(3):458-469.
3. Chinnery PF, Turnbull DM: Epidemiology and treatment of mitochondrial disorders. American journal of medical genetics 2001, 106(1):94-101.
4. Ko CW, Qu J, Black DD, Tso P: Regulation of intestinal lipid metabolism: current concepts and relevance to disease. Nat Rev Gastroenterol Hepatol 2020, 17(3):169-183.
5. Moschandrea C, Kondylis V, Evangelakos I, Herholz M, Schneider F, Schmidt C, Yang M, Ehret S, Heine M, Jaeckstein MY et al:Mitochondrial dysfunction abrogates dietary lipid processing in enterocytes. Nature 2024, 625(7994):385-392.
6. Madison BB, Dunbar L, Qiao XT, Braunstein K, Braunstein E, Gumucio DL: Cis elements of the villin gene control expression in restricted domains of the vertical (crypt) and horizontal (duodenum, cecum) axes of the intestine. The Journal of biological chemistry 2002, 277(36):33275-33283.



