技术分享:新药MMK4抑制剂可增强肝脏再生和预防肝衰竭
肝脏疾病是一个日益严重的重大健康问题,造成全球每年200多万人死亡[1]。在过去三十年里,肝脏疾病导致的死亡人数增加了50%,预计未来20年还将翻倍[2]。急性和慢性肝病以及肝切除术后的一个关键特征是肝细胞无法充分再生、恢复或维持关键的功能性肝脏。尽管健康的肝脏具有几乎无限的再生潜力,但在急性或慢性损伤后,肝脏微环境的损伤相关变化会降低肝细胞的再生能力[3]。然而,人们对其潜在的分子机制知之甚少。
有研究发现双特异性激酶MKK4是肝细胞再生的主调节因子[4]。MKK4是一种MAP2激酶,也是应激活化蛋白激酶(SAPK)/丝裂原活化蛋白激酶(MAPK)信号网络的一部分[5, 6]。当细胞受到不同应激刺激时,MKK4可被激活,其下游底物是JNK1、2和3,它们也可被MKK7激活以及p38 MAPK亚型MKK3和MKK6激活[7]。shRNA介导的MKK4沉默可以解锁急性或慢性损伤后肝细胞的内源性再生能力,这主要通过MKK7和JNK1激活ATF2和ELK1介导的促再生转录程序[4]。
2024年3月,Cell期刊在线报道了一项新药MMK4抑制剂的临床前和I期临床试验数据,这种MKK4小分子抑制剂HRX215能在小鼠和猪模型中显著增加肝切除术后的肝脏再生,大幅提高致命性85%肝切除术后猪的存活率,并在肝病小鼠模型中显示出抗脂肪变性和抗纤维化作用。HRX215的首次人体I期临床试验(欧盟临床试验[EudraCT] 2021-000193-28)显示出良好的安全性和药代动力学,有望用于预防大体积的肝脏肿瘤切除术或小体积的肝脏移植术后出现的肝功能衰竭,具有巨大的临床应用前景[8]。
首先,为评估抑制MKK4的耐受性和安全性,研究者构建了诱导性全身抑制MKK4的小鼠模型。通过重组酶介导的盒式交换(RMCE)将tet反应元件(TRE)驱动的MKK4 shRNA和荧光报告GFP元件插入到内源性Col1a1基因座得到TRE-shMKK4小鼠,随后与组成型表达rtTA[9, 10]的小鼠杂交得到CAG-rtTA3;TRE-shMKK4小鼠(图一A)。选择非靶向shRNA(shNC)作为对照。当给予CAG-rtTA3;TRE-shMKK4小鼠多西环素(dox)后,可以在肠、肝、肾、肌肉和胰腺中观察到显著的GFP表达(图一B)。蛋白质印迹显示肝脏的MKK4表达被抑制(图一C)。CAG-rtTA3;TRE-shMKK4小鼠经dox预处理后进行部分肝切除术,发现增殖的肝细胞数量显著高于对照组小鼠(图一D-F),证实MKK4的抑制可增强肝脏再生。小鼠持续服用dox 12个月,体重发育维持正常(图一G),对肝脏、心脏、肺、胰腺、肾脏、脾脏和肠道的病理学评估没有发现任何毒性形态学证据(图一H)。以上数据表明,持续的系统性抑制MKK4具有良好的耐受性,并且在观察期内不会增加肝脏肿瘤发生风险。
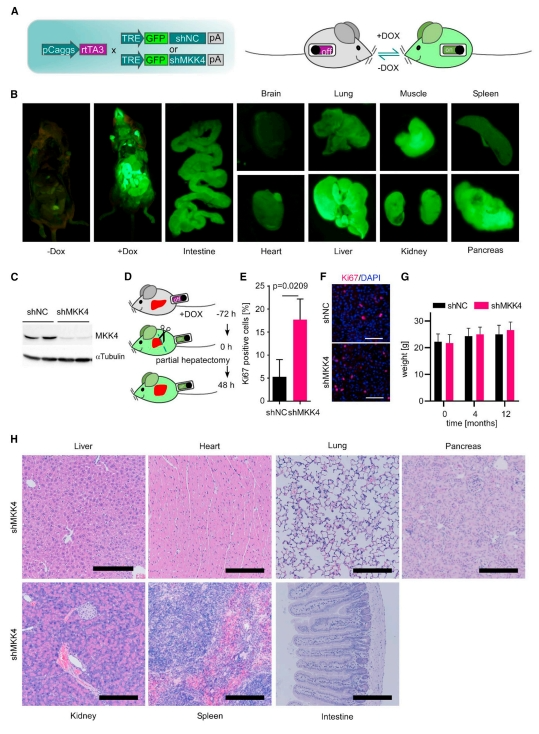
图一 敲降MKK4可增强小鼠肝脏再生并显示出长期安全性[8]
随后,研究者对已有的MMK4抑制剂Vemurafenib进行药物开发和改进,最终选定HRX215作为临床候选小分子MMK4抑制剂,进而探究HRX215能否在肝部分切除术后增加肝细胞增殖。在手术前12小时和手术进行前给小鼠服用HRX215,术后40小时通过Ki67染色测定肝细胞增殖(图二A)。对照药物处理的小鼠表现为4.93%的肝细胞增殖,而用0.4和2 mg/kg HRX215处理的小鼠分别显示15.38%和15.15%的增殖率,当浓度提高到10 mg/kg时,增殖的肝细胞数量可以进一步增加到26.3%(图二B和C),表明HRX215存在剂量-反应关系。值得注意的是,当对未进行手术的野生型小鼠使用HRX215时,没有观察到肝细胞增殖或肝/体重比的增加(图二D-G),表明在MKK4沉默后,需要肝细胞的应激信号来激活再生。分别收集shRNA敲降MKK4的肝切除小鼠肝脏与用HRX215处理的肝切除小鼠肝脏,进行mRNA测序和转录组分析,结果显示两组之间具有高度相关的基因表达谱(图二H)。此外,HRX215在纤维化肝脏小鼠模型的肝切除术后仍可增加肝细胞增殖(图二I-M),表明肝纤维化的存在不会干扰HRX215介导的促再生机制。HRX215在小鼠肝损伤模型中也能显著降低肝细胞死亡(图二N-P)。有趣的是,与0.4 mg/kg剂量组相比,10 mg/kg和2 mg/kg剂量组的肝细胞死亡没有进一步减少(图二O),表明剂量0.4 mg/kg已经达到了最佳的治疗效果。以上数据表明,HRX215可以增加肝部分切除术后的肝细胞增殖并减少细胞凋亡。
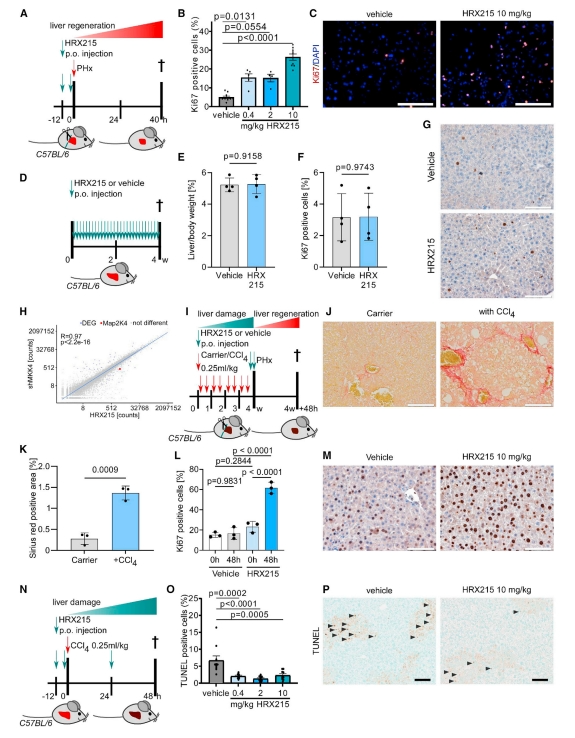
图二 HRX215可增加小鼠肝部分切除术后的肝细胞增殖并减少细胞凋亡[8]
研究者之前报道shRNA介导受损肝脏的MKK4敲降可通过MKK7和JNK1解除SAPK信号,随后激活肝细胞ATF2和ELK1依赖的促再生程序[4]。免疫印迹证实,HRX215给药小鼠接受肝部分切除术后同样存在这些通路的关键信号事件(图三A)。此外还观察到额外的信号传导和基因表达变化,如p38和p53激活的减少,NF-kB信号传导的激活和抗凋亡蛋白Bcl-XL的上调(图三A-C)。这些变化可能有助于稳定MKK4抑制的肝细胞表型。为表征HRX215的安全性,研究者对HRX215处理4周的小鼠血浆和肝脏样本进行非靶向代谢组学研究,发现与对照相比,只有HRX215衍生的代谢产物有所不同,未检测到其他与安全性相关的变化(图三D和E)。非酒精性脂肪性肝炎是癌症发展的危险因素,于是,研究者在GAN-NASH小鼠模型中检测HRX215疗效。小鼠接受GAN-NASH饮食60周后进行肝脏活检,将符合NASH标准(脂肪变性评分R2和纤维化3期)的小鼠随机分为HRX215组或对照组。64周后,对20只小鼠实施安乐死,以确定基线肝细胞癌负荷(图三F-H)。随后,在另外12周的饮食中,用HRX215或对照处理小鼠(图三F)。肿瘤负荷分析结果显示尽管所有肝脏都有肝癌(图三I和J),但与对照组相比,HRX215给药并没有导致肿瘤结节数量的增加(图三G),并且肿瘤体积具有减小的趋势(图三H)。在肉眼未见肿瘤负荷的肝脏区域进行显微镜观察,也没有显示出癌前病变数量的显著性差异(图三K)。以上数据表明,HRX215可以抑制已建立肿瘤的进展。
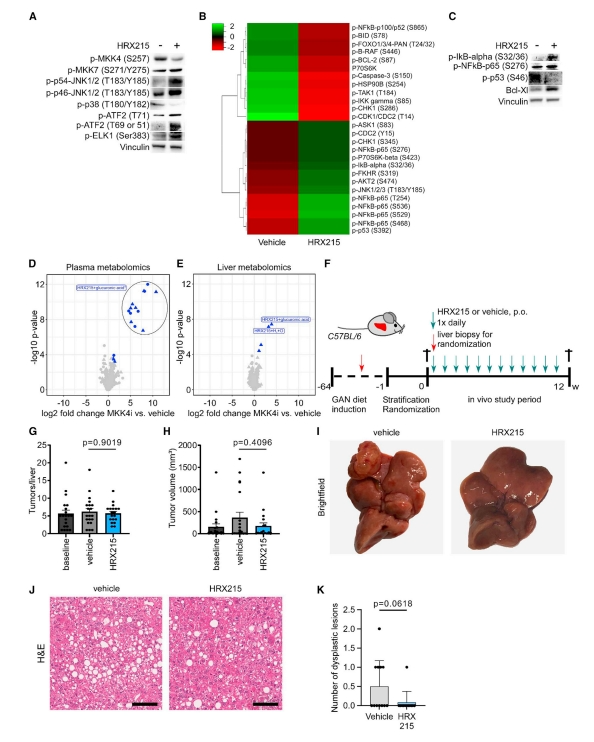
图三 HRX215长期用药具有安全性[8]
接下来,研究者探讨HRX215在猪肝切除术模型中增强肝脏再生的能力。猪肝切除术模型可以进行80%或85%的肝脏切除(图四A)。首先在80%肝切除术模型中测试HRX215。随机分配8头猪用于HRX215或安慰剂给药,从手术前24小时开始,每12小时静脉注射HRX215(5 mg/kg)或安慰剂一次(图四B)。手术后,通过计算机断层扫描(CT)进行肝脏体积测定(图四C)。CT成像证实切除程度相同,安慰剂组的剩余肝脏体积为158.3±33.3 mL,HRX215组为160.5±11.9 mL(图四D)。肝切除术后43小时,安慰剂组的再生肝脏体积仅为160.0±23.5 mL,而HRX215组的肝脏已经再生251.8±13.6 mL(图四D)。根据这些值,确定HRX215组的再生指数(RI)为2.57±0.11,而安慰剂组仅为2.12±0.1(图四D)。肝切除术后43小时,对猪实施安乐死以收集样本。观察到与安慰剂组相比,HRX215组的肝细胞增殖显著增加(图四D和E)。这些数据表明,在猪肝切除术模型中,HRX215介导的MKK4抑制增加了肝细胞再生。
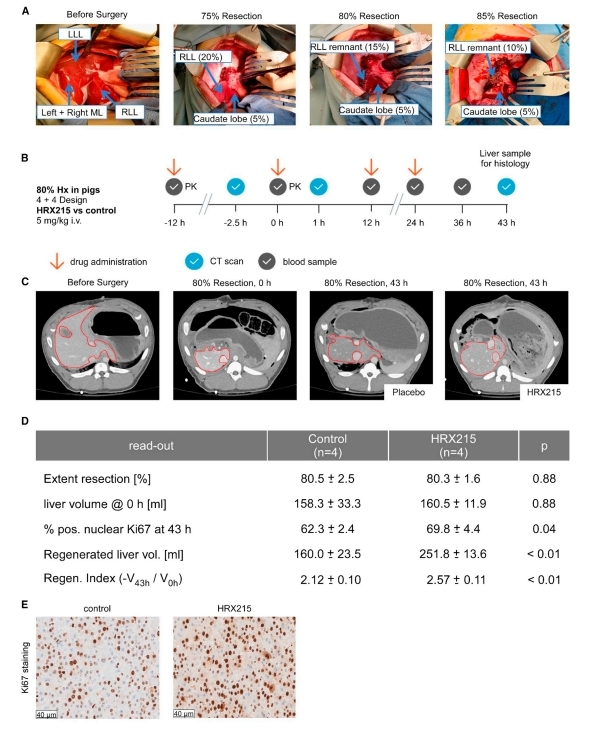
图四 HRX215增加猪80%肝切除术后的肝脏再生[8]
85%的猪肝切除术会导致致命的肝衰竭(PHLF),造成肝脏蛋白质合成崩溃、肝脏代谢受损、胆红素水平升高以及随后的颅内压(ICP)升高[11]。研究者随后测试HRX215在85%猪肝切除术中的治疗潜力,持续监测生命体征、心电图(ECG)记录、ICP测量、中心静脉压测量和所有相关血液参数(图五A)。将猪随机分为HRX215术前给药组和术后给药组分别在手术前12小时(n=6)或手术后12小时(n=6)开始给药,以及安慰剂组。值得注意的是,HRX215给药的猪在手术后没有显示出ICP值的增加,这是人类急性肝衰竭的典型发展(图五B)。通过定量血浆氨和胆红素水平测定残余肝脏的代谢能力,发现HRX215阻止了血浆氨的增加(图五C)。安慰剂组的胆红素血浆水平持续上升,但HRX215组仅出现短暂上升,随后下降(图五D)。国际标准化比值(INR)反映了肝脏合成凝血蛋白的能力,发现HRX215组的INR值仅短暂上升到1以上,而安慰剂组的INR值持续高达1.6(图五E)。与这些结果一致,HRX215组的天冬氨酸氨基转移酶在手术后仅短暂升高,而安慰剂组的水平保持在800U/L以上,表明出现急性肝衰竭(图五F)。六分之五接受安慰剂的猪在手术后24小时开始表现出呆板行为,随后陷入昏迷。与此形成鲜明对比的是,6只HRX215给药的两组猪中分别有4只(术前治疗组)和5只(术后治疗组)表现为正常并存活下来(图五G)。在死亡或预期收获时间点分析肝脏,HRX215组的肝脏显示出正常的颜色和质地,而安慰剂组的肝脏较小,呈淡黄色,血液灌注不足(图五H)。以上数据表明,HRX215介导的肝脏再生有效地防止了猪85%肝切除术后的致命肝衰竭。
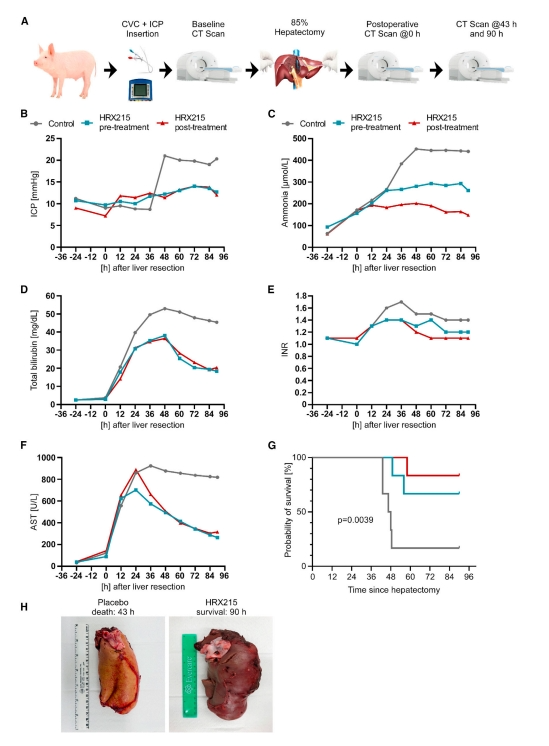
图五 HRX215可预防85%猪肝切除术后的肝功能衰竭[8]
最后,为了评估HRX215的安全性、耐受性和药代动力学,研究者开展探索性HRX215的首次人体I期临床试验(欧盟临床试验[EudraCT] 2021-000193-28)。共招募48名健康志愿者,其中安慰剂组12人,HRX215治疗组36人,并测试6种剂量梯度(图六A和B)。结果显示,I期临床试验没有报告严重或危重不良事件,治疗组和安慰剂组之间轻度至中度不良反应率相当(治疗组36.1% vs. 安慰剂组41.7%)。全血细胞计数显示HRX215治疗组和安慰剂组之间没有显著差异。研究者通过液相色谱-串联质谱(LC-MS/MS)分析HRX215的药代动力学,结果显示HRX215被快速吸收,并在达到最大浓度后呈双相消除(图六C和D)。随着HRX215剂量的增加,药物暴露呈比例增加。当在进餐后给药时,HRX215的吸收延迟,但生物利用度显著提高(图六C和D)。以上数据表明,HRX215具有良好的药代动力学、安全性和耐受性,为未来的II期临床试验奠定了基础。
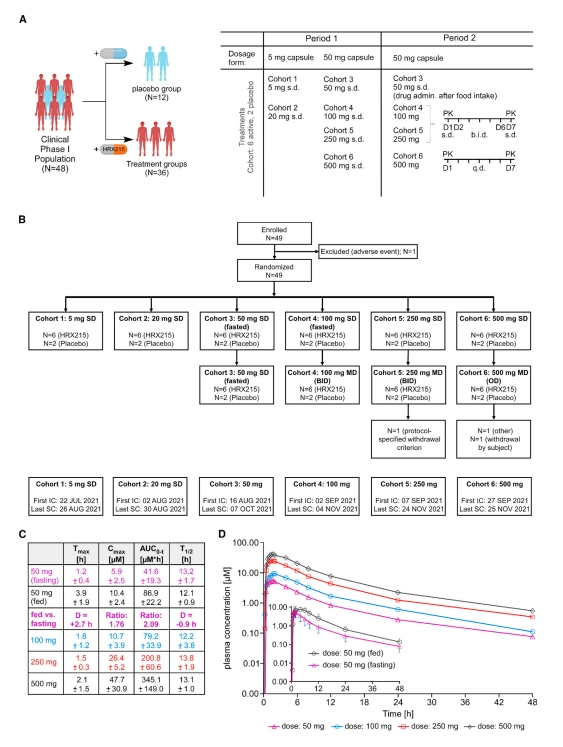
图六 HRX215的首次人体I期临床试验[8]
综上所述, 研究者描述了MKK4小分子抑制剂HRX215的开发与临床前试验表征。在小鼠和猪模型中,HRX215均增加了肝切除术后的肝细胞增殖和肝脏再生,大幅提高致命性85%肝切除术后猪的存活率。HRX215还在NASH小鼠模型中显示了抗肿瘤功效,以及在CCl4 肝损伤小鼠模型中的抗纤维化功效。最后,研究者进行了首次HRX215人体I期临床试验,显示出良好的安全性和药代动力学,是肝脏再生领域的一个里程碑事件。围手术期HRX215治疗有望在肝切除术后安全预防肝衰竭,并可能突破肝脏肿瘤手术的界限,使得更大体积的肝切除术成为可能,从而为更多的癌症肝转移患者和原发性肝癌患者提供潜在的治疗前景。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Asrani SK, Devarbhavi H, Eaton J, Kamath PS: Burden of liver diseases in the world. J Hepatol 2019, 70(1):151-171.
2. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. The lancet Gastroenterology & hepatology 2020, 5(3):245-266.
3. Campana L, Esser H, Huch M, Forbes S: Liver regeneration and inflammation: from fundamental science to clinical applications. Nature reviews Molecular cell biology 2021, 22(9):608-624.
4. Wuestefeld T, Pesic M, Rudalska R, Dauch D, Longerich T, Kang TW, Yevsa T, Heinzmann F, Hoenicke L, Hohmeyer A et al: A Direct in vivo RNAi screen identifies MKK4 as a key regulator of liver regeneration. Cell 2013, 153(2):389-401.
5. Canovas B, Nebreda AR: Diversity and versatility of p38 kinase signalling in health and disease. Nature reviews Molecular cell biology 2021, 22(5):346-366.
6. Shen YH, Godlewski J, Zhu J, Sathyanarayana P, Leaner V, Birrer MJ, Rana A, Tzivion G: Cross-talk between JNK/SAPK and ERK/MAPK pathways: sustained activation of JNK blocks ERK activation by mitogenic factors. The Journal of biological chemistry 2003, 278(29):26715-26721.
7. Kasuya Y, Umezawa H, Hatano M: Stress-Activated Protein Kinases in Spinal Cord Injury: Focus on Roles of p38. International journal of molecular sciences 2018, 19(3):867.
8. Zwirner S, Abu Rmilah AA, Klotz S, Pfaffenroth B, Kloevekorn P, Moschopoulou AA, Schuette S, Haag M, Selig R, Li K et al: First-in-class MKK4 inhibitors enhance liver regeneration and prevent liver failure. Cell 2024.
9. Nguyen AT, Dow AC, Kupiec-Weglinski J, Busuttil RW, Lipshutz GS: Evaluation of gene promoters for liver expression by hydrodynamic gene transfer. The Journal of surgical research 2008, 148(1):60-66.
10. Kosuga M, Enosawa S, Li XK, Suzuki S, Matsuo N, Yamada M, Roy-Chowdhury J, Koiwai O, Okuyama T: Strong, long-term transgene expression in rat liver using chicken beta-actin promoter associated with cytomegalovirus immediate-early enhancer (CAG promoter). Cell transplantation 2000, 9(5):675-680.
11. Chen HS, Joo DJ, Shaheen M, Li Y, Wang Y, Yang J, Nicolas CT, Predmore K, Amiot B, Michalak G et al: Randomized Trial of Spheroid Reservoir Bioartificial Liver in Porcine Model of Posthepatectomy Liver Failure. Hepatology 2019, 69(1):329-342.



