技术分享:微环境炎症信号调控乳腺再生的机制研究
再生是促使损伤细胞或组织修复重建的一种机制。细胞毒性应激会影响组织稳态,导致细胞死亡和可塑性改变[1]。然而,干细胞对应激表现出卓越的恢复能力,一旦应激得到缓解,它们就能增强活性重新工作[2]。但是,这种应激和干细胞行为之间的分子机制尚不清楚。
乳腺是一种具有周期性再生特征的双层上皮器官[3]。在反复出现的发情周期中,乳腺经历着周期性的形态变化[4]。在发情间期,乳腺发育成为最复杂的上皮结构,有着许多分支导管和腺泡,并通过细胞死亡和重塑发生退化[5]。直至下一轮发情期,随着激素变化,乳腺经历新一轮的增殖和分化周期,而这种周期性的再生是由乳腺干细胞(MaSC)所推动的[6]。现已在成年组织中发现了各种乳腺干细胞/祖细胞群体,反映出上皮层级的内在复杂性。一般认为单潜能祖细胞主要负责日常稳态维持和分娩后的形态发生,而多潜能MaSC参与了长期的导管维持[7]。在先前研究中鉴定出一群表达蛋白c受体(Procr)的MaSC[8],采用Procr标记的MaSC可分化为基底细胞和管腔细胞,并在移植后展现出强大的重构能力。这种Procr+ MaSC缺失会导致乳腺发育缺陷,说明它们在发育和稳态维持中具有重要作用[9]。已发现乳腺中存在两种类型的组织驻留巨噬细胞:基质巨噬细胞和导管巨噬细胞。近期报道发现了一种独特的CD11c+ 导管巨噬细胞群体,它们位于基底上皮和管腔上皮之间,并在妊娠期发生增殖,主要负责吞噬妊娠后退化死亡的上皮细胞[10]。然而,目前尚不清楚Procr+ MaSC如何响应微环境刺激并促进发情周期的乳腺重塑,以及CD11c+ 导管巨噬细胞是否参与其中。
2023年12月,Cell Stem Cell期刊上报道了一项成果,揭示应激调控乳腺干细胞(MaSC)存活及其分化的机制。具体来说,细胞毒性应激诱导的CD11c+ 导管巨噬细胞活化有助于MaSC存活并阻止其分化。在发情周期中,这些巨噬细胞通过IL1β-IL1R1-NF-kB信号以周期循环的方式增强Procr+ MaSC活性。MaSC缺失IL1R1会导致干细胞损伤和管腔分化。此外,在化疗药物紫杉醇的细胞毒性应激下,导管巨噬细胞可分泌出更高水平的IL1β,促进MaSC的存活并阻止其分化。这一MaSC响应细胞毒性应激的分子机制可能对开发靶向癌症干细胞的策略和提高癌症治疗效果具有重要意义[11]。
首先,研究者分析Procr+ MaSC的分子特征。使用流式细胞分选(FACS)分离Procr+ 和Procr- 基底细胞(图一A),RNA-seq分析发现Procr+ 细胞具有较高的NF-kB信号活性(图一B)。qPCR分析证实,NF-kB信号靶基因Ccl2、Ccl7、Ccl19、Ccl20、Mmp3和Mmp9在Procr+ 细胞中的表达显著高于Procr- 基底细胞(图一C)。与Procr- 基底细胞相比,Procr+ 细胞中磷酸化P65增加和Ik-bα减少(图一D)。此外,还观察到分离的Procr+ 基底细胞中含有核P65的细胞比例显著高于Procr- 基底细胞(图一E),表明NF-kB信号传导在Procr+ MaSC中被特异性激活。随后,研究者探究MaSC和导管巨噬细胞之间的空间关系。他莫昔芬(TAM)处理8周龄的ProcrCreERT2/+;Rosa26mTmG/+小鼠,1天后分析标记的mGFP+ 细胞,此时mGFP+ 细胞指示Procr+ 细胞,结果发现大部分的mGFP+ 细胞靠近导管巨噬细胞(图一F)。基底和导管巨噬细胞的三维绘制进一步证实CD11c+ 导管巨噬细胞定位于Procr+ 基底层和管腔层之间(图一G)。于是,研究者研究导管巨噬细胞能否调节MaSC的活性。分离导管巨噬细胞(CD45+,CD64+,F4/80+和CD11c+)和Procr+ MaSC(Lin-,CD24+,CD29hi和Procr+),以1:1的比例混合进行共培养实验,同时分离基质巨噬细胞(CD45+,CD64+,F4/80+和CD11c-)与MaSC共培养作为对照(图一H)。结果显示,与CD11c+ 导管巨噬细胞共培养显著提高了MaSC的集落形成能力(图一I和J)。以上数据表明,Procr+ MaSC与导管巨噬细胞的定位非常接近,这可能促进了MaSC的活性。
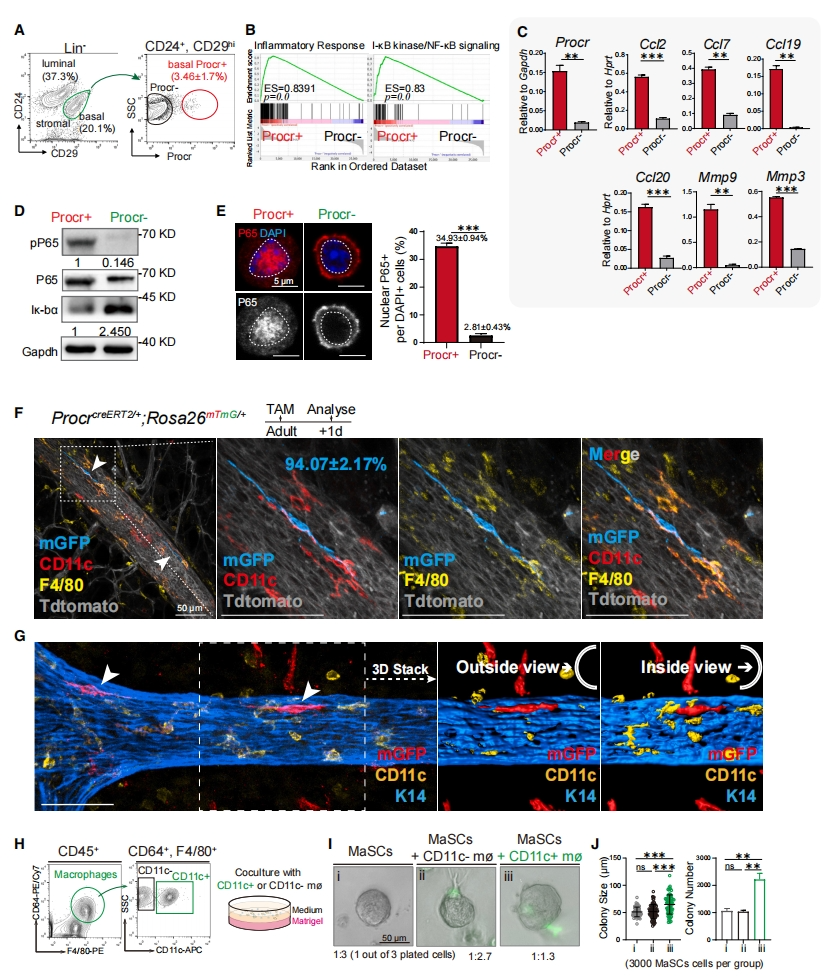
图一 Procr+ MaSC邻近CD11c+ 导管巨噬细胞,表现出NF-kB激活信号[11]
为研究发情周期中NF-kB信号的潜在变化,研究者从不同发情周期的小鼠乳腺组织中分离出Procr+ 基底细胞和导管巨噬细胞(图二A)。观察到Procr+ 基底细胞NF-kB信号活性在发情期发生显著变化,其中在发情前期观察到最高百分比的核P65染色和最高表达水平的NF-kB信号标记基因如Mmp3和Mmp9(图二B和C)。与此同时,发情前期导管巨噬细胞表现出最高表达水平的NLRP3、Caspase1和核TFE3(图二D和E),以及Il1b,Mmp12,Mmp13和Hexb(图二F和G)。全组织包埋免疫荧光染色分析导管巨噬细胞,发现在发情间期CD11c+ Caspase 3+ 细胞数量最多(图二H和I)。以上数据表明,CD11c+ 导管巨噬细胞的激活与发情前期MaSC的NF-kB活性增强有关,这种导管巨噬细胞在发情间期参与死亡细胞的清除,随后在发情前期因细胞因子分泌的增加而被激活。
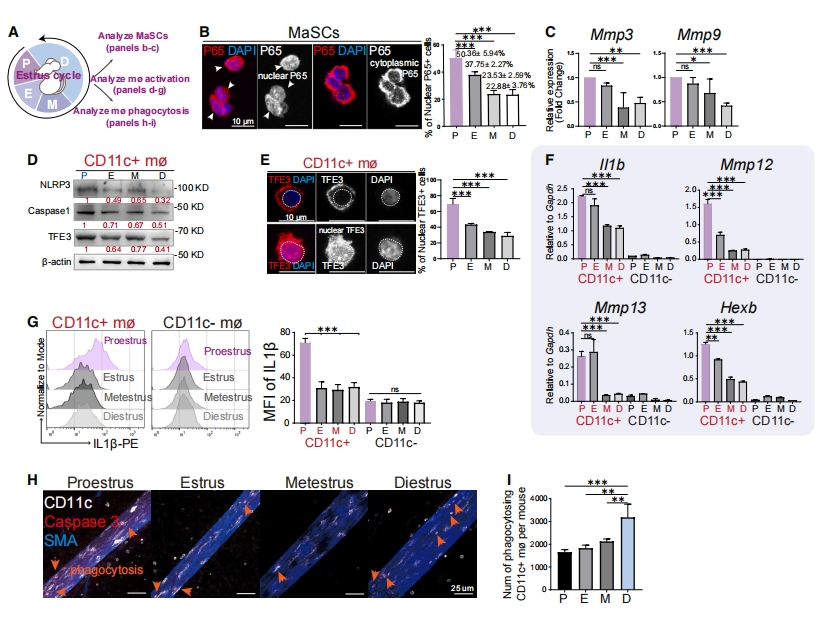
图二 CD11c+ 导管巨噬细胞的激活与邻近MaSC的NF-kB活性增强有关[11]
随后,研究者探究乳腺组织中MaSC和免疫细胞之间的相互作用。从8周龄成年小鼠的乳腺中分离富集到乳腺上皮细胞、Procr+ MaSC和免疫细胞。使用UMAP绘制基底细胞、管腔细胞、Procr+ MaSC、间充质细胞、内皮细胞和免疫细胞图谱(图三A)。配体-受体分析确定了在MaSC中特异性激活的三种信号,包括IL1、NT和ncWNT,其中IL1主要由CD11c+ 巨噬细胞分泌(图三B)。UMAP分析发现Il1b在CD11c+ 巨噬细胞中特异性表达,而受体Il1r1在MaSC中表达丰富(图三C)。Western blot进一步验证IL1R1在MaSC中的富集表达(图三D)。FACS分析证实,IL1β在CD11c+ 导管巨噬细胞中表达,而在CD11c- 基质巨噬细胞、树突状细胞和其他免疫细胞中不表达(图三E)。为评估IL1β的重要性,研究者在导管巨噬细胞和MaSC共培养系统中添加抗IL1β中和抗体(Anti-IL1β)。发现Anti-IL1β抑制了巨噬细胞共培养诱导的集落大小、数量和EdU掺入的增加(图三F-H)。此外,添加IL1β足以增强MaSC的活性,表现为集落大小增加、EdU+ 细胞增多(图三I-K)和集落形成效率提高(图三L)。这种IL1β增强效果可以被IL1R1抑制剂anankinra(Ana)所阻断(图三I-L)。以上数据表明,CD11c+ 导管巨噬细胞通过分泌IL1β促进Procr+ MaSC的活性。
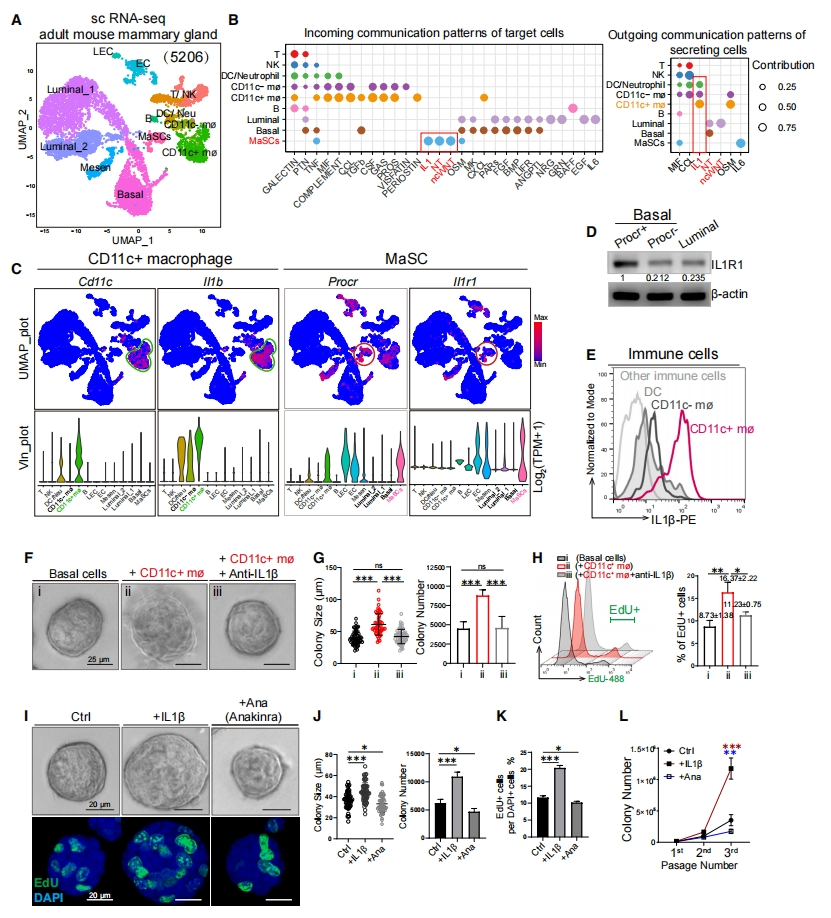
图三导管巨噬细胞通过IL1β-IL1R1信号通路促进MaSC活性[11]
接下来,研究者探究IL1R1对 MaSC的作用。生成ProcrCreER/+;IL1R1flox/flox小鼠(Il1r1-cKO)[12],分别在2周龄青春期前或4周龄青春期给予TAM,在9周龄成年时对乳腺进行分析。结果显示在青春期前或青春期阶段的MaSC中缺失IL1R1对乳腺发育都有显著影响,表现为发育迟缓(图四A和B)。8周龄的成年小鼠给予TAM处理,4周后分析,发现与对照组相比,Il1r1-cKO小鼠的乳腺侧分支和基底细胞显著更少(图四C和D)。FACS分析证实,Il1r1-cKO小鼠乳腺基底细胞比例显著降低(图四E),Procr+ MaSC的数量也显著减少(图四E-G)。qPCR证实Il1r1-cKO小鼠的NF-kB信号传导靶基因Il6、Ccl2和Ccl7的表达也显著降低(图四H)。通过给发情期的野生型小鼠服用Ana,重复三个周期(图四I),发现Ana处理组的侧支显著减少(图四J和K)。以上数据表明,IL1R1在维持MaSC特性和乳腺稳态中发挥着关键作用。
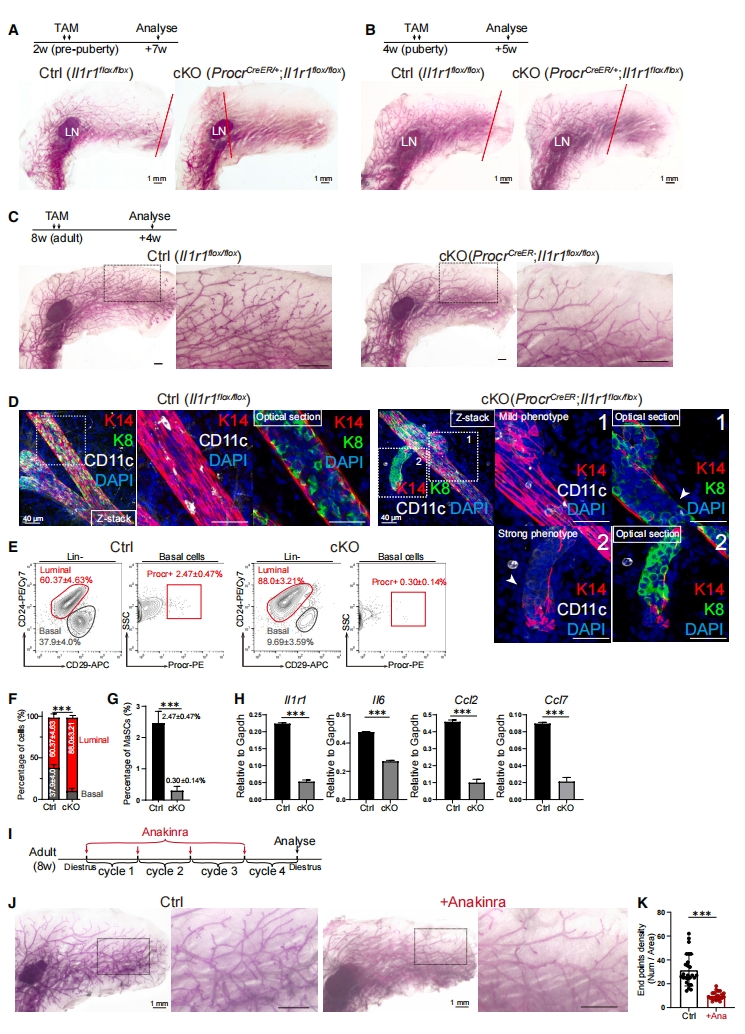
图四 MaSC中的IL1R1对乳腺发育和稳态至关重要[11]
接着,研究者在分子水平上探索IL1R1-NF-kB信号激活对MaSC的影响。在MaSC培养中添加或不添加IL1β,随后进行转录组分析。基因集富集分析(GSEA)显示,IL1β处理增强了Wnt信号,同时抑制了Notch信号和管腔成熟(图五A)。qPCR分析进一步证实这些发现,表现为Wnt靶基因Axin2的表达增加,而Notch靶基因Hes1和Hey1的表达减少(图五B)。进一步研究IL1β处理对细胞命运的影响,对MsSC来源的细胞集落进行K14和K8染色。加入IL1β处理导致基底细胞比例显著增加,管腔细胞比例下降,Ana处理结果则相反(图五C和D)。Procr是Wnt的靶基因[8]。使用ProcrrtTA/+;TetO-H2B-GFP小鼠[13],观察到IL1β处理增加了集落中Procr+(H2B-GFP+)细胞的数量(图五E)。在IL1β存在时,Procr+ 细胞百分比增加,而在Ana处理后,Procr+ 细胞百分比下降(图五F)。由于导管巨噬细胞可以分泌IL1β,如预期的那样,与导管巨噬细胞共培养上调了MaSC中的Wnt信号,抑制了Notch信号(图五G和H),导致集落中形成更多的基底细胞(图五I)。以上数据表明,MaSC中的IL1R1-NF-kB信号传导增强了Wnt信号并减少了Notch信号传导,进而增强MaSC的特性并抑制其管腔分化。
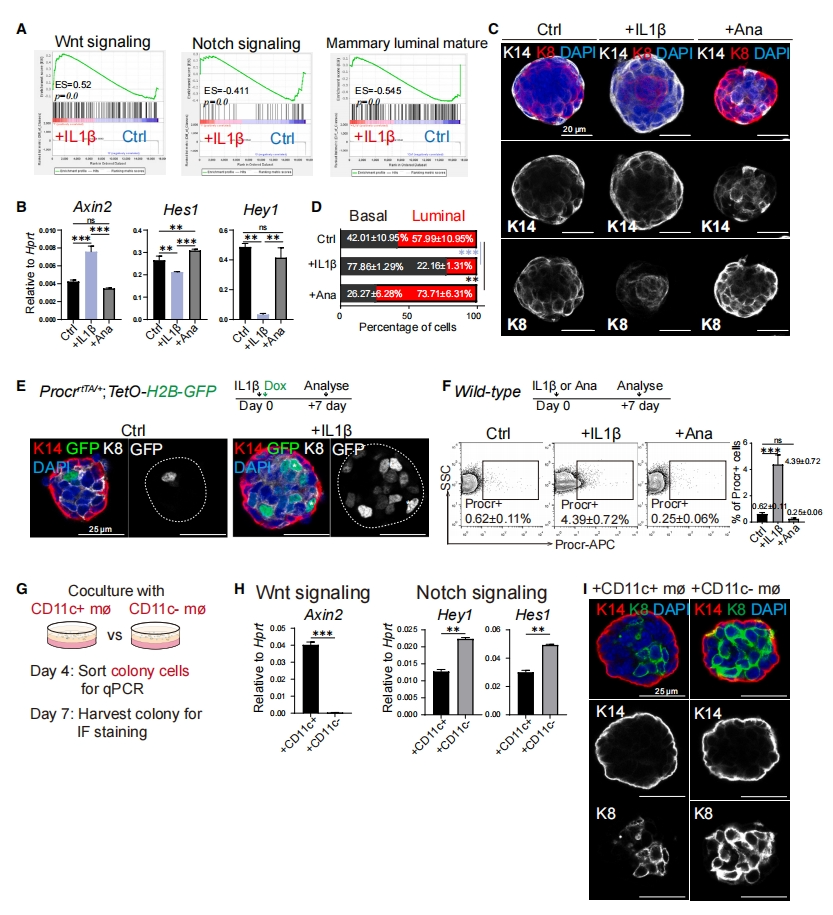
图五 MaSC中的IL1R1-NF-kB信号转导增强Wnt和抑制Notch信号通路,并增强MaSC特性和抑制其管腔分化[11]
研究者进一步使用ProcrCreER/+;Il1r1flox/flox;Rosa26mTmG/+小鼠(cKO)进行谱系示踪(图六A)。给8周龄小鼠注射TAM,以特异性敲除MaSC的Il1r1并启动示踪,3周后进行乳腺分析(图六B)。FACS分析显示Il1r1缺失的Procr+ MaSC显著减少(图六C),mGFP标记的上皮细胞即为Procr+ MaSC的后代。发现在对照组中,mGFP标记细胞里包含基底细胞和管腔细胞的比例为3:1,Il1r1缺失后导致管腔细胞增加,比例近似2:3(图六D)。全组织包埋免疫荧光染色发现cKO组中有较大的mGFP+ 集落,其中管腔细胞数量增加,基底细胞数量减少(图六E和F)。给予3周龄小鼠TAM和Ana处理,抑制IL1R1信号通路,并在6周后对乳腺进行分析(图六G)。Ana导致管腔/基底比值增加到约2:3(图六H),Ana处理组的mGFP+集落更大,其中管腔细胞数量增加,基底细胞数量减少(图六I和J)。以上结果表明,IL1R1-NF-kB信号通路在Procr+ MaSC细胞命运决定中起着关键作用,抑制NF-kB信号促使MaSC向管腔细胞分化。
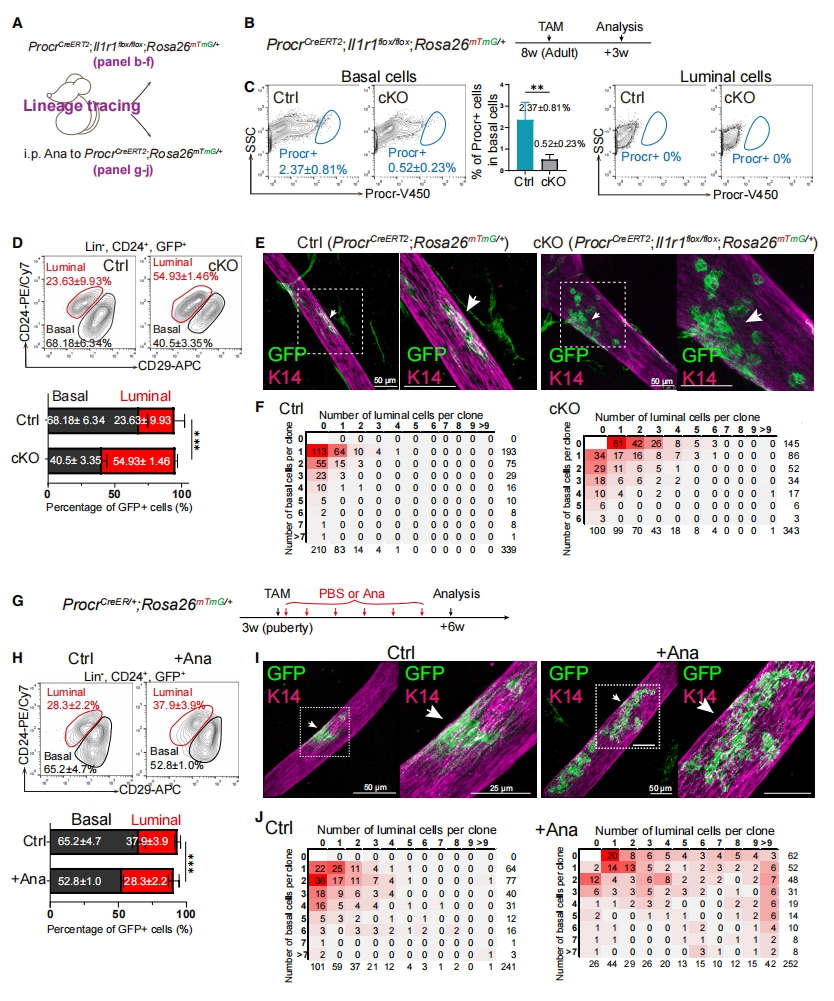
图六 IL1R1信号通路减少后MaSC倾向于分化为管腔细胞[11]
最后,研究者探究导管巨噬细胞和Procr+ MaSC之间的这种相互作用是否有助于化疗药物损伤下干细胞的存活。紫杉醇(PTX)是治疗乳腺癌的一线化疗药物,可稳定微管蛋白聚合,导致有丝分裂停滞和细胞凋亡。对野生型成年小鼠给予PTX,并在2天后分析乳腺上皮细胞和导管巨噬细胞(图七A和B)。分选Procr+ 和Procr- 基底细胞并对其进行TUNEL染色量化凋亡细胞。注射PTX后,Procr- 基底细胞的TUNEL+ 细胞比例显著增加;而Procr+ MaSC的凋亡细胞比例在PTX注射前后仍然保持相对较低(图七B),表明它们的存活率没有受到影响。推测PTX诱导的上皮细胞死亡增加激活了导管巨噬细胞。发现PTX处理后,导管巨噬细胞含有更多的溶酶体(图七C),吞噬作用增强(图七D)。此外,PTX处理后,导管巨噬细胞表达了更高水平的IL1β,而CD11c- 基质巨噬细胞未被PTX处理激活(图七E)。PTX诱导的细胞毒性应激还增强了Procr+ MaSC的NF-kB信号通路,激活Wnt信号传导(图七F和G)。PTX处理后,Procr- 基底细胞的促凋亡蛋白BIM表达增加,而Procr+ MaSC中抗凋亡蛋白XIAP表达增加(图七H),表明与其他基底细胞相比,Procr+ MaSC对PTX处理更有抵抗力。从小鼠中分离出MaSC进行体外培养,发现PTX处理组的集落数量更多和克隆更大,表现出更优的克隆性(图七I)。值得注意的是,PTX处理后的基底细胞比例更高(图七J),这种细胞命运的转变与MaSC中NF-kB信号传导的增加相一致。进一步给予ProcrCreER/+;Rosa26mTmG/+小鼠TAM和PTX处理,3周后收集乳腺(图七K)。发现对照组中mGFP标记细胞的基底/管腔细胞比例为3:1,PTX处理后将比值提高到9:1(图七L)。免疫染色可见PTX处理后的基底细胞数量更多,管腔细胞更少(图七M),这与增强MaSC的NF-kB信号传导可阻止其管腔分化结果相一致。野生型成年小鼠中单独给予PTX或PTX+Ana,3天后收集乳腺分析(图七N)。发现与单独使用PTX相比,PTX+Ana诱导了Procr+ MaSC的细胞死亡(图七O和P);抑制了MaSC中NF-kB信号的激活(图七Q);减弱了PTX诱导的克隆性增强(图七R)。以上结果表明,PTX诱导的细胞毒性应激增强了导管巨噬细胞和MaSC之间的IL1β-IL1R-NF-kB信号传导,从而促进MaSC的存活并阻止其分化,阻断IL1R可有效提高PTX处理后MaSC的敏感性并导致其凋亡。
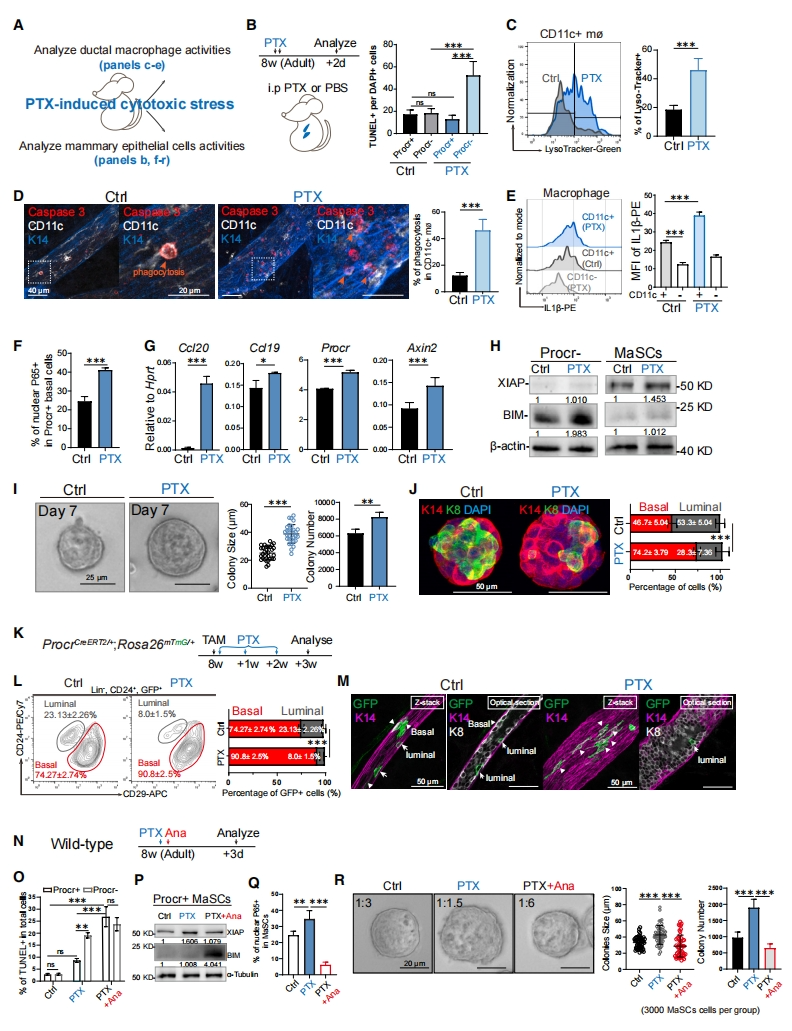
图七 细胞毒性应激增强MaSC的IL1R1信号传导,促进其存活并阻止分化[11]
综上所述,该研究发现在正常生理状态下,组织干细胞随着生理周期的节律进行周期性地NF-κB信号通路活性震荡,产生的后代细胞贡献于组织器官的稳态维持和再生。在病理状态下,例如在使用化疗药物紫杉醇时,组织中更多的细胞死亡,引起CD11c+巨噬细胞活动增加,其与Procr+干细胞的交流增强,赋予了干细胞更强的存活能力,即干细胞在细胞毒性应激条件下存活,表现为化疗耐药性。最后,阻断巨噬细胞与干细胞的互作,降低了干细胞在应激条件下的NF-κB活性,可以提高干细胞对紫杉醇治疗的敏感性。该研究揭示了干细胞为何具有更强的生存能力,为何具有化疗耐药性的分子机制,对开发靶向肿瘤干细胞治疗策略,具有潜在的重要意义;发现了Procr+干细胞与免疫微环境细胞新的互作,并揭示了干细胞主动调控其免疫微环境的能力。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:甜点
新媒体运营:suway
参考文献
1. Gadd VL, Aleksieva N, Forbes SJ: Epithelial Plasticity during Liver Injury and Regeneration. Cell Stem Cell 2020, 27(4):557-573.
2. Machado L, Geara P, Camps J, Dos Santos M, Teixeira-Clerc F, Van Herck J, Varet H, Legendre R, Pawlotsky JM, Sampaolesi M et al: Tissue damage induces a conserved stress response that initiates quiescent muscle stem cell activation. Cell Stem Cell 2021, 28(6):1125-1135.e1127.
3. Visvader JE, Stingl J: Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes Dev 2014, 28(11):1143-1158.
4. Nazário AC, Simões MJ, de Lima GR: Morphological and ultrastructural aspects of the cyclical changes of human mammary gland during the menstrual cycle. Sao Paulo medical journal = Revista paulista de medicina 1994, 112(2):543-547.
5. Fata JE, Chaudhary V, Khokha R: Cellular turnover in the mammary gland is correlated with systemic levels of progesterone and not 17beta-estradiol during the estrous cycle. Biology of reproduction 2001, 65(3):680-688.
6. Sreekumar A, Roarty K, Rosen JM: The mammary stem cell hierarchy: a looking glass into heterogeneous breast cancer landscapes. Endocrine-related cancer 2015, 22(6):T161-176.
7. Fu NY, Nolan E, Lindeman GJ, Visvader JE: Stem Cells and the Differentiation Hierarchy in Mammary Gland Development. 2020, 100(2):489-523.
8. Wang D, Cai C, Dong X, Yu QC, Zhang XO, Yang L, Zeng YA: Identification of multipotent mammary stem cells by protein C receptor expression. Nature 2015, 517(7532):81-84.
9. Liu C, Lin C, Wang D, Wang J, Tao Y, Li Y, Chen X, Bai L, Jia Y, Chen J et al: Procr functions as a signaling receptor and is essential for the maintenance and self-renewal of mammary stem cells. Cell Rep 2022, 38(12):110548.
10. Dawson CA, Pal B: Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. 2020, 22(5):546-558.
11. Liu C, Xu Y, Yang G, Tao Y, Chang J, Wang S, Cheung TH, Chen J, Zeng YA: Niche inflammatory signals control oscillating mammary regeneration and protect stem cells from cytotoxic stress. Cell Stem Cell 2024, 31(1):89-105.e106.
12. Robson MJ, Zhu CB, Quinlan MA, Botschner DA, Baganz NL, Lindler KM, Thome JG, Hewlett WA, Blakely RD: Generation and Characterization of Mice Expressing a Conditional Allele of the Interleukin-1 Receptor Type 1. Plos One 2016, 11(3):e0150068.
13. Wang J, Wang D, Chu K, Li W, Zeng YA: Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. 2019, 10(1):4966.



