技术分享:肠上皮IL-17RA信号传导可通过微生物调节远端肿瘤生长
肠道内复杂的微生物群落与宿主相互作用着,通过调节免疫和新陈代谢,影响着人类健康[1, 2]。肠道上皮屏障作为隔离管腔抗原的物理屏障,是维持粘膜免疫不可或缺的一部分。常驻免疫细胞和上皮细胞均可分泌免疫球蛋白、抗菌蛋白和细胞因子来调节肠道微生物[2]。在正常生理条件下,共生微生物包括细菌和真菌可触发促炎细胞因子白细胞介素17(IL-17)家族的产生,这对于调节粘膜免疫和肠道屏障完整性以维持肠道稳态相当重要。IL-17A和IL-17F的同源或异源二聚体通过结合受体IL-17RA和IL-17RC形成的异二聚体复合物来激活下游信号[3, 4]。IL-17主要由免疫细胞分泌[5],但肠上皮细胞和Paneth细胞也可以分泌IL-17,以应对损伤和炎症反应,进而调节局部微生物群落[6, 7]。
IL-17与多种自身免疫性疾病的发病机制有关,例如银屑病、类风湿性关节炎、狼疮、炎症性肠病和多发性硬化症[8]。IL-17-IL-17RA信号转导被报道与胰腺癌的发生和发展以及胰腺导管腺癌(PDAC)的免疫抑制和肿瘤微环境(TME)重塑有关[9, 10]。致病微生物如产肠毒素脆弱拟杆菌(ETBF)可触发免疫细胞产生IL-17,并通过IL-17RA信号传导来促进结肠肿瘤的发生[11]。这些研究都强调IL-17在癌症中的作用可能与微环境有关,并取决于其稳态功能。在小鼠模型中,微生物消融可延迟胰腺癌的发生和生长[12],抗生素的使用与转移性PDAC患者生存率的提高具有相关性[13]。然而,微生物调节肿瘤行为的分子机制仍然未知。
2024年1月,Cancer Cell期刊报道了一项研究,揭示了癌症对细胞因子抑制的抵抗机制,该机制依赖于肠道IL-17-IL17RA信号介导的微生物调节。阻断肠上皮IL-17RA信号传导会引发肠道微生态失调,使得人和小鼠胰腺导管腺癌中IL-17主要来源的Th17以及B细胞过度发育,并循环至远端肿瘤,促进远端胰腺或脑肿瘤的生长。这种微生物依赖的IL-17信号增加肿瘤细胞中的DUOX2信号。联合IL-17RA抑制剂和微生物消融疗法可以更好地发挥抗肿瘤功效。该研究揭示了IL-17-IL17RA信号的复杂性,抑制肠道微生物的重要性以及系统影响肿瘤生长的免疫机制[14]。
首先,研究者探究肿瘤外的IL-17-IL-17RA信号对胰腺癌生长的作用。在IL-17RA缺陷小鼠(Il17ra-/-)与对照小鼠(Il17ra+/+)分别原位和皮下移植胰腺癌KPC细胞(LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx1-Cre)(图一A),其中KPC细胞有IL-17RA表达。结果显示,与对照组相比,Il17ra-/-小鼠的原位(图一B–D)以及皮下移植(图一E和F)的胰腺肿瘤生长都显著增加。经RNA-seq转录组学分析显示,与对照组相比,Il17ra-/-小鼠胰腺肿瘤中IL-17信号传导相关靶基因和途径显著上调,而回肠中显著下调(图一G和H)。qPCR验证IL-17信号通路靶基因Il1b和Lcn2的表达,证实它们在Il17ra-/-小鼠肿瘤中上调以及在回肠中下调(图一I)。RNAScope检测到Il17ra-/-小鼠的肿瘤和回肠中较高的Il17a mRNA表达(图一J)。随后研究者检测循环中异常表达的细胞因子,发现与对照组相比,IL-17A和IL-17F在Il17ra-/-小鼠中显著升高(图一K)。由于IL-17参与微生物调节,研究者测试在缺乏有效的IL-17RA信号的情况下,IL-17水平的增加是否是由微生物过度生长所驱动。用抗菌剂(氨苄青霉素、万古霉素、新霉素和甲硝唑)和抗真菌剂(两性霉素B)的口服混合物处理小鼠,发现Il17ra-/-小鼠的血浆IL-17水平显著降低,而对照小鼠的水平保持不变(图一L)。随后测试单剂抗生素,发现只有氨苄青霉素可模拟混合抗生素的效果(图一L)。基于这些结果,研究者推测临床抑制IL-17-IL-17RA的疗效不佳可能是由于肠道微生物失调。于是,将抗IL-17RA的单克隆抗体aIL-17RA与氨苄青霉素联合处理(图一M),以阻断微生物驱动的IL-17补偿回路。发现aIL-17RA的单剂处理显著增加了IL-17循环水平,而这能被氨苄青霉素的联合给药所抑制(图一N)。单独使用aIL-17RA处理不影响肿瘤生长,但与氨苄青霉素联合用药可产生协同抗肿瘤作用(图一O)。以上数据表明,肿瘤外IL-17RA的缺失,促使微生物驱动全身IL-17升高和胰腺肿瘤生长。
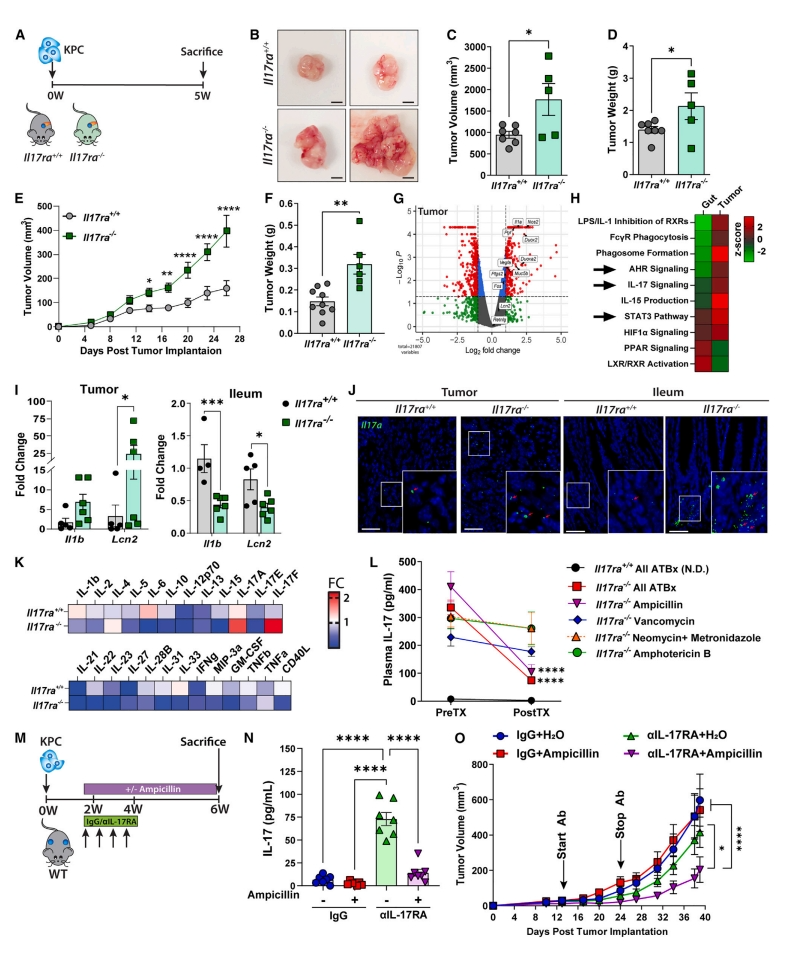
图一 微生物驱动循环IL-17升高促进胰腺肿瘤生长[14]
随后,研究者探究上述观察到的促肿瘤作用是否是由于肠道微生物对IL-17-IL-17RA信号的调控。构建肠上皮细胞特异性IL-17RA缺失小鼠Il17rafl/fl;Villin-Cre,发现血浆IL-17显著增加(图二A)。然后在该小鼠中原位移植KPC细胞,并在存在或不存在氨苄青霉素的情况下评估肿瘤生长,以测试IL-17是否为微生物依赖性上调(图二B)。与在Il17ra-/-小鼠中的发现类似, Il17rafl/fl;Villin-Cre小鼠相比对照组肿瘤生长显著增加,氨苄青霉素处理消除了肿瘤生长的增加,同时降低了血浆IL-17水平,显示出微生物依赖性效应(图二C-F)。为证实IL-17直接调节肿瘤生长,通过CRISPR-Cas9敲除KPC细胞中的IL-17RA得到KPCIl17ra-/-,并原位植入Il17rafl/fl;Villin-Cre小鼠,发现未能增加肿瘤生长(图二C-F)。另外,通过CRISPR-Cas9敲除KPC细胞中的IL-17RA信号传导的受体复合物衔接蛋白ACT1,构建ACT1缺失的KPC细胞,发现肿瘤细胞的ACT1缺失也导致Il17rafl/fl;Villin-Cre小鼠的肿瘤生长显著减少(图二G-I)。RNA-seq分析同样显示Il17rafl/fl;Villin-Cre小鼠回肠中 IL-17信号传导途径的下调及其在肿瘤中的上调(图二J和K)。由于Il17rafl/fl;Villin-Cre小鼠中的肿瘤较大,但IL-17水平不如Il17ra-/-小鼠高,发现是由于血浆 IL-17F的急剧增加(图二L)。Il17rafl/fl;Villin-Cre小鼠的肠道微生物组成没有像Il17ra-/-小鼠(图二M)那样显著改变,但其特定微生物增加包括普雷沃氏菌和拟杆菌。以上数据表明,肠上皮细胞特异性的IL-17RA缺失导致肠道微生物变化,从而驱动产生更多的IL-17,最终通过肿瘤细胞的IL-17RA信号促进肿瘤生长。
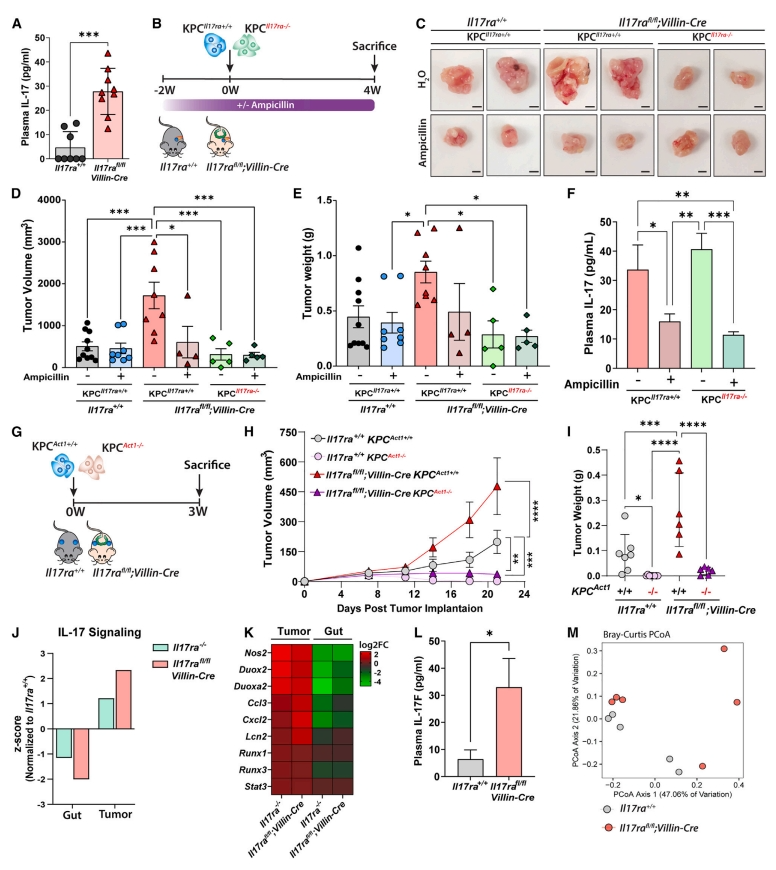
图二 肠道IL-17RA缺失促进微生物驱动的胰腺肿瘤生长[14]
研究者进一步探究这种微生物稳态破坏能否影响远离胃肠道如大脑的肿瘤,原位植入小鼠胶质瘤细胞Gl261进行造模(图三A)。类似的,与对照小鼠相比,Il17ra-/-小鼠的肿瘤生长明显更快,而Il17rafl/fl;Villin-Cre小鼠经历了最具侵袭性的肿瘤生长(图三B-E)。评估神经体征发现Il17rafl/fl;Villin-Cre小鼠的反射显著降低,20%的Il17ra-/-和50%的Il17rafl/fl;Villin-Cre小鼠中有自发癫痫发作,而对照小鼠正常(图三F和G)。IL-17相关基因同样在Il17ra-/-和Il17rafl/fl;Villin-Cre小鼠的肿瘤中增加,在回肠中降低(图三H)。以上数据表明,肠道IL-17-IL-17RA信号的破坏加速了脑肿瘤的生长。
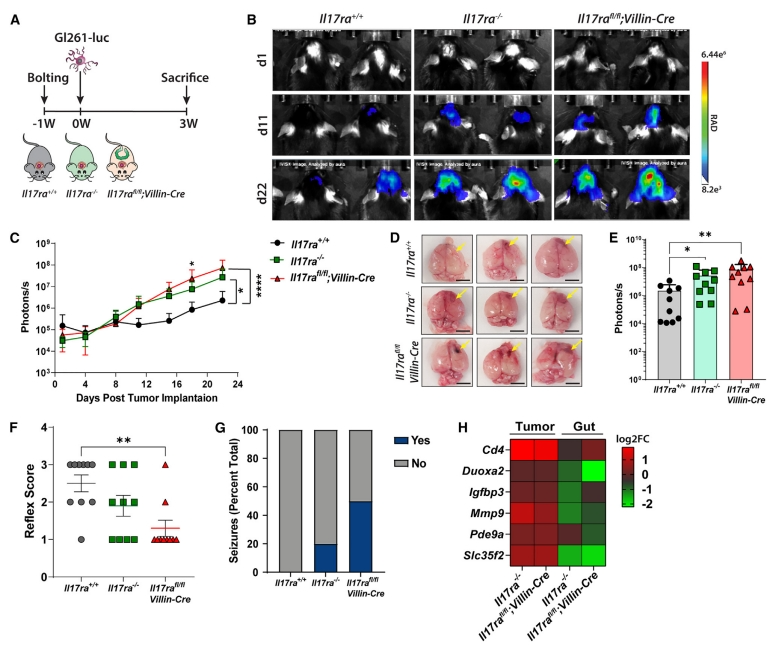
图三 肠道IL-17-IL-17RA依赖性微生物失调可影响远端肿瘤生长[14]
接下来,研究者进行基于CyTOF和流式细胞术的无偏免疫分析,以确定在缺乏肠道IL-17-IL-17RA信号传导的情况下主要免疫细胞类群的变化,可能有助于解释这一促肿瘤作用。在肿瘤的早期阶段,当各组之间的肿瘤大小相似时,消化回肠和胰腺原位肿瘤后获得单细胞(图四A)。CyTOF分析显示,大多数主要免疫细胞群体在两组之间相似,但Il17rafl/fl;Villin-Cre小鼠的固有层(LP)和肿瘤中的B细胞显著增加(图四B-E)。流式细胞术证实肿瘤浸润性B细胞的增加(图四F和G),以及肠系膜淋巴结(mLN)和脾脏组织的B细胞增加(图四G)。对原位胰腺肿瘤中的CD20进行免疫组织化学染色,显示Il17ra-/-和Il17rafl/fl;Villin-Cre小鼠中有更高数量的B细胞(图四H)。随后,研究者探究B细胞如何影响肿瘤生长,在PDAC皮下模型中使用CD20抗体在体内耗尽B细胞(图四I),发现处理后B细胞减少,包括肿瘤、LP、mLN、脾脏等(图四J),抑制了Il17rafl/fl;Villin-Cre小鼠的肿瘤生长,但在对照小鼠中增强了肿瘤生长(图四K),表明在缺乏有效的IL-17-IL-17RA肠道信号传导的情况下产生的B细胞具有肿瘤促进能力。
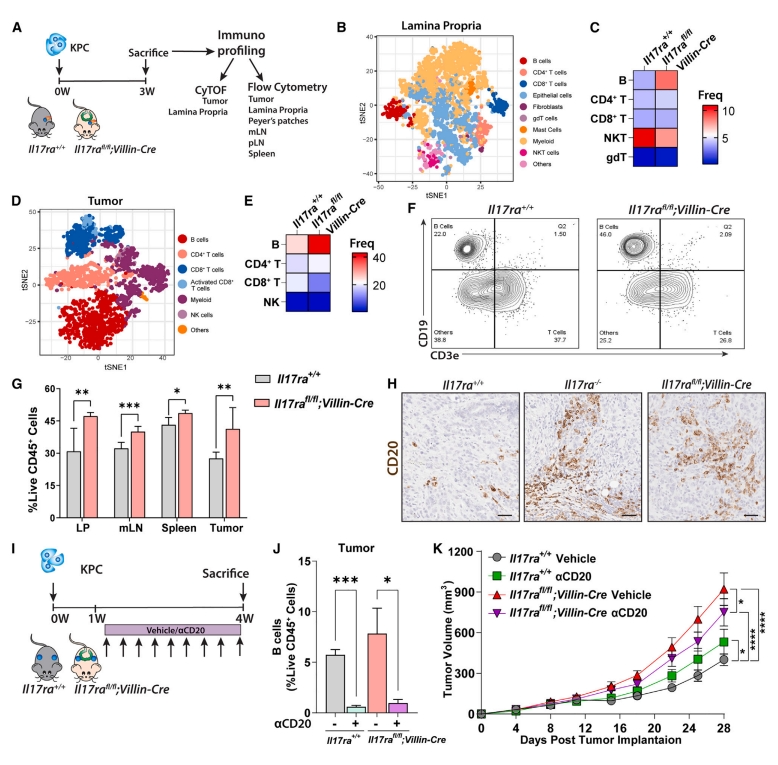
图四 肠道IL-17RA缺乏触发B细胞发育[14]
鉴于Il17rafl/fl;Villin-Cre小鼠中血浆IL-17增加,研究者使用单细胞测序(scRNA-seq)来确定IL-17的细胞来源(图五A-C)。结果显示,肠道Il17a和Il17f的表达仅限于Il17rafl/fl;Villin-Cre小鼠中的Th17细胞(图五D)。肿瘤中的Il17a主要在CD4+ T细胞(Th17细胞)中表达,而Il17f在Th17和B细胞中表达(图五D)。RNA原位杂交验证发现,Il17rafl/fl;Villin-Cre小鼠的肿瘤中检测到更高数量的表达Il17a和Il17f的细胞(图五E)。此外,在CD20+ 细胞中检测Il17f证实肿瘤内存在表达IL-17F的B细胞(图五F)。转录组学分析显示,相比对照小鼠,Il17rafl/fl;Villin-Cre小鼠肿瘤浸润的B细胞对细菌、脂多糖和抗微生物体液反应的防御能力降低(图五G)。以上数据表明,肠道微生物失调会触发Th17细胞和B细胞的肠道发育,这是IL-17A和IL-17F的主要来源,它们可以通过系统循环进入肿瘤。
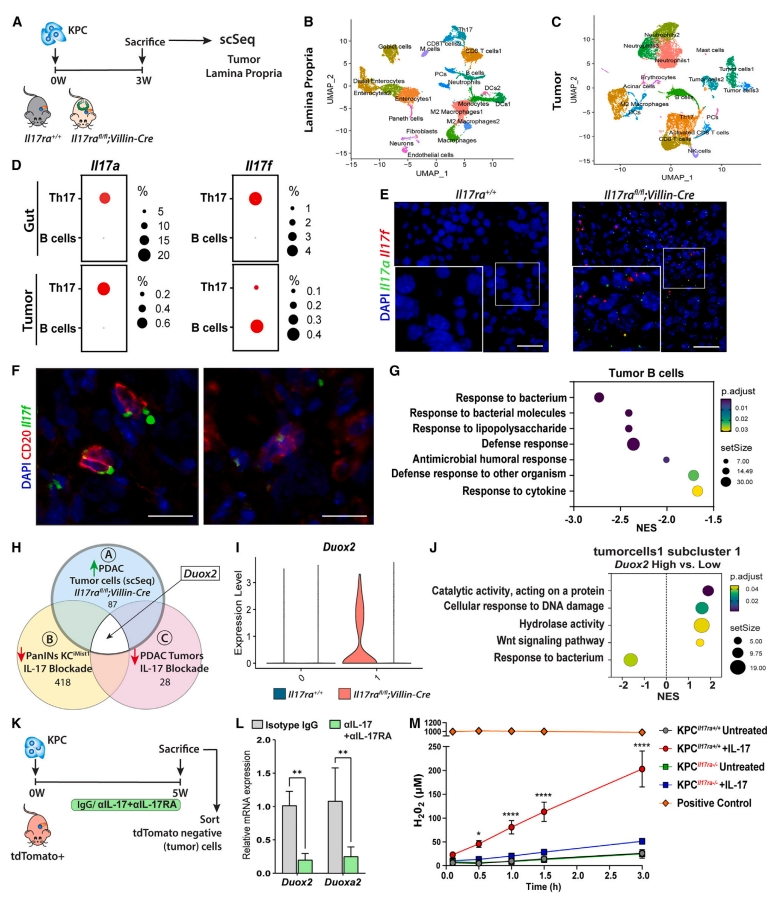
图五 肠道IL-17RA缺失驱动的微生态失调重塑免疫和肿瘤细胞[14]
接下来,研究者剖析肿瘤细胞的转录变化,将单细胞基因表达数据与先前报道的IL-17驱动胰腺数据集进行比较[10]。结果显示Duox2是IL-17差异调节的常见基因(图五H),主要表达在Il17rafl/fl;Villin-Cre小鼠的肿瘤细胞中(图五I)。通路分析显示,高Duox2表达的肿瘤细胞的催化活性、DNA损伤反应、水解酶活性和Wnt信号传导较高,但对细菌的反应降低(图五J)。DUOX2是一种氧化酶,受IL-17RA信号控制[15]。研究者在tdTomato荧光小鼠中原位植入非荧光胰腺癌细胞,并用aIL-17A/aIL-17RA抗体处理小鼠(图五K)。IL-17信号阻断后,肿瘤细胞中Duox2及其成熟因子Duoxa2均下调(图五L)。富集的KPC细胞在体外直接暴露于IL-17导致氧化酶基因如Nox1、Duox2和Duoxa2的增加,显著增加了ROS和H2O2, 而IL-17RA的缺失消除了ROS和H2O2的产生(图5M)。以上数据表明,肠道IL-17RA缺失介导的IL-17分泌增加了胰腺肿瘤中DUOX2的信号传导。
最后,研究者在单细胞水平上研究PDAC患者的IL-17细胞来源。使用CosMx空间分子成像(SMI)技术对原代PDAC进行了空间单细胞转录组分析,以创建全面的空间PDAC IL-17图谱(图六A);鉴定出不同的细胞类型,包括肿瘤细胞、胰腺内分泌细胞、基质细胞和几种类型的免疫细胞(图六B)。根据细胞类型评估基因表达,发现IL17A转录本主要在T细胞中表达,而其他免疫细胞如浆细胞、髓细胞和肥大细胞的表达较低(图六B和C)。检查癌症基因组图谱(TCGA)数据库,根据IL17A表达对PDAC进行分组,发现在IL17A高表达的组织中DUOX2表达显著较高(图六D)。根据DUOX2表达对PDAC进行分组,提取差异表达基因进行通路分析,发现在高表达DUOX2的PDAC中,对脂多糖、细菌和含氧化合物的反应降低(图六E和F)。以上数据表明,PDAC患者具有循环和肿瘤浸润的表达IL-17细胞,其水平与DUOX2有关。
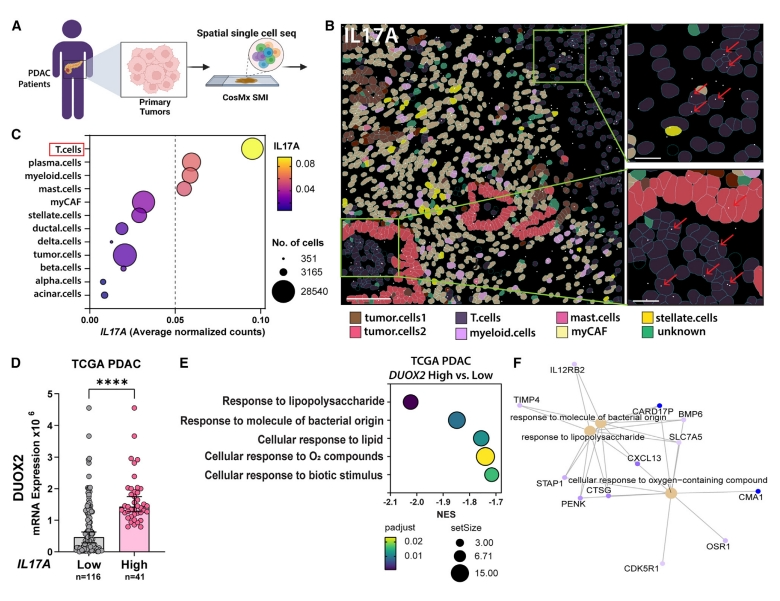
图六 PDAC患者的循环和肿瘤浸润IL-17表达细胞,与DUOX2有关[14]
综上所述, 该研究通过小鼠模型发现系统性或肠道上皮特异性缺失IL-17RA可诱导肠道微生态失调,诱导Th17以及循环至远端肿瘤的B细胞过度发育,促进了胰腺和脑肿瘤的生长。这种微生物依赖性IL-17信号传导增加了肿瘤细胞中DUOX2信号传导。通过微生物消融可阻断补偿回路,克服药物抑制IL-17RA的无效性,提高肿瘤抑制效果。该研究揭示了IL-17-IL-17RA信号在不同区域的复杂性,以及在癌症治疗期间解释其平衡宿主防御功能的相关性。

GTP研发中心拥有自主知识产权的“人造精子细胞”介导的半克隆技术,可在体外实现“人造精子细胞”的多位点改造并进行功能元件测试,最后将“人造精子细胞”通过卵母细胞注射可以一步法获得基因改造小鼠。基于“人造精子细胞”单倍体打靶高效率的优势,可快速构建定制化小鼠,如基因组安全位点大片段敲入、条件性基因敲除/敲入和人源化基因改造等。多个复杂调控元件可以通过多次体外细胞打靶构建在同一株“人造精子细胞”中,经细胞水平质控后,一步法获得基因改造小鼠。

如有需要欢迎联系我们,GTP研发中心将竭诚为您设计最佳方案,制定专属于您的基因改造小鼠。
网址:http://www.sibcb.ac.cn/gtp/
地址:上海市岳阳路320号
责任编辑:多一百
新媒体运营:suway
参考文献
1. Goldszmid RS, Dzutsev A, Trinchieri G: Host immune response to infection and cancer: unexpected commonalities. Cell host & microbe 2014, 15(3):295-305.
2. Belkaid Y, Hand TW: Role of the microbiota in immunity and inflammation. Cell 2014, 157(1):121-141.
3. Toy D, Kugler D, Wolfson M, Vanden Bos T, Gurgel J, Derry J, Tocker J, Peschon J: Cutting edge: interleukin 17 signals through a heteromeric receptor complex. J Immunol 2006, 177(1):36-39.
4. Wright JF, Guo Y, Quazi A, Luxenberg DP, Bennett F, Ross JF, Qiu Y, Whitters MJ, Tomkinson KN, Dunussi-Joannopoulos K et al: Identification of an interleukin 17F/17A heterodimer in activated human CD4+ T cells. The Journal of biological chemistry 2007, 282(18):13447-13455.
5. Cua DJ, Tato CM: Innate IL-17-producing cells: the sentinels of the immune system. Nature reviews Immunology 2010, 10(7):479-489.
6. Ishigame H, Kakuta S, Nagai T, Kadoki M, Nambu A, Komiyama Y, Fujikado N, Tanahashi Y, Akitsu A, Kotaki H et al: Differential roles of interleukin-17A and -17F in host defense against mucoepithelial bacterial infection and allergic responses. Immunity 2009, 30(1):108-119.
7. Takahashi N, Vanlaere I, de Rycke R, Cauwels A, Joosten LA, Lubberts E, van den Berg WB, Libert C: IL-17 produced by Paneth cells drives TNF-induced shock. The Journal of experimental medicine 2008, 205(8):1755-1761.
8. Chiricozzi A, Guttman-Yassky E, Suárez-Fariñas M, Nograles KE, Tian S, Cardinale I, Chimenti S, Krueger JG: Integrative responses to IL-17 and TNF-α in human keratinocytes account for key inflammatory pathogenic circuits in psoriasis. J Invest Dermatol 2011, 131(3):677-687.
9. Zhang Y, Zoltan M, Riquelme E, Xu H, Sahin I, Castro-Pando S, Montiel MF, Chang K, Jiang Z, Ling J et al: Immune Cell Production of Interleukin 17 Induces Stem Cell Features of Pancreatic Intraepithelial Neoplasia Cells. Gastroenterology 2018, 155(1):210-223.e213.
10. Zhang Y, Chandra V, Riquelme Sanchez E, Dutta P, Quesada PR, Rakoski A, Zoltan M, Arora N, Baydogan S, Horne W et al: Interleukin-17-induced neutrophil extracellular traps mediate resistance to checkpoint blockade in pancreatic cancer. The Journal of experimental medicine 2020, 217(12):e20190354.
11. Wu S, Rhee KJ, Albesiano E, Rabizadeh S, Wu X, Yen HR, Huso DL, Brancati FL, Wick E, McAllister F et al: A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nature medicine 2009, 15(9):1016-1022.
12. Sethi V, Kurtom S, Tarique M, Lavania S, Malchiodi Z, Hellmund L, Zhang L, Sharma U, Giri B, Garg B et al: Gut Microbiota Promotes Tumor Growth in Mice by Modulating Immune Response. Gastroenterology 2018, 155(1):33-37.e36.
13. Imai H, Saijo K, Komine K, Otsuki Y, Ohuchi K, Sato Y, Okita A, Takahashi M, Takahashi S, Shirota H et al: Antibiotic therapy augments the efficacy of gemcitabine-containing regimens for advanced cancer: a retrospective study. Cancer management and research 2019, 11:7953-7965.
14. Chandra V, Li L, Le Roux O, Zhang Y, Howell RM, Rupani DN, Baydogan S, Miller HD, Riquelme E, Petrosino J et al: Gut epithelial Interleukin-17 receptor A signaling can modulate distant tumors growth through microbial regulation. Cancer Cell 2024, 42(1):85-100.e106.
15. Matsunaga Y, Clark T, Wanek AG, Bitoun JP, Gong Q, Good M, Kolls JK: Intestinal IL-17R Signaling Controls Secretory IgA and Oxidase Balance in Citrobacter rodentium Infection. J Immunol 2021, 206(4):766-775.



